INTRODUCCIÓN
La cirrosis secundaria a la infección crónica por el virus de la hepatitis C (VHC) es una de las principales indicaciones de trasplante hepático en nuestro medio. La recurrencia de la infección viral y la reinfección del injerto es constante y, además, se produce en las primeras horas postrasplante1. Al cabo de un período variable, que puede oscilar de unas pocas semanas hasta meses, se desarrolla una hepatitis histológica en la gran mayoría de los pacientes2. Pese a que la progresión de esta hepatitis sigue un curso variable, se estima que, como media, en torno al 20-30% de los pacientes desarrolla una recidiva de la cirrosis por VHC en el transcurso de los primeros 5 años tras la cirugía2,3. La historia natural de esta cirrosis también es más agresiva que la descrita en pacientes no trasplantados, con una probabilidad acumulada de desarrollar una descompensación del 65% en 3 años4. Tras el desarrollo de estas complicaciones evolutivas, el pronóstico es sombrío con una mortalidad a los 2 años de aproximadamente un 80%4. De hecho, varios estudios longitudinales que comparan la supervivencia en receptores de trasplante hepático VHC-positivo frente a los VHC-negativo han constatado que los resultados son significativamente inferiores en los pacientes infectados por el VHC, con una supervivencia global a los 5 años del 70% frente al 80% en los VHC-negativo5-7. Por tanto, el principal objetivo del manejo de los pacientes VHC-positivo en el contexto del trasplante hepático es evitar la progresión a cirrosis descompensada y pérdida del injerto por recurrencia de la enfermedad primaria. Desde un punto de vista teórico, podemos instaurar un tratamiento en distintos momentos de este proceso: a) antes del trasplante hepático (tratamiento pretrasplante); b) justo en el momento del trasplante (tratamiento profiláctico); c) de forma precoz tras el trasplante (tratamiento preventivo); y d) en una fase más tardía como tratamiento de la hepatitis establecida. La última opción es la estrategia terapéutica más comúnmente utilizada. En esta revisión, se repasan los aspectos más relevantes, fundamentalmente la base racional y la eficacia, de estas alternativas profilácticas y terapéuticas.
TRATAMIENTO ANTIVIRAL PRETRASPLANTE
El objetivo de este tratamiento es eliminar el virus antes del trasplante y con ello evitar la reinfección del injerto. Hasta la fecha se han publicado 4 estudios que han analizado esta estrategia terapéutica8-11. En un primer estudio, Crippin et al8 trataron a 15 pacientes con cirrosis descompensada (Child-Pugh, 11,9 ± 1,2) con dosis bajas de interferón y ribavirina. Incluso con estas dosis bajas de interferón estándar, obtuvieron una respuesta virológica durante el tratamiento en el 33% de los casos (5 de 15). Desafortunadamente, se produjeron numerosos efectos secundarios en 13 (87%) de los pacientes, y además los investigadores consideraron graves la mayoría de estos efectos, lo cual condujo a la finalización prematura del estudio. De los 15 pacientes del estudio, 2 fueron trasplantados, pero en ambos casos la viremia era positiva antes del trasplante y se produjo, como era de prever, la recidiva virológica en los 2 casos. La principal conclusión de este primer trabajo fue, por tanto, establecer los riesgos potenciales de un tratamiento antiviral en pacientes con enfermedad hepática avanzada. En un segundo estudio de Forns et al9, los autores trataron a 30 cirróticos en lista de espera de trasplante cuando el tiempo estimado para el trasplante era de aproximadamente unos 5 meses. La mayoría de ellos estaban infectados por el genotipo 1 (83%) y un 50% tenía una reserva funcional hepática relativamente buena (Child-Pugh A). La dosis de inicio de interferón *-2b y de ribavirina fue de 3 MU y 800 mg/día, respectivamente. Los efectos secundarios fueron, no obstante, frecuentes, lo que obligó a reducir la dosis de uno o ambos fármacos en el 63% de los casos. Se obtuvo una respuesta virológica durante el tratamiento en el 30% de los pacientes tratados (9/30), y en 6 (20%) la viremia se mantuvo negativa después del trasplante. La obtención de una respuesta virológica precoz al mes de haber iniciado el tratamiento fue el único factor predictivo de respuesta. La principal conclusión de este estudio fue demostrar que el tratamiento pretrasplante es una estrategia factible, con la que se puede lograr prevenir la reinfección del injerto en un 20% de los pacientes tratados; sin embargo, se trata de una alternativa limitada al subgrupo de pacientes que pueden tolerarla, fundamentalmente aquéllos con función hepática poco avanzada (Child-Pugh < B7 o MELD < 15). El tercer estudio, publicado por Thomas et al10, con un total de 20 cirróticos tratados en lista de espera, muestra resultados muy parecidos; es decir, la posibilidad de obtener una respuesta virológica en un porcentaje no despreciable de casos y, en consecuencia, la posibilidad de prevenir la reinfección del injerto si el trasplante se realiza en estas condiciones. El último estudio, de Everson et al11, es el más amplio en cuanto a número de pacientes tratados. El régimen terapéutico utilizado es el denominado low accelerating dose regimen, en el cual las dosis iniciales de antivirales son bajas y van incrementándose progresivamente según la tolerancia. La media de Child-Pugh fue de 7,4 ± 2,3. En este estudio, un 46% de los 124 cirróticos tratados obtuvieron una respuesta virológica, que fue sostenida en un 24% (30/124). Los 2 factores predictivos de respuesta fueron la infección por el VHC con genotipo distinto del 1 y la utilización de dosis completas de tratamiento. De los 47 pacientes que se trasplantaron, se logró prevenir la reinfección en 12 de los 15 ARN-VHC negativo antes del trasplante; por el contrario, la reinfección fue la norma en los 32 pacientes trasplantados con ARN-VHC positivo antes del trasplante.
A partir de estos 4 estudios, podemos extraer las siguientes conclusiones sobre el tratamiento antiviral pretrasplante: a) se trata de una estrategia potencialmente útil, capaz de prevenir la reinfección del injerto en un promedio del 20% de los cirróticos tratados; b) su aplicabilidad es muy limitada, ya que en un porcentaje relativamente importante de casos (aproximadamente la mitad) existen contraindicaciones a priori, fundamentalmente citopenias; c) la tolerancia es escasa, con desarrollo de numerosos efectos secundarios, sobre todo citopenias e infecciones. El interferón induce neutropenia, trombocitopenia y anemia principalmente por la supresión medular. Por su parte, la ribavirina induce anemia tanto por la hemólisis como por la supresión medular. La inducción y/o el empeoramiento de las citopenias preexistentes en pacientes cirróticos pueden tener consecuencias muy graves, tales como infecciones y hemorragias. Para controlar estos efectos secundarios, se han propuesto 2 alternativas: reducir la dosis de interferón y/o ribavirina o añadir factores de crecimiento. Aunque aún no se ha establecido el posible papel beneficioso de los factores de crecimiento en prevenir complicaciones y/o aumentar la eficacia virológica, lo que sí sabemos es que la reducción de dosis compromete la obtención de una respuesta virológica, sobre todo en la población cirrótica. Por eso en estos pacientes cirróticos usar factores de crecimiento es preferible a la reducción de dosis. Debido a su alto coste, es imperativo, no obstante, que se establezcan guías de utilización de estos factores (dosis idónea, momento de utilización, ya sea profiláctivo o terapéutico). En definitiva, hoy día, esta opción se considera una estrategia válida para los pacientes cirróticos con función hepática aceptable (Child-Pugh < 7 o MELD < 15), sobre todo si tienen factores basales predictivos de respuesta virológica favorables (genotipos 2 y 3, genotipo 1 y baja carga viral).
TRATAMIENTO PROFILÁCTICO
La base racional para intentar un tratamiento profiláctico con gammaglobulina específica antihepatitis C es similar a la establecida para la hepatitis B. Sin embargo, y a diferencia de la experiencia con gammaglobulina antihepatitis B, los resultados con gammaglobulina antihepatitis C no han resultado satisfactorios. Hasta la fecha, se han realizado 2 estudios analizando esta estrategia. En el primero, un estudio multicéntrico Canadiense, 16 pacientes fueron aleatorizados para recibir dosis bajas de gammaglobulina (Cangene Corp, Canadá) (500 mg en la fase anhepática, 250 mg/día por 10 días, 75 mg/2 semanas durante un total de 48 semanas), dosis altas (1.500 mg en la fase anhepática, 750 mg/día por 10 días, 250 mg/2 semanas durante un total de 48 semanas), o placebo. Se produjo una recidiva de la infección en todos los casos y no se apreciaron diferencias en la carga viral en ninguno de los puntos analizados12. Los resultados del segundo estudio, una investigación norteamericana multicéntrica que utilizó dosis significativamente más altas (Civacir, NABI Inc, Estados Unidos), fueron similares, si bien los valores de transaminasas y la actividad necroinflamatoria en la biopsia del final de tratamiento (14 semanas) fueron menores en el grupo tratado con las dosis más altas12. Por lo tanto, aunque de momento no parece que la profilaxis con inmunoglobulinas específicas antihepatitis C pueda lograr prevenir la reinfección del injerto, se especula sobre un posible efecto protector frente al desarrollo de daño histológico mediado por la respuesta inmunitaria, posiblemente al enmascarar los antígenos virales.
TRATAMIENTO PREVENTIVO
Los estudios de cinética viral postrasplante han permitido demostrar que la reinfección del injerto es un proceso que ocurre muy precozmente tras el trasplante hepático1. Sin embargo, el daño histológico no suele establecerse hasta pasadas 2 a 8 semanas del trasplante. Es por ello que algunos autores han analizado la posibilidad de eliminar el virus mediante tratamiento antiviral durante este período inicial postrasplante, cuando el virus está presente pero aún no existen indicios de hepatitis recurrente (normalidad de transaminasas y ausencia de lesión histológica). Hasta la fecha se han publicado 6 estudios con resultados desalentadores, tanto en lo que respecta a la eficacia como, sobre todo, la tolerancia13-18. La tasa de respuesta virológica sostenida con interferón estándar o pegilado en monoterapia es muy pobre (alrededor de un 5-17%). Los mejores resultados publicados hasta la fecha se han logrado con la combinación interferón estándar o pegilado + ribavirina (18%-39%). Las limitaciones de esta terapia son similares a las descritas para el tratamiento pretrasplante: a) baja aplicabilidad, ya que en un porcentaje de hasta el 58% el tratamiento no puede iniciarse en el período postrasplante precoz por la existencia de contraindicaciones, sobre todo citopenias, inestabilidad clínica, rechazo o complicaciones extrahepáticas18. En general, los pacientes que se trasplanta en mejores condiciones (MELD y Child-Pugh bajos), tales como los sometidos a trasplante hepático de donante vivo18,19, son aquéllos en los que es más factible iniciar el tratamiento antiviral durante las primeras 8 semanas postrasplante; b) pobre tolerancia, por lo que en un elevado porcentaje de casos se requiere reducir la dosis de uno o ambos fármacos (el 80% como media) o interrumpirlos definitivamente (aproximadamente el 35%). Esta dificultad en mantener dosis completas de interferón y ribavirina es, en parte, la causa de la baja eficacia obtenida en este contexto; c) posibilidad de sobretratamiento; en efecto, si se opta por utilizar esta estrategia, el tratamiento se utiliza en aquellos que lo toleran, individuos que no siempre son los que van a presentar una recidiva agresiva de la hepatitis. En este sentido, el conocimiento de factores de riesgo de mala evolución postrasplante, presentes tanto antes como inmediatamente después del trasplante2,3, nos puede ayudar a seleccionar candidatos de riesgo para recibir un tratamiento preventivo. Estos pacientes de riesgo serían, por ejemplo, los coinfectados por el VIH o sometidos a retrasplante hepático por la recurrencia de la enfermedad en el primer injerto, pacientes que reciben órganos de mala calidad, sobre todo de donantes añosos, o pacientes con grados de viremia altos antes del trasplante.
TRATAMIENTO DE LA HEPATITIS ESTABLECIDA
La alternativa más utilizada hasta la fecha ha sido tratar la hepatitis establecida en la fase crónica. Los resultados con interferón en monoterapia fueron muy desalentadores, con una tasa de respuesta virológica de solamente un 1% (intervalo, 0%-3%)20. Con la adición de la ribavirina, la respuesta virológica sostenida aumentó a un 20% (7%-30%)21-33, y hoy día, con inteferón pegilado+ribavirina, la eficacia ha aumentado a un 39% (26%-50%)34-38. Esta respuesta virológica perdura en el tiempo, y tras seguimientos de 3-5 años, el ARN-VHC sigue indetectable en sangre en más del 90% de los pacientes39,40. Además, en la mayoría de los casos, la actividad necroinflamatoria, al igual que la fibrosis, mejora en los respondedores virológicos. Sin embargo, así como los cambios en necrosis e inflamación suelen ser precoces, los cambios de la fibrosis no suelen ser evidentes hasta pasados 3 a 5 años de la finalización del tratamiento39,40. El principal problema del tratamiento radica en su mala tolerancia, que obliga en la mayoría de los casos a reducir la dosis de uno o ambos fármacos, e incluso a interrumpirlo en un tercio de los pacientes. Uno de los riesgos más graves es el desarrollo de rechazo celular o crónico41,42. Su incidencia en las series es muy variable (0-35%), aunque es posible que ésta esté subestimada tanto por la dificultad en establecer un diagnóstico diferencial entre rechazo y hepatitis43 como por la ausencia de biopsias durante y al final del tratamiento. Para evitar esta complicación, se recomienda no reducir demasiado la inmunosupresión durante y tras el tratamiento, y biopsiar siempre que haya dudas, y posiblemente de forma sistemática al finalizar éste. Los factores predictivos de respuesta incluyen la infección por los genotipos 2 y 3, el cumplimiento terapéutico (dosis de al menos el 80% durante al menos el 80% del tiempo), y la respuesta virológica precoz estimada a los 3 meses de iniciado el tratamiento44. Existen pocas alternativas para los pacientes no respondedores a interferón-ribavirina. En estos pacientes, el tratamiento con interferón pegilado+ribavirina puede lograr la eliminación del virus en aproximadamente un 10% de los casos (resultados preliminares)38. Otra alternativa es asociar la amantadina. En un estudio reciente preliminar, la respuesta virológica alcanzada fue del 33% con la combinación interferón+ribavirina+amantadina45, si bien el tamaño muestral fue demasiado pequeño para extraer conclusiones definitivas.
El aspecto más dudoso en el tratamiento de la hepatitis establecida es definir el mejor momento para iniciar el tratamiento antiviral (por ejemplo, en la fase aguda o en la crónica; a partir de un estadio de fibrosis específico; teniendo en cuenta el tiempo desde el trasplante; solamente en pacientes en los que se evidencia la progresión de la enfermedad en las biopsias seriadas realizadas por protocolo a intervalos regulares...). Existen datos que demuestran una asociación entre hepatitis aguda y un curso de la enfermedad más agresivo2. Además, un estudio reciente demuestra que la eficacia del tratamiento es similar cuando se inicia en la fase de hepatitis aguda46. No obstante, la estabilidad clínica y la voluntad de los pacientes no suelen ser óptimos durante los primeros meses postrasplante. Por ello, la tendencia es a tratar a los pacientes en la fase crónica. En esta fase, existen estudios que demuestran una relación entre el desarrollo de fibrosis portal y posterior progresión a cirrosis2. Finalmente, la existencia de actividad necroinflamatoria importante también nos permite predecir con relativa fiabilidad una evolución más agresiva de la hepatitis2. Por todo ello, hoy día se recomienda iniciar el tratamiento antiviral en pacientes: a) en los que se evidencie progresión de la fibrosis en las biopsias de protocolo, y b) en los que se objetive fibrosis al menos portal y/o actividad necroinflamatoria llamativa en alguna de las biopsias realizadas tras el trasplante.
Definir el tratamiento óptimo, en cuanto a dosis, duración y estrategias para mejorar la tolerancia y lograr mantener dosis óptimas durante el tratamiento, es el principal desafío. Aunque se desconoce si los factores de crecimiento mejoran la eficacia, representan una alternativa a la reducción de dosis, factor que de por sí se asocia con tasas de respuesta virológica inferiores. Aún se desconoce cuáles deben ser la dosis (incremento progresivo según tolerancia o dosis completa desde el inicio) y la duración óptimas (6 o 12 meses, según genotipo; un mínimo de 6 meses tras la negativización de la viremia, según la cinética de respuesta virológica). En un estudio italiano, 6 y 12 meses aportaron resultados similares29, aunque se precisa de más estudios para confirmar estos datos.
RETRASPLANTE
La prevalencia de pacientes sometidos a retrasplante por cirrosis del primer injerto causada por el VHC ha aumentado progresivamente en los últimos años. Hoy por hoy, las decisiones de retrasplantar a un paciente con cirrosis hepática C del injerto se hacen de forma individualizada. No hay consenso respecto a los criterios a utilizar para indicar el trasplante en estos pacientes por varias razones, tales como mortalidad postoperatoria relevante entre los pacientes retrasplantados por cirrosis por el VHC en injerto, dudas respecto a la agresividad de la hepatitis C tras el retrasplante y escasez de órganos donantes frente al aumento progresivo de candidatos a un primer trasplante.
En caso de optarse por un retrasplante, se recomienda tomar cierto tipo de medidas para evitar la elevada mortalidad postoperatoria y mejorar el pronóstico a largo plazo, tales como indicar el retrasplante antes del desarrollo de complicaciones renales e infecciosas, inclusión en ensayos que valoren el papel de la terapia antiviral profiláctica, y utilización de órganos provenientes de donantes jóvenes47.
MEDIDAS ALTERNATIVAS
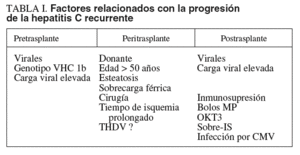
Las herramientas de que disponemos para mejorar el pronóstico de los pacientes trasplantados hepáticos e infectados por el VHC son fundamentalmente los fármacos antivirales/inmunomoduladores (interferón y ribavirina). No obstante, una estrategia alternativa es potenciar los factores antifibrogénicos y/o eliminar/evitar los que se asocian con una progresión más agresiva de la hepatitis2,48,49. Desafortunadamente, aunque hasta la fecha se han identificado muchos factores de mala y buena evolución a partir de estudios retrospectivos (tabla I), solamente un estudio ha valorado si la modificación de estos factores se acompaña de mejoras en el pronóstico50. En ese estudio, se comprobó que la modificación en el manejo de la inmunosupresión, en concreto la reducción paulatina de los esteroides, junto a no utilizar triple/cuádruple terapia inmunosupresora de inicio y/o bolos de corticoides, se seguía de una reducción significativa en la tasa de hepatitis grave.
CONCLUSIONES
La cirrosis por el VHC es la principal indicación de trasplante hepático. La recurrencia de la infección es universal, y la mayoría desarrolla hepatitis crónica que con el tiempo progresa a cirrosis y fallo del injerto, con el consiguiente impacto negativo en la supervivencia. Es por tanto necesario ampliar las estrategias destinadas, bien a evitar la reinfección del injerto, bien a prevenir su evolución a formas graves. Desafortunadamente, los únicos fármacos disponibles en la actualidad son el interferón estándar o pegilado y la ribavirina, fármacos que, aunque logran eliminar el VHC en un porcentaje no despreciable de pacientes, tienen un potencial tóxico elevado, con una pobre tolerancia y una aplicabilidad limitada.