Se han apreciado cambios permanentes en las subpoblaciones de linfocitos intraepiteliales (LIE) en los pacientes con enfermedad celíaca.
ObjetivoEl objetivo principal de este estudio fue demostrar la utilidad de la determinación de las subpoblaciones de LIE receptores de células T gamma-delta y CD3−/CD7+, mediante citometría de flujo, como marcador diagnóstico de la enfermedad celíaca del adulto.
Pacientes y métodosPara ello, hemos realizado un estudio prospectivo sobre una muestra de 128 pacientes adultos (70 con enfermedad celíaca y 58 controles). A todos ellos se les realizaron biopsias de duodeno distal, que fueron procesadas mediante citometría de flujo para la determinación de subpoblaciones de LIE.
ResultadosSegún los resultados obtenidos, la muestra de pacientes celíacos presenta un aumento de la subpoblación de LIE gamma-delta y un descenso en la subpoblación de LIE CD3−/CD7+, independientemente de la dieta realizada, cuando se comparan con el grupo control.
ConclusionesSegún los datos obtenidos, se puede concluir que la determinación de subpoblaciones de LIE mediante citometría de flujo podría resultar de utilidad para confirmar el diagnóstico de enfermedad celíaca. Sería necesario investigar las subpoblaciones de linfocitos intraepiteliales en otras enfermedades distintas de la enfermedad celíaca, así como en pacientes con enfermedad celíaca latente o potencial.
Permanent changes have been found in intraepithelial lymphocyte (IEL) subsets in patients with celiac disease.
ObjectiveThe main aim of this study was to demonstrate the utility of determining CD3−/CD7+ and T cell receptor (TCR) gamma-delta IEL subsets by flow cytometry as a diagnostic marker of adult celiac disease.
Patients and methodsWe performed a prospective study in a sample of 128 adult patients (70 with celiac disease and 58 controls). In all patients, distal duodenal biopsy was performed and IEL subsets were determined by flow cytometry.
ResultsPatients with celiac disease showed an increase in gamma-delta IEL subsets and a decrease in CD3−/CD7+ IEL subsets in comparison with the control group, independently of diet.
ConclusionsThe results indicate that IEL subset determination by flow cytometry could be useful to confirm diagnosis of celiac disease. IEL subsets should be investigated in diseases other than celiac disease, as well as in patients with potential or latent celiac disease.
El tejido linfoide asociado a la mucosa intestinal es un componente importante del sistema inmunitario humano. Los linfocitos intraepiteliales (LIE) tienen una localización privilegiada en el intestino humano. Sus funciones son controvertidas. No solamente son efectores de una respuesta inmunitaria, sino también mediadores en la tolerancia oral a los antígenos alimentarios1–3. Un gran porcentaje (> 50%) de los LIE son linfocitos T con las siguientes características fenotípicas: CD8+ (hasta el 85%) o CD4+ (< 10%), receptores de células T (TCR)α/β(80- 85%) o TCR γ/δ (< 10%). Recientemente, y utilizando la citometría de flujo, se ha descrito una subpoblación de LIE en la mucosa del intestino delgado, que no son linfocitos T, que representan algo menos del 40% de los LIE del intestino delgado normal y que muestran marcadores fenotípicos sugestivos de población celular natural killer4–6: CD3−, CD7+, CD4−, CD8−, TCR−, CD56+ y CD16+.
Partiendo de la hipótesis de que los pacientes con enfermedad celíaca pueden presentar un desequilibrio en las subpoblaciones de LIE, con un aumento de la expresión TCR γ/δ en células CD3+, así como una disminución en la subpoblación CD3−/CD7+, nos planteamos el objetivo de demostrar la utilidad, como marcador diagnóstico, de la determinación de estas subpoblaciones, mediante citometría de flujo, en una muestra de pacientes celíacos adultos.
La enfermedad celíaca (EC) es una entidad mediada por fenómenos autoinmunes, que se presenta en sujetos susceptibles genéticamente. El 90% de los pacientes presenta el heterodímero HLA-DQ2, y el 10% restante suele presentar el HLA-DQ87.
MATERIAL Y MÉTODOSPacientesSe estudió una muestra de 128 pacientes con edades comprendidas entre los 16 y los 85 años. Se establecieron 3 grupos de pacientes:
- –
Grupo I (celíacos con gluten): 37 pacientes celíacos (las 29 mujeres y los 8 varones) con edades entre los 18 y los 70 años (41 ± 16,18), cuyas biopsias intestinales se realizaron mientras consumían gluten. El diagnóstico de EC se realizó en función de la existencia de atrofia vellositaria de grado III de Marsh y la positividad de anticuerpos antiendomisio (IgA o IgG).
- –
Grupo II (celíacos sin gluten): 33 pacientes celíacos (29 mujeres y 7 varones) con una edad entre los 18 y los 69 años (39 ± 15,58), cuyas biopsias intestinales se tomaron mientras seguían una dieta estricta sin gluten al menos desde 2 años antes.
- –
Grupo III (grupo control): 58 pacientes (43 mujeres y 15 varones) con una edad entre los 16 y los 85 años (47,40 ± 18,62), seleccionados al azar, en la unidad de endoscopia digestiva, a la que acudieron para la realización de una endoscopia digestiva alta. En todos ellos se excluyó l a existencia de una EC mediante criterios serológicos e histológicos. Los diagnósticos de los pacientes del grupo control se detallan en la tabla I.
Las biopsias de intestino delgado se obtuvieron del duodeno distal durante la realización de una endoscopia digestiva alta. En todos los casos se solicitó y obtuvo el consentimiento informado por escrito de los pacientes. De cada paciente se obtuvieron dos biopsias, una para su estudio anatomopatológico y otra para el estudio de poblaciones de LIE por citometría de flujo. Estas últimas, fueron incubadas durante 1 h en medio completo (MC) con EDTA 1 mM y DDT 1 mM a temperatura ambiente. El procesamiento debe realizarse antes de que transcurran 2 h desde la extracción de las biopsias para evitar su desepitelización espontánea. El uso de EDTA y DDT provoca la rotura de las uniones intercelulares y la liberación al medio de los LIE y los enterocitos, lo que permite su marcado individualizado. Los agregados celulares se disgregan por paso repetido por una aguja de 25 G. Tras ello, se lava la suspensión celular en suero salino para su posterior marcado con anticuerpos monoclonales. Por término medio (biopsia por endoscopia) se suelen obtener unas 10.000-20.000 células, con un tamaño y granularidad adecuados, y se analizan los linfocitos que hay (un 10%) y su fenotipo.
Una vez realizado el marcado de membrana, las muestras se analizaron por citometría de flujo en un FAC Scan Standard (Becton Dickinson), lo cual permite un método de lectura rápido para analizar un elevado número de células y proporcionar un registro computarizado de los resultados. Los LIE se detectan porque son más de un 95% CD103+ (marcador de células intraepiteliales).
Análisis estadísticoLas diferencias de distribución en las densidades poblacionales de LIE en los distintos grupos se determinaron mediante las pruebas no paramétricas de Kruskal-Wallis y la U de Mann-Withney. Para el análisis de variables cualitativas se utilizó el test de la χ2. El valor de significación utilizado durante todo el estudio fue p ≤ 0,05.
Para la obtención de los puntos de corte en los diferentes análisis de LIE se utilizaron las curvas ROC. Se consideró el punto de corte más óptimo en el que la suma de sensibilidad y especificidad fue más alta. Una prueba o determinación analítica es muy buena como método diagnóstico si el área bajo la curva es > 0,8, mientras que un valor cercano a 0,5 indica que la discriminación es escasa8.
RESULTADOSLos puntos de corte óptimos obtenidos mediante curva ROC fueron los siguientes:
- –
Los IEL totales: normal los valores inferiores a 14 LIE por cada 100 células del epitelio. Área bajo la curva = 0,803.
- –
Los IEL γ/δ: normal los valores inferiores a 15 LIE γ/δ por cada 100 células LIE. Área bajo la curva = 0,93.
- –
Los IEL CD3−/CD7+, normal los valores mayores de 5 LIE CD3−/CD7+, por cada 100 células LIE. Área bajo la curva = 0,892. El porcentaje de LIE totales se referencia al total de células purificadas de la muestra biológica. Los CD3−/CD7+ y los TCR γ/δ se referencian al total de linfocitos en la muestra.
La densidad de estas células se muestra en la figura 1. Los pacientes celíacos que consumían gluten presentaron valores medios (19,8 ± 7,9%) significativamente más altos (p < 0,05) que los observados en pacientes celíacos que realizaban una dieta sin gluten (12,3 ± 5,4%) y que los pacientes del grupo control (10,2 ± 4,8%).
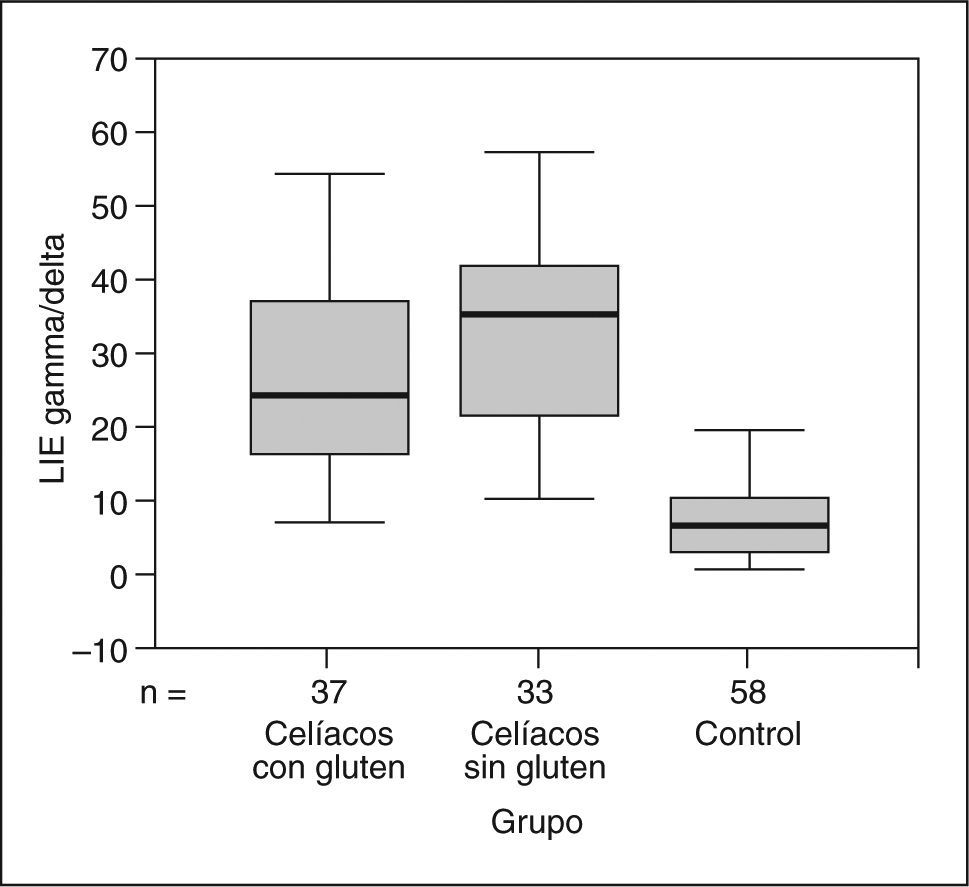
Linfocitos intraepiteliales TCR g/dComo se muestra en la figura 2, los pacientes celíacos (tanto los del grupo I que consumían gluten como los del grupo II que realizaban dieta sin gluten) presentaron unos valores medios significativamente superiores de LIE TCR γ/δ (29,3 ± 13,6%) que los pacientes del grupo control (p < 0,05). El porcentaje medio de LIE TCR γ/δ fue del 8,4% (mediana 6,9%) en el grupo control, y los percentiles 10 y 90 se establecieron en 1,7 y 16,5%, respectivamente.
Cuando se compararon los valores medios de LIE TCR γ/δ entre los grupos I (26,6 ± 13,9%) y II (32,4 ± 12,8%),
Linfocitos intraepiteliales CD3–/CD7+Como se muestra en la figura 3, el porcentaje medio de LIE CD3−/CD7+ observado en los pacientes controles fue del 14,7% (mediana 10,2%); los percentiles 10 y 90 se establecieron en 3,4 y 33,8%, respectivamente. Los valores medios de LIE CD3−/CD7+ en los 2 grupos de pacientes celíacos (I y II) fueron del 2,5 ± 2%. Hay que reseñar que los valores medios de LIE CD3−/CD7+ observados en cada subgrupo de pacientes celíacos fueron significativamente más bajos que los del grupo control (p < 0,05). Además, se observaron pequeñas diferencias, aunque no significativas estadísticamente (p > 0,05), cuando se compararon los valores medios de LIE CD3−/CD7+ de los pacientes celíacos que consumen gluten (2,3 ± 2,1%) y los que realizan dieta sin gluten (2,8 ± 1,9%).
Sexo y edadCuando se analizó la cifra media de LIE totales, γ/δ y CD3−/CD7+, no se encontraron diferencias estadísticamente significativas (p > 0,05) en relación con el sexo o la edad de los pacientes de cada grupo.
Tipificación de HLA-clase IILa tipificación serológica de HLA-clase II se realizó mediante la técnica de microlinfocitotoxicidad en placas de Terakasi en un total de 42 pacientes celíacos de los grupos I y II (60%). Los 42 (100%) presentaban asociado el HLA-DQ2. Treinta y ocho de ellos (90,5%) presentaban el haplotipo HLA-DR3. Los 4 restantes (9,5%) mostraban el haplotipo HLA-DR5/DR7.
DISCUSIÓNEn los 3 grupos había un predominio del sexo femenino (3:1). En cuanto a la edad, entre los grupos II y III había mayores diferencias en la media de edad, lo que puede explicarse porque gran parte de los pacientes del grupo II fueron diagnosticados en la infancia y remitidos posteriormente desde la consulta de pediatría a la de gastroen terología de adultos, por lo que se trata de pacientes más jóvenes.
Es conocido por estudios previos9–17, principalmente llevados a cabo por técnicas de inmunohistoquímica, que en la mucosa intestinal de los pacientes con EC se produce un incremento de LIE TCR γ/δ. En este estudio, al igual que en el estudio previo de Camarero et al1 realizado en población pediátrica, se ha constatado que hay una población de LIE que se encuentra disminuida en los pacientes celíacos, independientemente de la dieta que realicen. Las características fenotípicas de esta subpoblación de LIE son: CD7+, CD45+, CD103+, CD2+ (marcadores linfoides); CD3−, TCR−, CD4−, CD8−, CD5− (ausencia de marcadores linfoides T); CD56+, CD16+ (marcadores específicos de células natural killer implicados en fenómenos de citotoxicidad directa no asociados al MHC). Un estudio previo demostró la actividad natural killer de esta subpoblación de LIE, que puede desempeñar un importante papel en la inmunidad innata de la mucosa (defensa frente a infecciones, vigilancia tumoral) y en la tolerancia a determinados antígenos18. Nuestro estudio también demuestra, al igual que los estudios previos realizados en pacientes celíacos en edad pediátrica, que hay un porcentaje aumentado en cuanto a la expresión TCR γ/δ en células CD3+, así como un bajo porcentaje de células CD3−/CD7+(natural killer), independientemente de la dieta que realicen, cuando se comparan con sujetos no celíacos1–4.
A partir de los resultados obtenidos se puede deducir que la cifra de LIE totales está elevada cuando hay un estímulo antigénico que provoca una reacción por parte de la mucosa intestinal, como es el caso del gluten, y se normaliza cuando dicho estímulo desaparece o no existe. Se trataría de un marcador inespecífico que puede indicar la existencia de «una agresión a la mucosa». La cifra de LIE γ/δ puede estar aumentada en algunas enfermedades distintas de la EC, como es en el caso de la giardiasis o en determinadas alergias alimentarias (soja, proteínas de leche de vaca, huevo). Sin embargo, hasta ahora no se han descrito descensos en la población de LIE CD3−/CD7+, salvo en la EC.
Según los resultados obtenidos en este estudio, la cifra de LIE γ/δ y de LIE CD3−/CD7+ sería un marcador inherente a la propia enfermedad celíaca, con independencia de la dieta realizada.
Por todo ello, la determinación de la ratio TCR γ/δ y CD3−/CD7+ por citometría de flujo en biopsias intestinales podría convertirse en un marcador útil para el diagnóstico de la EC, sobre todo en determinados casos:
- 1.
En la EC clásica en el momento del diagnóstico: como apoyo al estudio anatomopatológico que no es patognomónico de la enfermedad.
- 2.
En los pacientes que realizan una dieta sin gluten puede ser el único marcador constante.
Si bien el estudio se realizó en pacientes con diagnóstico de EC según los criterios clásicos (anticuerpos antiendomisio positivos y atrofia vellositaria de grado III de Marsh), creemos que no se pueden extraer conclusiones en cuanto a los pacientes con EC latente o potencial, dado que no se incluyó a los pacientes con este diagnóstico. No obstante, podría ser interesante realizar la determinación de LIE por citometría de flujo en este subgrupo de pacientes, en estudios futuros, para avalar los resultados obtenidos en este trabajo. Igualmente, podría estudiarse la utilidad diagnóstica en presentaciones atípicas de la enfermedad, así como en los casos de déficit asociado de IgA en los cuales los anticuerpos séricos más específicos serían negativos.
La citometría de flujo es un método de lectura rápido, que permite analizar un elevado número de células (de 10.000 a 50.000 para cada anticuerpo monoclonal) y proporciona un registro computarizado de los resultados. Presenta ventajas respecto a otras técnicas como la inmunohistoquímica, al ser rápida, objetiva y permitir la realización de marcados múltiples19–21. Al ser la distribución de los LIE difusa y regular a lo largo del epitelio, es una técnica reproducible, con la que se obtienen linfogramas similares y estables en el tiempo en un mismo paciente, a pesar de no proceder exactamente de la misma localización.
La determinación de las subpoblaciones de LIE por citometría de flujo creemos que aporta información que complementa a la aportada por el estudio histológico en el diagnóstico de la EC. Destacan la capacidad de predecir positivamente la enfermedad por parte del aumento de LIE γ/δ, y el importante valor predictivo negativo de la normalidad de los LIE CD3−/CD7+.
Por último, los haplotipos HLA clase II encontrados en la muestra de pacientes celíacos estudiados (60%) es muy similar a lo descrito en la bibliografía, es decir, el predominio del HLA DQ2 y los HLA DR3 y DR5/DR722.