La relación entre enfermedad inflamatoria intestinal (EII) y gestación plantea problemas clínicos relevantes. En el artículo analizamos, entre otros, los datos existentes acerca de la influencia mutua entre una y otra, la incidencia de enfermedad y los fármacos en maternidad, paternidad, parto y lactancia, las modificaciones en el curso del parto que pudieran ser necesarias y la influencia de la enfermedad en fecundidad y sexualidad. La conclusión más relevante es que es muy recomendable que la EII esté inactiva en el momento de planificar una gestación, que la mayoría de los fármacos se pueden emplear con tranquilidad (con la notoria excepción del metotrexato, entre otros) y que la procreación no tiene por qué verse limitada en estas personas.
The coexistence of inflammatory bowel disease and pregnancy poses a major clinical challenge. The present article analyzes data on the mutual influence of the two entities, the effect of the disease and its pharmacological treatment on maternity, paternity, delivery and breast-feeding, the modifications that may be required during delivery, and the influence of the disease on fertility and sexuality, among other factors. The most important conclusions are the strong recommendation that inflammatory bowel disease be inactive when planning a pregnancy, that most drugs can be safely used (with the notorious exception of methotrexate, among others) and that reproduction does not need to be limited in these patients.
Se ha dicho numerosas veces que la enfermedad inflamatoria intestinal (EII) es una entidad de incidencia creciente1,2 que afecta a personas en edad reproductiva y que por esa razón hay que tenerla en cuenta de uno u otro modo en el momento en que un paciente afectado decide que quiere tener descendencia. Esto es rigurosamente cierto y, si bien la mayoría de las veces estos esfuerzos reproductivos terminan con éxito, no deja de haber un grupo de pacientes en los que se generan dudas, razonables o no, que pueden plantear dificultades de diverso orden.
Puede ser interesante dar algunos datos. La incidencia de la EII en España se calcula al menos de unos 2 a 9 casos por 100.000 habitantes al año en el caso de la colitis ulcerosa (CU) y de 4 a 6 casos por 100.000 habitantes al año para la enfermedad de Crohn (EC)1,2. Las edades de presentación son diversas, pero se agrupan en las 3 o 4 primeras décadas de la vida, lo que corresponde a la fase reproductiva del ser humano2. No sólo esto es fuente de problemas, pues si la enfermedad fuera de curso agudo, no influiría tanto durante la vida de los pacientes. Sin embargo, como es bien conocido, son enfermedades crónicas que precisan frecuentemente tratamientos a largo plazo3–5, que serán un factor para tener en cuenta en los momentos en que se decida intentar la reproducción. Otro último elemento para considerar es la posible aparición de factores fisiológicos o anatómicos que dificulten la función reproductiva, como pueden ser malnutrición, deficiencias vitamínicas o lesiones posquirúrgicas, entre otros. No podemos terminar sin tener en cuenta que la sexualidad humana va más allá del coito y que, por esto, hay situaciones en las que los pacientes con EII presentarán alteraciones psicológicas que pueden tener también su incidencia en este terreno.
Quisiéramos ser capaces de dar con este documento una guía que el médico que trata pacientes con EII pueda tener a mano, ya que no pasa mucho tiempo sin que algún paciente nos plantee una cuestión en torno al tema que nos ocupa. La existencia de un texto de referencia rápida y actualizada debe ser beneficiosa para todos.
Fertilidad y fecundidad en la enfermedad inflamatoria intestinalSe denomina fertilidad a la capacidad potencial de generar descendencia. El término infertilidad tiene en general un significado práctico y se define habitualmente como la disminución parcial o completa en la capacidad de concebir y tener descendencia tras un período de 12 meses de relaciones sexuales regulares sin utilización de métodos anticonceptivos6. El término fecundidad se define como la capacidad real de concebir, se estima por lo general por períodos de tiempo y se expresa como fecundabilidad, que es la probabilidad de embarazo por ciclo menstrual al mantener relaciones sexuales sin protección7.
Antes de tener en cuenta los estudios disponibles en cuanto a fertilidad y a fecundidad en la EII, es necesario recordar que la mayoría datan de hace tiempo, antes de la aparición del tratamiento con fármacos biológicos y de la generalización del uso de los fármacos inmunomoduladores.
Fertilidad y fecundidad en la mujer con enfermedad inflamatoria intestinal- a)
Enfermedad de Crohn
Existen datos contradictorios sobre la fertilidad en mujeres con EC. En líneas generales, parece que se encuentra disminuida cuando la enfermedad está activa y revierte a la normalidad una vez controlada ésta8. La dispareunia, los efectos sistémicos de la enfermedad y los efectos secundarios de algunos fármacos sobre la libido disminuyen la actividad sexual y dificultan así la concepción en el momento del brote9.
Fuera de la fase aguda, hay datos algo dispares. En un amplio estudio internacional publicado en 198610, se describió que la fertilidad de las mujeres con EC en el período previo al inicio de la enfermedad era similar a la de los controles. Sin embargo, tras el diagnóstico disminuyó a la mitad. Como posibles causas se señalaron 2: el que un grupo de mujeres con EC recibiera consejo médico en contra de la gestación (lo que quizás invalide estas observaciones) y la mayor edad de las mujeres con EC en el momento de intentar la concepción11. Todos los resultados fueron independientes de la localización de la enfermedad. Estos datos contrastan con los obtenidos por otros autores tanto previamente12 como posteriormente13,14, para quienes el porcentaje de infertilidad era similar al de la población general y se estimaba en un 5–14%, aunque algo mayor para las pacientes con intervención quirúrgica previa.
- b)
Colitis ulcerosa
La fertilidad en las mujeres con CU es similar a la de la población general15–22. Sin embargo, la fecundidad disminuye en aquellas mujeres con CU que precisan una proctocolectomía con reservorio ileoanal. Un metaanálisis publicado en el año 200620 encontró un riesgo relativo de infecundidad de 3 tras esta cirugía: la infecundidad del 15% en la CU en tratamiento médico aumentaba a un 48% tras la realización del reservorio, y una reciente revisión sistemática, con un total de 945 pacientes, calculó una tasa de infecundidad previa a la proctocolectomía del 12% y posterior a la cirugía del 26%23. Quizás este riesgo de infecundidad es mayor en las mujeres en las que la técnica quirúrgica fue más dificultosa21, con una mayor superficie disecada, lo que contribuyó a la formación de adherencias y de disfunción de las trompas de Falopio, que es probablemente el factor más importante en este contexto22,24. Es muy importante considerar que, dada la especial relación entre la colectomía con anastomosis ileoanal y la infecundidad25, en mujeres intervenidas en edades tempranas podrían considerarse otras técnicas con menor repercusión en la fertilidad. Por ejemplo, una colectomía con ileostomía y preservación rectal o una colectomía con ileoproctostomía se asocian a menos lesiones pélvicas y pueden adoptarse como solución temporal en mujeres con deseo claro de descendencia. Una vez conseguida ésta, se procedería a completar la técnica con la creación de un reservorio, la proctectomía y la anastomosis ileoanal.
En estas pacientes con infecundidad posquirúrgica es importante valorar la fecundación in vitro15. Por todo lo expuesto anteriormente, es ineludible que la cuestión de la fecundidad se trate con la paciente en el momento de informar de los riesgos potenciales de la intervención quirúrgica.
Se ha puesto poca atención en los problemas de reproducción y fertilidad de los hombres con EII. Debemos recordar que estos pacientes están especialmente expuestos a fármacos, a intervenciones quirúrgicas y a trastornos del estado de ánimo que pueden afectar la libido, producir disfunción eréctil y disminuir la fertilidad.
Algunos investigadores han valorado la tasa precisa de infertilidad en hombres con EII. En un estudio en el que se incluyó a 106 varones con EC, a 62 con CU y a 140 controles sanos emparejados por edad, se encontró que las tasas globales de embarazo eran menores en las parejas de los pacientes con EII que en los controles26. Sin embargo, no hubo diferencia significativa en la fecundidad, es decir, el tiempo que se tarda en conseguir la gestación en la pareja, por lo que estos autores concluyeron que los hombres con EII no presentaban trastornos reproductivos y que las bajas tasas de paternidad tras el diagnóstico de la EII posiblemente estaban relacionadas con el deseo voluntario de evitar la concepción. En otro estudio, en el que se compararon 70 varones con EC con controles sanos, se encontró que la tasa de embarazo antes del diagnóstico de la EII era similar a la de los controles27. Luego del diagnóstico, esta disminuía independientemente del uso de esteroides o de sulfasalazina. Los autores concluyeron que los pacientes con EC tienen menores tasas de fertilidad, pero no quedó claro si esta diferencia era el resultado directo de la EII o del uso deliberado de métodos de control del embarazo tras el diagnóstico de la EII. Ciertos estudios han asociado el mal estado nutricional a anormalidades en la función espermática en varones con EII. Por ejemplo, se sabe que el cinc es importante en la espermatogénesis, y en una revisión crítica se indica que la deficiencia de cinc, que se ha hallado en hasta un 70% de los pacientes con EC28, puede contribuir a la infertilidad en hombres con esta enfermedad. Finalmente, se ha comunicado la presencia de anticuerpos antiesperma tanto en hombres como en mujeres con EII, y esto podría contribuir a la infertilidad29.
Alteraciones en la sexualidadLos factores psicológicos, tan importantes en la EII, influyen sin duda en la sexualidad. Aun sin existir problemas sexuales reconocibles, puede provocarse una disfunción. Los pacientes con EII presentan síntomas que pueden interferir en las relaciones sexuales (astenia, diarrea, dolor abdominal, incontinencia fecal, etc.), la enfermedad perianal está presente en un cuarto a un tercio de los enfermos de EC, muchos pacientes precisan intervenciones quirúrgicas y algunos requieren estomas transitorios o permanentes. La malnutrición o algunos tratamientos como los corticoides pueden cambiar la apariencia corporal y, por último, la depresión es común en la EII.
La actividad sexual se encuentra disminuida en mujeres con EC y CU30,31, y esto puede afectar hasta al 80% de ellas: existe una fuerte relación con la presencia de alteraciones del ánimo de tipo depresivo. Es importante conseguir un ambiente de comprensión social y dentro de la pareja para hacer frente de forma óptima a las consecuencias de la EII. El tratamiento de los trastornos del estado de ánimo puede a veces ser más importante que un tratamiento sexual específico32.
En cuanto a los varones33, se describe que hasta el 44% se ve afectado sexualmente por su enfermedad, lo que contrasta con un porcentaje de disfunción eréctil similar a la población general (6–10%). De nuevo, la depresión tuvo un impacto notable. La función sexual fue mejor en varones con enfermedad de larga duración, probablemente debido a la aceptación de la enfermedad tanto por el paciente como por sus parejas34.
En nuestro medio, se ha descrito que la influencia de la EII en la sexualidad está condicionada por la actividad de la enfermedad y la depresión35. Fueron llamativos los resultados sobre la percepción subjetiva de los pacientes en relación con su sexualidad: un 66% describió cambios debidos a su enfermedad, un 24% presentaba sentimientos negativos hacia ellos mismos y su cuerpo, más del 20% presentaba dolor abdominal durante las relaciones sexuales y algo más del 6% tenía miedo a la incontinencia fecal durante el sexo.
El deseo de evitar la transmisión de la EII a la descendencia y de no arriesgarse a la exposición fetal a los tratamientos puede conducir a una infecundidad voluntaria. Es importante una estrecha comunicación y colaboración entre el paciente, su pareja, el gastroenterólogo y el obstetra para tomar las decisiones oportunas conjuntamente y de manera informada36.
Medicaciones y reproducciónInfluencia de la medicación y otros factores en el varón con enfermedad inflamatoria intestinal (tabla 1)La práctica totalidad de casos de alteraciones espermáticas relacionadas con aminosalicilatos se debe a la sulfasalazina, aunque la oligospermia por mesalazina no es imposible37–40. Esta oligospermia es reversible tras la suspensión del fármaco o con el cambio a mesalazina41–43, pero se debe recordar que inclusive dosis tan bajas como de 500mg de sulfasalazina pueden producirla. Como el tiempo de espermatogénesis es de 64 días, el cambio debería hacerse al menos 3 meses antes de intentar la concepción. Por otra parte, es preciso avisar a los pacientes que la sulfasalazina no es un anticonceptivo. En cuanto a la teratogenicidad, a pesar de existir alguna comunicación aislada44, se considera que los aminosalicilatos son seguros.
Recomendaciones sobre la utilización de medicamentos en el varón que desee descendencia
| Medicación y recomendación |
|
6-MP: mercaptopurina; AZA: azatioprina.
No se ha descrito efecto negativo del tratamiento con glucocorticoides en la fertilidad masculina ni aumento de anomalías congénitas en la descendencia6,27. Es más, los corticoides se utilizan actualmente en el tratamiento de la infertilidad inmunológica, sin evidencia de un aumento de anomalías congénitas. Por esto, sobre la base de los limitados datos disponibles, el tratamiento corticoideo se puede continuar durante el período de la concepción.
El metotrexato puede afectar a la fertilidad masculina al causar alteraciones en la espermatogénesis45,46. Se dispone de información aislada acerca de gestaciones procedentes de varones tratados con metotrexato47, pero dado que no tenemos datos de seguridad suficientes y vista la teratogenicidad descrita tras exposición de la madre, se recomienda suspender el metotrexato durante al menos 4 meses antes de intentar la concepción6.
La azatioprina (AZA) y la mercaptopurina (6-MP) parecen no influir por lo general en la calidad del esperma en hombres con EII en comparación con pacientes con EII sin este tratamiento14, aunque en alguna ocasión ha habido datos clínicos y experimentales que apuntaban en ese sentido48–50. En cuanto a las malformaciones congénitas, hay autores que comunican la aparición de anomalías en hijos de varones tratados con tiopurinas51–53, mientras que otros no han observado este efecto54. En una serie de nuestro ámbito55, la más importante en este aspecto, se comparó a 47 pacientes varones con EII tratados con tiopurinas al momento de la concepción o en los 3 meses previos a esta con 84 pacientes con EII no tratados con tiopurinas en el momento de la concepción. No se encontraron diferencias significativas en cuanto a las tasas de fertilidad, abortos, malformaciones congénitas, bajo peso al nacer ni prematuridad. Basados en estos resultados, y dada la escasa calidad de las series previas que creían detectar efectos adversos en la descendencia de varones expuestos a tiopurinas, no recomendamos a nuestros pacientes de manera general suspender el tratamiento con tiopurinas en caso de buscar la paternidad.
No hay datos claros sobre los efectos de la ciclosporina y el tacrolimus en la fertilidad masculina ni comunicación de efectos colaterales en la descendencia de varones tratados con estos fármacos.
En cuanto a los fármacos biológicos, el infliximab parece presentar pocos efectos sobre la fertilidad. Los datos en ratones no encontraron efectos adversos sobre la reproducción56. Diversos estudios han observado cambios en la morfología y la motilidad de los espermatozoides, sin afectar al número, en varones tratados con infliximab, hecho que hasta la actualidad no se ha relacionado con una disminución de la fertilidad57. Respecto a las malformaciones en la descendencia, existen pocos trabajos publicados, pero no se ha descrito un aumento de éstas58. En este momento no se recomienda suspender el tratamiento con infliximab en varones que estén considerando la concepción. Los riesgos de la interrupción del tratamiento incluyen un brote de la EII subyacente y el desarrollo de anticuerpos frente a infliximab que pueden impedir su reintroducción. Sólo si la infertilidad es clínicamente evidente y la evaluación de la pareja infértil indica que la calidad del semen es anormal, en ausencia de otros factores de riesgo de infertilidad, se debe considerar la suspensión del tratamiento con infliximab6. Son menores aún los datos sobre adalimumab, aunque cabe suponer una identidad de clase.
Influencia de los fármacos y otros factores médicos en la mujer con enfermedad inflamatoria intestinalAntes de abordar este asunto, es conveniente recordar las categorías en que la FDA clasifica los fármacos en relación con su posible efecto en el embarazo59 (tabla 2). Después, expondremos el riesgo asociado a las diferentes clases de fármacos (tabla 3).
- a)
Salicilatos
Algunos aminosalicilatos (sulfasalazina, mesalazina y balsalazida) pertenecen a la categoría B de la FDA, mientras que la olsalazina pertenece a la categoría C. Diversos trabajos publicados, tanto series de casos como ensayos controlados y estudios de cohorte de base poblacional, no han demostrado un aumento del riesgo teratogénico con la mesalazina60–64.
En los primeros momentos de su empleo, se indicó teratogenicidad asociada al tratamiento con sulfasalazina con evidencia de enfermedades cardiovasculares y genitourinarias y de defectos neurológicos65–67. Sin embargo, en trabajos posteriores más amplios68,69, no se encontró un aumento significativo de anomalías congénitas. Se recomienda, como en todo tratamiento con sulfasalazina, tomar suplementos de ácido fólico (2mg diarios), tanto en el período de preconcepción como durante todo el embarazo, para evitar los posibles efectos antifolato del fármaco y así disminuir el peligro de defectos del tubo neuronal, anomalías cardiovasculares y del tracto urinario y fisuras orales70.
- b)
Antibióticos
El uso de ciclos de corta duración de metronidazol y de quinolonas parece no tener efectos adversos importantes durante el embarazo6. El metronidazol pertenece a la categoría B. Múltiples trabajos han indicado que el uso prenatal de metronidazol no se asocia a malformaciones congénitas71–75, con excepción de un estudio poblacional de casos y controles76, en el que los nacidos de mujeres expuestas al metronidazol durante el segundo y el tercer mes de embarazo tenían tasas más altas de labio leporino con o sin hendidura del paladar, sin ser esta diferencia estadísticamente significativa.
Las quinolonas pertenecen a la categoría C según la FDA, tienen una alta afinidad por el tejido óseo y el cartílago y pueden causar artropatías en niños77. Existen 2 estudios donde no se encuentra un mayor riesgo de malformaciones congénitas78,79. En general, el riesgo se considera mínimo, pero si se tiene en cuenta que existen alternativas más seguras, el fármaco debe evitarse, sobre todo en el primer trimestre6,36.
La rifaximina pertenece a la categoría C de la FDA. Al ser una medicación relativamente nueva, existe poca información sobre su seguridad en el embarazo. En ratas no se ha encontrado ni afectación de la fertilidad ni en la evolución del embarazo80, pero sí puede causar complicaciones teratogénicas81. En general, dada además la escasa evidencia que existe de beneficio en EII, debe evitarse durante el embarazo36.
Cuando se necesita un antibiótico, una buena elección sería la amoxicilina-ácido clavulánico, que corresponde a la categoría B de la FDA y cuyo uso no se ha asociado a teratogenicidad82,83.
- c)
Glucocorticoides
Los glucocorticoides, incluida la budesonida, se incluyen en la categoría C. Aunque algunos estudios describieron un aumento de paladar hendido en los nacidos de madres que tomaron glucocorticoides durante el primer trimestre84–86, un estudio controlado prospectivo realizado posteriormente en más de 300 gestantes no confirmó estos resultados87. Los glucocorticoides atraviesan la placenta, pero esto tiene muy pocos riesgos para el niño cuando se utilizan en el primer trimestre8. Aunque teóricamente puede aparecer una supresión suprarrenal en el recién nacido, en la práctica clínica diaria no se observa. Ello no resta importancia al hecho de que el neonatólogo que vaya a tener contacto con el recién nacido esté informado de este extremo. No se ha descrito aumento de complicaciones en el embarazo68. Las preparaciones rectales de glucocorticoides pueden utilizarse hasta el tercer trimestre, excepto si existen problemas de aborto o prematuridad88. Es importante informar a la madre de los beneficios y los riesgos del tratamiento corticoideo6,36.
Existen muy pocos datos sobre la seguridad de budesonida oral durante el embarazo, pero los casos descritos no presentaron efectos adversos mayores89. La budesonida inhalada o intranasal tampoco se ha asociado a efectos secundarios90,91.
- d)
Bifosfonatos
Los bifosfonatos (el alendronato y el risedronato, entre otros) se utilizan en los pacientes con EII para el tratamiento y la prevención de la osteoporosis. Pertenecen a la categoría C y deben evitarse en el embarazo. Estos fármacos se acumulan en el hueso y se liberan lentamente durante mucho tiempo (el alendronato durante más de 10 años), por lo que el feto se encuentra expuesto de forma continua al fármaco. El único estudio del que disponemos describió la exposición a alendronato de 24 mujeres embarazadas sin encontrarse un mayor riesgo de efectos adversos fetales92; sin embargo, en animales sí se han descrito cambios anatómicos93. El uso a largo plazo de los bifosfonatos en mujeres en edad fértil debe hacerse con precaución y bajo la orientación de un especialista en Endocrinología6.
- e)
Inmunomoduladores
El metotrexato pertenece a la categoría X, lo que significa que está contraindicado en el embarazo. Es claramente teratogénico y no debe usarse en mujeres que están considerando la concepción. Su uso durante el período crítico de la organogénesis (6–8 semanas después de la concepción) se asocia a anomalías congénitas múltiples llamadas en conjunto «embriopatía por metotrexato» o «síndrome fetal metotrexato-aminopterina»94, que se caracterizan por el retraso en el crecimiento intrauterino, la disminución de la osificación de la bóveda craneal, la hipoplasia de las crestas supraorbitarias, las orejas pequeñas con base de implantación baja, la micrognatia, las anomalías en las extremidades y, en ocasiones, el retraso mental95. La exposición en el segundo y el tercer trimestre puede estar asociada a toxicidad y a mortalidad fetales94. Se recomienda la suspensión del fármaco de 3 a 6 meses antes de intentar la concepción6,36. Si una mujer se queda embarazada mientras toma metotrexato y no concibe el aborto terapéutico, se debe suspender el fármaco e iniciar la toma de ácido fólico en altas dosis96.
La AZA y la 6-MP pertenecen a la categoría D según la FDA. Aunque estudios en animales mostraron un efecto teratogénico, los diversos trabajos publicados tanto en mujeres trasplantadas como en pacientes con EII no han demostrado un aumento de anomalías congénitas, por lo que a menudo se utilizan en el embarazo para mantener la remisión materna54, 97–101. La transmisión transplacentaria y transamniótica de la AZA y sus metabolitos al feto puede ocurrir102, sin embargo, el metabolismo fetal no procesa las tiopurinas, lo que lo protege de sus efectos8.
La ciclosporina pertenece a la categoría C. Aunque existe un metaanálisis de 15 estudios en el que se encontró una tasa de malformaciones mayores similar a la de la población general103, hay muy pocos casos publicados de la utilización con éxito de este fármaco en embarazadas con CU fulminante104–106. Se recomienda su uso sólo para evitar la colectomía durante el embarazo6,36,107, ya que presenta alta toxicidad materna (hipertensión, nefrotoxicidad y hepatotoxicidad).
El tacrolimus se incluye también en la categoría C. Hay un solo caso comunicado de gestación bajo tacrolimus tacrolimus en una paciente con EII, con resultado feliz108. En estudios en pacientes trasplantadas se ha descrito un mayor riesgo de prematuridad, tasas algo más elevadas de anomalías congénitas (aunque ninguna persistente) y una mayor incidencia de hiperpotasemia y de diabetes perinatal109,110. Los efectos secundarios maternos son menores que los de la ciclosporina111.
La talidomida, de la categoría X, está contraindicada en el embarazo. Su teratogenicidad, incluyendo defectos de las extremidades, del sistema nervioso central y alteraciones del aparato respiratorio, cardiovascular, digestivo y genitourinario, se encuentra ampliamente documentada94. Las mujeres en edad fértil que precisen su uso deben utilizar 2 métodos anticonceptivos durante un mes antes de iniciar el tratamiento, durante el tratamiento y durante un mes después de dejar el tratamiento112.
- f)
Biológicos
El infliximab pertenece a la categoría B del embarazo, y la evidencia científica disponible hasta la fecha indica que es un fármaco con bajo riesgo en la gestación. Los datos más amplios de los que disponemos son el registro de tratamiento del infliximab, que incluye prospectivamente a más de 6.000 pacientes con EII, de los que 36 corresponden a mujeres embarazadas que han precisado el tratamiento biológico previamente al embarazo113, y la base de datos de seguridad del infliximab gestionada por Centocor®, donde se encuentra de forma retrospectiva a 96 mujeres con exposición directa al biológico (bien durante la concepción o bien en el primer trimestre)58. En ningún caso se han descrito malformaciones fetales, sin encontrarse diferencias entre la tasa de aborto involuntario y las complicaciones neonatales con los enfermos con EII sin tratamiento biológico, en el primer caso, y con la población general, en el segundo caso. Existen otras series con menor número de pacientes donde tampoco se han descrito malformaciones congénitas114–116. El infliximab no cruza la placenta en el primer trimestre del embarazo, pero puede hacerlo en el tercer trimestre117; esto es importante, ya que durante el período de la organogénesis no hay exposición al fármaco36. En 2 trabajos se han descrito niveles elevados de infliximab en niños cuya progenitora recibía el fármaco; los niveles descendieron hasta hacerse indetectables a los 6–7 meses, incluso cuando los niños estaban recibiendo lactancia materna116–118. El efecto del infliximab en el sistema inmunológico del recién nacido no se conoce, aunque en uno de los trabajos anteriores se comprobó que a los 7 meses el bebé tenía un recuento de células B y T normales y se consiguió una respuesta adecuada a la vacunación. Se aconseja detener el tratamiento con el infliximab durante el tercer trimestre, de ser posible, para disminuir el paso placentario y así disminuir los niveles en el recién nacido. El tratamiento puede reestablecerse inmediatamente después del parto. Si la enfermedad rebrota durante este tiempo, se pueden administrar las dosis de infliximab según el intervalo normal o bien optar por glucocorticoides durante este período36.
El adalimumab, de categoría B según la FDA, parece presentar también un bajo riesgo en el embarazo. Todos los datos publicados, bien sean casos aislados o registros119–122, describieron una tasa de aborto espontáneo, mortinatos, prematuridad y malformaciones congénitas similares a la de la población general. Aunque se espera que atraviese la placenta en el tercer trimestre, como el infliximab, los niveles de adalimumab no se pueden comprobar comercialmente, por lo que no se han podido confirmar. Como la administración del medicamento es quincenal y hay tiempo suficiente para que rebrote la enfermedad si lo suspendemos en el tercer trimestre, actualmente se recomienda hacerlo de 6 a 8 semanas antes de la fecha prevista de parto36.
El certolizumab, de categoría B según la FDA, es un fragmento del anticuerpo anti-TNF. En ratas, los niveles en la descendencia y en la leche materna son menores que con el anticuerpo completo123; sin embargo, el hecho de poder cruzar la placenta en el primer trimestre, cosa que el anticuerpo completo no hace, es una preocupación por no saber las consecuencias que esto supone, ya que el feto estaría expuesto al fármaco en el período de organogénesis. Se necesitan estudios en humanos para conocer los riesgos36
El natalizumab pertenece a la categoría C. Las recomendaciones actuales en el embarazo consideran su uso según las necesidades individuales36.
- g)
Estudios endoscópicos, preparación del colon y medicación para sedación
Los estudios endoscópicos no aumentan el riesgo de parto prematuro o de anomalías fetales, y tanto la colonoscopia como la sigmoidoscopia y la rectoscopia rígida son seguras durante el embarazo124,125. Siempre se debe hacer una indicación óptima y, si es posible, se debe diferir la exploración al segundo trimestre o al posparto; están contraindicadas en situación de parto inminente, rotura de membranas, placenta previa y eclampsia126. La frecuencia cardíaca fetal puede monitorizarse durante el procedimiento, especialmente en la colonoscopia, y si se precisa sedación, deben utilizarse la menor cantidad de fármaco y la menor dosis posible, y se deben seleccionar fármacos del grupo B según la FDA.
La seguridad de las soluciones de limpieza colónica (polietilenglicol y soluciones de fosfato de sodio) durante el embarazo no se ha estudiado. Se consideran de categoría C según la clasificación de la FDA. Si es necesario realizar una colonoscopia completa, se prefiere el uso de polietilenglicol, ya que existe un caso publicado de retraso en el crecimiento óseo de un recién nacido cuya madre utilizaba de forma repetida enemas de fosfatos127. Para la realización de una rectosigmoidoscopia, la mejor alternativa es el uso de enemas de agua con sal común a concentración de salino fisiológico.
La meperidina pertenece al grupo B de la FDA, no se ha evidenciado teratogenicidad y se prefiere su uso al de la morfina o el fentanilo, este último pertenece al grupo C y parece seguro en humanos si se emplea en dosis bajas126. Las benzodiacepinas pertenecen al grupo D y deben evitarse en las embarazadas, sobre todo el diacepam, que se ha asociado a teratogenicidad. La benzodiacepina de elección es el midazolam (siempre que se utilice fuera del primer trimestre)128. El propofol pertenece a la categoría B de la FDA y se recomienda que lo utilice un anestesista en embarazadas; no queda claro su uso durante el primer trimestre126. No se deben emplear antiespasmódicos como el butilbromuro de hioscina (Buscapina®)88.
Categorías en que la Food and Drug Administration clasifica los fármacos en relación con su posible efecto en el embarazo
| Categoría A | Estudios controlados en animales y mujeres embarazadas no muestran riesgo en el primer trimestre y posiblemente es infrecuente el daño fetal |
| Categoría B | Estudios en animales no muestran riesgos fetales pero no hay estudios controlados en humanos o en los estudios de animales se han observado efectos adversos, pero no se han confirmado en estudios controlados en mujeres en el primer trimestre |
| Categoría C | Se han realizado estudios no controlados en humanos y en los estudios en animales se han observado efectos adversos o los estudios en humanos y animales no son válidos; se deben usar si el beneficio potencial sobrepasa el riesgo |
| Categoría D | Existe evidencia positiva de riesgo fetal, sin embargo, los beneficios pueden superar a los riesgos si existe riesgo para la vida o la enfermedad es grave |
| Categoría X | Estudios en animales o en humanos muestran anomalías fetales (fármacos contraindicados) |
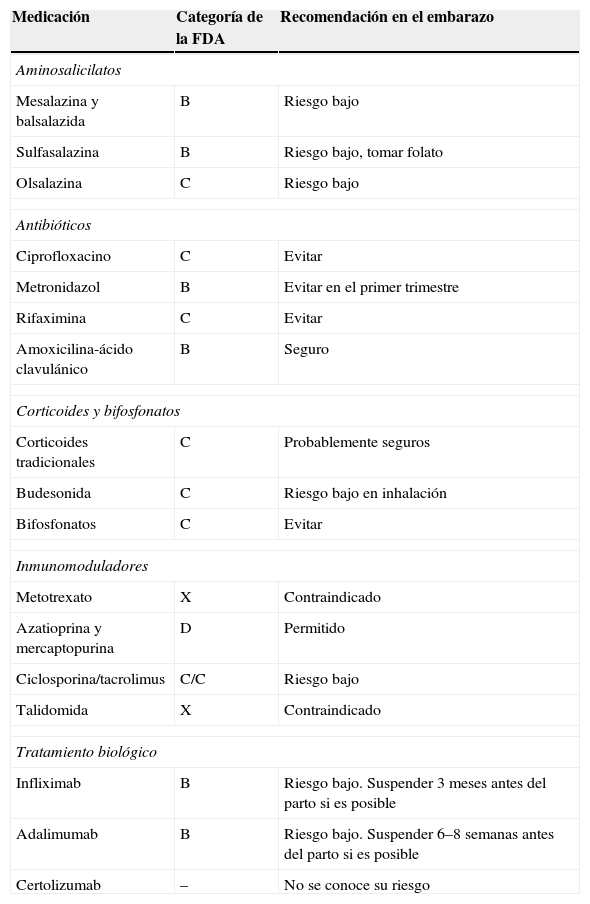
Recomendaciones sobre la utilización de medicamentos en la mujer embarazada
| Medicación | Categoría de la FDA | Recomendación en el embarazo |
| Aminosalicilatos | ||
| Mesalazina y balsalazida | B | Riesgo bajo |
| Sulfasalazina | B | Riesgo bajo, tomar folato |
| Olsalazina | C | Riesgo bajo |
| Antibióticos | ||
| Ciprofloxacino | C | Evitar |
| Metronidazol | B | Evitar en el primer trimestre |
| Rifaximina | C | Evitar |
| Amoxicilina-ácido clavulánico | B | Seguro |
| Corticoides y bifosfonatos | ||
| Corticoides tradicionales | C | Probablemente seguros |
| Budesonida | C | Riesgo bajo en inhalación |
| Bifosfonatos | C | Evitar |
| Inmunomoduladores | ||
| Metotrexato | X | Contraindicado |
| Azatioprina y mercaptopurina | D | Permitido |
| Ciclosporina/tacrolimus | C/C | Riesgo bajo |
| Talidomida | X | Contraindicado |
| Tratamiento biológico | ||
| Infliximab | B | Riesgo bajo. Suspender 3 meses antes del parto si es posible |
| Adalimumab | B | Riesgo bajo. Suspender 6–8 semanas antes del parto si es posible |
| Certolizumab | – | No se conoce su riesgo |
FDA: Food and Drug Administration.
Los efectos de la EII en la evolución de la gestación y en el neonato se han valorado en varios estudios. Probablemente debido a la heterogeneidad de la EII, los resultados son variables. En un metaanálisis basado en 12 estudios publicados entre 1980 y 2006129, con un total de 3.907 pacientes con EII y 320.531 controles, se encontró una tasa incrementada estadísticamente significativa de nacimientos prematuros (<37 semanas) entre las mujeres con EII versus el grupo control (OR: 1,87, IC del 95%: 1,52–2,3; p<0,001) y un aumento en la tasa de bajo peso al nacer (<2.500g) (OR: 2,1, IC del 95%: 1,38–3,79; p<0,001). Además, se halló una tasa de cesáreas más elevada que en el grupo control (OR: 1,5, IC del 95%: 1,26–1,79; p<0,001). El riesgo de malformaciones congénitas no estaba incrementado con respecto a la población general; sin embargo, sí se halló una diferencia significativa en el análisis de subgrupos de estudios más recientes y con mayor número de pacientes, con un riesgo incrementado de malformaciones congénitas en pacientes con CU versus controles (OR: 2,37, IC del 95%: 1,47–3,82). Sin embargo, esto sólo fue evidente en 2 de los 4 estudios que informaban de malformaciones congénitas, y no se diferenció entre malformaciones mayores y menores. La presencia de EII no tuvo impacto en las complicaciones maternas, como hipertensión y proteinuria. Globalmente, se concluyó que las mujeres con EII presentan un riesgo aumentado de dar a luz en forma prematura, de tener hijos con bajo peso al nacer y de cesárea, comparadas con mujeres no afectas de EII. La principal limitación de este metaanálisis fue que no se tuvo en cuenta la actividad de la EII. En una cohorte danesa130 se investigó el efecto de la actividad de la EII en la evolución de la gestación. Los autores evaluaron todos los nacimientos de mujeres con EC entre 1977 y 2005 y las dividieron en 2 grupos: con EII activa (n: 71) y con EII inactiva (n: 86). Las pacientes con EII activa durante el embarazo presentaron más nacimientos prematuros en forma significativa; también se detectó un aumento en el riesgo de bajo peso al nacer, pero no estadísticamente significativo.
En general, se podría afirmar que si la gestante se encuentra en remisión de su EII, la gestación transcurrirá sin complicaciones16. Estas mujeres aparentemente no tienen más posibilidades de experimentar abortos espontáneos, partos prematuros o neonatos con malformaciones congénitas. Al contrario, si la EII se encuentra activa, es posible que continúe así durante todo el curso del embarazo, aumente el riesgo de complicaciones y llegue a tasas de aborto tan altas como el 35%131; esto es más marcado en la EC que en la CU132. Por tanto, es prioridad fundamental conseguir y mantener la remisión de la EII antes de la concepción. Como en todas las gestaciones, se deberán abandonar el hábito tabáquico y el consumo de alcohol.
Probabilidad de enfermedad inflamatoria intestinal en el hijoTodos los pacientes se preocupan acerca de la posibilidad de transmitir la enfermedad a sus descendientes. Los pacientes con EII, que son un colectivo joven y especialmente informado, acceden con facilidad al concepto de que la EII tiene un cierto componente hereditario y la pregunta surge con más fuerza aún.
Debemos intentar transmitir al paciente una idea fundamental: la EII no es hereditaria en el sentido clásico del término, que podemos llamar mendeliano. No se comporta, por tanto, como una hemocromatosis o una enfermedad de Wilson. Hay, efectivamente, una serie de variantes alélicas mutadas que se asocian a una mayor frecuencia de EII o a una presentación diferente o de mayor o menor intensidad. Estas variantes alélicas son hereditarias. Pero ni todas las personas que portan estas variantes alélicas presentan EII ni tampoco todos los pacientes con EII tienen estas variantes. En resumen, y esto es más fácil de transmitir, no se hereda la enfermedad, se hereda una cierta predisposición a presentarla.
Aunque más del 85% de las personas con EII no tiene otros casos en la familia, los familiares de primer grado de personas con EII presentan un riesgo aumentado de presentarla a su vez, y se dan entre ellos formas de comienzo más precoz133.
La información que más interesa a los pacientes con EII que se plantean tener descendencia es la probabilidad que tienen sus hijos de presentar un problema similar. Se puede estimar134 que el hijo de un paciente con CU tiene una probabilidad de presentar la misma enfermedad 5 veces mayor que la de un niño sin esos antecedentes. También hay un riesgo de presentar EC, algo menor, en torno a 2 y 3 veces el riesgo basal. En cuanto a la descendencia de una persona con EC, la probabilidad de presentar la misma enfermedad es aproximadamente 12 veces la basal, mientras que para presentar CU es sólo de 4 veces. Si hablamos en porcentajes, la posibilidad de tener descendencia con EII en pacientes con EC o CU será de alrededor de un 5%, posibilidad más alta para la EC que para la CU135. Si ambos progenitores presentan EII, la probabilidad aumenta exponencialmente.
Hasta cierto punto, algo se puede hacer para disminuir el riesgo de EII en la descendencia. Por ejemplo, si se evita que los hijos de un paciente con EC fumen, se reduce 15 veces su riesgo de presentar la enfermedad136.
Parto y enfermedad inflamatoria intestinalEn las pacientes con EII, la tasa de cesáreas es mayor que en la población general. En la práctica clínica existen 3 situaciones especialmente controvertidas que se relacionan con este aumento del número de cesáreas: la enfermedad perianal en los pacientes con EC, la existencia de reservorios ileoanales funcionantes tras colectomías en pacientes con CU y la presencia de estomas.
En relación con el tratamiento obstétrico de la enfermedad perianal, algunos autores recomiendan realizar cesárea de forma electiva, y argumentan un elevado riesgo de reactivación inflamatoria perianal y de aparición de nuevas fístulas tras la realización de episiotomía cuando el parto se produce por vía vaginal137. Ilnyckyji et al138 analizaron estos aspectos en un estudio retrospectivo que incluía a 281 pacientes con EC. Observaron que en caso de ausencia de historia previa de enfermedad perianal o inactividad de ésta en el momento del parto, el riesgo de reactivación o aparición de nuevas fístulas era bajo (2%) y, por tanto, no justificaba la práctica generalizada de cesáreas. Por el contrario, todas las pacientes con enfermedad perianal activa en las que se realizó parto vaginal presentaron empeoramiento de su enfermedad con aparición de fístulas en la zona de episiotomía. De acuerdo con los resultados de este trabajo, que confirman los hallazgos de un estudio previo, la cesárea en pacientes con EC y afectación perianal se recomienda hoy únicamente en caso de que exista actividad inflamatoria perianal en el momento del parto o historia previa de enfermedad perianal grave.
La presencia de estomas enterales cutáneos, en principio, no debe influir en la elección de la vía del parto, de forma que la indicación de cesárea se establecerá sobre la base de criterios estrictamente obstétricos139,140. Por otra parte, durante el embarazo se produce un aumento del diámetro del estoma que favorece la aparición de complicaciones, como prolapsos, dislaceración de la mucosa del estoma, aparición de hernias y obstrucción intestinal. Por este motivo, se aconseja extremar los cuidados generales del estoma. En las primeras semanas después del parto, de manera espontánea, el estoma recupera su tamaño y aspecto habitual141.
Sin duda alguna, el aspecto que genera más controversia en cuanto a la elección de la vía del parto en la EII es el antecedente de colectomía y la presencia de reservorio ileoanal funcionante. Algunos autores recomiendan la cesárea en toda paciente con reservorio para evitar lesiones de las estructuras esfinterianas del canal anal durante el parto vaginal que condicionen posteriormente incontinencia crónica142. Sin embargo, la mayoría de los estudios han demostrado que, aunque en el tercer trimestre del embarazo e inmediatamente después del parto existe mayor incidencia de incontinencia, entre 6 y 10 meses después el reservorio ileoanal recupera su funcionalidad, y consideran seguro el parto vaginal salvo que el periné sea excesivamente cicatricial y rígido23. De cualquier forma, parecen necesarios más estudios a largo plazo para evaluar de forma más precisa el efecto del parto en el funcionamiento del reservorio.
En resumen:
- •
se debería realizar cesárea electiva en pacientes con EC perianal activa o historia previa de enfermedad perianal grave;
- •
la presencia de estomas no contraindica el parto por vía vaginal, y
- •
aunque son necesarios más estudios, parece seguro permitir el parto vaginal en pacientes con reservorio ileoanal, pero deberá individualizarse cada caso para tomar una decisión de forma consensuada entre la paciente, el obstetra, el gastroenterólogo y el cirujano.
La lactancia materna proporciona una nutrición ideal para el niño y tiene beneficios tanto para este como para la madre. Sin embargo, cuando la madre necesita tomar medicaciones, estas pueden excretarse por la leche, provocar efectos adversos en el recién nacido y contrarrestar así los beneficios de la lactancia. Solo un 29% de las madres con EC amamanta a sus hijos por miedo a los efectos secundarios de las medicaciones, lo que corresponde a menos de la mitad de la población general113.
Existen muy pocos estudios que evalúen la influencia de la lactancia en la actividad de la EII, pero podría concluirse que existe un riesgo ligeramente aumentado de brote en las mujeres con EC, riesgo que no está presente en las madres con CU143, aunque la información es escasa36.
En cuanto a la influencia de los fármacos en la lactancia, de nuevo es necesaria una descripción pormenorizada. Se puede recomendar la consulta de la página de internet www.e-lactancia.org, radicada en España y que es de una excelente calidad (tabla 4).
- a)
Salicilatos
Los aminosalicilatos y la sulfasalazina son compatibles con la lactancia materna8. La leche materna excreta la mesalazina, que no significa un mayor riesgo para el niño144. Aunque es poco frecuente, puede aparecer diarrea en el recién nacido, en este caso habría que interrumpir la lactancia145. Con la sulfasalazina, no existe mayor riesgo de desplazamiento de la bilirrubina no conjugada ni de kernicterus146, de tal forma que este fármaco es seguro en la lactancia, excepto si el feto presenta una hemólisis que se sospeche secundaria a una incompatibilidad de Rh entre la madre y el feto147.
- b)
Antibióticos
El uso prolongado de metronidazol puede provocar toxicidad, por lo que no se recomienda en la lactancia6. Los datos disponibles sobre la utilización de quinolonas en la lactancia materna son limitados, pero es probable que sean compatibles8,80. La seguridad de la rifaximina en la lactancia materna es desconocida6 y, por último, la amoxicilina-ácido clavulánico es compatible con la lactancia82,83.
- c)
Glucocorticoides
Los corticoides se secretan en bajas dosis en la leche materna (el 5–25% de la concentración en el suero materno)148 y son compatibles con la lactancia6,8. Se recomienda aplazar la lactancia materna hasta 4h después de la toma oral de esteroides para reducir la exposición neonatal149. La seguridad de la budesonida no se conoce6.
- d)
Bifosfonatos
La seguridad de los bifosfonatos en la lactancia materna no se conoce6,36.
- e)
Inmunomoduladores
El metotrexato se excreta en la leche materna en bajas concentraciones, pero puede acumularse en los tejidos del recién nacido, por lo que está contraindicado en la lactancia materna, ya que no se conoce el umbral de dosis tóxica6,36.
A pesar de que existe potencial toxicidad con AZA/6-MP en el lactante y se atribuyen problemas de supresión medular, inmunosupresión, hepatitis y pancreatitis88, la concentración de AZA y sus metabolitos en la leche es mucho menor que en el plasma150–153, y en los trabajos publicados los recién nacidos no presentaron complicaciones88,150–153. Por esto, actualmente no se contraindica la lactancia materna en este caso.
La ciclosporina y el tacrolimus se excretan en la leche materna en altas concentraciones, y se contraindica su uso en la lactancia para evitar la inmunosupresión neonatal. No hay datos en humanos sobre el uso de la talidomida en lactancia materna, pero no se recomienda debido a su alta toxicidad6.
- f)
Tratamiento biológico
Teóricamente, el tratamiento con infliximab durante la lactancia materna podría provocar inmunosupresión en el recién nacido154, aunque los escasos casos publicados no muestran toxicidad en los recién nacidos de mujeres en tratamiento con infliximab que amamantaron a sus hijos114,36, incluso en una serie de 3 casos publicada recientemente155 no se detectaron niveles del fármaco ni en el recién nacido ni en la leche materna, lo que indica que el infliximab no se transfiere de la madre al niño, ni intrauterinamente ni en la leche materna, por lo que probablemente sea compatible con la lactancia.
No hay datos sobre el tratamiento con adalimumab8. Se desconoce si se excreta por la leche. En general, se piensa que el fármaco se puede continuar durante la lactancia dependiendo de la importancia de su administración para la madre36.
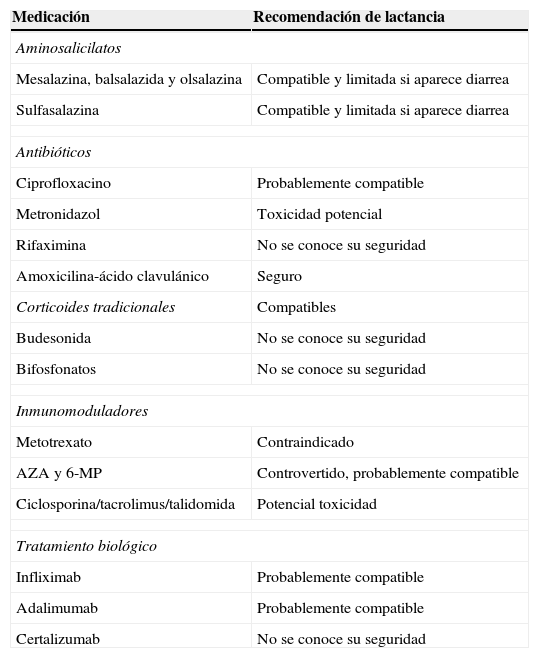
Seguridad de las medicaciones durante la lactancia
| Medicación | Recomendación de lactancia |
| Aminosalicilatos | |
| Mesalazina, balsalazida y olsalazina | Compatible y limitada si aparece diarrea |
| Sulfasalazina | Compatible y limitada si aparece diarrea |
| Antibióticos | |
| Ciprofloxacino | Probablemente compatible |
| Metronidazol | Toxicidad potencial |
| Rifaximina | No se conoce su seguridad |
| Amoxicilina-ácido clavulánico | Seguro |
| Corticoides tradicionales | Compatibles |
| Budesonida | No se conoce su seguridad |
| Bifosfonatos | No se conoce su seguridad |
| Inmunomoduladores | |
| Metotrexato | Contraindicado |
| AZA y 6-MP | Controvertido, probablemente compatible |
| Ciclosporina/tacrolimus/talidomida | Potencial toxicidad |
| Tratamiento biológico | |
| Infliximab | Probablemente compatible |
| Adalimumab | Probablemente compatible |
| Certalizumab | No se conoce su seguridad |
6-MP: mercaptopurina; AZA: azatioprina.
La información mencionada anteriormente puede ser de utilidad si nuestros pacientes nos piden consejo a la hora de considerar tener descendencia.
En primer lugar, es muy importante que cada paciente tenga una idea general pero precisa del pronóstico de su enfermedad. Para personas con enfermedad muy invalidante, quizás la maternidad o la paternidad es una aventura excesiva. Si el paciente se encuentra capacitado, hay que transmitir la idea de que el momento ideal para la concepción es aquel en que la enfermedad se encuentre menos activa. Especialmente en la mujer, pero también en el varón, la corrección de situaciones de malnutrición y de déficits vitamínicos puede ayudar a concebir y, desde luego, a una eventual gestación posterior.
Los consejos acerca de la capacidad de transmitir la enfermedad pueden desde luego ofrecerse, así como la planificación de las medicaciones y la actitud ante un posible brote (que se puede también anticipar).
Pero lo más importante, es dar claramente el mensaje de que la persona con EII puede, en general, plantearse tener descendencia y ponernos a disposición de nuestros pacientes para asesorarlos en las posibles dificultades que pudieran surgir en el camino.
Conflicto de interesesEl Dr. Van Domselaar es receptor de una beca de Schering-Plough.