La diarrea es un síntoma habitual después de un trasplante de órgano sólido o hematopoyético con una incidencia superior al 70%, generalmente en el primer año postrasplante. Entre las causas más frecuentes se encuentran las colitis infecciosas, sobre todo por citomegalovirus (CMV) y Clostridium difficile (C. difficile), y los inmunosupresores empleados para la prevención del rechazo, micofenolato mofetilo (MMF), tacrolimus y ciclosporina. La enfermedad inflamatoria crónica intestinal (EICI) debe formar parte del diagnóstico diferencial ya que, a pesar de ser infrecuente, presenta una incidencia mayor en el paciente trasplantando que en la población general (206 vs. 20 casos/100.000 habitantes/año), especialmente después de un trasplante hepático ortotópico (THO) más que de otros órganos sólidos. Paradójicamente, va a desarrollarse en enfermos bajo inmunosupresión farmacológica, suficiente para evitar el rechazo del aloinjerto, pero no la aparición de una EICI, tanto de la recidiva de una previa como el desarrollo de una enfermedad de novo1,2.
Presentamos el caso clínico de un paciente varón de 71 años con antecedentes personales de: hipertensión arterial, fibrilación auricular persistente —portador de marcapasos permanente y antiagregado con 150mg/día de ácido acetilsalicílico—, glomerulonefritis mesangial IgA con insuficiencia renal crónica moderada (aclaramiento de creatinina basal de 37ml/min) y THO en 1999 por una cirrosis criptogenética, probablemente de origen autoinmune. Tras el trasplante, se inició tratamiento con esteroides y ciclosporina que se sustituyó precozmente por tacrolimus y MMF por deterioro de la función renal e hiperplasia gingival. El paciente no desarrolló infecciones graves y realizó tratamiento combinado con tacrolimus y MMF hasta el año 2009, cuando se suspendió el anticalcineurínico por nefrotoxicidad.
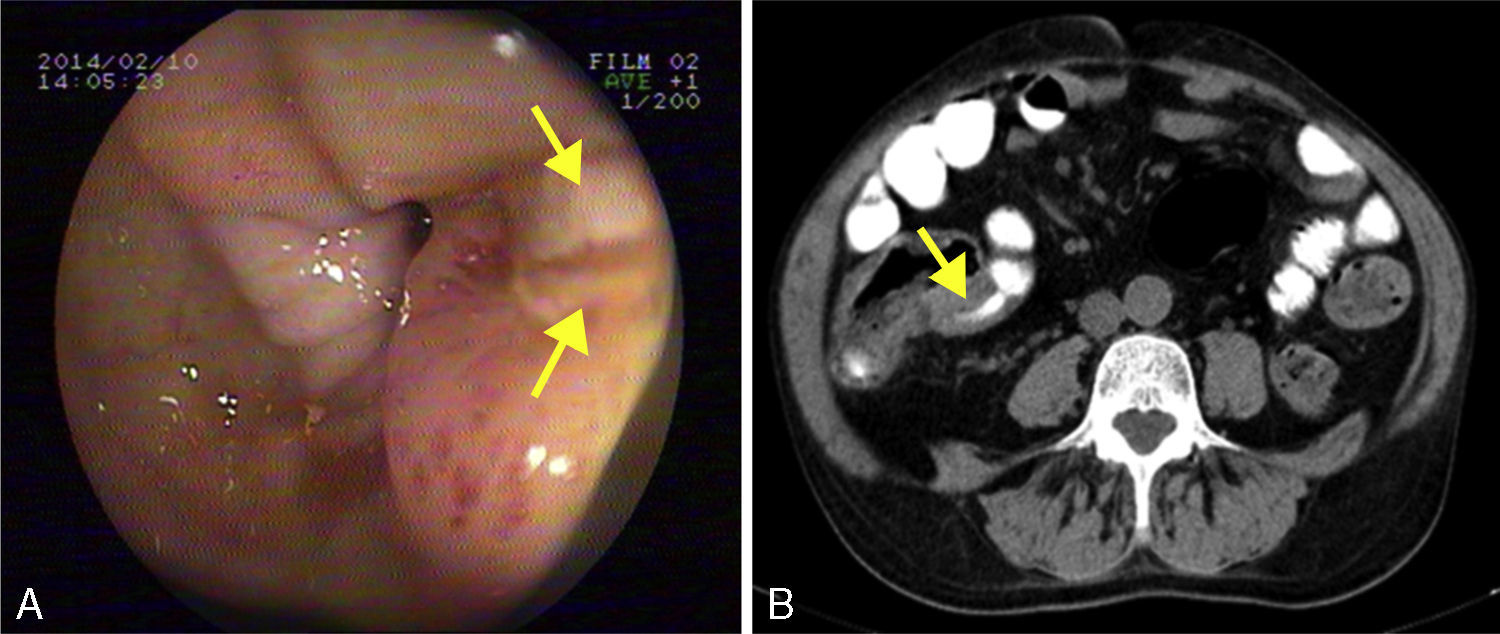
El paciente ingresó en nuestro hospital en 2014 para estudio de diarrea crónica sin productos patológicos, acompañada de dolor cólico abdominal y síndrome constitucional, con pérdida ponderal no cuantificada. Realizaba tratamiento con MMF 2g/día. En la analítica basal destacaba: Hb 10,5g/dl (normocítica y normocrómica), creatinina 2,1mg/dl, colestasis disociada con gamma GGT 100 (VN 7-66U/l) y fosfatasa alcalina 199 (VN 40-129U/l); las transaminasas, la bilirrubina total y la actividad de protrombina eran normales. Proteínas totales 5,1g/dl (albúmina 2,4), PCR 6,5mg/dl. Los autoanticuerpos de celiaquía (antigliadina y antitransglutaminasa) fueron negativos con valores normales de IgA. Otros anticuerpos órgano-específicos (ANA, AMA, anti-LKM, ASMA), negativos, y TSH normal. Análisis microbiológico de heces (coprocultivo, estudio de parásitos y toxina de C. difficile), sin alteraciones. Serologías: inmunidad frente al VHB, IgG CMV positiva; VHC y VIH, negativos. La prueba de Mantoux y el efecto Booster fueron negativos. Inicialmente, se realizó una colonoscopia en la que se encontraron varias úlceras serpiginosas longitudinales en el colon derecho con deformidad del ciego y de la válvula ileocecal, siendo imposible intubar el íleon terminal (fig. 1A). En un TAC toracoabdominal posterior se observó un engrosamiento de la pared de un segmento de unos 25cm del íleon terminal, sin afectación de la grasa adyacente, líquido libre, adenopatías regionales ni dilatación preestenótica (fig. 1B). La anatomía patológica fue compatible con fondo de úlcera, sin signos de especificidad. Se realizaron técnicas de inmunohistoquímica y PCR en las muestras que descartaron infección por CMV y tuberculosis, respectivamente. Finalmente, y ante la sospecha de una enfermedad de Crohn, se administraron corticoides iv (0,8mg/kg/día de metilprednisolona). Tras 10 días de tratamiento sin respuesta clínica, el paciente presentó una hemorragia digestiva alta grave con inestabilidad hemodinámica que necesitó transfusión de 6 concentrados de hematíes. Se practicó una endoscopia oral en la que se apreciaron numerosas úlceras profundas desde la 2.ª porción duodenal hasta las proximidades del ángulo de Treitz, una de ellas con un vaso visible que se trató con un hemoclip. Ante criterios de corticorrefractariedad y afectación extensa del intestino delgado, se planteó tratamiento de rescate con azatioprina (50mg/día) e infliximab (5mg/kg). Después de las 2 primeras dosis de inducción, el paciente no presentó recidiva hemorrágica, pero finalmente necesitó tratamiento quirúrgico por cuadros suboclusivos repetidos. En la laparotomía se apreciaron varias estenosis cortas en el yeyuno, y otras 2 que condicionaban dilatación preestenótica en el íleon, de unos 15 y 25cm de longitud que se trataron mediante resección segmentaria e ileocecal con anastomosis término-terminal y latero-lateral, respectivamente. La anatomía patológica de la pieza quirúrgica fue compatible con enfermedad de Crohn. Tras un postoperatorio tórpido en cuidados intensivos por problemas cardiorrespiratorios y renales no atribuibles a complicaciones de la cirugía, el paciente mejoró progresivamente y, actualmente, mantiene una remisión prolongada clínica y biológica con 50mg/día de azatioprina y 5mg/kg de infliximab cada 8 semanas, sin alteraciones de la función hepática.
Hasta la fecha se han comunicado menos de 100 casos de EICI de novo en pacientes sometidos a trasplante hepático (no nos consta la publicación de casos previos en España), la mayoría ellos de colitis ulcerosa (70%)3. Este claro predominio de la colitis podría explicarse por su fuerte asociación con la colangitis esclerosante primaria, enfermedad que constituye una indicación frecuente de trasplante hepático (6-10% del total)4.
Se ha sugerido que la utilización del tacrolimus para prevenir el rechazo puede favorecer la aparición de una EICI de novo5. Este fármaco, que es un potente inhibidor de la interleucina-2 (IL-2), produce una disfunción de las células T reguladoras que altera la homeostasis intestinal, aumentando su permeabilidad y la exposición de antígenos al sistema inmune en la mucosa. También interfiere en el proceso de muerte celular programada de los linfocitos T, haciéndolos más resistentes a la apoptosis, ambas consideradas factores importantes en la patogenia de la EICI. Por otra parte, el desarrollo de una infección por CMV, especialmente en receptores seronegativos de donantes seropositivos, también parece ser otro factor de riesgo para el desarrollo de la enfermedad de novo. La colonización de la mucosa por el virus también aumentaría la permeabilidad intestinal, la expresión de moléculas de adhesión endotelial tipo I (VCAM1), del complejo mayor de histocompatibilidad tipo I y la producción de IL6.
El pronóstico de la EICI de novo generalmente es favorable, mejor que el de la recidiva de la enfermedad previamente diagnosticada6, y suele obtenerse la remisión con tratamiento convencional (mesalazina, corticoides y azatioprina, fármaco también eficaz para prevenir el rechazo7). En nuestro caso no fue así, y hubo que recurrir a tratamiento anti-TNF y, finalmente, al quirúrgico. Además de lo inusual de esta enfermedad, nos parece destacable la forma de presentación, con afectación extensa del intestino delgado proximal, y la grave complicación en forma de hemorragia digestiva. Aunque no pudo evitarse la cirugía, es posible que el infliximab contribuyera al control de la hemorragia, a mejorar la situación general del paciente, y a que el tratamiento quirúrgico pudiera realizarse de forma electiva. Nos gustaría recalcar que la experiencia con los anti-TNF en pacientes trasplantados es escasa, y solo tenemos constancia de 22 casos comunicados hasta la fecha por enfermedad refractaria, la mayoría tratados con infliximab8. La eficacia y la seguridad de estos fármacos parecen similares cuando se emplean en pacientes trasplantados, aunque desconocemos la influencia que pueden tener sobre el injerto a corto y medio plazo9,10.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.