INTRODUCCION
La infección por el virus de la hepatitis B (VHB) constituye un grave problema sanitario mundial, ya que se considera que hasta la mitad de la población del planeta reside en áreas con elevada prevalencia de la enfermedad y que hasta 400 millones de personas son portadores del virus, de los cuales el 25-40% desarrollará cirrosis hepática, insuficiencia hepática y/o hepatocarcinoma.
La hepatitis B crónica se define por la presencia, durante más de 6 meses del antígeno de superficie del VHB (HBsAg) en el suero acompañado de necroinflamación crónica en la biopsia hepática y/o el aumento persistente o intermitente de la AST/ALT.
Los objetivos principales del tratamiento de la hepatitis crónica B son:
Reducir los valores de ADN del VHB sérico y normalizar las transaminasas.
Evitar la progresión a cirrosis y el desarrollo de complicaciones y hepatocarcinoma.
Inducir la seroconversión (en el caso de una hepatitis B crónica HBeAg positivo).
Incrementar la supervivencia y la calidad de vida.
La elección del tratamiento adecuado reside en la eficacia, la seguridad y la buena tolerancia que éste ofrezca. En la actualidad disponemos de 5 fármacos aprobados para el tratamiento de la hepatitis B crónica: interferón alfa, interferón pegilado alfa-2a, lamivudina, adefovir dipivoxil y entecavir.
Uno de los últimos tratamientos aprobado por la FDA y la EMEA para la hepatitis B crónica es el entecavir, el cual ha demostrado ser superior a lamivudina en términos de supresión viral y mejoría histológica, y además es activo frente a cepas que han desarrollado resistencias a la lamivudina, sin desarrollo de resistencias a las 48 semanas. A la hora de elegir un tratamiento, hay que tener en cuenta que en la mayor parte de los pacientes, éste va a ser a largo plazo, por lo que no sólo es importante valorar el grado de eficacia, seguridad y efectos adversos del fármaco, sino también el posible desarrollo de resistencias con los años de tratamiento que hagan que éste se vuelva ineficaz.
PROPIEDADES FARMACOLOGICAS
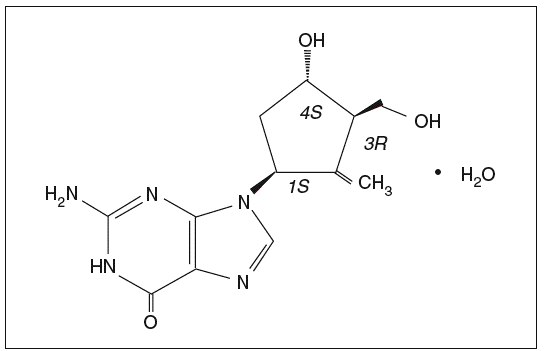
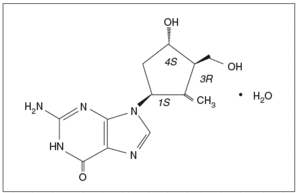
El entecavir es un nucleósido análogo de la 2'-deoxiguanosina (fig. 1) que, en el interior celular presenta una rápida conversión a su forma activa 5'-trifosfato. Este metabolito activo inhibe la replicación del VHB de forma dosis-dependiente, compitiendo con el dGTP para su incorporación dentro de la cadena del ADN en los 3 pasos que constituyen el proceso de replicación viral1. Su vida media in vitro es de 15 h.
Fig. 1. Estructura química del entecavir monohidrato.
In vitro, el entecavir ha demostrado ser un fármaco muy potente como supresor de la replicación viral (mucho más potente que la lamivudina), además de mostrarse activo frente a cepas resistentes a lamivudina, emtricitabina, o clevudina o adefovir1.
Su vía de administración es la oral, y es rápidamente absorbido de forma dosis-dependiente, y distribuido extensamente por todos los tejidos. Su principal vía de excreción es la renal1, por lo que se recomienda el ajuste de dosis en los casos en que el aclaramiento de creatinina (CrCl) sea menor a 50 ml/min.
EFICACIA TERAPÉUTICA
Estudios preliminares en animales han demostrado una gran potencia antiviral y han sugerido una capacidad potencial de reducir el riesgo de desarrollo de hepatocarcinoma1,2.
El entecavir ha sido aprobado por la FDA como tratamiento en la hepatitis B crónica en adultos con replicación viral activa, elevación persistente de las transaminasas y/o actividad necroinflamatoria en la biopsia hepática. Su aprobación se basa en varios estudios publicados3-7, en fase II, multicéntricos, aleatorizados y doble ciego, y en 3 estudios en fase III, en los que están incluidos un total de 1.633 pacientes con hepatitis B crónica HBeAg positivo y negativo, con elevación de las transaminasas y una inflamación crónica a nivel histológico8-13. Asimismo el entecavir se ha evaluado en pacientes que han desarrollado resistencias a lamivudina y en coinfectados por el VHB y el virus de la inmunodeficiencia humana (VIH).
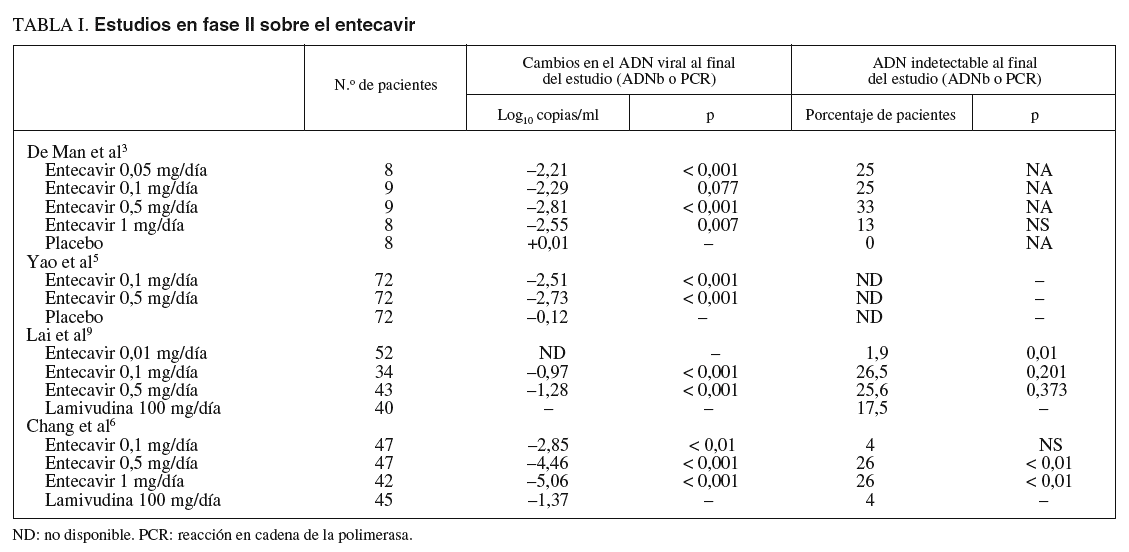
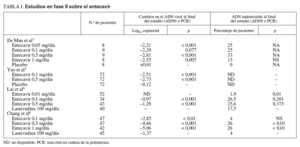
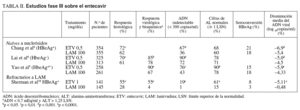
En los estudios en fase II (tabla I) se compararon distintas dosis de entecavir (0,05, 0,1, 0,5 y 1 mg/día) frente a placebo administrado durante 28 días a un total de 258 pacientes con hepatitis B crónica (HBeAg positivo y negativo)3,5. En ellos se observó que éste lograba una mayor supresión del ADN viral al final del tratamiento con respecto al placebo, y esta diferencia era estadísticamente significativa. Además, en los pacientes que recibían dosis de 0,5 o 1 mg/día, se apreció un retorno más lento a los valores basales de ADN viral que los que recibían dosis menores del fármaco, sin efectos secundarios importantes3. Cuando se comparaba entecavir frente a lamivudina4, éste nuevamente se mostraba superior como supresor de la replicación viral (mayor disminución media de la carga viral y mayor proporción de pacientes con ADN indetectable a la semana 22 de tratamiento), aunque no había diferencias estadísticamente significativas entre ambos grupos en términos de tasa de seroconversión o de normalización de las cifras de transaminasas. En los estudios que incluían a pacientes que habían desarrollado resistencias o eran refractarios al tratamiento con lamivudina6,7, entecavir volvió a ser más eficaz que lamivudina en términos de supresión de la replicación viral (tabla I).
Basándose en los resultados de estos estudios, se decidió que la dosis de entecavir más adecuada para el tratamiento de pacientes sin tratamiento previo (naïves) sería de 0,5 mg/día, reservando la dosis de 1 mg/día para los pacientes con falta de respuesta al tratamiento con lamivudina (con o sin desarrollo de resistencias YMDD documentadas).
HEPATITIS B CRONICA HBeAg POSITIVO
La eficacia del entecavir se ha estudiado en términos de respuesta histológica (definida ésta como mejoría de al menos 2 puntos en la escala de necroinflamación de Knodell sin empeoramiento de la fibrosis), virológica (supresión del ADN viral al final del tratamiento mediante técnicas de reacción en cadena de la polimerasa [PCR] y descenso medio de la carga viral (expresada en log10 copias/ml), bioquímica (normalización de la ALT, definida por valores inferiores a 1,25 veces el límite superior de la normalidad) y serológica (pérdida del HBeAg y aparición del anti-HBe).
Respuesta histológica
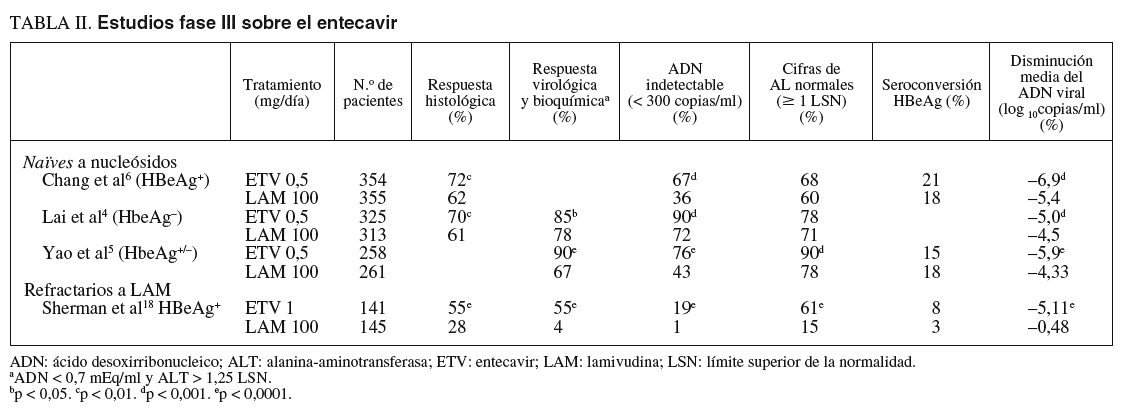
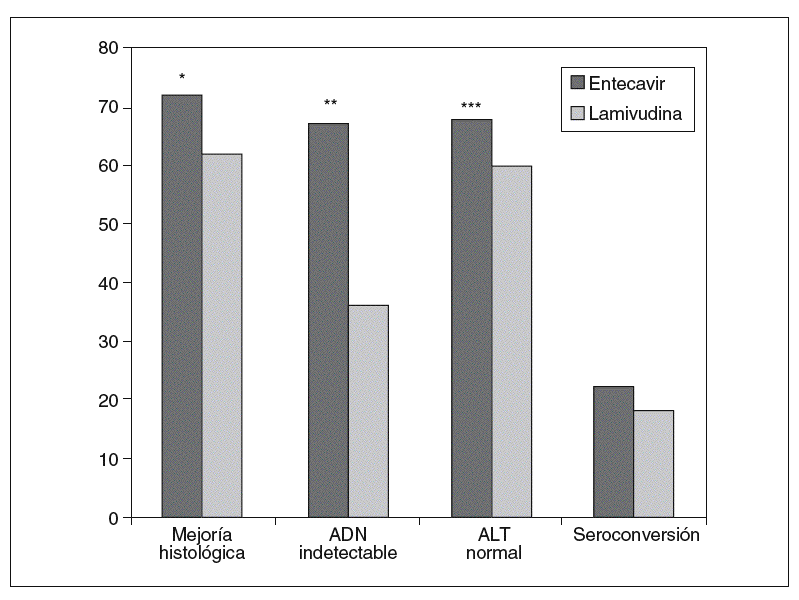
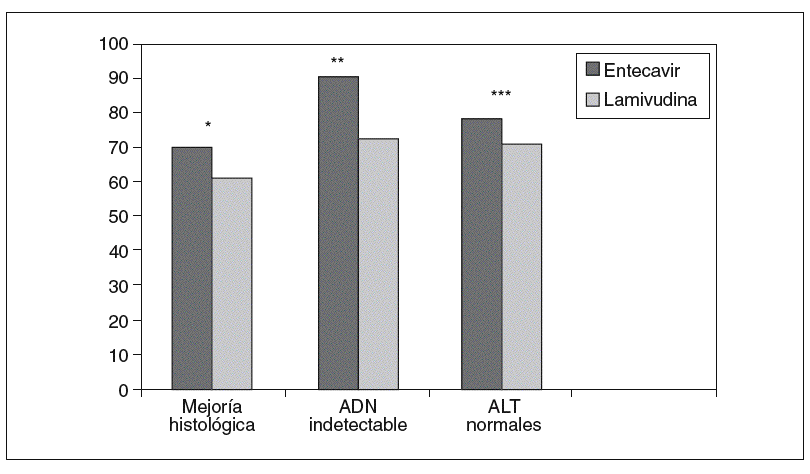
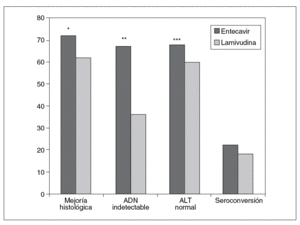
Chang et al8, en un estudio multinacional doble ciego, incluyeron a 715 pacientes adultos (mayores de 16 años) con hepatitis B crónica HBeAg positivo, que fueron aleatorizados para recibir entecavir 0,5 mg/día o lamivudina 100 mg/día durante 52 semanas. Los criterios de inclusión fueron presentar una hepatitis B crónica HBeAg positivo compensada, ADN viral detectable (> 3 mEq/ml), ALT $ 1,3-10 veces el límite superior de la normalidad y no haber recibido terapia con análogos de los nucleósidos durante más de 12 semanas previamente a la inclusión en el estudio. El objetivo principal fue valorar el grado de mejoría histológica, observándose en el grupo de entecavir una mejoría histológica a la semana 48 significativamente mayor que en el grupo de lamivudina (el 72 frente al 62%; p < 0,009) (tabla II) (fig. 2). Asimismo, el 39% mostró mejoría en la escala de fibrosis de Ishak frente al 35% de los tratados con lamivudina (sin diferencias estadísticamente significativas).
Fig. 2. Eficacia del entecavir frente a lamivudina a las 48 semanas en HBeAg positivo. *p < 0,009. **p < 0,001. ***p < 0,02. ADN: ácido desoxirribonucleico; ALT: alanina-aminotransferasa.
Respuesta virológica
En los pacientes tratados durante 48 semanas con entecavir frente a lamivudina, se evaluaron como objetivos secundarios la disminución media en el ADN viral con respecto a la basal y la proporción de pacientes con ADN indetectable a la semana 48 (< 300 copias/ml por PCR), y se objetivó una mayor respuesta virológica con respecto al grupo tratado con lamivudina (ADN indetectable en el 67 frente al 36% de los pacientes, respectivamente; p < 0,001), con una media de descenso también mayor en el grupo del entecavir (6,9 frente a 5,4 log10 copias/ml en el grupo de lamivudina; p < 0,0001)8 (fig. 2).
La durabilidad de la respuesta fue buena, ya que entre los pacientes que alcanzaron una respuesta completa (definida ésta por ADNb < 0,7 mEq/ml y pérdida del HBeAg) a la semana 48 (el 21% en el grupo de entecavir y el 19% en el grupo de lamivudina) y suspendieron el tratamiento, la mantuvieron a la semana 24 postratamiento el 82% de los que recibieron entecavir frente al 72% de los de lamivudina8,11. En un subanálisis de este estudio, el entecavir conseguía una mejor respuesta que lamivudina, independientemente de los valores basales de transaminasas en cuanto a las tasas de ADN viral indetectable al final del tratamiento y una disminución media del ADN12.
En un estudio presentado en forma de comunicación oral, el tratamiento se prolongó hasta la semana 96 en 407 pacientes (243 grupo entecavir y 164 grupo lamivudina) que habían logrado sólo una respuesta virológica a la semana 48 (ADN < 0,7 mEq/ml) pero continuaban con el HBeAg positivo11. En estos pacientes, en el grupo del entecavir se produjo un incremento en el descenso medio del ADN viral de 0,05 log10 copias/ml con respecto a lo obtenido en la semana 48, frente a +0,61 log10 copias/ml conseguido en el grupo de lamivudina al final de la semana 96. Además, entre los pacientes que presentaban ADN detectable por PCR en la semana 48, éste se hizo indetectable en la semana 96 en el 54% de los que recibieron entecavir frente al 16% de los del grupo de lamivudina. Es importante resaltar que estos resultados han sido presentados sólo como datos acumulados.
Asimismo, durante este segundo año de tratamiento, el entecavir mantuvo mayores tasas de supresión viral (el 81 frente al 39%) que lamivudina, pero no hubo diferencias significativas entre ambos grupos en el porcentaje de seroconversión a anti-HBe (el 31 frente al 25%, respectivamente).
Por último, en un reciente estudio con un diseño complejo presentado en forma de comunicación oral, de los 202 pacientes del grupo entecavir que participaron en el ensayo anterior que lograron sólo una respuesta virológica a la semana 96 (definida esta por ADN < 0,7 mEq/ml y HBeAg positivo), 119 recibieron una dosis aumentada de entecavir de 1 mg/día hasta la semana 144 para intentar incrementar la tasa de respuesta. Se evaluó la proporción de pacientes que consiguieron ADN indetectable en la semana 144 (ADN viral < 300 copias/ml por PCR), observándose que el 90% de los pacientes que recibieron durante el tercer año de tratamiento una dosis de 1 mg/día de entecavir mantenían un ADN indetectable al final del estudio (un 5% más con respecto a la semana 96)13.
Respuesta bioquímica
En la semana 48, los pacientes tratados con entecavir 0,5 mg/día consiguieron una respuesta bioquímica mayor que el grupo tratado con lamivudina (normalización de la ALT según el criterio previamente definido del 68 frente al 60%; p < 0,02) (fig. 2). Además, en una menor proporción de los pacientes tratados con entecavir se observaron elevaciones significativas de las transaminasas (en el 3 frente al 6% de los tratados con lamivudina), y en todos ellos esta elevación se acompañó de una disminución en los valores de ADN viral de al menos 2 log10 copias/ml, a diferencia de lo que ocurrió en el grupo de lamivudina, en el que hasta la mitad de ellos se asociaron con incrementos en los valores de ADN8.
Esta mayor tasa de normalización de la ALT se mantuvo entre los pacientes tratados durante 96 semanas (el 79 frente al 68%)11 y 144 semanas (el 80% persistía con ALT # 1 vez el límite superior de la normalidad)13.
Respuesta serológica
La tasa de pérdida del HBeAg y de seroconversión fue similar en ambos grupos de tratamiento a las 48 semanas (el 22 frente al 20%, y el 21 frente al 18%, respectivamente)8 (fig. 2) y 96 semanas (el 31 frente al 26%)11 sin diferencias estadísticamente significativas.
Entre los pacientes que prolongaron el tratamiento al tercer año con dosis de 1 mg/día, la pérdida del HBeAg y la seroconversión a anti-HBe continuaba alcanzando tasas del 33 y el 16%, respectivamente, al finalizarlo13.
Si se analizaba las características basales de los pacientes que lograban la pérdida del HBsAg a la semana 120 (un 4% del total), éstos se caracterizaban por ser varones de raza caucásica, estar infectados por los genotipos A o D y eliminar el HBeAg la semana 24 del tratamiento14.
Todos los datos obtenidos de los ensayos clínicos a la semana 96 y 144 deben ser tomados con precaución, ya que son estudios de diseño complejo, en algún caso con cambio de dosis y que en el momento actual han sido presentados sólo de forma oral y en forma de resultados acumulados. Los datos más sólidos son los publicados a 48 semanas y se necesita más datos para poder definir exactamente la eficacia y la tasa de resistencias a largo plazo.
Hasta la fecha sólo se ha publicado un estudio aleatorizado (en forma de resumen) que comparaba la eficacia de entecavir (0,5 mg/día) frente a adefovir (10 mg/día) a las 24 semanas en 69 pacientes naïves con hepatitis B crónica HBeAg positivo15. La disminución media del ADN viral en las semanas 12 y 24 fue de 6,23 y 6,97 log10 copias/ml en el grupo de entecavir, respectivamente, frente a 4,42 y 4,84 log10 copias/ml en el de adefovir (p < 0,0001); presentó ADN indetectable por PCR en la semana 24 el 45% de los tratados con entecavir frente al 13% de los de adefovir. Además, entre los pacientes que presentaban un ADN < 106 c/ml en el décimo día de tratamiento, el 91% del grupo entecavir mostraba ADN indetectable en la semana 24, frente al 50% del grupo adefovir, y la determinación del ADN en el día 10 de tratamiento puede convertirse en un predictor de la respuesta viral en la semana 24.
HEPATITIS B CRONICA HBeAg NEGATIVO
La eficacia del entecavir en este grupo de pacientes se ha estudiado en términos de respuesta histológica, virológica y bioquímica.
Respuesta histológica
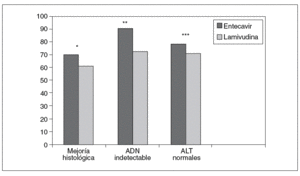
Lai et al9 en un estudio multinacional, doble ciego, incluyeron a un total de 648 pacientes adultos con hepatitis B crónica HBeAg negativo, aleatorizados a recibir entecavir 0,5 mg/día o lamivudina 100 mg/día durante 52 semanas. Los criterios de inclusión fueron: hepatitis B crónica HBeAg negativo compensada, ADN viral detectable (> 3 mEq/ml) y ALT $ 1,3-10 veces el límite superior de la normalidad y no haber recibido terapia con análogos de los nucleósidos durante más de 12 semanas previamente a la inclusión en el estudio. El objetivo principal, al igual que en el estudio de fase III diseñado para el HBeAg positivo era valorar el grado de mejoría histológica. En el grupo de entecavir se observó una mejoría histológica significativamente mayor desde el punto de vista estadístico que en el grupo de lamivudina a las 48 semanas de tratamiento (el 70 frente al 61%) (fig. 3). Asimismo, el 36% de los pacientes que recibieron entecavir mejoraron en la escala de Ishak de fibrosis, frente al 38% de los que recibieron lamivudina (sin diferencias estadísticamente significativas).
Fig. 3. Eficacia del entecavir frente a lamivudina a las 48 semanas en HBeAg negativo. *p = 0,014. **p < 0,001. ***p 0,045. ADN: ácido desoxirribonucleico; ALT: alanina-aminotransferasa.
Respuesta virológica y serológica
A las 48 semanas de tratamiento, el entecavir se mostró superior a la lamivudina en términos de reducción media del ADN viral (5,04 frente a 4, 53 log10 copias/ml) y proporción de pacientes con ADN indetectable a la semana 48 (< 300 copias/ml por técnica de PCR) (el 90 frente al 72%) (tabla II) (fig. 3). Entre los pacientes que lograron una respuesta completa (definida ésta por ADNb < 0,7 mEq/ml y ALT < 1,25 veces el límite superior de la normalidad) en la semana 48 (el 85% del grupo entecavir y el 78% del grupo lamivudina) e interrumpieron el tratamiento, mantuvieron respuesta sostenida a las 24 semanas postratamiento el 48 frente al 35%, respectivamente9.
En la semana 48, un paciente de cada grupo negativizó el HBsAg.
En un estudio publicado en forma de resumen, los pacientes que consiguieron sólo una respuesta virológica a las 48 semanas (definida ésta por presentar ADNb < 0,7 mEq/ml pero ALT > 1,5 veces el límite superior de la normalidad), prolongaron ambos tratamientos hasta la semana 96 (26 y 28 pacientes en el grupo del entecavir y de lamivudina, respectivamente), observándose que el grupo entecavir fue nuevamente más eficaz en términos de supresión viral, ya que el 96% de los pacientes tratados con el primero mantuvieron una respuesta virológica (ADN < 300 copias/ml) frente al 64% de los que recibieron lamivudina. Además, el 88% del grupo de entecavir logró el objetivo conjunto de ADN viral < 0,7 mEq/ml y ALT # 1,5 veces el límite superior de la normalidad, frente al 81% del grupo de lamivudina16.
En la semana 96, del total de pacientes que se incluyeron en el estudio inicial de Lai et al mantuvieron una respuesta virológica el 94% del grupo de entecavir frente al 84% del de lamivudina (p < 0,0001)16.
Respuesta bioquímica
Asimismo, a las 48 semanas el entecavir logró la normalización de las transaminasas definida por valores de ALT < 1 el límite superior de la normalidad, en una tasa mayor de pacientes que la lamivudina (78 frente al 71%; p < 0,045) (fig. 3), aunque sin mostrar diferencias estadísticamente significativas en la semana 96 entre ambos grupos de tratamiento (el 89 frente al 84%, respectivamente)16.
En los estudios fase III realizados en China (publicados en forma de resumen) sobre un total de 519 pacientes con hepatitis B crónica HBeAg positivo y negativo, a los que se les aleatorizó a recibir entecavir 0,5 mg/día o lamivudina 100 mg/día, los resultados fueron similares a los expuestos previamente: el entecavir mostró nuevamente más potencia que lamivudina como supresor de la replicación viral y normalización bioquímica tanto a las 48 como a las 96 semanas10,17.
HEPATITIS B CRONICA REFRACTARIA Y RESISTENTE A LAMIVUDINA
En el estudio en fase II desarrollado por Chang et al6 se aleatorizó a 182 pacientes con hepatitis B crónica HBeAg-positivo y negativo con ADN viral detectable a pesar de 24 semanas de tratamiento con lamivudina o con mutaciones YMDD conocidas, a recibir entecavir (en dosis de 0,1, 0,5 y 1 mg/día) o continuar con lamivudina (100 mg/día) durante 76 semanas. En la semana 24 una proporción significativamente mayor de pacientes en tratamiento con entecavir en dosis de 1 y 0,5 mg/día presentaban ADN indetectable comparado con el grupo que recibía lamivudina (79, 51 y 14%, respectivamente; p < 0,0001); además, la dosis de 1 mg/día de entecavir era superior a la de 0,5 mg/día para lograr este objetivo (p < 0,01). Asimismo, en la semana 48 el entecavir, en cualquiera de sus dosis, conseguía un descenso medio de la carga viral más pronunciado que la lamivudina (5,06, 4,46 y 2,85 log10 copias/ml con 1, 0,5 y 0,1 mg/día, respectivamente, frente a 1,37 log10 copias/ml del grupo de lamivudina) y un mayor número de pacientes normalizó las cifras de ALT (68, 59 y 47% con 1, 0,5 y 0,1 mg/día, respectivamente, frente al 6% de los tratados con lamivudina) (tabla I).
Posteriormente, Sherman et al18 valoraron la eficacia del entecavir en un estudio en fase III multinacional y controlado, en el que se aleatorizó a 286 pacientes con hepatitis B crónica HBeAg positivo y refractarios al tratamiento con lamivudina (definida ésta por persistencia de la viremia a pesar de recibir durante al menos 36 semanas lamivudina, ADN viral detectable tras haber logrado negativizarlo anteriormente o por la identificación de mutaciones tipo YMDD independientemente de la duración del tratamiento con ésta) a recibir entecavir 1 mg/día o a continuar con lamivudina 100 mg/día durante 52 semanas.
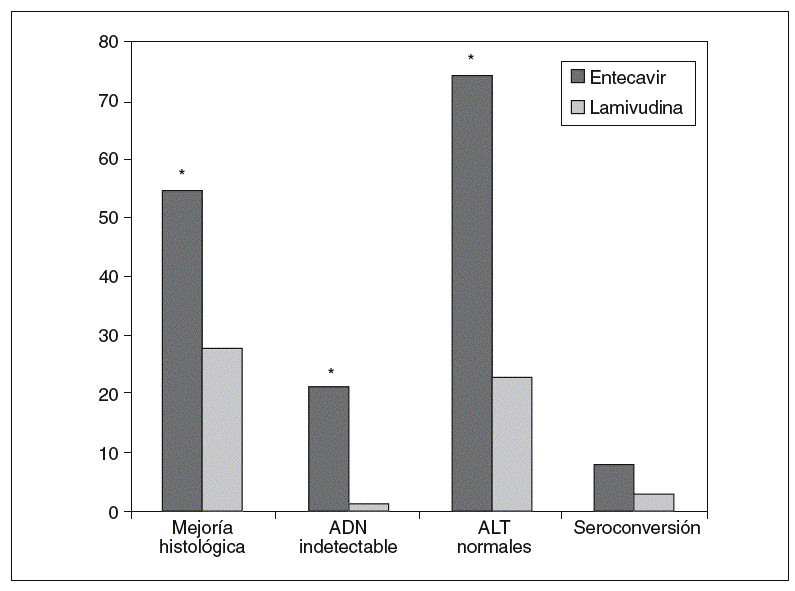
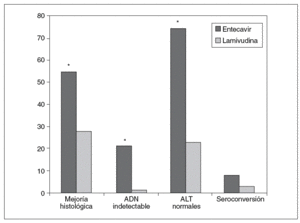
Los 2 objetivos primarios eran la mejoría histológica (descenso de 2 puntos o más en la escala de necroinflamación de Knodell sin empeoramiento de la fibrosis) y la respuesta combinada definida por ADN viral indetectable (ADN < 0,7 mEq/ml) y cifras de ALT < 1,25 veces el límite superior de la normalidad al final del tratamiento. El entecavir logró una mejoría histológica en el 55% de los pacientes frente al 28% de los tratados con lamivudina (p < 0,001), además de conseguir la respuesta combinada a la semana 48 en una proporción mayor de pacientes (el 55 frente al 4%) y obtener descensos medios mayores en la carga viral (5,11 frente a 0,48 log10 copias/ml), todo ello con diferencias estadísticamente significativas. El entecavir se mostró igualmente superior en la tasa de pacientes con ADN indetectable (< 300 copias/ml) en la semana 48 (el 19 frente al 1%). La pérdida del HBeAg también fue mayor en el grupo del entecavir (el 10 frente al 3%) y se logró la seroconversión en el 8 y el 3% de los pacientes, respectivamente (tabla II) (fig. 4).
Fig. 4. Eficacia de entecavir frente a lamivudina en pacientes refractarios a lamivudina HbeAg positivo. *p < 0,001. ADN: ácido desoxirribonucleico; ALT: alanina-aminotransferasa.
De los 286 pacientes que participaron en el estudio de Sherman et al18, 77 del grupo del entecavir y 3 del grupo de lamivudina que habían alcanzado una respuesta virológica en la semana 48 (ADNb < 0,7 mEq/ml y HBeAg positivo) prolongaron el tratamiento hasta la semana 96. En el grupo de entecavir, la administración continuada del fármaco hasta la semana 96 hizo que se mantuviera el beneficio virológico y bioquímico, ya que al final del tratamiento se constató una mayor tasa de ADN indetectable por PCR entre estos pacientes (del 21% a la semana 48 se incrementó hasta el 40%), así como una mayor normalización de las cifras de ALT (del 65 al 81%) y un descenso medio mayor en el ADN viral (de 5,7 log10 copias/ml en la semana 48 a 5,9 log10 copias/ml en la 96)19.
Si se evalúa la respuesta al final de la semana 96 entre todos los pacientes incluidos inicialmente en el estudio, se pone de manifiesto que entecavir es más eficaz que lamivudina en términos de supresión viral (ADN < 300 copias/ml en el 30 frente al 1%; p < 0,001), tasa de seroconversión (el 16 frente al 4%; p = 0,0011) y normalización bioquímica (el 85 frente al 29%; p < 0,0001) en este tipo de pacientes19. Sin embargo, hasta en el 9% de los pacientes se observó un aumento de la carga viral en relación con la aparición de resistencias19.
Por tanto, el entecavir es útil para tratar a los pacientes que han desarrollado resistencias a lamivudina pero con una eficacia sustancialmente menor comparada con pacientes naïves (a pesar de utilizar dosis de 1 mg/día).
GRUPOS ESPECIALES
Pacientes con fibrosis avanzada
En un reciente estudio publicado en forma de resumen se evaluó la eficacia del entecavir administrado durante 48 semanas frente a lamivudina en términos de mejoría histológica en pacientes con hepatitis B crónica naïves (HBeAg positivo y negativo) y resistentes a lamivudina (HBeAg positivo) con fibrosis avanzada y cirrosis (fibrosis según la escala de Ishak de 4-6). Entre los pacientes que recibieron entecavir, tanto HBsAg positivo como los resistentes a lamivudina, mostraron al final del tratamiento una tasa de mejoría histológica mayor (de al menos un punto) con respecto al grupo de lamivudina (el 26 y el 10% frente al 23 y el 7%, respectivamente). Asimismo, no se produjo nigún empeoramiento en el grado de fibrosis en un mayor número de pacientes en el grupo de entecavir, en este caso también en los HBeAg negativo (16, 16 y 8% frente a 13, 10 y 6%, respectivamente)20.
Pacientes coinfectados por el VIH
Hay una experiencia limitada en el uso del entecavir en estos pacientes. El estudio controlado mayor incluía a un total de 68 pacientes coinfectados que presentaban una viremia detectable a pesar de estar en tratamiento con terapia HAART (que incluye lamivudina 300 mg/día), a los que se aleatorizó a recibir entecavir 1 mg/día o placebo durante 24 semanas, seguidas éstas de una fase abierta de otras 24 semanas en que todos los pacientes recibían entecavir. El descenso medio del ADN viral fue de forma estadísticamente significativa mayor en el grupo del entecavir (3,66 frente a 0,11 log10 copias/ml; p < 0,001), además de presentar ADN indetectable (< 400 copias/ml) en la semana 24 y una normalización de la ALT un porcentaje mayor de pacientes que el grupo placebo (el 84 frente al 0% y el 49 frente al 17%, respectivamente)2,21.
Trasplante hepático
En un estudio en que se administró entecavir 1 mg/día durante una media de 42 semanas a 9 pacientes con hepatitis B crónica sometidos a un trasplante hepático, sin respuesta a lamivudina, se puso de manifiesto que en 5 de ellos el ADN era indetectable a la semana 24 (por PCR) y en 3 se normalizaron las cifras de transaminasas, sin efectos secundarios importantes o aumento llamativo de la ALT que hicieran interrumpir el tratamiento2,22. Se necesitan más estudios para establecer el papel del entecavir en los pacientes trasplantados.
RESISTENCIAS
En los 2 grandes estudios publicados en pacientes naïves HBeAg positivo y negativo, no se han observado resistencias al entecavir durante el primer año de tratamiento8,9, aunque posteriormente se ha comunicado un caso de resistencia al entecavir durante el primer año de tratamiento23. En los estudios a 2 y 3 años se ha constatado la aparición de éstas en menos del 1% de los pacientes, si bien cabe señalar que son ensayos no específicamente diseñados para valorar la tasa de resistencias de este fármaco a largo plazo11,13,16.
Sin embargo, entre los pacientes que habían desarrollado previamente resistencias a lamivudina, en el 1% apare cían resistencias en la semana 4824, en el 9% en la semana 9618,19 y hasta en el 15-19% a los 3 años de tratamiento23. Esto se debe a que para el desarrollo de resistencias al entecavir se necesita previamente la existencia de mutaciones a la lamivudina (tipo rtL180M y rtM240V) y el posterior desarrollo de sustituciones de residuos de la transcriptasa reversa T184, S202 O M250, entre otros. Estas mutaciones que confieren resistencia al entecavir son sensibles al adefovir25. En este caso, las resistencias se han comunicado por año de tratamiento y ntadas, que presentaban las 5 mutaciones en la polimerasa viral identificadas que confieren resistencia a lamivudina, el entecavir se mostró activo frente a ellas pero en una concentración mayor que la requerida para ser eficaz frente a cepas sin mutaciones2,26, lo que indica un cierto grado de resistencias cruzadas entre ambos fármacos. Por otra parte, en estudios in vitro también se ha constatado que las cepas que han desarrollado resistencias al adefovir son sensibles a la acción del entecavir2,27.
TOLERABILIDAD
En los estudios de los que disponemos hasta el momento, en entecavir posee un perfil de seguridad similar a placebo1,3 y lamivudina8,9,11,13,16, sin apreciarse diferencias entre las distintas dosis empleadas ni entre los tipos de pacientes tratados.
Aproximadamente el 7% de los pacientes naïves y el 10% de los refractarios a lamivudina presentan efectos adversos graves28. La mayoría (observados hasta en el 84% de los pacientes) son leves o moderados. Entre los efectos secundarios de grado 3-4 producidos por entecavir, se encuentran una elevación marcada de la ALT (en torno al 17-27%), un aumento de la bilirrubina sérica (2%) o las alteraciones hematológicas (disminución de los valores de hemoglobina, plaquetas, neutrófilos y tiempo de protrombina < 1%). Asimismo, pueden producir alteraciones analíticas del tipo hiperglucemia (2%), elevación de amilasa y lipasa (2-8%) y aumento de la creatinina sérica (1-2%).
Sólo un 1-2% de los pacientes incluidos en los estudios publicados han suspendido el tratamiento por efectos adversos frente al 3% de la lamivudina.
El 2% de los pacientes naïves y refractarios a lamivudina presentan elevaciones de la ALT > 10 veces el límite superior de la normalidad, frente al 4 y el 11% de los tratados con este fármaco, respectivamente29.
PAPEL DEL ENTECAVIR EN EL TRATAMIENTO DE LA HEPATITIS B CRONICA
Por su alta eficacia como supresor de la replicación viral, gran tolerabilidad y aparente baja tasa de resistencias, creemos que el entecavir va a ocupar un lugar preponderante en el tratamiento de los pacientes naïves. En los pacientes que han desarrollado resistencias a la lamivudina, a pesar de que ha demostrado ser eficaz, por la posible aparición de resistencias cruzadas, no parece ser la primera opción que cabría considerar.
En los pacientes HBeAg positivo, con valores de ADN viral $ 20.000 U/ml o más de 100.000 copias/ml y transaminasas elevadas, el entecavir, el adefovir, el interferón pegilado alfa-2a o la lamivudina se consideraron en el reciente Consenso español para el tratamiento de la hepatitis B y C como tratamientos de primera línea30. Sin embargo, los 2 primeros pueden ser más apropiados en los casos con alta carga viral y ALT baja, ya que la eficacia de la terapia al interferón pegilado en estos casos es menor. La lamivudina, dada su menor eficacia en comparación con entecavir e interferón pegilado alfa-2a y la alta tasa de resistencias con los años de tratamiento, en la actualidad no parece ser de primera elección en estos pacientes. De todas formas, la elección de uno u otro también debe basarse en los posibles costes de la terapia.
En los pacientes HBeAg negativo con ADN viral detectable $ 2.000 U/ml, el entecavir, el adefovir, la lamivudina o el interferón pegilado alfa-2a constituyen nuevamente las terapias recomendadas como de primera elección30. En estos pacientes, dadas las altas tasas de supresión del ADN viral y la baja tasa de resistencias reportadas hasta la fecha, parece que el entecavir podría ocupar un lugar preponderante con respecto a las otras opciones terapéuticas de las que disponemos en la actualidad.
En pacientes previamente tratados y con resistencia a lamivudina, tanto adefovir como entecavir constituirían una buena opción terapéutica, pero parece que la adición del primero sería más acertada por la presencia de resistencias cruzadas con el entecavir. Una posible terapia en un futuro no muy lejano sería la adición de tenofovir o la sustitución de la lamivudina por la combinación de emtricitabina y tenofovir29. En pacientes que han desarrollado resistencia al adefovir, aunque no hay una casuística relevante sobre el tema, la sustitución por entecavir (si no ha habido previamente resistencias a lamivudina) o en un futuro la terapia combinada con emtricitabina y tenofovir podrían constituir unas buenas opciones29.
CONCLUSIONES
El entecavir es un nuevo antiviral muy potente que ha demostrado en estudios en fase III su superioridad con respecto a lamivudina en los pacientes infectados de forma crónica por el VHB, tanto en HBeAg positivo como negativo. Esta mayor eficacia se observa en términos de mejoría histológica, disminución media del ADN viral, proporción de pacientes con ADN indetectable y normalización de la ALT, pero no en tasa de seroconversión y pérdida del HBeAg. Asimismo, ha demostrado ser eficaz en pacientes resistentes o refractarios a lamivudina en dosis de 1 mg/día. Su tolerabilidad es buena, ya que sus efectos secundarios, en su mayoría, suelen ser leves o moderados, con una incidencia de aparición similar a la encontrada con placebo o lamivudina. En pacientes naïves se ha observado la aparición de resistencias en menos del 1% de los casos tras 3 años de tratamiento; sin embargo, en pacientes con resistencia previa a lamivudina la incidencia de éstas alcanza en torno al 15% a los 3 años. Se necesitan más estudios que lo comparen con las otras opciones terapéuticas disponibles actualmente, así como estudios que evalúen su efecto a más largo plazo.
AGRADECIMIENTOS
Los autores quieren agradecer especiamente a Maria Buti la revisión crítica del manuscrito.