INTRODUCCION
El viejo adagio hipocrático «primun non nocere», interpretado en un sentido amplio, nos recuerda que el objetivo de la ciencia médica es beneficiar al ser humano, en lo que a la salud se refiere. En realidad, prácticamente hasta mediados del siglo xx la falta de conocimientos científicos era la principal limitación de las disciplinas médicas1; es probable que en aquellos tiempos la mayoría de las intervenciones sanitarias causaran daño o no influyeran en la historia natural de las enfermedades2. Por otra parte, el progreso científico no es suficiente para garantizar una buena medicina si no tiene en cuenta los principios éticos básicos3 y se aplica en un medio con desigualdades sociales4. En cualquier caso, en el mejor de los escenarios un país desarrollado con un sistema sanitario bien dotado, equitativo y accesible, el paciente seguirá expuesto a un riesgo: el «error» humano5.
Un informe del Institute of Medicine de Estados Unidos, titulado «To err is human: building a safer health system», puso de actualidad las graves repercusiones de los errores en el sistema sanitario6. El trabajo clínico diario implica la toma constante de decisiones, y cada una de ellas está sujeta a un posible error. No es nuestra intención profundizar en el área de la seguridad o del análisis de los tipos de errores (del sistema o personales), aunque todo médico debería conocer la bibliografía fundamental sobre el tema7-11. No obstante, conviene reconocer que entre los errores humanos se pueden identificar algunos en los que una buena revisión del conocimiento puede incidir (prevenir)12. Unos son los errores basados en las reglas (ruled-based mistakes), que son los que derivan de aplicar de forma automática una norma aprendida, bien porque ésta no sea adecuada en una situación concreta o porque sea errónea de raíz. El otro tipo de error puede derivar del simple desconocimiento.
El objetivo del presente manuscrito es revisar los errores frecuentes en el manejo del paciente grave con enfermedad inflamatoria intestinal (EII). Esta situación de gravedad es frecuente, puesto que, por ejemplo, hasta un 15% de los pacientes con colitis ulcerosa tendrá durante algún momento de su evolución un brote que requerirá ingreso hospitalario13. Durante estos episodios de gravedad la vida del paciente puede correr grave peligro; de hecho, previamente a la introducción de los corticoides, la mortalidad de un brote grave de colitis ulcerosa superaba el 30%14. Incluso hoy en día, con una mortalidad próxima al 0%, un diagnóstico o un tratamiento inadecuados pueden producir secuelas irreversibles, como la ceguera causada por una uveítis o las lesiones cutáneas causadas por un pioderma gangrenoso. Es en estos casos de mayor gravedad donde los posibles errores diagnósticos o terapéuticos pueden tener consecuencias más trascendentales. Nuestra aproximación al problema consistirá en enunciar un error que se observa frecuentemente en la práctica clínica en el manejo del paciente grave con EII, para posteriormente revisar la evidencia científica que disponemos al respecto y, finalmente, proponer la actitud más adecuada.
DIAGNOSTICO DIFERENCIAL CON OTRAS ENFERMEDADES
No hay ningún síntoma ni signo patognomónico de la EII, de modo que para llegar a su diagnóstico se precisa la combinación de una serie de datos clínicos, radiológicos, endoscópicos e histológicos sugestivos15. Además, se deben descartar otras entidades que pueden cursar con una clínica similar, como las enfermedades infecciosas. Aunque el problema del diagnóstico diferencial ante un paciente con clínica compatible se plantea fundamentalmente en los casos no diagnosticados previamente de EII16, también puede haber dudas diagnósticas al valorar a los pacientes graves con una enfermedad de Crohn o una colitis ulcerosa ya establecida.
Al ingresar a un paciente previamente diagnosticado de colitis ulcerosa que presenta rectorragia, no es necesario realizar coprocultivos, pues es evidente que se trata de un brote de su enfermedad
Las infecciones intestinales pueden simular las manifestaciones clínicas, e incluso endoscópicas, de la colitis ulcerosa17-19. Además, diversos agentes infecciosos pueden causar una sobreinfección en pacientes con EII, capaz de desencadenar una recidiva o agravar un brote de la enfermedad inflamatoria19-25. Por ello, en todo paciente que ingresa por un presunto brote de colitis ulcerosa deberán excluirse las causas infecciosas de diarrea13,26-32. De este modo, aunque el diagnóstico de colitis ulcerosa sea previamente conocido, es recomendable solicitar coprocultivos para descartar una posible infección por Salmonella, Shigella, Campylobacter o Escherichia coli13,26-31. Además, probablemente debería efectuarse un estudio de huevos y parásitos en heces.
No obstante, la rentabilidad real, en la práctica clínica, de la determinación rutinaria de patógenos en las heces en pacientes con supuesta recidiva de su EII no está claramente establecida, aunque parece ser relativamente escasa33. Un reciente ensayo en el que se realizó sistemáticamente un estudio de heces en los pacientes que presentaban un brote de EII demostró que el coprocultivo era positivo en sólo el 4% de los casos33. Más recientemente, un grupo español34 ha confirmado estos decepcionantes resultados al evaluar prospectivamente, durante 2 años, la incidencia de sobreinfección intestinal por enteropatógenos (mediante realización sistemática de coprocultivos) en 99 brotes de actividad de EII que requirieron ingreso hospitalario; con esta estrategia diagnóstica únicamente se detectaron 5 infecciones bacterianas (por C. jejuni), lo que representa tan sólo el 5% de los casos, y además no se pudo demostrar ninguna correlación entre la infección y el curso de la enfermedad34. En cualquier caso, es preciso destacar que, si bien colectivamente el número de pacientes con supuesta recidiva de su EII e infección bacteriana concomitante parece ser muy reducido, individualmente la consecuencia de su correcta identificación es muy relevante. Además, el uso cada vez más común de fármacos que modifican de forma notoria la respuesta a las infecciones en la EII (inmunomoduladores tiopurínicos, anticuerpos monoclonales), solos o en combinación, puede provocar una mayor frecuencia de complicaciones infecciosas35,36.
De todos modos, aunque puede ser difícil o incluso imposible diferenciar entre el brote de EII y la diarrea enteroinvasiva, no se debe demorar el tratamiento con esteroides a la espera del resultado de los coprocultivos (que puede retrasarse varios días) en un paciente con el diagnóstico previo establecido de colitis ulcerosa o con una sospecha muy fundamentada de esta enfermedad30,37.
La infección por Clostridium difficile únicamente debe tenerse en consideración en los pacientes con EII que han recibido antibióticos recientemente
La infección por C. difficile se ha asociado con las exacerbaciones de la EII20-23,38-43. No obstante, otros estudios restan importancia a este patógeno20,44, por lo que la indicación de estudiar sistemáticamente la presencia de dicha infección no está establecida. El método diagnóstico de elección, tanto en los pacientes sin EII como en los que tienen esta enfermedad, es la determinación de la toxina de C. difficile en heces28. Algunos autores recomiendan realizar esta prueba sólo si el paciente ha recibido tratamiento antibiótico o ha estado hospitalizado recientemente, o cuando no haya una respuesta adecuada a la terapia habitual28,33. Otros autores, por el contrario, consideran que el estudio de la toxina de C. difficile en heces debe solicitarse sistemáticamente en todo paciente que ingresa por un brote grave de EII, al margen de que haya recibido o no tratamiento antibiótico previamente13,19,26,27,30-32. Un argumento a favor de esta última estrategia es la demostración de episodios de colitis seudomembranosa en ausencia de tratamiento reciente con antibióticos21,39. Además, el paciente no siempre recuerda con precisión si ha tomado antibióticos, particularmente si esto ha ocurrido como puede ser en este caso varias semanas antes de producirse al cuadro de colitis18.
Con respecto al efecto del tratamiento de la infección por C. difficile sobre la actividad de la EII hay también opiniones contrapuestas. Así, algunos estudios han demostrado un efecto beneficioso del tratamiento antibiótico sobre la EII23,33,38,39,42,45,46, mientras que otros han comprobado que la mejoría clínica se puede lograr mediante el tratamiento de la EII subyacente y los pacientes negativizan finalmente la toxina en heces sin precisar antibióticos20,22,41,44.
En resumen, la relevancia de la infección por C. difficile en los pacientes con EII es controvertida, lo que probablemente indica que el papel que este microorganismo desempeña en esta enfermedad puede ser muy diverso: enteropatógeno causante de diarrea infecciosa independientemente de la EII subyacente, colonizador no patógeno en pacientes con esta enfermedad o desencadenante del brote de la EII.
TÉCNICAS DIAGNOSTICAS RADIOLOGICAS Y ENDOSCOPICAS
La radiografía simple de abdomen no aporta información de interés en los pacientes con enfermedad inflamatoria intestinal grave, por lo que puede obviarse
Al contrario, en todo paciente que es valorado por un brote grave de EII debería realizarse una radiografía simple de abdomen27-30. Ésta es la prueba más sencilla, económica y rápida para valorar inicialmente a los pacientes con EII47. A pesar del desarrollo de técnicas de imagen más sofisticadas, la radiología simple de abdomen sigue vigente, especialmente en la valoración inicial de los casos más graves de EII47.
En los pacientes con enfermedad de Crohn, esta prueba puede proporcionarnos información sobre la existencia de una obstrucción intestinal (al identificar la dilatación de las asas y valores hidroaéreos en la radiografía realizada en bipedestación) o de un absceso abdominal (al visualizar una masa habitualmente localizada en la fosa ilíaca derecha)30,48. En algunos casos la presencia de un absceso retroperitoneal se puede sospechar por la difuminación de la línea del psoas49.
Por su parte, en la colitis ulcerosa la radiografía simple de abdomen es fundamental para descartar la presencia de un megacolon (dilatación > 6 cm en la radiografía realizada en decúbito supino)30. Puesto que las heces habitualmente no se localizan en las zonas de la mucosa inflamada, la visualización de éstas (con el denominado patrón en «miga de pan») puede ser útil para estimar la extensión de la afectación cólica50. De este modo, cuanto mayor sea la longitud de los segmentos cólicos únicamente rellenos de aire, mayor será la extensión y, por consiguiente, la gravedad de la colitis ulcerosa50. Además, la visualización de aire en el intestino delgado (neumatización de 3 o más asas intestinales), debido a un cierto grado de íleo paralítico, se ha descrito como un signo de mal pronóstico en la colitis ulcerosa51,52. Otros datos, como la valoración del espacio situado entre el gas intragástrico y el gas del colon transverso, nos pueden orientar acerca del grosor de la pared cólica, que es mayor cuanto más grave es la afectación del colon47. El contorno del gas intracólico también nos puede dar cierta idea sobre el estado de la mucosa; así, el luminograma puede poner de manifiesto una irregularidad de la mucosa, las ulceraciones presentes en su superficie, el acortamiento o la desaparición de la hasturas49. En raras ocasiones, es posible detectar la presencia de gas intramural, localizado dentro de la pared del colon, como consecuencia de la ulceración extensa de la mucosa, lo que representa, por tanto, un signo de gravedad que puede preceder a la perforación cólica49. Por último, ante la sospecha clínica de perforación, la radiografía de abdomen en bipedestación o en decúbito lateral izquierdo es la primera prueba que se debe realizar. Si ésta es normal y la sospecha de perforación es elevada, debería practicarse una tomografía computarizada (TC)53.
En los brotes graves de colitis ulcerosa (o de enfermedad de Crohn) es necesario realizar una colonoscopia completa, para definir con precisión la extensión de la enfermedad y escoger el tratamiento más adecuado
En primer lugar, es preciso recalcar que ante un brote grave de colitis ulcerosa (en un paciente con el diagnóstico ya establecido) el conocimiento detallado de la extensión de la enfermedad no cambiará la actitud terapéutica, pues independientemente de la longitud de la afectación cólica será preciso el tratamiento con esteroides i.v. En segundo lugar, se debe tener presente que la colonoscopia podría desencadenar un megacolon tóxico en estos pacientes graves54-56, probablemente debido a la distensión que provoca y que, a su vez, afecta al riego sanguíneo de la pared del colon, aumentando la captación mucosa de productos bacterianos57. Por tanto, esta exploración debería evitarse en lo posible en los casos graves de colitis ulcerosa. De igual modo, la realización de un enema de bario está contraindicada en esta situación, pues podría también desencadenar un megacolon tóxico por mecanismos similares a la colonoscopia27,57-59. Por tanto, en caso de ser necesaria la exploración endoscópica del colon, ésta debería ser lo más limitada posible explorando únicamente el recto y la parte más distal del sigma y efectuarse con sumo cuidado, insuflando la menor cantidad posible de aire y aspirando al final de la exploración27-30,60,61. Esta breve y limitada exploración endoscópica será suficiente para evaluar la gravedad de las lesiones (recordemos que en la colitis ulcerosa la afectación más aparente se encuentra habitualmente en el tramo más distal61) y para obtener biopsias del recto y del sigma (para valorar infección por citomegalovirus).
En este sentido, las excepciones en las que sí estaría indicada una endoscopia digestiva baja en una colitis grave serían: ante la duda diagnóstica en un paciente sin EII conocida que acude a urgencias por un primer episodio de colitis grave16; o si el diagnóstico de colitis ulcerosa era ya conocido, en casos de corticorresistencia (previo al planteamiento de administrar ciclosporina/infliximab o realizar colectomía); en esta última situación, especialmente si la respuesta al tratamiento esteroideo es sólo parcial, la información que nos proporciona la rectosigmoidoscopia puede ayudarnos a tomar la decisión de continuar administrando corticoides u optar por otra alternativa médica o incluso quirúrgica62-65. La sobreinfección por citomegalovirus, como se revisará más adelante, puede ser causa de corticorrefractariedad en algunos pacientes graves, y esta posibilidad puede confirmarse o descartarse mediante la realización de una rectosigmoidoscopia y la obtención de biopsias.
Por último, cabe mencionar que en caso de que se desee conocer con más precisión la extensión de la afectación intestinal, es posible realizar una gammagrafía con leucocitos marcados, ya que esta técnica es inocua en el brote grave de EII66.
ABSCESOS ABDOMINALES
El absceso abdominal es una complicación relativamente frecuente de los pacientes con enfermedad de Crohn con fenotipo fistulizante67,68. Así, se ha estimado que entre un 10 y un 30% de los pacientes con enfermedad de Crohn tendrá esta complicación durante su vida68-75. La mayoría de los abscesos abdominales se asocian con una perforación transmural de la pared abdominal generalmente el íleon terminal afectada por la enfermedad de Crohn67,68; de ahí que la localización más frecuente de los absce sos abdominales en estos pacientes sea la fosa ilíaca derecha67,68.
En el brote de enfermedad de Crohn no complicada es muy frecuente la fiebre elevada
Los síntomas de los pacientes con un absceso abdominal pueden ser difíciles de diferenciar de los descritos en los pacientes con un brote de enfermedad de Crohn no complicada27. Así, por ejemplo, la presencia de febrícula o fiebre, dolor abdominal o astenia es frecuente en ambas situaciones76-79. No obstante, el hallazgo de fiebre elevada (> 39 °C) podría indicar la presencia de una complicación, típicamente un absceso abdominal27. Por tanto, la identificación de fiebre alta en un paciente con enfermedad de Crohn obliga a descartar esta complicación mediante realización de ecografía o, mejor aún, una TC27. Es preciso recordar aquí que la respuesta pirética puede estar disminuida en los pacientes tratados con esteroides, lo que podría dificultar el diagnóstico clínico de un absceso abdominal27.
Los abscesos abdominales se deben tratar inicialmente con antibióticos solos, reservando el drenaje (percutáneo o quirúrgico) para los casos que no respondan a éstos
Aunque es cierto que algunos autores han descrito la resolución de los abscesos abdominales en pacientes con enfermedad de Crohn únicamente con tratamiento antibiótico80, esta observación ha sido excepcional y otros estudios han puesto de manifiesto que los antibióticos aisladamente no son suficientes en la mayoría de los casos68,81. Por ello, actualmente se considera que, si es posible, los abscesos abdominales deben drenarse siempre, ya sea percutánea o quirúrgicamente27,28,67,82. No obstante, excepcionalmente, pequeños abscesos abdominales visualizados en la TC pueden responder al tratamiento antibiótico aislado, en cuyo caso será obligado efectuar un seguimiento estricto mediante una TC de control e indicar el drenaje de la lesión si ésta no disminuye de tamaño en un tiempo prudencial80,83.
El método de drenaje de elección de un absceso abdominal es el quirúrgico
Tradicionalmente, los abscesos abdominales se han drenado por vía quirúrgica. Sin embargo, actualmente se considera que la vía de drenaje de primera elección es la percutánea, guiada por ecografía o TC27,67,70,71,75,81,84-92. La colocación de un catéter y su mantenimiento durante unos días o semanas evitará la recidiva del absceso a corto plazo27. El drenaje quirúrgico debería reservarse para los casos en que el absceso no sea susceptible de drenaje percutáneo (por ser inaccesible, multilocular o mal definido) o cuando éste fracase. Aunque es relativamente frecuente que la intervención quirúrgica sea en último término necesaria en los pacientes que han presentado un absceso abdominal93, el drenaje percutáneo inicial hará que la cirugía posterior, en caso de que sea necesaria, se realice electivamente y en mejores condiciones67,91,92,94.
En un paciente con un absceso abdominal nunca se deben administrar esteroides, aunque presenten una enfermedad de Crohn activa, ya que éstos facilitan la diseminación de la infección
Esta recomendación, ampliamente extendida, no tiene realmente una base científica95,96. Al contrario, un estudio ha demostrado que el tratamiento esteroideo no se asocia a una mayor incidencia de complicaciones en los pacientes que tienen un absceso abdominal96. No obstante, puesto que estos fármacos no tienen efecto alguno sobre la fístula o el absceso en sí, deberían reservarse para los pacientes que presenten actividad de la enfermedad de Crohn. Evidentemente, e independientemente de que se administren o no esteroides, se deberá indicar tratamiento antibiótico y drenar de forma correcta el absceso.
No obstante, los esteroides pueden enmascarar los síntomas propios de la infección (p. ej., la fiebre) o del proceso séptico subyacente (p. ej., irritación peritoneal por absceso o perforación intestinal), por lo que, en este contexto, la valoración clínica debe ser extremadamente cuidadosa y basarse en datos objetivos: analítica, ecografía y TC19,76. Además, es bien conocido que estos fármacos favorecen el desarrollo de complicaciones infecciosas (y de abscesos en concreto), tanto en los pacientes no operados como en el postoperatorio en caso de que precisen cirugía90,97-101.
ESTENOSIS INTESTINAL
La estenosis intestinal es la complicación más frecuente y la principal causa de cirugía de la enfermedad de Crohn67,102,103. Se pueden distinguir 2 tipos fundamentales de estenosis en la enfermedad de Crohn, según su mecanismo patogénico sea predominantemente inflamatorio o fibrótico, aunque en ocasiones puede ser consecuencia de una combinación de ambos104. El primero estaría causado por la inflamación y el edema asociados al brote de actividad de la enfermedad, mientras que la variante «fibroestenosante» sería consecuencia de cambios fibróticos crónicos; todo ello tiene consecuencias en el pronóstico y en la respuesta al tratamiento. Las estenosis «inflamatorias» se suelen asociar a síntomas y signos sugerentes de actividad de la enfermedad, como fiebre, leucocitosis, diarrea y elevación de reactantes de fase aguda, pero la diferenciación con una lesión «fibroestenosante» en ocasiones puede ser difícil104.
Un cuadro obstructivo en un paciente con enfermedad de Crohn se debe siempre a una estenosis intestinal como consecuencia de su enfermedad de base
La estenosis intestinal debida a la enfermedad de Crohn produce una serie de síntomas típicos de cualquier proceso obstructivo intestinal: dolor cólico, distensión abdominal, vómitos y empeoramiento de la clínica tras la ingestión alimentaria. Si bien el comienzo de los síntomas de una obstrucción parcial puede ser brusco, la enfermedad de Crohn estenótica casi nunca se presenta de forma «catastrófica» como una obstrucción total, y en la mayoría de los casos no hay afectación vascular asociada104. Por tanto, la identificación de una obstrucción completa debe sugerir otra causa, como las adherencias secundarias a cirugía previa, un proceso herniario o un vólvulo intestinal. Es imprescindible distinguir la estrangulación debida a estas últimas complicaciones, que deben operarse inmediatamente, de la obstrucción secundaria al estrechamiento luminal104. Inicialmente, esta diferenciación es imposible en no pocas ocasiones, ya que no disponemos de datos patognomónicos de estrangulación, si bien la clínica suele ser más grave. Por ello, es de capital importancia la observación estricta, con vigilancia de la evolución clínica, radiológica y analítica, la clásicamente denominada por los cirujanos como «vigilancia armada»104. Por último, cabría señalar que una obstrucción intestinal no complicada debida a una enfermedad de Crohn casi invariablemente se resuelve de forma espontánea (o con tratamiento esteroideo) y rápida (p. ej., en 2 o 3 días), de modo que la ausencia de mejoría evidente en este plazo debe hacer sospechar otro diagnóstico y plantear el tratamiento quirúrgico27,105.
MEGACOLON TOXICO
El megacolon tóxico se caracteriza por una dilatación cólica no obstructiva, total o segmentaria, asociada a toxicidad sistémica27,57,106. La incidencia de esta complicación ha disminuido gradualmente, debido al diagnóstico y el tratamiento cada vez más precoces de la colitis ulcerosa27,57,59.
El megacolon tóxico es una complicación exclusiva de la colitis ulcerosa
El megacolon tóxico puede ocurrir como complicación de cualquier colitis grave, independientemente de su etiología57,59,67. Así, prácticamente cualquier proceso inflamatorio del colon puede predisponer a la aparición de esta complicación: EII (incluida tanto la colitis ulcerosa como, más raramente, la enfermedad de Crohn), colitis infecciosa (por Salmonella, Shigella, Campylobacter, Yersinia, C. difficile, Cryptosporidium, Entameba o citomegalovirus), isquemia o procesos malignos (como el sarcoma de Kaposi)59. Por tanto, ante un megacolon tóxico es obligado descartar otras etiologías diferentes de la EII, como las infecciosas, mediante la realización de coprocultivos, parásitos en heces y toxina de C. difficile.
El diagnóstico de megacolon tóxico se basa exclusivamente en la demostración radiológica de dilatación cólica
La radiografía simple de abdomen es la técnica radiológica más útil para el diagnóstico de megacolon tóxico. En ella, el colon transverso o el derecho suele ser el más dilatado, por lo que es necesario que alcance los 6 cm de diámetro para poder diagnosticar un megacolon tóxico27,57,106. Pero el diagnóstico de megacolon tóxico se basa en la coincidencia de dilatación cólica con manifestaciones clínicas de toxicidad sistémica27,57,67,106. Por tanto, el mero hallazgo radiológico de una dilatación cólica no es un criterio diagnóstico definitivo. Los criterios clínicos que definen este cuadro y que se emplean de forma generalizada, propuestos por Jalan et al107 hace ya varias décadas, están resumidos en la tabla I, donde se puede observar que, además de la constatación de la dilatación cólica, se deben cumplir al menos 4 criterios clínicos. No obstante, los criterios mencionados no han sido validados, y la exigencia del cumplimiento de todos ellos podría llevar a retrasar el diagnóstico y el consiguiente tratamiento del megacolon tóxico. Por tanto, una opción más práctica consiste en considerar la existencia de esta complicación cuando se demuestre una dilatación cólica ($ 6 cm) en un paciente con criterios de colitis ulcerosa grave, definida esta última según la reciente clasificación de Montreal, como la que presenta 6 o más deposiciones diarias con sangre, fiebre, taquicardia, anemia y aumento de la velocidad de sedimentación globular108,109.
Las manifestaciones clínicas del megacolon tóxico son muy características, por lo que habitualmente su diagnóstico es sencillo
Los datos clínicos caracterísicos del megacolon tóxico incluyen, habitualmente, una diarrea sanguinolenta refractaria al tratamiento médico durante una semana o más (aunque otras veces la aparición del cuadro puede ser más rápida)57. En los pacientes con colitis ulcerosa, a diferencia de lo que ocurre en la enfermedad de Crohn, el dolor abdominal continuo es excepcional (aunque el dolor cólico que calma con la deposición es frecuente), por lo que su presencia sugiere la posibilidad de un megacolo;nico habitual del brote grave de colitis ulcerosa, su aparición indica claramente la posibilidad de una perforación cólica27,67.
No obstante, no siempre es sencillo el diagnóstico del megacolon tóxico. Aunque la aparición de diarrea inicial es prácticamente invariable, posteriormente ésta puede estar disminuida incluso puede haber estreñimiento, probablemente debido a la pérdida de función motora del colon (lo que se conoce como «falsa mejoría»)59. Acorde con ello, en la exploración física suele demostrarse una disminución o desaparición de los ruidos intestinales y un incremento del timpanismo abdominal59. Por último, debe tenerse en cuenta la posibilidad de que el tratamiento esteroideo pueda enmascarar los síntomas y los signos propios del megacolon tóxico, haciendo aún más difícil su diagnóstico precoz59. Por todo ello, es obligado practicar inicialmente una radiografía simple de abdomen en todo paciente con un brote grave de EII, con independencia de que presente dolor abdominal o diarrea, y posteriormente con frecuencia (p. ej., cada 24 o 48 h) durante el seguimiento del brote.
INFECCION POR CITOMEGALOVIRUS
Al igual que ocurre con otras infecciones por herpesvirus, la infección primaria por citomegalovirus se sigue de un estado latente, a partir del cual el virus puede reactivarse110,111. La prevalencia de infección activa por citomegalovirus en pacientes no seleccionados con EII oscila entre el 1 y el 5% de los casos112-114. Sin embargo, la prevalencia de esta infección es considerablemente más alta en pacientes que padecen, en concreto, una colitis ulcerosa grave, alcanzando cifras que oscilan alrededor del 10% y prácticamente el 100% según los diversos estudios115-121. Esta notable variabilidad en las cifras de prevalencia se debe, al menos en parte, al empleo de diferentes métodos diagnósticos en los múltiples estudios y a la dispar gravedad de los pacientes incluidos en ellos111. El riesgo de infección por citomegalovirus se encuentra incrementado en los pacientes con EII debido, fundamentalmente, al frecuente empleo de fármacos inmunodepresores115,122. No obstante, aunque la mayoría de los casos de colitis por citomegalovirus en pacientes con EII se han descrito en los que estaban recibiendo tratamiento con esteroides, fármacos tiopurínicos o ciclosporina110, excepcionalmente también se han publicado casos de infección sin tratamiento inmunodepresor concomitante123-127. La infección por citomegalovirus debe considerarse ante todo paciente con EII que no responda al tratamiento esteroideo114.
La infección por citomegalovirus siempre que está presente desempeña un papel causal en el brote de colitis ulcerosa o en el episodio de corticorrefractariedad
Se han publicado numerosos casos clínicos en los que se evalúa el papel de la infección por citomegalovirus en pacientes con EII110. Además, disponemos de diversas series cortas de pacientes que, salvo excepciones128,129, sugieren un papel etiológico de esta infección, especialmente en la colitis ulcerosa corticorrefractaria112,113,115-117,130,131. Por último, se han descrito, en repetidas ocasiones, respuestas satisfactorias al ganciclovir en colitis ulcerosas corticorrefractarias113,115,117-119. Sin embargo, también se han constatado casos en los que el tratamiento antiviral no ha sido capaz de inducir la remisión clínica o evitar la cirugía113,115,117. Además, también se ha comprobado en ocasiones la mejoría clínica de pacientes con colitis ulcerosa e infección concomitante por citomegalovirus que han recibido únicamente tratamiento esteroideo (y no antiviral)110,132; esto último indica que, al menos en algunas ocasiones, la infección por citomegalovirus actuaría como un mero comensal o «espectador inocente». La recomendación práctica que se deriva de esta conclusión es que, independientemente de que se decida administrar tratamiento frente al citomegalovirus, no se debe dejar de tratar la enfermedad (inflamatoria intestinal) de base.
El método diagnóstico de elección para diagnosticar una sobreinfección por citomegalovirus en un paciente con colitis ulcerosa es la serología
La serología es útil para detectar la exposición previa del paciente al citomegalovirus111. Por consiguiente, el valor de la serología viene limitado por el hecho de que el antecedente de infección (curada) por citomegalovirus es muy frecuente en la población general. De todos modos, algunos autores han recomendado la evaluación sistemática del estado serológico en todo paciente con colitis ulcerosa activa que va a ser tratado con esteroides19; en caso de seropositividad para inmunoglobulina (Ig) G frente a citomegalovirus, si el paciente desarrolla posteriormente corticorrefractariedad, debería investigarse la presencia de infección en biopsias rectales; mientras que en caso de corticorrefractariedad en sujetos con serología IgG negativa debería iniciarse sin demora tratamiento con ciclosporina o infliximab, o evaluarse la posibilidad de una colectomía, y no cabría considerar la posibilidad de sobreinfección por citomegalovirus19. Sin embargo, la elevada prevalencia de la positividad serológica frente al citomegalovirus limita considerablemente la utilidad de esta estrategia diagnóstica.
El diagnóstico de infección activa por citomegalovirus habitualmente se establece mediante el estudio histológico empleando típicamente la tinción de hematoxilina-eosina de las biopsias cólicas obtenidas mediante endoscopia, al observar la presencia de las células citomegálicas con los característicos cuerpos de inclusión intranucleares (en ocasiones rodeados por un halo claro, lo que les confiere una apariencia en «ojo de búho»)28,111. Sin embargo, no es excepcional que la infección por citomegalovirus no haya sido detectada inicialmente (basándose sólo en las biopsias cólicas), pero sí posteriormente en la pieza quirúrgica de pacientes que han sido sometidos a colectomía por una colitis ulcerosa corticorrefractaria112,116,119,120,129,130. Esta observación recalca la importancia de alertar al patólogo ante todo paciente en el que estimemos una posible infección por citomegalovirus.
Más recientemente, se ha demostrado que las técnicas inmunohistoquímicas (que permiten la tinción de los antígenos virales) son superiores a las histológicas que se utilizan habitualmente111, por lo que las primeras podrían emplearse cuando las segundas sean negativas y persista la sospecha de infección por citomegalovirus28,119 o como confirmación diagnóstica110. En resumen, el diagnóstico histológico continúa siendo de primera elección para identificar inicialmente la infección por citomegalovirus, si bien la inmunohistoquímica, debido a su elevada fiabilidad, parece altamente recomendable como técnica de confirmación o exclusión.
Las técnicas de biología molecular, como la reacción en cadena de la polimerasa, han demostrado también ser sensibles y específicas para la detección de la infección por citomegalovirus111,133-135, y permiten llegar al diagnóstico de forma más sencilla al no precisar la obtención de biopsias cólicas, sino únicamente sangre periférica. Sin embargo, estas técnicas moleculares no permiten distinguir entre infección asintomática y enfermedad activa111.
Ante un paciente con colitis ulcerosa grave corticorresistente en el que se detecta una infección por citomegalovirus y se comienza tratamiento con ganciclovir, es obligado suspender inmediatamente los esteroides
Cuando se detecta una infección por citomegalovirus en las biopsias cólicas de un paciente con una colitis grave corticorresistente, el médico se enfrenta a la difícil disyuntiva de suspender (rápidamente) el tratamiento inmunodepresor, lo que favorecería la respuesta de la infección a los antivirales pero, por otra parte, podría empeorar la actividad de la EII debida a la propia enfermedad inflamatoria110. La recomendación de descender rápida aunque progresivamente la dosis de esteroides y de otros inmunodepresores en los pacientes con colitis ulcerosa corticorresistente, en quienes se ha diagnosticado infección por citomegalovirus y se ha comenzado tratamiento con ganciclovir, está ampliamente extendida28, pero el beneficio de esta actitud nunca ha sido demostrado y no es tan obvio como podría parecer. También se podría argumentar que los esteroides pueden ser útiles para controlar la inflamación concomitante y, por tanto, que el tratamiento combinado con corticoides y ganciclovir permitiría actuar simultáneamente sobre la inflamación y la infección. En este sentido, desconocemos si el fenómeno de la corticorresistencia es permanente en esta situación de sobreinfección, pero algunos datos indirectos indican que la refractariedad a los esteroides es reversible tanto en condiciones experimentales como clínicas136. No sabemos tampoco hasta qué punto el hecho de que tratemos la infección por citomegalovirus revierte el componente inflamatorio que la reactivación viral perpetúa137. Por último, debemos recordar aquí la recomendación mencionada con anterioridad de que, independientemente de que se decida administrar tratamiento frente al citomegalovirus, no se debía dejar de tratar la enfermedad de base. Por todo ello, no parece prudente una retirada inmediata o excesivamente rápida de los corticoides en esta situación137.
NUTRICION
Los pacientes que ingresan por un brote de colitis ulcerosa se benefician de la dieta absoluta durante los primeros días, ya que ello disminuye la actividad de la enfermedad. La vía de administración de los suplementos nutricionales debe ser la parenteral, porque es más efectiva y mejor tolerada que la enteral
La desnutrición energético-proteica se asocia con frecuencia a la EII en fase de actividad138. Los pacientes que ingresan por un brote grave de colitis ulcerosa a menudo están desnutridos, presentan un estado catabólico y, además, deberán estar forzosamente en ayunas para la realización de las frecuentes pruebas a las que son sometidos139. Por otra parte, ni la dieta absoluta ni la nutrición parenteral total han demostrado ser efectivas en el tratamiento de la colitis ulcerosa140-142. A modo de ejemplo, en un estudio ya clásico publicado en 1980 se demostró que la tasa de colectomía era similar en los pacientes con colitis ulcerosa que permanecían a dieta absoluta (y nutrición parenteral total) y en los que recibían una dieta oral ordinaria140. Estos datos han sido confirmados posteriormente por otro estudio similar141. Más recientemente, González-Huix et al142 han comparado el papel de la nutrición enteral y parenteral totales, como tratamiento adyuvante a los esteroides en la colitis ulcerosa grave, y han demostrado que, aunque ambas son equivalentes, la primera es más barata y se asocia con menos efectos adversos. Esto no es de extrañar, pues la nutrición enteral es más fisiológica y carece de las complicaciones asociadas a la nutrición parenteral, como la infección del catéter de infusión o los diversos problemas metabólicos143,144.
En resumen, mantener al paciente con colitis ulcerosa (aunque ésta sea grave) a dieta absoluta con la intención de alcanzar el «reposo intestinal» no sólo no es beneficioso para el enfermo, sino que incrementa su estado de desnutrición y puede ser pernicioso29. La dieta absoluta priva a los colonocitos del contacto con los ácidos grasos de cadena corta, vitales para su metabolismo y reparación139,143-145. Sólo en casos de EII complicada con obstrucción intestinal, hemorragia masiva, megacolon tóxico o sospecha de perforación se deberá plantear el ayuno y la nutrición parenteral total29,139. Por el contrario, en pacientes con EII hospitalizados debe valorarse la necesidad de nutrición artificial, habitualmente mediante suplementos orales. Por tanto, se concluye que en caso de precisarse soporte nutricional, la nutrición enteral debería ser la alternativa de elección, recomendación que queda plasmada en el aforismo «cuando el intestino funciona, úsalo»139.
FENOMENOS TROMBOEMBOLICOS
Los pacientes con una enfermedad inflamatoria intestinal tienen un riesgo de presentar fenómenos tromboembólicas semejante al de cualquier otra enfermedad de gravedad similar, y esta complicación es exclusiva de los casos muy graves
La prevalencia de fenómenos tromboembólicos es relativamente elevada en los pacientes con EII. Se han descrito cifras que oscilan entre el 1 y el 8% (y de hasta el 41% en estudios necrópsicos), lo que supone una prevalencia entre 3 y 4 veces mayor a la descrita en la población general146-160. El tromboembolismo puede considerarse realmente como una manifestación extraintestinal de la EII159,160, puesto que el riesgo de presentar esta complicación es relativamente específico de la enfermedad de Crohn y la colitis ulcerosa, sin afectar a otras enfermedades inflamatorias, como la artritis reumatoide, u otros procesos intestinales, como la enfermedad celíaca157. En los pacientes con EII, el riesgo incrementado de tener un episodio trombótico no se limita a los casos graves que requieren ingreso hospitalario o cirugía, sino que afecta también a los pacientes con una EII leve que precisa únicamente un control ambulatorio159. Aunque la actividad de la EII incrementa el riesgo de sufrir esta complicación150,156,157,161,162, hasta la mitad de los pacientes que experimentan una trombosis lo hacen durante un período de remisión de la enfermedad150,152,163,164.
Los fenómenos trombóticos que ocurren en los pacientes con enfermedad inflamatoria intestinal son siempre leves
La presentación clínica más frecuente es la tromboflebitis o la trombosis venosa profunda de las extremidades inferiores, con o sin embolismo pulmonar asociado27,160,165, aunque la trombosis puede ocurrir también en localizaciones atípicas, como en la circulación venosa retiniana, mesentérica, renal o cerebral159,160. La relevancia clínica de los fenómenos tromboembólicos es muy elevada, pues éstos suponen una de las causas más frecuentes de mortalidad en los pacientes con EII158,159,166,167. Considerando globalmente las complicaciones tromboembólicas de la EII, la mortalidad calculada ha sido del 8-25% durante la fase aguda del episodio trombótico150,156,166. A modo de ejemplo, la trombosis portal representa aproximadamente el 10% de las trombosis venosas profundas, y tiene una tasa de mortalidad del 50%168.
En los pacientes con colitis ulcerosa que ingresan no está indicada la profilaxis de fenómenos tromboembólicos, ya que habitualmente son jóvenes (y por tanto de bajo riesgo) y presentan rectorragia (que podría empeorar con la anticoagulación)
La extensión y la gravedad de la afectación intestinal guarda relación con la aparición de las complicaciones tromboembólicas156,166,169-171, y éstas coinciden con frecuencia con los episodios de actividad de la EII150,156,157,161,162. Así, un estudio que valora las complicaciones vasculares de los pacientes con EII ha puesto de manifiesto que el 60% de los enfermos con EII activa presentan un estado de hipercoagulabilidad, mientras que esto sólo ocurre en el 15% de los que se encuentran en remisión150,171. Por otra parte, otros factores de riesgo convencionales, como el encamamiento inherente (demasiado a menudo) al ingreso hospi talario de estos pacientes graves, la infección, la colocación de catéteres venosos, la realización de procedimientos agresivos o la cirugía, favorecen aún más la aparición de estas complicaciones167.
Por todo lo expuesto, se recomienda realizar profilaxis con heparina de bajo peso molecular sistematicamente en todos los pacientes que ingresan por un brote, ya sea de enfermedad de Crohn o de colitis ulcerosa27-30,37,76,159,166. Así, aunque esta última enfermedad se manifiesta casi invariablemente por rectorragia, también parece recomendable instaurar en ella tratamiento profiláctico con heparina de bajo peso molecular. Aunque esta actitud pueda parecer contraintuitiva, no debemos olvidar que son los pacientes que ingresan los más graves quienes precisamente tienen, como se ha mencionado previamente, un mayor riesgo de presentar complicaciones tromboembólicas. Aunque se ha publicado un caso de hemorragia masiva en un paciente con colitis ulcerosa corticorrefractaria que se atribuyó a la administración de heparina de bajo peso molecular172, y resulta claro que hay que emplear este fármaco con cautela en los enfermos con una hemorragia grave167, en la mayoría de los pacientes la profilaxis de los fenómenos tromboembólicos constituye una parte esencial del tratamiento.
ANTIDIARREICOS
Los antidiarreicos son útiles en el tratamiento de la colitis ulcerosa grave, pues disminuyen el número de deposiciones y no tienen riesgo de producir efectos adversos
El empleo de fármacos que reducen la motilidad digestiva, como los antidiarreicos, los opiáceos o los anticolinérgicos, podría desencadenar un megacolon tóxico en los pacientes con un brote grave de colitis ulcerosa, por lo que están cotraindicados27,30,31,57-59.
5-AMINOSALICILATOS (5-ASA)
La sulfasalazina fue el primer salicilato utilizado, y es el fármaco con más antigüedad en el tratamiento de la EII. Químicamente, se compone de 2 fracciones, sulfapiridina y 5-ASA, unidas por un enlace tipo azo. Posteriormente, se descubrió que el componente más activo era el 5-ASA, mientras que el resto de la molécula era la responsable fundamental de los efectos adversos, lo que permitió el desarrollo de nuevas formulaciones que contienen sólo el teórico componente activo173.
El tratamiento tópico con 5-ASA no tiene sentido en el paciente que ingresa por un brote grave de colitis ulcerosa, pues no añade nada al tratamiento con esteroides intravenosos
En el paciente con colitis ulcerosa que ingresa por un brote grave se pautará, en todos los casos, tratamiento con esteroides intravenosos (i.v.). No obstante, en los pacientes con síntomas rectales predominantes se ha recomendado añadir tratamiento tópico con 5-ASA (p. ej., en forma de enema o espuma)26,30,31,37. Este último tratamiento puede ser útil como adyuvante del i.v., sobre todo para controlar la afectación cólica distal26,30,31. En ocasiones, el paciente con colitis ulcerosa refiere numerosas deposiciones y puede ser incluso considerado como corticorresistente cuando, en realidad, lo que expulsa son «esputos» rectales en lugar de verdaderas deposiciones, donde predominan el tenesmo y la urgencia defecatoria; es en estos casos donde el tratamiento tópico podría ser más efectivo como tratamiento coadyuvante174. Lamentablemente, no es infrecuente que la tolerancia y la capacidad de retener los enemas en estos pacientes sea limitada, debido a la disminución de la elasticiad rectal que a menudo tienen. En ocasiones, la administración del fármaco mediante sistemas artesanales de goteo o reduciendo el volumen total del enema permite aumentar la tolerancia.
ESTEROIDES
Los glucocorticoides son el grupo de fármacos más útil, aún hoy en día, en el tratamiento de los brotes agudos de la EII175. Su elevada potencia y su bajo coste sólo se ven contrarrestados por sus efectos secundarios, muy importantes, especialmente si su utilización se prolonga175.
La eficacia de los corticoides en el tratamiento del brote grave de colitis ulcerosa es muy elevada, cercana al 100%
La introducción del tratamiento esteroideo en el año 1955 redujo la mortalidad de la colitis grave hasta el 7%, comparado con el 24% constatado en el grupo placebo, lo que supuso un notable avance en el manejo del paciente grave con EII14. No obstante, cuando consideramos las tasas de remisión obtenidas con el tratamiento esteroideo los resultados no son tan brillantes. Así, los esteroides inducen la remisión en aproximadamente el 70% de los pacientes con enfermedad de Crohn moderada-grave, aunque las cifras han oscilado entre menos del 50 y más del 90%95,173,176-191. De igual modo, la eficacia de los esteroides en la colitis ulcerosa grave dista mucho de ser perfecta, puesto que la remisión se alcanza, como media, en poco más de la mitad de los casos, aunque la cifras oscilan ampliamente desde menos del 50% hasta más del 80%14,52,177,179,182,185,190,192-204. Dicho de otro modo, aproximadamente una cuarta parte, o quizá más, de los pacientes que ingresan por una colitis ulcerosa grave serán refractarios al tratamiento esteroideo. Puesto que el fenómeno de corticorrefractariedad no supone, por tanto, una rareza, debemos estar preparados para identificarlo precozmente y actuar en consecuencia, administrando el tratamiento de segunda línea más adecuado en casa caso.
Las variables clínicas o analíticas no son útiles para predecir la respuesta de los pacientes con colitis ulcerosa al tratamiento esteroideo
El principal dilema en el manejo del paciente grave con colitis ulcerosa es cómo identificar precozmente a los que no van a responder al tratamiento esteroideo y que, por tanto, van a ser candidatos a tratamiento con ciclosporina/infliximab o cirugía205,206. Si dispusiéramos de algún factor predictor de corticorresistencia, las mencionadas alternativas de rescate podrían emplearse sin demora, incrementando al máximo la probabilidad de éxito terapéutico y disminuyendo la incidencia de complicaciones como consecuencia del excesivo deterioro del paciente206. Para ello, se precisan marcadores objetivos y fáciles de obte ner e interpretar. Se han propuesto numerosos marcadores, tal como se detalla en la tabla II51,52,176,179,182,197-200,202-204,207. Como puede observarse en esta tabla, los potenciales factores predictivos pueden dividirse en radiológicos, clínicos y analíticos206. Los marcadores pronósticos radiológicos incluyen la presencia de dilatación del intestino delgado o del colon, o la identificación de islotes mucosos en la radiografía simple de abdomen. Los parámetros clínicos con capacidad pronóstica incluyen, fundamentalmente, el número de deposiciones y la presencia de sangre en éstas, así como el hallazgo de fiebre o taquicardia a la exploración física. Por último, los marcadores analíticos incluyen esencialmente la proteína C reactiva, la velocidad de sedimentación globular, la albúmina y el pH. El momento preciso (desde la instauración del tratamiento esteroideo) en que estos marcadores pronósticos se evalúan difiere según los estudios; algunos de ellos se recogen al ingreso, mientras que otros se evalúan al primer182,202,203, segundo176, tercer179,182,198,202,204 o quinto203 día de tratamiento. De la valoración conjunta de todos los estudios mencionados se desprende que la cuantificación del número de deposiciones y la presencia de sangre en éstas al ingreso, así como la comprobación de la evolución de estos 2 parámetros a los pocos días de haber iniciado el tratamiento esteroideo (más adelante se discute cuál es el momento más adecuado para ello), nos permite estimar con relativa fiabilidad la probabilidad de éxito terapéutico final. En cualquier caso, no debemos olvidar que los modelos predictivos indican probabilidades, no certeza, y que ninguno de los factores pronósticos descritos dispone de una capacidad de discriminación perfecta entre éxito y fracaso del tratamiento corticoideo185. En resumen, aunque como ocurre en la mayoría de las enfermedades no hay ningún criterio pronóstico que aisladamente pueda sustituir a la experiencia del médico y al sentido común de éste, la evaluación protocolarizada de un conjunto de variables clínicas nos proporciona una idea muy aproximada del pronóstico en cada caso individual.
Se recomienda empezar siempre con dosis bajas o intermedias de corticoides, y sólo en caso de que no se constate una respuesta, emplear dosis elevadas («completas»)
La actitud de comenzar con dosis bajas de esteroides e incrementarlas si no se obtiene la respuesta deseada, con la intención de reducir la incidencia de efectos adversos, no tiene una base científica. Una vez que se ha decidido administrar esteroides, éstos deben pautarse en las dosis que han demostrado ser eficaces, esto es, «completas» (véase más adelante). Esta afirmación se basa en diversos argumentos13,60,175: a) la dosis acumulada de esteroides que recibe el paciente en el que se prescriben dosis «completas» desde el principio suele ser menor que si comenzamos por dosis «bajas» y se aumentan progresivamente (ya que esta última estrategia se asocia frecuentemente con una respuesta clínica incompleta, lo que obliga a incrementar la dosis y, finalmente, se sigue de una mayor duración y una mayor dosis total de esteroides); b) se ha sugerido (aunque no demostrado) que el uso paulatino de dosis crecientes de esteroides puede favorecer el desarrollo de corticorresistencia o corticodependencia, y c) el empleo desde el principio de dosis «completas» de esteroides hace más fácil definir un brote como refractario, puesto que si tras el tratamiento con dosis altas no se ha obtenido respuesta, ya podremos clasificar al paciente como corticorresistente sin tener dudas sobre una posible insuficiencia de la dosis.
No obstante, la dosis de esteroides que debe administrarse en el tratamiento de la EII no está bien establecida. Un estudio ha comparado 3 dosis de prednisona (20, 40 y 60 mg/día) en pacientes con colitis ulcerosa y ha demostrado que las 2 dosis más elevadas son más efectivas que la de 20 mg/día208. El limitado tamaño muestral de este estudio, y la consiguiente reducida potencia estadística, no permitían comprobar si había diferencias respecto a la eficacia de las dosis de 40 y de 60 mg/día de prednisona208. La mayoría de los clínicos emplean estos fármacos en dosis que oscilan entre 0,75 y 1 mg/kg/día de prednisona (o equivalente), es decir, aproximadamente entre 40 y 80 mg/día30,31,37,82,175,209-211. En los pacientes con EII grave probablemente se deban emplear las dosis máximas que han demostrado ser eficaces, es decir, aproximadamente 60-80 mg/día. La administración de dosis superiores a 1 mg/kg/día de prednisona no incrementan la eficacia y, por el contrario, se asocian con una mayor incidencia de efectos adversos30,31,212.
En el brote grave de enfermedad inflamatoria intestinal los esteroides deben administrarse preferentemente por vía oral
En los pacientes que ingresan por un brote grave de EII los esteroides deberían administrarse, al menos inicialmente, preferentemente por vía i.v.37. Aunque no hay estudios que demuestren que esta vía es preferible a la oral, se ha postulado que la primera obviaría los problemas de absorción que pudieran tener estos pacientes graves (especialme quirúrgicas76,82,213,214.
Para poder considerar a un paciente con colitis ulcerosa grave tratado con corticoides por vía i.v. como refractario se debe esperar al menos 10 días
La determinación del período a partir del cual se define la refractariedad al tratamiento esteroideo es crucial, pues a medida que pasa el tiempo, especialmente en los pacientes que no evolucionan francamente peor, pero que tampoco lo hacen favorablemente, pueden desarrollarse complicaciones graves, en ocasiones enmascaradas por la administración de esteroides215. Además, la catalogación de un enfermo con colitis ulcerosa como corticorrefractario deberá seguirse del planteamiento de un tratamiento de rescate, ya sea ciclosporina/infliximab o cirugía.
Habitualmente se ha definido la situación de corticorresistencia en el paciente con colitis ulcerosa grave (ingresado) que recibe corticoides i.v. como la ausencia de respuesta al cabo de 7-10 días26,29,31,37,210,211,216. No obstante, más recientemente se ha considerado que la respuesta a los corticoides debe evaluarse de forma más precoz. Así, algunos autores han sugerido que 3-5 días de tratamiento podrían ser suficientes28,30,137,217,218, mientras otros consideran que 5 días219, o quizá entre 5 y 7 días como máximo27, podría considerarse como un período razonable para evaluar la respuesta al tratamiento esteroideo. En este sentido, se ha demostrado que la prolongación del tratamiento con esteroides durante más de 7-10 días en los pacientes corticorresistentes no consigue incrementar la respuesta terapéutica y, por el contrario, es perjudicial porque incrementa los efectos adversos y retrasa la administración de otros tratamientos de rescate potencialmente eficaces195,196.
Si bien es cierto que la mayoría de los pacientes responden en los primeros 5 días de tratamiento esteroideo193, no todos los autores coinciden en la necesidad de esta evaluación precoz207. Así, se ha pretendido justificar la prolongación desde 7 hasta 10 días, o hasta 14 días195,196,220, o más incuso201,221, basándose en que algún estudio ha demostrado que ciertos pacientes pueden ser considerados como respondedores «lentos»195,222. A modo de ejemplo, Daperno et al201 constataron una respuesta favorable tras 10 días de tratamiento esteroideo en tan sólo el 57% de los pacientes con colitis ulcerosa grave; pero, lo que es más llamativo, la prolongación del tratamiento esteroideo durante 10 días más logró la respuesta en un 19% adicional de pacientes201. No obstante, en realidad, estos respondedores «lentos» habían sido previamente clasificados como respondedores parciales, es decir, habían mejorado al menos en parte tras el tratamiento con esteroides. En cualquier caso, no debemos olvidar que prolongar excesivamente el tratamiento esteroideo incrementa el riesgo de tener complicaciones graves, como megacolon tóxico, perforación, hemorragia masiva o fallo multiorgánico. Por tanto, si en alguna ocasión excepcional optamos por prolongar el tratamiento con esteroides más allá de los 7-10 días, se deberá realizar un seguimiento estricto, con un estrecho control medicoquirúrgico. Parece aquí adecuado recordar el sensato aforismo que insta a no empecinarnos en salvar el colon del paciente, sino al propio paciente218,223.
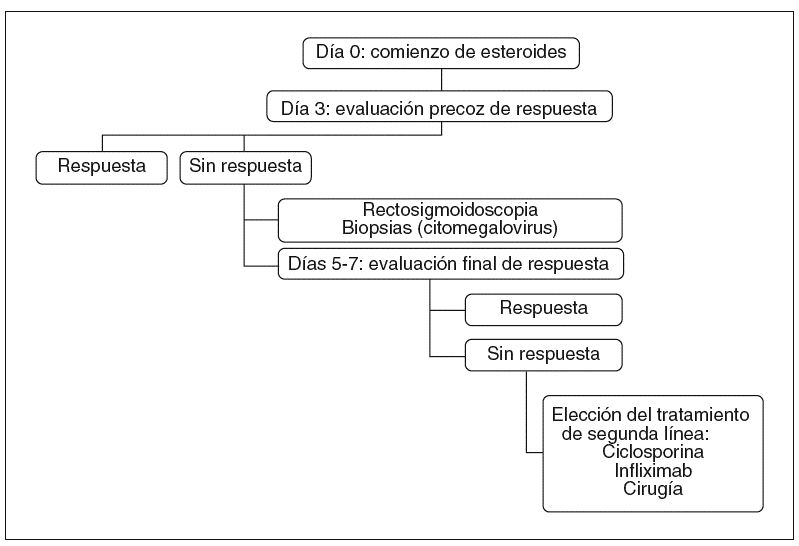
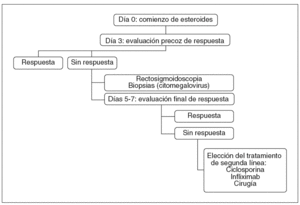
En resumen, en los pacientes con colitis ulcerosa grave la respuesta al tratamiento esteroideo debería inicialmente evaluarse precozmente, tan pronto como al tercer día. La ausencia de respuesta ya en este momento aconsejará la práctica precoz de una rectosigmoidoscopia con toma de biopsias (para descartar una infección por citomegalovirus), lo que nos permitiría ir «por delante» de la enfermedad y hacer posible la planificación, con tiempo, de los posibles tratamientos de rescate (ciclosporina, infliximab o cirugía) antes de que la situación clínica del paciente se deteriore excesivamente. Entre 5 y 7 días (posiblemente 5, y desde luego no más de 7) después de haber iniciado el tratamiento esteroideo debería revaluarse la respuesta, empleando los factores predictivos clínicos y analíticos previamente comentados, entre los que destaca el número de deposiciones y la presencia de sangre en la heces (tabla II), lo que permitirá estimar con relativa fiabilidad la probabilidad de respuesta ulterior215. En este momento (5-7 días) es donde probablemente deberemos decidir si «tirar la toalla» del tratamiento esteroideo y elegir un tratamiento de rescate más eficaz. El mencionado algoritmo diagnóstico-terapéutico se encuentra resumido en la figura 1.
Fig. 1. Evaluación de la respuesta al tratamiento esteroideo en el paciente con colitis ulcerosa grave.
AZATIOPRINA (AZA) Y MERCAPTOPURINA (MP)
La dosis de comienzo del tratamiento con tiopurínicos debe ser inicialmente baja (p. ej., 50 mg de AZA), para posteriormente incrementarse de forma progresiva, con la intención de reducir la aparición de efectos adversos
Muchos autores comienzan con dosis de 50 mg/día de AZA e incrementan esta dosis en 25 o 50 mg semanalmente224,225. Sin embargo, esta actitud no parece estar justificada105, pues si el mecanismo de toxicidad de este fármaco fuera alérgico, al no depender de la dosis no se prevendría por comenzar con dosis bajas, y si la toxicidad fuera mediada por un mecanismo no alérgico, requeriría la acumulación de una dosis relativamente elevada para que se produzca, bastante más alta que los 50 mg que recomiendan los defensores de la pauta de ascenso progresivo226,227. Por otra parte, puesto que el comienzo con dosis bajas de AZA/MP podría asociarse con un retraso innecesario en la administración de las dosis terapéuticas efectivas, últimamente hay una tendencia creciente a comenzar directamente con la dosis «completa» de inmunodepresores tiopurínicos.
Puede acelerarse el comienzo de acción de la AZA mediante su administración por vía i.v.
Es bien sabido que se precisa un tratamiento prolongado de varios meses con AZA o MP en los pacientes con EII para conseguir la respuesta clínica224,228-230. En 1995, Sandborn et al231 realizaron un estudio piloto en el que se concluía que una dosis «de carga» i.v. de AZA podía acelerar el comienzo de acción en los pacientes con enfermedad de Crohn que inician tratamiento con AZA. Posteriormente, se ha descrito el uso de AZA por vía i.v. en dosis bajas en 3 pacientes con colitis fulminante, con buena respuesta clínica en todos ellos232. Sin embargo, un estudio posterior, aleatorizado, doble ciego, multicéntrico y controlado con placebo233, no demostró ninguna ventaja de la dosis de carga i.v. de AZA en los pacientes que iban a comenzar tratamiento oral con este fármaco, por lo que actualmente no puede recomendarse esta alternativa terapéutica en los pacientes con enfermedad de Crohn. La experiencia con dosis i.v. de AZA en la colitis ulcerosa es aún más escasa y, aparte de la publicación previamente mencionada232, sólo se ha evaluado esta estrategia en otro estudio piloto que incluyó a 9 pacientes hospitalizados con colitis ulcerosa grave refractaria a esteroides. Los pacientes recibieron entre 20 y 40 mg/kg i.v. de AZA en infusión continua durante 36 h o en 3 infusiones de 8 h de duración, con lo que se obtuvo la respuesta y se evitó la colectomía en el 56% de los pacientes, alcanzando el 33% la remisión clínica. No obstante, la ausencia de un grupo control y en concreto un grupo control con AZA oral limita considerablemente las conclusiones de este estudio.
En un paciente con enfermedad inflamatoria intestinal tratado con AZA, que acude a urgencias por dolor abdominal, éste debe ser siempre atribuido a la propia enfermedad de base
Los pacientes con EII, sobre todo los que presentan una enfermedad de Crohn, tienen un mayor riesgo de presentar una pancreatitis aguda234,235, aunque no está bien establecido hasta qué punto puede ser responsable de esta complicación la medicación que frecuentemente requieren. En este sentido, diversos fármacos empleados en el tratamiento de la EII, como los esteroides, aminosalicilatos o inmunomoduladores tiopurínicos, se han propuesto como posibles causantes de la pancreatitis aguda, aunque los resultados de algunos estudios son discordantes167,236-240. De estos fármacos, la AZA y la MP son los más claramente relacionados con esta complicación.
Los efectos adversos como consecuencia del tratamiento con AZA o MP pueden dividirse en 2 grandes categorías: alérgicas y no alérgicas241. Entre las primeras se encuentra la pancreatitis aguda, complicación que se ha descrito entre el 0,4 y el 4% de los pacientes tratados con fármacos tiopurínicos35,239,242-245. Algún estudio ha sugerido que, de entre los pacientes que reciben AZA o MP, el riesgo de presentar una pancreatitis aguda es mayor en los diagnosticados de EII (fundamentalmente de enfermedad de Crohn), aunque se desconoce el motivo de esta posible mayor susceptibilidad al tratamiento tiopurínico235.
La pancreatitis inducida por fármacos en general, y por tiopurínicos en particular, suele ocurrir durante las primeras semanas de tratamiento242,246. El episodio de pancreatitis suele ser leve y habitualmente se resuelve rápidamente tras la retirada del fármaco167. Este efecto adverso parece estar mediado inmunológicamente y es por ello independiente de la dosis administrada. Así, se ha descrito que una dosis tan baja como 6 mg de MP puede causar un episodio de pancreatitis aguda242. Otro argumento que sugiere la naturaleza idiosincrásica de esta complicación es el hecho de que la readministración de AZA/MP se haya asociado casi invariablemente a la reaparición de la pancreatitis aguda242,247, recalcando la necesidad de suspender definitivamente estos fármacos una vez que haya aparecido un brote de pancreatitis; ni siquiera debería plantearse el cambio de AZA a MP (o viceversa)210,211.
En resumen, ante la aparición de dolor abdominal intenso en un paciente con EII debe siempre descartarse una pancreatitis aguda mediante la evaluación clínica cuidadosa y la determinación de amilasa y/o lipasa séricas, en especial si la clínica aparece en las primeras semanas después de haber iniciado tratamiento con AZA o MP.
CICLOSPORINA
La indicación más firmemente establecida hoy en día para el empleo de la ciclosporina en la EII es el brote grave y corticorresistente de colitis ulcerosa217,248,249. Para optimizar el tratamiento se recomiendan una selección correcta de los pacientes y la aplicación de un protocolo estandarizado de tratamiento y seguimiento clínico217.
La dosis recomendada de ciclosporina en el tratamiento de la colitis ulcerosa grave es como mínimo de 4 mg/kg/ día, pues el empleo de dosis inferiores no ha demostrado ser efectivo
Aunque clásicamente se ha recomendado la dosis de 4 mg/ kg/día de ciclosporina250, más recientemente se ha sugerido que podrían ser suficientes 2 mg/kg/día137,210,211,217. Esta posibilidad se basa en un estudio aleatorizado publicado por Van Assche et al251 en 2003, en el que se compararon 4 frente a 2 mg/kg/día y se demostró que ambas dosis eran igualmente eficaces. No obstante, como muy acertadamente apuntan Nos e Hinojosa137 en un ponderado editorial, este estudio debe interpretarse con cautela. En primer lugar, adolece de un defecto metodológico básico, y es que se trata de un estudio realizado en un único centro en el que no se especifica la secuencia de ocultación de la aleatorización. Además, en la pauta seguida en el estudio, tras comenzar con 2 o 4 mg en cada grupo, esta dosis se ajustaba inmediatamente a las concentraciones séricas que los autores del estudio interpretaron como adecuados en 250-350 ng/ml para el grupo de 4 mg y en 120-250 ng/ml para el grupo de 2 mg. Como también recalcan estos autores137, en el segundo día de seguimiento el grupo que había comenzado con 4 mg ya estaba con una dosis media de ciclosporina de 2,8 mg y en el octavo día esta dosis era de 2 mg. Por tanto, aunque parece que la intención de los autores era comparar 2 dosis de ciclosporina, lo que en realidad acaban comparando en su estudio es si los valores de este fármaco ajustados más a la alta o a la baja (valores de 250-350 o de 120-250 ng/ml) son igual de eficaces137. En todo caso, parece razonable iniciar el tratamiento con una dosis de 2 mg/kg de peso y, en función de la respuesta, la toxicidad y los valores séricos en cada caso individual, ajustar la dosis.
Al suspender la ciclosporina i.v. es obligado continuar con este fármaco por vía oral durante unos meses para evitar la recidiva de la colitis ulcerosa
Tradicionalmente, se ha recomendado que, en los pacientes con una colitis ulcerosa corticoresistente que ha sido controlada con ciclosporina i.v., este fármaco debe continuarse posteriormente por vía oral durante unos meses con la intención de prevenir la recidiva de la EII30,210,211,250. Sin embargo, algunos autores han demostrado que la administración de fármacos tiopurínicos, como la AZA o la MP, tras la suspensión de la ciclosporina i.v. puede mantener la remisión de la colitis ulcerosa en una elevada proporción de los pacientes, haciendo así innecesaria la administración prolongada de ciclosporina oral252,253. Esta última estrategia tendría la ventaja, con respecto a la administración prolongada de ciclosporina oral, de asociarse con una menor inmunodepresión y, teóricamente, a un menor riesgo de complicaciones infecciosas254.
No deja de llamar la atención el hecho de que un fármaco como la AZA (o la MP), que precisa un período de latencia relativamente prolongado, de varios meses, para alcanzar su efecto terapéutico, pueda ser útil en esta situación «aguda» de corticorrefractariedad, donde se precisa un efecto rápido de acción. No obstante, la refractariedad a los corticoides probablemente no representa un fenómeno fijo e irreversible, sino más bien temporal y, una vez controlado con la ciclosporina por vía i.v., podría ser susceptible de tratamiento con otros inmunodepresores, como los tiopurínicos de acción más lenta. En resumen, la elección entre la administración o no de ciclosporina oral tras haber controlado el brote de colitis ulcerosa corticorresistente queda a criterio del médico pero, aunque es evidente que se precisan más estudios, parece que de momento disponemos de evidencia suficiente aunque sea procedente de estudios no controlados para elegir la alternativa de obviar la prescripción de ciclosporina oral tras suspender la intravenosa254.
INFLIXIMAB
La aparición de una reacción infusional inmediata leve al infliximab obliga a interrumpir su administración inmediatamente y contraindica su readministración en el futuro por el riesgo de aparición de reacciones infusionales más graves
Las reacciones infusionales se clasifican en agudas y diferidas (o tardías)211,255. Las primeras aparecen durante o en las primeras 24 h tras la administración de infliximab, mientras que las segundas se identifican entre las 24 h y los 14 días tras la infusión211,255. Las reacciones inmediatas se presentan aproximadamente en un 5-10% de las infusiones e incluyen fiebre, escalofríos, prurito, urticaria, dolor torácico, hipotensión, disnea, náuseas y cefalea256-261. La mayoría de estas reacciones infusionales son leves, mientras que sólo aproximadamente el 1% o menos son clasificadas como graves211,255,259. Curiosamente, no suelen estar mediadas por un mecanismo alérgico de hipersensibilidad tipo I (excepto quizá la hipotensión y el broncospasmo), lo que explica que baste con disminuir el ritmo de infusión para controlarlas255,259; de hecho, en diversos ensayos clínicos se ha constatado que menos del 1% de las reacciones infusionales ha sido la causa de exclusión del estudio257,258,260.
La aparición de los mencionados efectos adversos leves debe seguirse del enlentecimiento del ritmo de la infusión (la mayoría de las veces no es necesario siquiera detenerla) y la administración de paracetamol o antihistamínicos (aunque también se podrían prescribir esteroides)255,259. Una vez que los síntomas hayan desaparecido, se podrá reiniciar la infusión, esta vez a una velocidad más lenta (p. ej., la mitad de la previa)255. Cabe destacar que con esta estrategia se podrá completar la infusión de la dosis adecuada de infliximab sin problemas en la mayoría de los pacientes, y no estará contraindicado en el futuro la administración de reinfusiones si se considera necesario255,259. Evidentemente, la aparición de reacciones alérgicas graves (como hipotensión, disnea o dolor torácico, que sugieren una reacción anafiláctica) obligará a la suspensión definitiva de la infusión de infliximab255.
La mayoría de los fármacos que se emplean en el tratamiento de la enfermedad inflamatoria intestinal (esteroides, tiopurínicos e infliximab) incrementan por igual el riesgo de complicaciones posquirúrgicas
El tratamiento con corticoides representa un factor de riesgo para el desarrollo de complicaciones durante y tras la cirugía90. Así, diversos estudios han demostrado que estos fármacos favorecen el desarrollo de abscesos, tanto en los pacientes no operados como en el postoperatorio en caso de que precisen cirugía90,97-101,262. Sin embargo, a diferencia de los esteroides, el tratamiento con inmunomoduladores tiopurínicos no incrementa el riesgo de complicaciones postoperatorias (infecciosas u otras) en los pacientes sometidos a cirugía por su EII90,98,100,263,264. Por tanto, se concluye que el empleo de AZA y MP puede continuarse con seguridad en el período perioperatorio. Por último, en coincidencia con los tiopurínicos, parece que el empleo de infliximab previamente a la cirugía tampoco supone un riesgo adicional90,264-266. En particular, aunque haya el temor de que el cierre rápido de las fístulas como consecuencia del tratamiento con infliximab pudiera favorecer el desarrollo de abscesos abdominales, recientemente se ha comprobado que esto no es así267.
MANIFESTACIONES EXTRAINTESTINALES
La EII se asocia con diversas manifestaciones extraintestinales que pueden afectar a prácticamente cualquier órgano del cuerpo humano167,268-270. Estas manifestaciones extradigestivas son frecuentes, y se han descrito en aproximadamente un 20-40% de los pacientes con EII167,268-270. Aunque no es frecuente que las complicaciones extraintestinales se manifiesten como una urgencia médica, es importante conocer adecuadamente su forma de presentación, para diagnosticarlas y tratarlas precoz y eficazmente. Hay 2 entidades que merecen una consideración especial: el pioderma gangrenoso y la uveítis.
El tratamiento de segunda línea del pioderma gangrenoso que no responde a esteroides es siempre la ciclosporina
El pioderma gangrenoso es, sin duda, la lesión cutánea de mayor gravedad asociada a la EII270-272. Aunque esta lesión no es patognomónica de la enfermedad de Crohn ni de la colitis ulcerosa, aproximadamente el 30-50% de los pacientes con pioderma gangrenoso presenta una de estas 2 enfermedades167,272. Desde otra perspectiva, en torno al 1-2% de los pacientes con EII tendrá un pioderma gangrenoso durante su evolución167,273. Característicamente, esta lesión comienza como pústulas o nódulos fluctuantes, que después se ulceran, con bordes violáceos y eritema periférico167,268-270. El pioderma gangrenoso puede aparecer en cualquier localización, pero habitualmente afecta a la zona pretibial o el dorso del pie167,268-270.
Aunque el pioderma gangrenoso frecuentemente no guarda relación con la actividad de la enfermedad intestinal, en ocasiones se asocia con los casos más graves de EII270. Por ello, no es excepcional observar esta lesión en los pacientes con EII que precisan ingreso hospitalario. Es importante tener presente que el pioderma gangrenoso puede progresar y extenderse rápidamente, y que el tratamiento precoz reduce el riesgo de presentar lesiones cicatrizales y deformidades residuales274. Por tanto, ante la sospecha de un pioderma gangrenoso, el paciente debería ser valorado urgentemente por un especialista capaz de diagnosticar y tratar correctamente esta lesión167,272.
El tratamiento del pioderma gangrenoso no está claramente establecido y su elección depende en gran parte de la experiencia particular de cada médico272,273,275. No obstante, habitualmente se considera que los esteroides sistémicos (prednisona o equivalentes, generalmente en dosis elevadas, al menos de 60 mg/día) es el tratamiento de primera línea270,275-277. Clásicamente, se ha considerado la ciclosporina como el tratamiento de elección de segunda línea cuando fracasan los esteroides, pues su empleo se ha asociado, en general, con buenos resultados272,275,278. Sin embargo, más recientemente se ha ido acumulando experiencia que sugiere que el infliximab representa una alternativa al menos tan eficaz como la ciclosporina para el tratamiento del pioderma gangrenoso corticorresistente272,276,277,279-286. Esto no es de extrañar, pues se ha sugerido que el factor de necrosis tumoral alfa desempeña un papel relevante en esta lesión cutánea276,287. En este sentido, muy recientemente se ha publicado el primer estudio aleatorizado en el que un fármaco en este caso el infliximab se ha comparado frente a placebo como tratamiento del pioderma gangrenoso287. En este relevante estudio, 30 pacientes con pioderma gangrenoso (asociado o no a EII) fueron aleatorizados a recibir infliximab (5 mg/kg) o placebo; la diferencia entre la eficacia de ambas alternativas fue del 40% a las 2 semanas, lo que indica un número necesario a tratar de tan sólo 2 o 3 pacientes287.
Una ventaja del infliximab sobre la ciclosporina es su más favorable perfil de seguridad276,277. Así, es bien conocido que la ciclosporina se asocia con importantes efectos adversos, como hipertensión, insuficiencia renal, convulsiones o un mayor riesgo de infecciones, lo que en ocasiones aunque muy raramente ha llegado a ocasionar la muerte del paciente217,249,288. Además, la administración de ciclosporina es más farragosa, pues precisa una infusión i.v. continua y la determinación frecuente de valores séricos; por último, exige descartar la presencia de hipocolesterolemia o hipomagnesemia, alteraciones analíticas que se asocian con un mayor riesgo de presentar convulsiones debidas a este fármaco. Por el contrario, la administración de infliximab es considerablemente más sencilla.
No está establecido el número de infusiones de infliximab que se deben administrar, pero, siguiendo el esquema habitualmente empleado para el tratamiento de la enfermedad de Crohn36,289-291, probablemente sea adecuado comenzar con una pauta de inducción de 3 dosis (5 mg/kg inicialmente, a las 2 y a las 6 semanas)272,284. Tampoco está esclarecido si posteriormente es necesario administrar dosis de mantenimiento (p. ej., cada 8 semanas) de infliximab272, como es práctica habitual en el tratamiento de la enfermedad de Crohn36. Por último, aunque una vez más la información es insuficiente, puesto que el pioderma gangrenoso se considera una lesión grave y con relativa tendencia a la recidiva, se ha aconsejado la administración de AZA/MP concomitantemente al infliximab y, quizá también, el mantenimiento de estos fármacos tiopurínicos durante un tiempo prolongado272,276,285,287,292.
Las manifestaciones oculares de la enfermedad inflamatoria intestinal nunca constituyen una urgencia y, por ello, los pacientes que las presentan deben remitirse para su valoración diferida, de forma ambulatoria, por el oftalmólogo
Se han descrito 2 tipos fundamentales de manifestaciones oftalmológicas en la EII167,268,270. El primero es una afectación «benigna», que incluye procesos como la conjuntivitis, la escleritis o la epiescleritis. Todos ellos se manifiestan por el denominado «ojo rojo», y clínicamente producen sensación de cuerpo extraño, pero no se acompañan de dolor ocular ni de pérdida de visión293. Estas afectaciones oculares leves suelen responder favorablemente al tratamiento de base de la EII y, si es necesario, se pueden administrar esteroides tópicos293. Por el contrario, las manifestaciones oftalmológicas pueden llegar a ser graves, como ocurre con la uveítis, complicación que se ha descrito en el 0,5-3% de los pacientes con EII167,294. La uveítis se manifiesta por alteraciones visuales (visión borrosa o disminución de la agudeza visual), dolor ocular, fotofobia y cefalea293. La afectación ocular suele ser bilateral. A diferencia de la epiescleritis, el curso de la uveítis es habitualmente independiente de la actividad de la enfermedad intestinal167,268,270. El diagnóstico y el tratamiento precoz de la uveítis es esencial, lo que evitará la aparición de complicaciones como la pérdida irreversible de la visión, por lo que esta manifestación extraintestinal debe considerarse una urgencia oftalmológica. La uveítis puede ser difícil de diferenciar de una conjuntivitis o una epiescleritis para el médico no especialista (a menos que se disponga de lámpara de hendidura y experiencia adecuada para utilizarla), y no resulta prudente instaurar tratamientos de prueba locales por el riesgo de complicaciones. Por tanto, el paciente con EII y manifestaciones oculares debe ser valorado en su momento por el oftalmólogo y no debe remitirse para su evaluación diferida por este especialista277,293. El tratamiento de la uveítis se basa en la administración de esteroides tópicos y sistémicos27,277,293,295. En algunos casos refractarios se ha descrito el empleo de infliximab con resultados prometedores296-299.