La enteropatía pierde-proteínas (EPP) es un síndrome caracterizado por la fuga de proteínas a través del tracto gastrointestinal que condiciona una disminución en la presión oncótica plasmática y clínicamente se manifiesta con edema, ascitis, derrame pleural y/o derrame pericárdico1.
Presentamos el caso de un paciente varón de 6 años de edad, originario de una comunidad rural, hospitalizado por presentar astenia, adinamia, evacuaciones diarreicas y vómito durante 7 días. Antecedentes de consumo de leche no pasteurizada y esquema de vacunación completo. A la exploración física presentó deshidratación moderada, distensión y dolor abdominal, edema de miembros inferiores y ruidos peristálticos disminuidos en frecuencia. Estado nutricional eutrófico (peso para la edad del 96% y talla para la edad de 109%). La radiografía de abdomen mostró abundante gas en marco colónico y múltiples niveles hidroaéreos. Los estudios de laboratorio reportaron hemoglobina 16,7g/dl (normal [n]: 11,5-13,5), hematocrito 46,4% (n: 34-40), albumina sérica 1,2g/dl (n: 3,5-5,2), calcio sérico 6,5mg/dl (n: 8,8-10,1), inmunoglobulinas séricas IgG 177mg/dl (n: 560-1.307), IgA 82mg/dl (n: 26-232), IgE 37,9Ul/ml (n: 0,3-17,6) y colesterol sérico 81mg/dl (n: 108-187). El urianálisis no presentó proteínas y las pruebas de función hepática fueron normales. Al quinto día de estancia hospitalaria se realizó laparotomía exploradora por datos clínicos de suboclusión intestinal, en el procedimiento se identificaron múltiples adenopatías en mesenterio. Posteriormente presentó derrame pleural bilateral y ascitis. Se realizó toracocentesis bilateral, y se aplicó ventilación asistida, infusión de albumina y diuréticos. El líquido pleural mostró características de trasudado: leucocitos cero, glucosa 95mg/dl y deshidrogenasa láctica 14UI/ml.
Con esta información se integró el diagnóstico de EPP, en las siguientes semanas persistió con hipoalbuminemia, hipogammaglobulinemia, hipocalcemia y presentó linfopenia profunda (linfocitos séricos totales 260cél/μl [n: 1.500-5.900], linfocitos T CD3 155cél/μl [n: 700-4.200] y linfocitos B CD19 49cél/μl [n: 200-1.600]).
Para el diagnóstico de diferentes causas de EPP se solicitaron estudios de heces (coprocultivos: 2; tinciones en fresco: 2, tinción de Kinyoun, cultivo en medio selectivo para Campylobacter sp., toxina A/B de Clostridium difficile) con resultados negativos. Reacción en cadena de la polimerasa (RCP) sérica para citomegalovirus y serología para el virus de la inmunodeficiencia humana negativas. Anticuerpos antinucleares negativos. Amilasa, lipasa y complemento séricos (C3 y C4) dentro de los parámetros normales. Ultrasonograma cardiaco sin anormalidades estructurales. La entero-resonancia magnética con gadolinio mostró engrosamiento de asas en yeyuno distal e íleon proximal (4-6mm de diámetro) con edema en la raíz del mesenterio y ganglios linfáticos de aspecto reactivo.
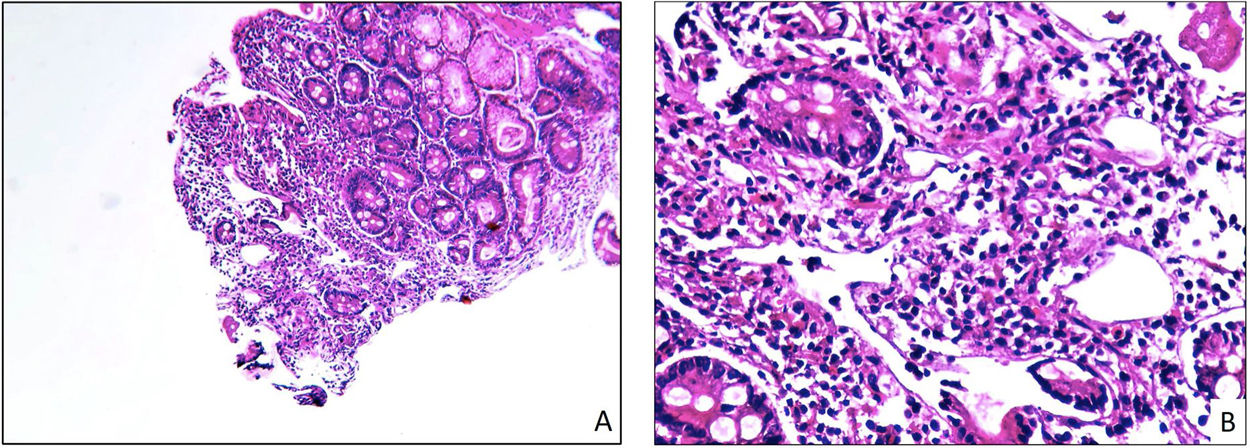
En la endoscopia digestiva alta se observaron lesiones blancas en parches (imágenes en copos de nieve) en primera y segunda porciones del duodeno y reflujo quiloso; el estudio histopatológico reportó duodenitis activa con ensanchamiento de las vellosidades, ileítis crónica y vasos linfáticos mucosos tortuosos y dilatados (fig. 1); se observaron 4 eosinófilos por campo de gran aumento. El estudio histopatológico de ganglio mesentérico mostró dilatación y proliferación sinusal compatible con transformación vascular.
Imagen histopatológica de biopsias duodenales con linfangiectasia. A) Microfotografía en aumento intermedio (×10) en la que se puede apreciar un fragmento de mucosa duodenal con linfangiectasia. Note el edema y la dilatación linfática observada en la zona central de la imagen. B) Microfotografía en gran aumento (×40) en la que se puede apreciar un fragmento de la mucosa duodenal afectada por la linfangiectasia. Note el infiltrado inflamatorio linfoplasmocitario de su lámina propia, así como la presencia de vasos linfáticos tortuosos y dilatados.
Se identificaron secuencias genéticas del complejo Mycobacterium Tuberculosis mediante RCP en tejido intestinal.
La EPP es una manifestación de enfermedades intestinales o sistémicas y es causada por lesión de la mucosa intestinal (enfermedades ulcerativas, inflamatorias y/o alergias) o por anormalidades en el sistema linfático (linfangiectasias) que pueden ser congénitas (enfermedad de Waldmann) o secundarias a obstrucción (sarcoidosis, linfoma o enfermedad inflamatoria intestinal) o por una presión venosa elevada (insuficiencia cardiaca congestiva o pericarditis constrictiva). El diagnóstico de EPP se establece por la presencia de signos y síntomas secundarios a la hipoalbuminemia sin otra causa aparente como proteinuria, desnutrición o insuficiencia hepática. Otras herramientas para el diagnóstico son la detección de alfa-1-antitripsina en muestra de heces o estudios de imagen funcionales1. El diagnóstico de linfangiectasia se realiza mediante el examen histológico de tejido intestinal2.
En pacientes con adenomegalia mesentérica debida a tuberculosis, el incremento en la presión linfática intestinal causa dilatación de los vasos linfáticos y fuga de proteínas a la superficie del epitelio3. Si bien, en pacientes adultos se ha descrito que M. tuberculosis puede agudizar la sintomatología de linfangiectasia primaria2 o causar linfangiectasia secundaria3 en niños no existe el reporte de esta asociación.
Para el tratamiento de pacientes con EPP se recomienda mantener un estado nutricional adecuado y tratar la causa de base1. En nuestro paciente, no fue posible definir si la infección tuberculosa se presentó por la inmunosupresión causada por la EPP o si fue la causa de la dilatación linfática intestinal. El paciente recibió tratamiento con antituberculosos, inmunoglobulina intravenosa y dieta baja en grasas e hiperproteica con triglicéridos de cadena media y vitaminas liposolubles. Siete semanas después presentó valores normales de albumina, calcio y colesterol séricos; incremento en el recuento de linfocitos y ausencia de signos y síntomas.
Debido a la presencia de eosinófilos en la biopsia intestinal se realizaron pruebas séricas para la detección de anticuerpos IgE específicos para alérgenos alimentarios, sin resultados reactivos. Similar a otros reportes, la mejoría del paciente con el tratamiento antituberculoso y sin la administración de corticoides sugiere relación de la eosinofilia intestinal con la infección tuberculosa.
En México, el consumo de leche no pasteurizada es una práctica frecuente4, y este hábito incrementa el riesgo de tuberculosis5, principalmente en niños y en pacientes con inmunodeficiencias. Para el diagnóstico de tuberculosis intestinal deben considerarse las manifestaciones clínicas (fiebre, dolor abdominal, hepatomegalia y diarrea), la exposición a una fuente de infección y la identificación de la bacteria en la biopsia intestinal o en el líquido peritoneal. Un hallazgo histológico fuertemente sugestivo son los granulomas caseificantes, sin embargo, estos se observan en menos de la mitad de los casos. En pacientes pediátricos con EPP y factores de riesgo para tuberculosis sugerimos realizar abordaje diagnóstico para esta infección.