La enteropatía sensible al gluten (ESG) cada vez se diagnostica con mayor frecuencia en el adulto, siendo frecuente su presentación con síntomas que en ocasiones se solapan con los de la dispepsia funcional. Se ha descrito una prevalencia de la ESG en la dispepsia entre el 1,2-6,2%, que podría ser superior si se tiene presente todo el espectro de lesiones relacionadas con la sensibilidad al gluten, incluida la enteropatía linfocítica. Un paciente con dispepsia secundaria a ESG podría ser erróneamente diagnosticado de dispepsia funcional, si la endoscopia digestiva alta no se completa con la toma de biopsias de duodeno y se realiza inmunotinción para linfocitos intraepiteliales. Este hecho podría tener importantes consecuencias en términos de morbimortalidad y calidad de vida de los pacientes. En consecuencia, la biopsia de duodeno debería completar el estudio endoscópico del paciente con dispepsia cuando el contexto clínico sugiere una ESG.
Gluten-sensitive enteropathy (GSE) is increasingly diagnosed in adults. The symptoms of this disease can overlap with those of functional dyspepsia. The prevalence of GSE in dyspepsia has been reported to be 1.2-6.2% and could be higher if the entire spectrum of lesions related to gluten sensitivity, including lymphocytic enteropathy, is considered. Patients with dyspepsia secondary to GSE could be mistakenly diagnosed with functional dyspepsia unless upper gastrointestinal endoscopy is completed with duodenal biopsy and immunostaining for intraepithelial lymphocytes. A missed diagnosis could have major consequences in terms of morbidity and mortality and quality of life. Consequently, endoscopic study of patients with dyspepsia should be completed by duodenal biopsy when there are symptoms suggestive of GSE.
La dispepsia funcional es una entidad frecuente, que aunque no reviste gravedad, tiene un importante impacto sobre la calidad de vida de los pacientes1. La enfermedad celíaca (EC) es una de las afecciones genéticamente determinadas más prevalentes en la población, que cada vez se diagnostica con mayor frecuencia en el adulto, siendo frecuente su presentación con síntomas digestivos atípicos que en ocasiones se solapan con los descritos en la dispepsia funcional2–4. La enteropatía sensible al gluten (ESG), concepto que incluye todo el espectro de lesiones relacionadas con la sensibilidad al gluten, puede ser una causa insospechada de dispepsia funcional, que podría ser infradiagnosticada si el estudio diagnóstico no se completa con la realización de una serología para EC y la toma de biopsias de duodeno. Este hecho podría tener importantes consecuencias en términos de morbimortalidad, debido al retraso en el diagnóstico y tratamiento de la ESG, así como en la calidad de vida de los pacientes, dado que la dispepsia en estos casos mejora con la retirada del gluten de la dieta2,5,6.
Dispepsia funcionalLa dispepsia ha sido definida por el comité de expertos que elaboró los criterios de Roma III, de la siguiente manera: «Síntoma o conjunto de síntomas que la mayoría de médicos consideran que tienen su origen en la región gastroduodenal, siendo estos la pesadez posprandial, la saciedad precoz, el dolor y el ardor epigástrico. Se clasifica en orgánica, cuando se diagnostica una causa orgánica que explica los síntomas, y funcional, cuando tras realizar un estudio adecuado no logra identificarse un daño estructural o bioquímico que justifique los síntomas1,7.
La dispepsia funcional, según los criterios de Roma III, se caracteriza por presencia durante al menos 3 meses de uno o más de los siguientes síntomas: 1) pesadez o plenitud posprandial; 2) saciedad precoz; 3) dolor epigástrico; 4) ardor epigástrico; y la ausencia de alteraciones estructurales en la endoscopia digestiva alta que puedan explicar los síntomas. Se podría concluir, por tanto, que la dispepsia funcional es un diagnóstico de exclusión que se establece cuando en un paciente que presenta síntomas atribuibles al tracto gastroduodenal, no existe ninguna evidencia de daño estructural (endoscopia negativa) o bioquímico que pueda explicar los síntomas.
La dispepsia funcional se subclasifica en síndrome de distrés posprandial, cuando predominan los síntomas de pesadez posprandial o saciedad precoz, y en síndrome de dolor epigástrico, si predominan los síntomas de dolor y/o ardor epigástrico7. Esta clasificación, sin embargo, no está totalmente aceptada y en la práctica clínica habitual no es infrecuente que en un mismo paciente puedan coexistir los síntomas de distrés posprandial y dolor epigástrico, así como síntomas de reflujo gastroesofágico, y otros síntomas gastrointestinales de compleja valoración e interpretación, como son las náuseas, la hinchazón abdominal, el meteorismo y la flatulencia8.
La dispepsia es un síntoma frecuente en la población general con una prevalencia entre un 20 y un 40% en los estudios poblacionales basados en encuestas. La prevalencia de dispepsia funcional es más difícil de determinar. Una revisión sistemática, con solo 2 estudios que proporcionan información suficiente, estima una prevalencia entre un 11 y un 14%9. Diversas revisiones no sistemáticas sobre la dispepsia investigada sitúan la dispepsia funcional como la causa más común (60%)10. Los mecanismos fisiopatológicos de la dispepsia funcional son desconocidos y probablemente múltiples. En diferentes estudios clínicos se han observado alteraciones de la motilidad y acomodación gástrica, enlentecimiento y/o aceleración del vaciamiento gástrico, e hipersensibilidad visceral gastroduodenal. También se ha implicado en su patogenia la disregulación autonómica, los polimorfismos genéticos, los agentes infecciosos y factores psicológicos como la respuesta general al estrés1.
La dispepsia funcional constituye un motivo de consulta frecuente, que en la mayoría de las ocasiones tiene carácter crónico y fluctuante. Aunque no reviste gravedad, tiene un importante impacto sobre la calidad de vida de los pacientes, y debido a su elevada frecuencia, conlleva un consumo considerable de recursos sanitarios directos e indirectos. No existe un acuerdo unánime sobre cómo y cuándo se debe de tratar la dispepsia funcional. La aproximación terapéutica en estos pacientes debe tener en cuenta la gravedad y la naturaleza de los síntomas, así como el grado de deterioro de la calidad de vida. La relación médico-paciente es fundamental para una adecuada comunicación y seguimiento1,10.
Enteropatía sensible al glutenLa enteropatía sensible al gluten (ESG) es una forma de enteropatía de base inmunológica debida a una intolerancia permanente al gluten, que afecta a individuos genéticamente predispuestos. El gluten es una proteína presente en el trigo (gliadina), centeno (secalina), cebada (hordeína) y triticale (híbrido del trigo y centeno)4. La distribución de esta enteropatía es universal, y a diferencia de lo que se pensaba inicialmente, está presente no solo en Europa y los países poblados por personas de ascendencia europea, sino también en Oriente Medio, Asia, Sudamérica y Norte de África. En países occidentales se ha descrito una prevalencia de EC en torno al 1%, pero podría ser superior porque una importante proporción de casos permanece sin detectar11,12.
La causa de la ESG es desconocida, pero en su desarrollo contribuyen factores genéticos (HLA DQ2 y DQ8 entre otros), inmunológicos y ambientales. El gluten es el principal desencadenante ambiental, pero existen otros factores como la duración de la lactancia materna o determinadas infecciones que podrían contribuir al desarrollo de la EC. La respuesta inmunológica, desencadenada por el gluten en la mucosa intestinal, determina la aparición de una lesión histológica característica, aunque no patognomónica, que en las formas más graves provoca atrofia de las vellosidades intestinales4.
El espectro de manifestaciones clínicas de la ESG es muy amplio y heterogéneo, variando desde formas asintomáticas hasta su forma clásica de presentación con síntomas de malabsorción con diarrea crónica, vómitos, distensión abdominal, y signos de malnutrición. En el adulto, es más frecuente su presentación en forma de síntomas atípicos digestivos y/o extradigestivos (tabla 1). Los síntomas digestivos atípicos como el dolor abdominal, la dispepsia, la flatulencia, la pirosis, o el síndrome de intestino irritable con predominio de diarrea, se describen cada vez con más frecuencia en el adulto. Esta gran heterogeneidad en la presentación clínica en el adulto dificulta en gran medida el diagnóstico. El único tratamiento eficaz actualmente es la exclusión del gluten de la dieta. La dieta sin gluten (DSG) estricta de forma indefinida es bien tolerada y mejora la sintomatología, la calidad de vida y consigue la recuperación de la lesión mucosa en la mayoría de los pacientes2,4.
Manifestaciones clínicas en la enfermedad celiaca
| Síntomas típicos |
| Diarrea crónica |
| Distensión abdominal |
| Desnutrición |
| Anorexia |
| Síntomas atípicos |
| Digestivos |
| Dispepsia |
| Dolor abdominal recidivante |
| Vómitos recidivantes |
| Pirosis y regurgitación |
| Diarrea crónica funcional |
| Síndrome de intestino irritable con predominio de diarrea |
| Extradigestivos |
| Anemia ferropénica |
| Osteopenia u osteoporosis |
| Dermatitis herpetiforme, hiperqueratosis folicular, erupciones cutáneas |
| Aftas bucales recidivantes |
| Hipertransaminasemia |
| Insuficiencia pancreática exocrina |
| Astenia, irritabilidad, ansiedad, depresión |
| Miopatía proximal, parestesias, tetania |
| Cefaleas, epilepsia, ataxia, neuropatía periférica |
| Alteraciones en el esmalte dental |
| Infertilidad, abortos recurrentes, amenorrea |
| Hipoesplenismo |
La enteropatía linfocítica (EL), también denominada enteritis linfocítica, enteritis microscópica o duodenosis linfocítica, se caracteriza por un aumento de linfocitos intraepiteliales (LIE) en las vellosidades intestinales13,14. Clásicamente se había considerado como EC latente y se pensaba que no se asociaba con síntomas ni complicaciones relacionadas con la enfermedad. Sin embargo, estudios recientes en series de pacientes no seleccionados por su sintomatología (familiares de primer grado y sujetos sanos en revisiones de empresa) han mostrado como en la EL existe un aumento significativo de síntomas clínicos como dispepsia, distensión abdominal y dolor abdominal inespecífico, así como complicaciones como anemia, hipertransaminasemia u osteopenia6,15,16. Además, se ha demostrado cómo estos síntomas mejoran en muchos casos tras una DSG17,18.
Sin embargo, la ESG no es la única entidad que puede ocasionar un aumento de LIE en la mucosa intestinal, y existen otras muchas causas de EL como la infección por Helicobacter pylori, el sobrecimiento bacteriano de intestino delgado, la intolerancia a otras proteínas alimentarias (leche de vaca, huevo, etc.), parasitosis como la giardiasis, la ingesta de antiinflamatorios no esteroideos (AINE), la enfermedad inflamatoria intestinal, la gastroenteritis eosinófila, enfermedades autoinmunitarias o la inmunodeficiencia común variable, entre otras. Es probable que el aumento de LIE en el intestino delgado represente una respuesta inmunitaria innata o no específica del epitelio intestinal a todos aquellos antígenos o microorganismos que acceden a través de la luz intestinal19.
Diagnóstico de la enteropatía sensible al glutenEl diagnóstico de la ESG se basa en 3 pilares básicos, que son: 1) la presencia de manifestaciones clínicas compatibles (tabla 1); 2) la existencia de enteropatía en las biopsias de la mucosa de duodeno o yeyuno; 3) la mejoría clínica o histológica tras la realización de una DSG. La serología y el estudio genético del HLA complementan el diagnóstico y son pruebas de gran utilidad para el cribado de la enfermedad4.
Biopsia intestinalLa demostración de la presencia de la lesión histológica intestinal continúa siendo el patrón de referencia para establecer el diagnóstico de la ESG. En los adultos, la toma de biopsias para el diagnóstico histológico se realiza habitualmente en el transcurso de una endoscopia digestiva alta (EDA). Dado que la distribución de la lesión intestinal es parcheada, se aconseja la toma de al menos 4 muestras para el análisis histológico, siendo una de ellas en el bulbo duodenal20.
La clasificación de Marsh, modificada posteriormente por Oberhuber19, incluye todo el espectro de lesiones histológicas que pueden presentar estos pacientes y distingue los siguientes grados: Marsh 1 o enteropatía linfocítica, caracterizada por un aumento en el número de LIE (> 25%); Marsh 2, cuando además se asocia una hiperplasia de las criptas; Marsh 3, cuando a las lesiones anteriores se asocia atrofia vellositaria que puede ser parcial (Marsh 3a), subtotal o moderada (Marsh 3b) o total (Marsh 3c). Clásicamente, la EL era considerada una forma latente de EC no asociada a síntomas ni complicaciones. Sin embargo, evidencias recientes muestran que puede cursar con síntomas y complicaciones con la misma frecuencia que las formas con atrofia6,15,16. Por este motivo, es importante el diagnóstico de este tipo de lesión que en ocasiones puede pasar desapercibida con la tinción de hematoxilina-eosina. La realización de técnicas adicionales de inmunohistoquímica con anticuerpos monoclonales para linfocitos CD3 facilita la visualización de los LIE y el diagnóstico de este tipo de lesión histológica21. El concepto de ESG hace referencia a todo el espectro de lesiones relacionadas con la sensibilidad al gluten, incluidas las formas de enteropatía leve.
SerologíaLos principales marcadores serológicos existentes son los anticuerpos antigliadina (AAG), los anticuerpos antiendomisio (AEM), los anticuerpos antitransaglutaminasa tisular (ATGT) y más recientemente los anticuerpos frente a péptidos desaminados de la gliadina (APDG). Los AAG, que pueden ser de clase IgA e IgG, se dirigen contra determinantes antigénicos de la α-gliadina y como otros anticuerpos antialimentos son marcadores de aumento de permeabilidad de la mucosa intestinal, por lo que no son específicos de EC y podrían aparecer en otros cuadros que asocian alteraciones de la mucosa. Hoy en día, se desaconseja su uso para el cribado de EC. Los AEM presentan una sensibilidad y especificidad superiores al 95%, pero su aplicabilidad práctica está limitada debido a la subjetividad que supone su interpretación mediante inmunofluorescencia indirecta y la utilización de sustratos de simio (esófago) o humano (cordón umbilical) para su realización. La identificación de la transaglutaminasa tisular como el sustrato contra el que se dirigían los AEM y la consiguiente aparición de los ATGT, que se determinan mediante técnicas de ELISA, permitieron solventar los problemas técnicos asociados a los AEM. Los ATGT de clase IgA tienen una sensibilidad cercana al 100% y una especificidad entre el 89-96% y actualmente constituyen los marcadores serológicos de elección para el diagnóstico y cribado de la ESG4.
Sin embargo, la sensibilidad de estos anticuerpos en general disminuye en caso de enteropatía leve, es decir, en ausencia de atrofia vellositaria moderada o severa (< 60% en Marsh 3a; < 30% en Marsh 2 y < 10% en Marsh 1)22,23. Por tanto, un resultado negativo de la serología no permite excluir el diagnóstico de ESG.
Estudio genéticoPor el momento, los únicos marcadores genéticos de riesgo de EC con utilidad clínica son la determinación de los alelos que codifican las moléculas HLA DQ2 o DQ8. El 90% de los pacientes con EC expresan el heterodímero HLA-DQ2 codificado por los alelos DQA1*05 y DQB1*02 y el resto presentan el heterodímero de riesgo HLA-DQ8 (codificado por los alelos DQA1*03 y DQB1*0302) o bien expresan alguno de los alelos que codifican para el DQ2 por separado. Sin embargo, entre un 20-30% de la población general puede expresar estos alelos, por lo que su presencia no indica la existencia de una ESG. Su utilidad diagnóstica radica primordialmente en su elevado valor predictivo negativo, de tal manera que su ausencia excluye con gran probabilidad el padecimiento de la enfermedad4.
La realización de estudio genético HLA DQ2 y DQ8 ha demostrado ser útil en las siguientes situaciones:
- 1.
Como apoyo al diagnóstico en personas con sospecha clínica bien fundada y presencia de una lesión histológica no concluyente. Por ejemplo pacientes con EL como única expresión morfológica de la enfermedad y serología negativa, o bien cuando no existen lesiones morfológicas características, pero la biopsia se realizó semanas o meses después de haber iniciada una DSG24,25.
- 2.
Como cribado de la ESG en grupos de riesgo. En familiares de primer grado se ha demostrado un mayor rendimiento diagnóstico al practicar biopsia de duodeno en aquellos DQ2/DQ8 positivos independientemente de la serología15.
La lesión histológica intestinal no es específica de la ESG, por lo que el diagnóstico final precisa demostrar que los síntomas y las lesiones histológicas son dependientes del gluten2,26. La DSG debería seguirse de una mejora de los síntomas, una negativización de la serología y la normalización de la lesión histológica intestinal para poder establecer el diagnóstico de ESG. En el adulto, sin embargo, la lesión intestinal puede tardar entre 2 y 5 años en normalizarse5.
En los pacientes con EL el diagnóstico de ESG puede ser más complejo. En estos casos, es necesario realizar una valoración en conjunto de la presentación clínica, la existencia de antecedentes familiares de ESG o enfermedades autoinmunes, la lesión histopatológica intestinal, la serología y el estudio genético HLA, así como demostrar que los síntomas y la enteropatía son gluten-dependientes13. En algunos casos, puede ser necesario, además, demostrar un empeoramiento de la lesión intestinal tras realizar una sobrecarga con gluten27. La demostración de depósitos de transglutaminasa tisular IgA en la mucosa intestinal de forma subepitelial y alrededor de los vasos sanguíneos15 o la caracterización de subpoblaciones linfocíticas (existe un incremento de LIEs γδ+ en pacientes con ESG que se mantiene tras la DSG)13 pueden ser también una ayuda para el diagnóstico. Sin embargo, se trata de técnicas de laboratorio complejas, lo cual limita su uso en la práctica clínica habitual. Existen otras situaciones en las que el diagnóstico de ESG sigue siendo un reto. Algunos ejemplos lo constituyen pacientes sintomáticos con serología positiva, pero biopsia normal, o pacientes sintomáticos, con biopsia intestinal compatible pero serología y estudio genético negativo.
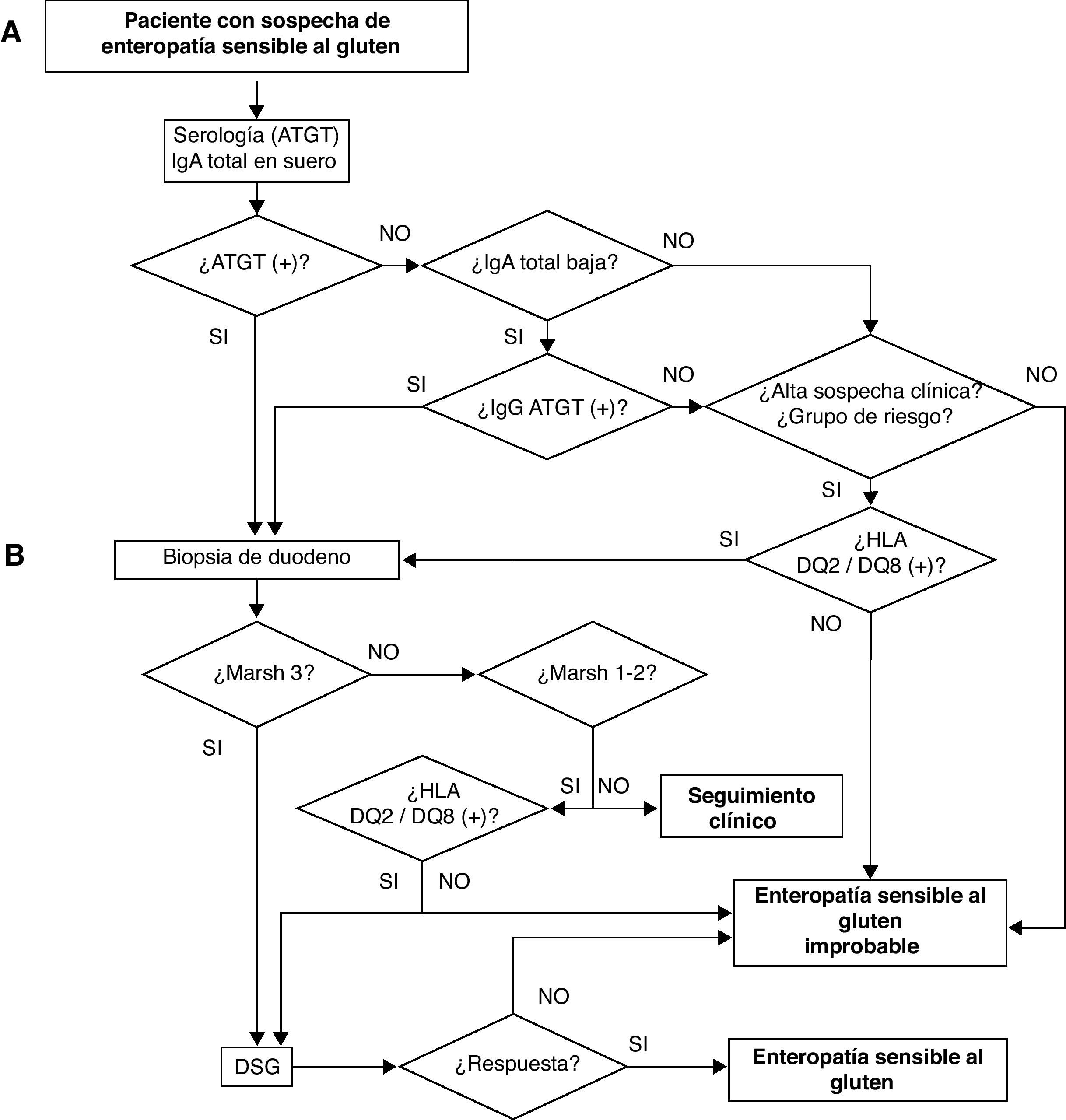
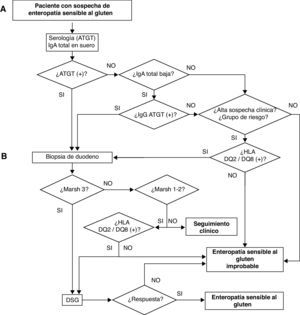
Debido a esta complejidad, se ha propuesto una simplificación del diagnóstico con la llamada regla «4 de 5», en la cual es necesario que se cumplan 4 de los siguientes 5 criterios (o 3 de 4 en ausencia del estudio genético)26: 1) presentación clínica compatible; 2) positividad de la serología a valores altos; 3) genotipo HLA-DQ2 y/o DQ8 compatible; 4) enteropatía en la biopsia intestinal (incluye Marsh 1, con serología positiva o asociado a depósitos subepiteliales de IgA); 5) respuesta clínica a la DSG (histológica en pacientes seronegativos). En la figura 1 se muestra el algoritmo diagnóstico propuesto por la Asociación Española de Gastroenterología4.
Algoritmo diagnóstico en el paciente con sospecha de ESG. ATGT: anticuerpos antitransglutaminasa tisular; DSG: dieta sin gluten4.
En el adulto con ESG son mucho más frecuentes las formas de presentación clínica con síntomas atípicos digestivos y/o extradigestivos (tabla 1). Entre los síntomas digestivos, la presencia de dolor o malestar en la línea media superior del abdomen, sobre todo posprandial, a menudo asociado a sensación de hinchazón, flatulencia, meteorismo y dolor abdominal, constituye una consulta frecuente que podría estar presente hasta en el 60% de los pacientes3. Ciacci et al.28 en un estudio retrospectivo que analizó 195 pacientes adultos con EC observaron cómo muchos pacientes presentaban en el momento del diagnóstico síntomas digestivos inespecíficos como dispepsia (40%), dolor abdominal (35%) y meteorismo (31%). Zipser et al.29 evaluaron mediante un cuestionario los síntomas de presentación en pacientes diagnosticados de enfermedad celíaca entre los años 1993 y 2001, describiendo como un 77% de ellos presentaban molestias abdominales; un 73%, flatulencia, y un 46%, náuseas y/o vómitos. Esteve et al.15, en un estudio realizado en nuestro país en 221 familiares de primer grado de 82 pacientes celíacos, observaron que los familiares con enteropatía presentaron con mayor frecuencia síntomas como dolor abdominal (39,1 vs 23,5%), hinchazón abdominal (52,2 vs 21,8%) o flatulencia (65 vs 39%).
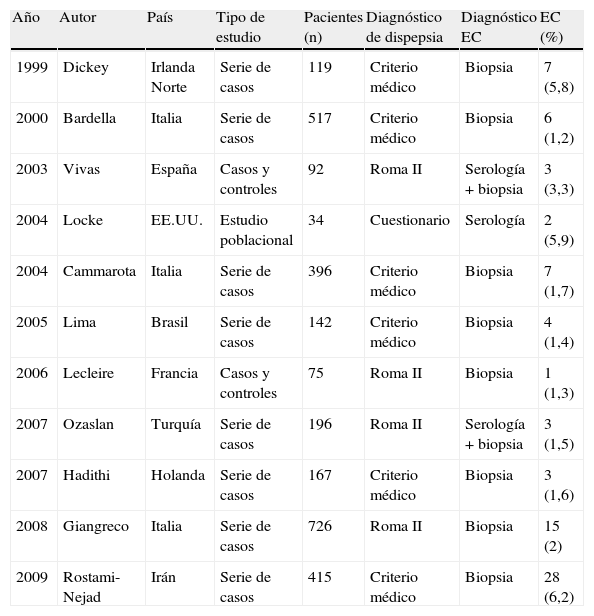
Prevalencia de enteropatía sensible al gluten en pacientes con dispepsiaExisten diferentes estudios que han evaluado la prevalencia de EC en pacientes con dispepsia. Aunque estos trabajos presentan una gran heterogeneidad en cuanto a metodología y definición de la dispepsia, muestran en general una prevalencia superior a la descrita en la población general, con cifras que oscilan entre el 1,2% y el 6,2% (tabla 2)30–40.
Estudios de prevalencia de enfermedad celíaca en pacientes con dispepsia
| Año | Autor | País | Tipo de estudio | Pacientes (n) | Diagnóstico de dispepsia | Diagnóstico EC | EC (%) |
| 1999 | Dickey | Irlanda Norte | Serie de casos | 119 | Criterio médico | Biopsia | 7 (5,8) |
| 2000 | Bardella | Italia | Serie de casos | 517 | Criterio médico | Biopsia | 6 (1,2) |
| 2003 | Vivas | España | Casos y controles | 92 | Roma II | Serología + biopsia | 3 (3,3) |
| 2004 | Locke | EE.UU. | Estudio poblacional | 34 | Cuestionario | Serología | 2 (5,9) |
| 2004 | Cammarota | Italia | Serie de casos | 396 | Criterio médico | Biopsia | 7 (1,7) |
| 2005 | Lima | Brasil | Serie de casos | 142 | Criterio médico | Biopsia | 4 (1,4) |
| 2006 | Lecleire | Francia | Casos y controles | 75 | Roma II | Biopsia | 1 (1,3) |
| 2007 | Ozaslan | Turquía | Serie de casos | 196 | Roma II | Serología + biopsia | 3 (1,5) |
| 2007 | Hadithi | Holanda | Serie de casos | 167 | Criterio médico | Biopsia | 3 (1,6) |
| 2008 | Giangreco | Italia | Serie de casos | 726 | Roma II | Biopsia | 15 (2) |
| 2009 | Rostami-Nejad | Irán | Serie de casos | 415 | Criterio médico | Biopsia | 28 (6,2) |
Bardella et al.31 evaluaron la prevalencia de EC en 517 pacientes remitidos para la realización de una EDA por dispepsia. Un diagnóstico de EC, basado en la presencia de atrofia vellositaria en las biopsias de duodeno, se estableció en 6 pacientes (1,2% con respecto al total de pacientes y un 1,8% si se consideran únicamente los 316 pacientes con EDA normal). El riesgo relativo de EC en los pacientes con dispepsia, en relación con la población general, fue 2,32 (IC 95%: 1,06-5,07). Los autores excluyeron del estudio aquellos pacientes con síntomas de ERGE, anemia ferropénica o sospecha de EC debido a la coexistencia de síntomas o signos de malabsorción. Dickey et al.30 evaluaron la presencia de atrofia vellositaria en las biopsias de duodeno tomadas a 150 pacientes que fueron derivados para la realización de una EDA para estudio diagnóstico de dispepsia o anemia ferropénica. Observaron la existencia de atrofia vellositaria en 8 (5,3%) pacientes: 2 de 48 (4,2%) pacientes con dispepsia, 4 de 52 (6,4%) pacientes con síntomas de reflujo gastroesofágico y 1 de 17 (5,8%) pacientes con náuseas y/o vómitos. Existen otros estudios que han evaluado la prevalencia de EC en pacientes con dispepsia, mediante la realización de serología seguida de EDA y biopsias de duodeno en los positivos32,33,37. Estos trabajos también han demostrado una mayor frecuencia de EC (1,5-5,9%) en comparación con la población general. En todos estos estudios, el diagnóstico de EC estuvo igualmente basado en la existencia de atrofia vellositaria, asociada a hiperplasia de criptas e incremento en el número de LIE. Por último, existe un metaanálisis y revisión sistemática de estudios que evalúan la prevalencia de EC en pacientes con dispepsia41. En este trabajo observaron una mayor frecuencia de un resultado positivo en la serología de celiaquía (7,9 vs 3,9%) y EC diagnosticada por biopsia duodenal (3,2 vs 1,3%) en los pacientes con dispepsia respecto a la población control, si bien estas diferencias no resultaron estadísticamente significativas.
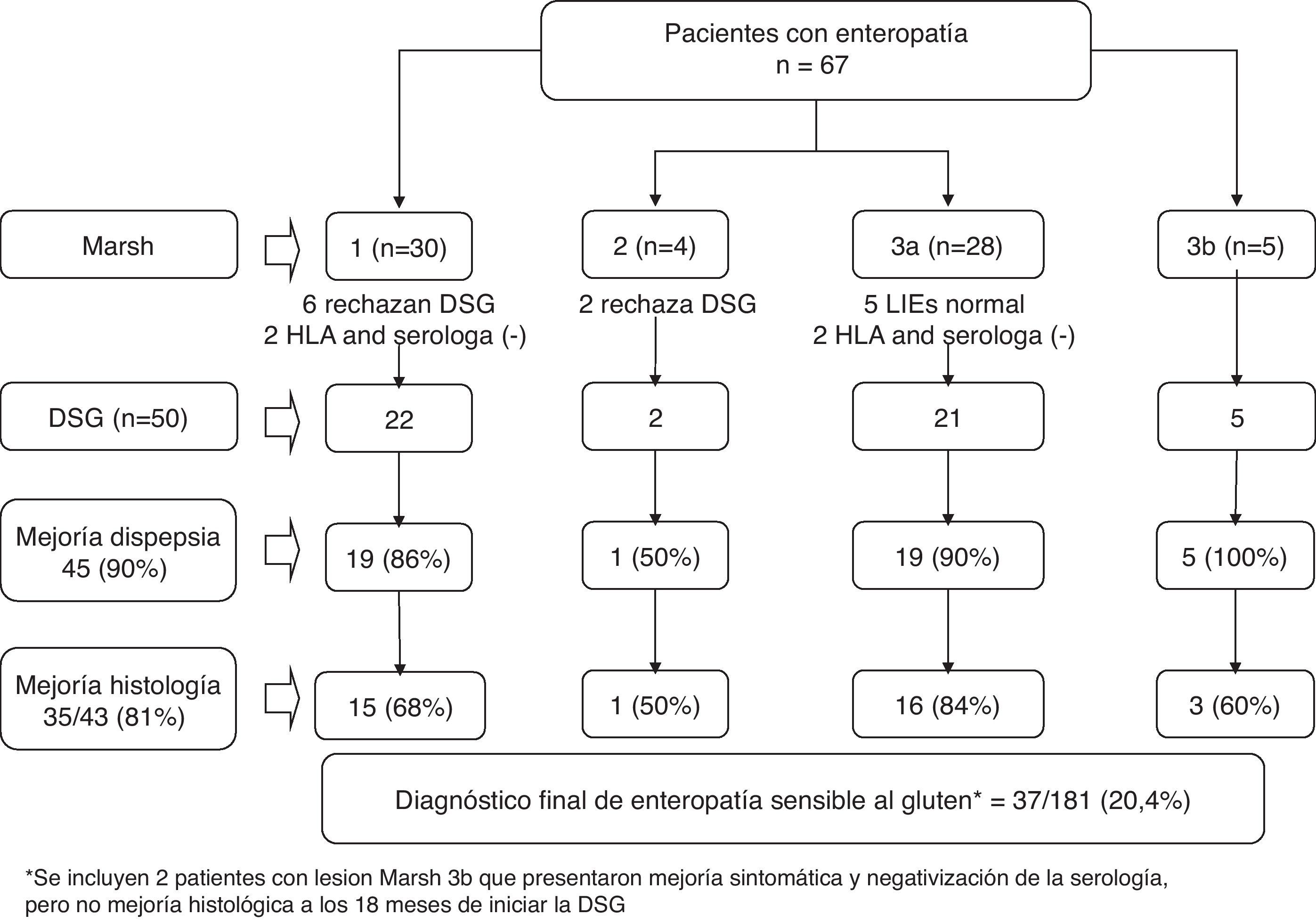
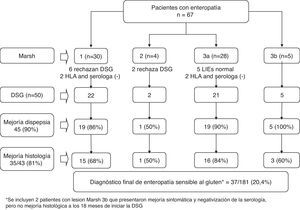
Se desconoce cuál es la prevalencia de todo el espectro de lesiones de la ESG, incluidas las formas leves de enteropatía, en los pacientes con dispepsia. En este sentido, un reciente estudio realizado en España en el que se tomaron biopsias de duodeno a 181 pacientes con dispepsia tipo distrés posprandial y EDA normal, mostró cómo 67 (37%) pacientes presentaron algún grado de enteropatía: 31 (17,1%) Marsh 1; 4 (2,2%) Marsh 2; 28 (15,5%) Marsh 3ª, y 5 (2,85%) Marsh 3b (fig. 2). Un diagnóstico final de ESG, se estableció en 37 (20,4%) pacientes. Hay que destacar que el estudio histológico de las biopsias de duodeno incluyó la realización de inmunohistoquímica para linfocitos CD3 (+), una herramienta que facilita la visualización de los LIE y por tanto el diagnóstico de formas de enteropatía leve42.
Respuesta a una dieta sin gluten (DSG) y diagnóstico final en 67 pacientes con dispepsia tipo distrés posprandial y enteropatía en la biopsia duodenal42.
La existencia de trastornos en la motilidad en el tracto gastrointestinal superior, como retraso en el vaciamiento gástrico o una actividad motora anormal, en los pacientes con EC podría explicar la aparición de síntomas como plenitud postprandial, distensión abdominal, flatulencia, náuseas, vómitos, regurgitación y pirosis43,44. Rocco et al.45 evaluaron el vaciamiento gástrico mediante ecografía y test de hidrógeno con octanoico en 20 pacientes con EC y 10 controles. Observaron cómo los pacientes con EC presentaron un retraso en el vaciamiento gástrico (252 ± 101 min) en relación con los pacientes del grupo control (89 ± 16 min), y como este se normalizaba un año después de iniciar una DSG (97±14 min). Bassoti et al.46 estudiaron la motilidad antroduodenoyeyunal mediante manometría en 11 pacientes con EC no tratada, 12 pacientes con EC en tratamiento con DSG durante al menos un año y 33 pacientes control. Observaron que los pacientes con EC presentaron alteraciones en la motilidad interdigestiva (ayuno) y posprandial en relación con los pacientes del grupo control. En el periodo de ayuno observaron una disminución de la periodicidad del complejo motor migratorio interdigestivo, con acortamiento de la fase I y fase II, y una menor velocidad de propagación de la fase III. Estas alteraciones mejoraron una vez iniciada la DSG aunque no llegaron a desaparecer por completo, hecho que los autores atribuyeron a la persistencia de signos de enteropatía leve en algunos pacientes.
Los pacientes con EC pueden presentar además trastornos de la motilidad a lo largo de todo el tracto digestivo44. Se ha demostrado la existencia de una disminución en la presión del esfínter esofágico inferior, un enlentecimiento del tránsito en el intestino delgado, un retraso en el vaciamiento de la vesícula biliar, así como un mayor grado de repleción de la misma durante el ayuno, y una aceleración del tránsito colónico. Todas estas alteraciones se normalizaron meses después del inicio de una DSG44.
La fisiopatología de estas alteraciones motoras no es bien conocida, y se ha intentado explicar por la existencia de complejas interacciones entre la malabsorción de determinados nutrientes, una disfunción del sistema nervioso autónomo, y finalmente alteraciones en la secreción de determinadas hormonas gastrointestinales44. La presencia de grasas no absorbidas en el intestino delgado puede favorecer un retraso en el vaciamiento gástrico, así como un enlentecimiento del tránsito orocecal. Por otra parte, la respuesta inmunológica generada por el gluten en la mucosa intestinal, junto con el aumento de células inflamatorias en la lámina propia, así como la secreción de diversas citocinas y mediadores de la inflamación, podría afectar a las células nerviosas de los plexos nerviosos intestinales y ocasionar una neuropatía autonómica extrínseca con la consiguiente alteración de la motilidad gastrointestinal47. Con esta hipótesis, Usai et al.48 estudiaron mediante la realización de manometría esofágica y tests autonómicos cardiovasculares a 30 pacientes con EC no tratada, realizando además pHmetría esofágica a 20, manometría gastrointesinal a 8 y estudio de vaciamiento gástrico mediante escintigrafía a 13 de ellos. Observaron cómo hasta un 75% de los pacientes presentaron alteraciones de la motilidad en el tracto digestivo superior (50% retraso en el vaciamiento gástrico y 50% alteraciones motoras esofágicas). Los tests autonómicos cardiovasculares fueron positivos en el 45% de los pacientes y se correlacionaron con las alteraciones en la manometría gastrointestinal, por lo que los autores concluyeron que las alteraciones motoras gastrointestinales en los pacientes con EC pueden estar favorecidas por la existencia de una neuropatía autonómica extrínseca.
Finalmente, en la ESG se han descrito alteraciones en la secreción de determinadas hormonas gastrointestinales, que entre otras funciones pueden alterar la motilidad gastrointestinal. La colecistoquinina es un péptido que se produce principalmente en el intestino delgado, en respuesta a la presencia de grasas y proteínas en la luz intestinal. Se ha demostrado que los pacientes con EC presentan una disminución en la secreción posprandial de colecistocinina en respuesta a una comida grasa, hecho que se ha relacionado con la existencia de un defecto en la lipólisis de las grasas49. Dado que la colecistocinina es el principal regulador hormonal de la contracción vesicular, estimula la secreción enzimática pancreática y aumenta la motilidad gastrointestinal, una disminución en su producción podría ocasionar un enlentecimiento en el vaciamiento vesicular y en el tránsito orocecal. La neurotensina es un péptido liberado en el íleon distal que puede inhibir la motilidad gastrointestinal, cuyos niveles se encuentran elevados en los pacientes con ESG y retraso en el vaciamiento gástrico44. El péptido plasmático YY es una hormona liberada en células endocrinas del íleon distal, colon y recto, que tiene efectos inhibitorios sobre la secreción ácida gástrica, el vaciamiento gástrico, la motilidad gastrointestinal y la secreción pancreática, cuya secreción se encuentra aumentada en los pacientes con EC no tratada50. Por último, la somatostatina es otra hormona gastrointestinal con función inhibitoria de la motilidad gastrointestinal cuyos valores se han encontrado aumentados en pacientes con EC. Al igual que ocurre con las alteraciones en la motilidad gastrointestinal, la secreción de estos péptidos gastrointestinales tiende a su normalización una vez que se inicia una DSG44.
Enteropatía sensible al gluten y sobrecrecimiento bacteriano de intestino delgadoLas alteraciones en la motilidad gastrointestinal pueden constituir por otra parte un factor de riesgo para el desarrollo de sobrecrecimiento bacteriano de intestino delgado (SBID) en los pacientes con ESG. Además, se ha demostrado que los pacientes con ESG presentan diferencias en la microbiota intestinal con respecto a la población general, como una menor proporción de Lactobacillus y Bifidobacterium en heces, y una mayor presencia de Bacteroides y Escherichia coli en biopsias de duodeno51. Los pacientes con ESG pueden presentar SBID en un rango que oscila entre el 9 y el 55%, siendo especialmente frecuente en aquellos pacientes que no responden a la DSG, o presentan una reaparición de los síntomas tras una mejoría inicial con la DSG52.
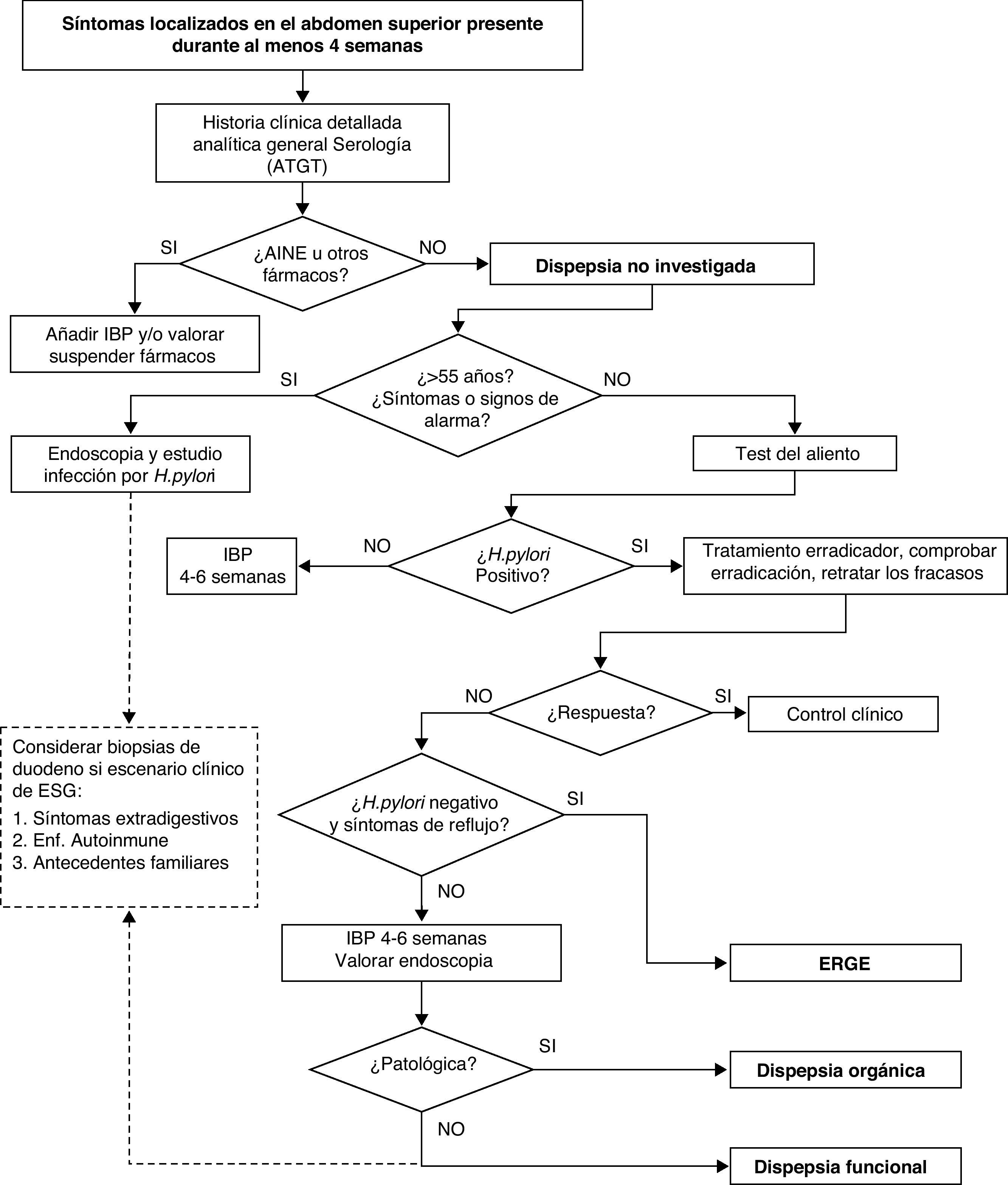
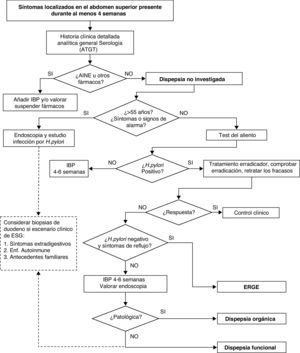
Diagnóstico de la en la dispepsia no investigadaLa dispepsia no investigada, se define como: «cualquier síntoma localizado en el abdomen superior, presente durante al menos 4 semanas, incluyendo cualquier dolor o malestar, ardor, reflujo, náuseas o vómitos»1. Las guías de práctica clínica sobre el diagnóstico y tratamiento de la dispepsia proponen 3 posibilidades de manejo del paciente con dispepsia, no excluyentes entre sí. Se contempla la posibilidad de realizar un examen endoscópico de entrada, investigar y en su caso tratar la infección por H. pylori, o finalmente la opción de iniciar un tratamiento empírico con antisecretores, en general inhibidores de la bomba de protones. Con esta última, un subgrupo de pacientes encuentra alivio sintomático, evitando con ello pruebas complementarias que resultan incómodas para el individuo y de elevado coste para el sistema sanitario. La última actualización de la guía de práctica clínica para el manejo del paciente con dispepsia en nuestro medio realiza las siguientes recomendaciones (fig. 3)1:
- 1.
En los pacientes mayores de 55 años, y/o en aquellos que presentan síntomas y/o signos de alarma (pérdida de peso significativa no intencionada, vómitos intensos y recurrentes, disfagia u odinofagia, presencia de signos de sangrado digestivo) se recomienda realizar una EDA de entrada.
- 2.
En los pacientes menores de 55 años, sin síntomas ni signos de alarma, se recomienda la estrategia investigar y tratar la infección por H. pylori como primera opción, por delante del tratamiento antisecretor o la endoscopia. Esta recomendación se ha establecido teniendo en cuenta las características de nuestra población, con una alta prevalencia de infección por H. pylori, y de nuestro sistema sanitario.
- 3.
La posibilidad de realizar una EDA debe valorarse en función de la sintomatología y del riesgo subyacente de enfermedad grave, especialmente neoplasia. Se sugiere mantener un alto índice de sospecha clínica y no retrasar excesivamente la endoscopia en pacientes con síntomas recurrentes, o ausencia de respuesta al tratamiento inicial realizado.
Algoritmo de actuación propuesto para el manejo del paciente con dispepsia no investigada en nuestro medio1. En línea discontinua, actuación propuesta para descartar una ESG en el paciente con dispepsia y endoscopia negativa. ATGT: anticuerpos antitransglutaminasa tisular; ESG: enteropatía sensible al gluten; IBP: inhibidores de la bomba protones.
La realización de una EDA estaría indicada, por tanto, en los pacientes mayores de 55 años, cuando existen signos y síntomas de alarma, o bien en aquellos pacientes en los que persiste la dispepsia a pesar de realizar una erradicación de la infección por H. pylori y/o no mejoran tras realizar un tratamiento empírico con inhibidores de la bomba de protones durante 4-6 semanas. En estos pacientes, la ausencia de lesiones macroscópicas de la mucosa del tracto digestivo superior acaba siendo el resultado final del examen endoscópico en más de la mitad de los casos, y se establece el diagnóstico de dispepsia funcional. Sin embargo, y como se ha comentado anteriormente, la ESG puede ser una causa frecuente y, a menudo, insospechada de dispepsia, que podría ser erróneamente diagnosticada como dispepsia funcional si el estudio diagnóstico no se completa con la toma de biopsias de duodeno.
La relación coste-eficacia de la toma de biopsias de duodeno para excluir la presencia de lesiones histológicas intestinales que puedan explicar la naturaleza de los síntomas, antes de establecer un diagnóstico de dispepsia funcional, hace necesaria la realización de estudios bien diseñados con este propósito. Entre tanto, parece razonable indicar la biopsia ante la presencia de un escenario clínico razonable, y/o indicativo de una ESG incluida la presencia de antecedentes familiares de primer grado, una o varias enfermedades autoinmunitarias concomitantes o cualquier historia previa de retraso de crecimiento en la infancia, osteoporosis a una edad temprana, ferropenia o infertilidad de causa no aclarada y otras como depresión o aftas orales recurrentes, aunque estas variables no sean el motivo principal de consulta (fig. 3). Esta recomendación adquiere mayor consistencia cuando el enfermo es portador de los haplotipos DQ2 o DQ8 del sistema HLA. La realización de una analítica general, que incluya determinación de ATGT, debería ser incluida de igual manera en la valoración inicial del paciente con dispepsia.
Resumen y conclusionesLa ESG es una de las afecciones genéticamente determinadas más prevalentes en la población, que cada vez se diagnostica con mayor frecuencia en el adulto, siendo frecuente su presentación con síntomas digestivos atípicos que en ocasiones se solapan con los descritos en la dispepsia funcional.
Se ha descrito una prevalencia de la EC en la dispepsia entre el 1,2-6,2%. Esta prevalencia podría ser superior si se tiene presente todo el espectro de lesiones relacionadas con la sensibilidad al gluten, incluida la EL. Este tipo de lesión considerada clásicamente como EC latente, se ha demostrado que puede cursar con síntomas y complicaciones con la misma frecuencia que las formas con atrofia.
El diagnóstico de ESG en la EL precisa la realización de técnicas adicionales de inmunohistoquímica con anticuerpos monoclonales para linfocitos CD3, estudio genético HLA-DQ2 y DQ8, y confirmar que los síntomas y la lesión histológica son dependientes de gluten. En ocasiones se hace necesario valorar la respuesta clínica e histológica a la reintroducción del gluten en la dieta para confirmar el diagnóstico.
La existencia de trastornos en la motilidad localizadas en el tracto gastrointestinal superior, como retraso en el vaciamiento gástrico o una actividad motora anormal, podría explicar la aparición de la dispepsia en los pacientes con ESG. La fisiopatología de estas alteraciones motoras no es bien conocida, y se ha intentado explicar por la presencia de complejas interacciones entre la malabsorción de determinados nutrientes, una disfunción del sistema nervioso autónomo y alteraciones en la secreción de determinadas hormonas gastrointestinales.
La ESG puede ser una causa frecuente y, a menudo, insospechada de dispepsia, que podría ser erróneamente diagnosticada como dispepsia funcional si el estudio diagnóstico no se completa con la realización de una serología para EC y la toma de biopsias de duodeno durante la EDA. Esta estrategia diagnóstica podría tener importantes consecuencias en términos de morbimortalidad y calidad de vida de los pacientes.
Será necesaria la realización de estudios prospectivos bien diseñados que evalúen la relación coste-eficacia de la toma de biopsias de duodeno en los pacientes con dispepsia que no presenten una lesión estructural en la EDA. Entre tanto, parece razonable incluir la realización de una determinación de ATGT en la valoración inicial del paciente con dispepsia e indicar la biopsia duodenal en el paciente con dispepsia, que presenta un escenario clínico indicativo de una ESG (incluido el estudio genético HLA-DQ2 y/o HLA-DQ8 positivo).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.