INTRODUCCIÓN
La hepatopatía grasa no alcohólica (HGNA) comprende un espectro anatomoclínico que va desde la esteatosis hepática hasta la cirrosis grasa y que se desarrolla en individuos sin hábito etílico1-4. Su patogenia no está bien definida, pero es probable que el origen y la evolución sean el resultado de diversos acontecimientos epigenéticos, en especial dietéticos y de estilo de vida, que inciden en un contexto genético adecuado para producir múltiples alteraciones metabólicas e inmunológicas5. Aunque no es una diferenciación de aceptación unánime, conviene separar la HGNA primaria, esto es, en la que no existe una causa aparente, de la HGNA secundaria, en la que sí es posible individualizar un factor etiológico, como ciertos cuadros metabólicos congénitos y adquiridos, la cirugía bariátrica o diversos fármacos y tóxicos. Parece bien establecido6 que la forma primaria es la manifestación hepática del síndrome metabólico, que engloba, al menos, obesidad, diabetes mellitus tipo 2, hipertrigliceridemia e hipertensión arterial7.
El impacto clínico de una enfermedad viene determinado por cuán frecuente es y cuál es su pronóstico. En la práctica clínica diaria, la aparente baja prevalencia de enfermedad hepática clínicamente significativa entre los pacientes con HGNA y su escasa representación entre los trasplantados hepáticos han generado un escepticismo generalizado sobre su trascendencia clínica y un reducido interés por formas agresivas de diagnóstico, tratamiento y seguimiento. En esa idea también influye que los primeros estudios la considerasen, por un lado, una entidad rara, con índices de prevalencia muy bajos entre la población general8 y con una relación frente a la hepatopatía alcohólica de un caso por cada 129 a 1710, y, por otro, de mínima mortalidad11. Sin embargo, la HGNA es causa de morbimortalidad hepática, cuyo reconocimiento es creciente12-14, paralelo al incesante aumento de la obesidad en los países desarrollados15-17.
EPIDEMIOLOGÍA
Prevalencia
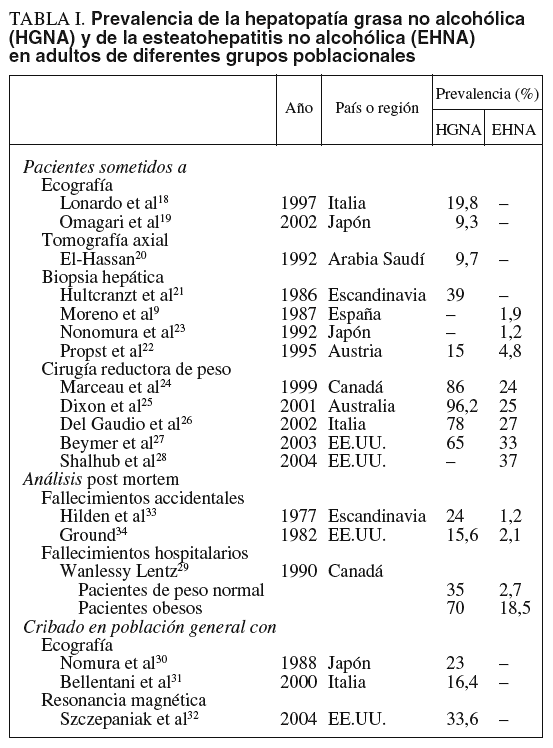
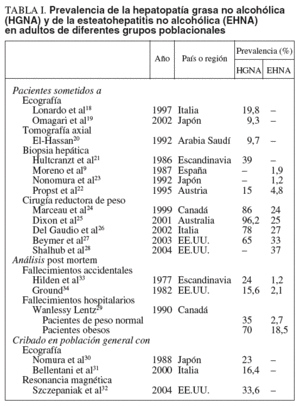
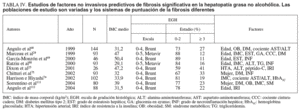
La prevalencia de la HGNA en la población general es mal conocida debido a su carácter silente, a la ausencia de un método de cribado aceptado, a que su diagnóstico preciso requiere un procedimiento agresivo (biopsia hepática) y a que no existe consenso sobre su caracterización y gradación histológica. Los estudios publicados (tabla I)9,18-34 adolecen de defectos metodológicos relevantes que introducen sesgos significativos por: a) enfocarse a grupos seleccionados de pacientes, en general subpoblaciones hospitalarias de obesos, diabéticos, etc., y b) utilizar técnicas diagnósticas de imagen, en especial ecografía, que pueden resultar adecuadas para cribar la esteatosis pero no la lesión hepatocelular y/o fibrosis esteatohepatitis no alcohólica (EHNA).
Así, en pacientes hospitalarios se han encontrado signos de hígado graso por eco o tomografía en el 9-20%18-20, y en individuos sometidos a biopsia hepática por elevación asintomática y persistente de aminotransferasas se han hallado datos histológicos de HGNA en el 15-39%21-22 y de EHNA en el 1-5%9,22,23, porcentajes que ascienden hasta el 90 y el 39,5%, respectivamente, si se considera sólo a aquéllos con marcadores etiológicos negativos35. En pacientes con obesidad mórbida antes de ser sometidos a cirugía bariátrica, se ha objetivado esteatosis en el 65-96%24-27 y EHNA en el 24-37%24-28. En un estudio sobre 351 necropsias de individuos no alcohólicos fallecidos en el hospital, se observó esteatosis en el 70% de los obesos y en el 35% de los individuos con peso normal, y esteatohepatitis en el 18,5 y el 2,7%, respectivamente, con una media del 6%29. En población general no alcohólica existe hígado graso por ecografía en el 16-23%30,31 y por resonancia magnética en el 34%32; además, se observan signos histológicos post mortem de HGNA en el 16-24% y de EHNA en el 1-2% de víctimas de accidentes de tráfico33 o aéreo34.
En la actualidad, la HGNA se considera la causa más frecuente de hipertransaminasemia persistente35-40 y de cirrosis criptogenética37,38,41-44, al menos entre los adultos norteamericanos. En cualquier caso, ¿cómo determinar la prevalencia de una enfermedad habitualmente asintomática en la que el método diagnóstico de referencia es anatomopatológico? Los investigadores han tratado de solventar ese problema con métodos de aproximación diferentes, bien basándose en encuestas epidemiológicas de salud en población general o sobre datos conocidos de prevalencia de ciertos procesos clínicos asociados a la HGNA.
Ejemplo del primer método es el estudio de Ruhl y Everhart45 sobre la etiología y prevalencia de la elevación persistente de aminotransferasas alanina-aminotransferasa (ALT) > 43 U/l basado en los datos de la encuesta epidemiológica National Health and Nutrition Examination Survey III (NHANES III), llevada a cabo entre 1988 y 1994. Tras eliminar a los individuos consumidores de alcohol, con serología positiva a los virus B o C de la hepatitis, elevación del índice de saturación de la transferrina o una historia de diabetes, obtuvieron una prevalencia del 2,8%. Con análisis multivariante observaron correlación positiva con la adiposidad central y la insulinemia. Sin embargo, autores italianos han objetivado una prevalencia superior en donantes voluntarios de sangre46. Los motivos pueden ser varios47. El análisis enzimático en el estudio norteamericano se realizó sobre muestra de sangre congelada, que puede subestimar su tasa sanguínea; el punto de corte de anormalidad de la ALT es superior al recomendado, y considerar a esa enzima como único marcador de enfermedad hepática subyacente es insuficiente. Además, excluyen a individuos diabéticos, grupo poblacional en el que la asociación con HGNA es alta. En cualquier caso, si la prevalencia de HGNA con elevación de aminotransferasas en la población norteamericana fuera del 2,8% ya, por ejemplo, duplicaría la de la hepatitis crónica por el virus C con una prevalencia en 2002 del 1,3%48. Clark et al38,39, con datos de la misma encuesta pero diferente punto de corte ALT > 40 y/o aspartato-aminotransferasa (AST) > 37 U/l en varones y ALT y/o AST > 31 UI/l en mujeres, observaron un 8% con elevación asintomática de aminotransferasas y sólo un 31% de ellos con una causa identificable (alcohol, hepatitis vírica y hemocromatosis, principalmente). Tal elevación se asoció de manera significativa con un mayor índice de masa corporal (IMC), perímetro de la cintura, trigliceridemia e insulinemia en ayunas en ambos sexos; en mujeres se asoció, además, con la existencia de diabetes tipo 2 e hipertensión arterial. Si esta aproximación es correcta, alrededor de 15 millones de norteamericanos padecerían HGNA con elevación de aminotransferasas.
Angulo49 aplica el segundo método, esto es, su estimación a partir de las conocidas prevalencias de obesidad y de diabetes tipo 2 en la población general. En Estados Unidos la obesidad afectaba al 22,5% de los individuos adultos al final del pasado siglo50. Se observa esteatosis en dos tercios de la población obesa, con independencia del estado glucémico29, y en más del 90% de los obesos mórbidos51. La EHNA afecta alrededor del 3% de la población sin sobrepeso, al 19% de la población obesa y casi a la mitad de los obesos mórbidos29,51. Por ello, y sobre la base de la población norteamericana en el año 2000, este autor49 estima que alrededor de 30,1 millones de obesos adultos tendrían esteatosis y 8,6 millones, EHNA, con independencia del estado glucémico. Además, la diabetes tipo 2 afectaba al 7,8% de la población norteamericana adulta a final de siglo52 y alrededor del 50%53 de los diabéticos; esto es, 7,8 millones de individuos49 padecerían HGNA con independencia de su IMC.
En virtud de estos datos y aproximaciones, voces autorizadas han estimado que el 16-24% de la población adulta padecería HGNA y el 2-3% EHNA12,37,54 en la última década del pasado siglo y en países occidentales. En la actualidad las cifras deben de ser aún mayores si tenemos en cuenta el incesante aumento tanto de la obesidad como de la diabetes tipo 2 en dichos países15,55,56. En Estados Unidos la prevalencia de la obesidad en adultos aumentó desde el 15 al 25% en mujeres y desde el 10 al 20% en varones en el período 1961-199157, ascendió al 22,5% a principios de la década de los noventa50, al 30,5% al final de esa década58, y se estima que alcanzará el 40% en el año 202555. Asimismo, la obesidad central ha pasado del 13 al 38% en varones y del 19 al 60% en mujeres desde el inicio de la década de los sesenta hasta el final del pasado siglo, respectivamente, en el mismo país59. La diabetes tipo 2 ha aumentado un 26% en Estados Unidos en la última década, pasando de una prevalencia del 5 al 7% en la población general60. Todo ello indica que en la actualidad la HGNA es la hepatopatía más frecuente en los países industrializados12,35,37,61 y que en un futuro nada lejano será el principal problema de salud que atenderán los hepatólogos de esos países13. La amenaza epidémica es todavía más patente si consideramos el extraordinario incremento de la HGNA en población infantil62,63.
Demografía
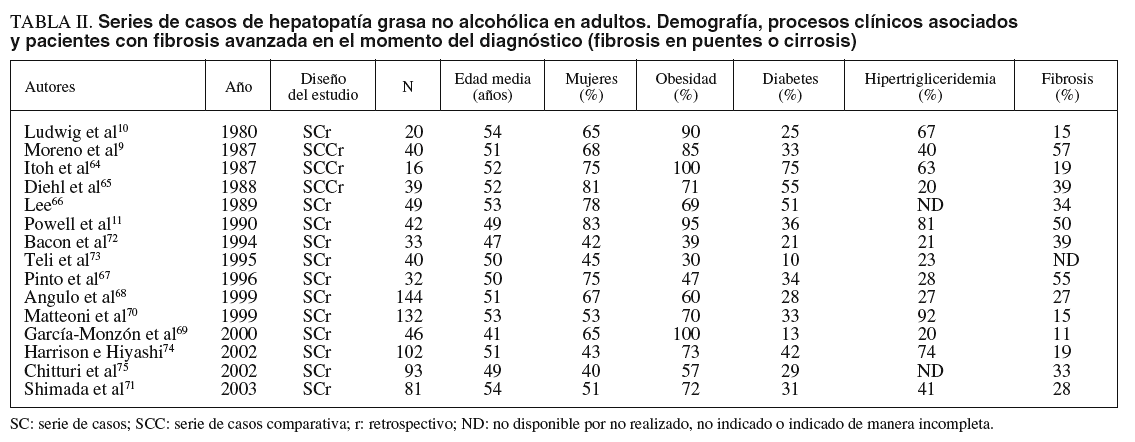
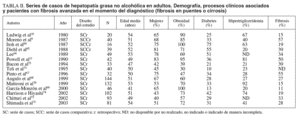
En las series publicadas hasta 1990 la mayoría de los pacientes eran mujeres, con un 65-83% de los casos9-11,64-66 (tabla II), pero en las más recientes, aunque en alguna persiste esa mayoría67-69, la tendencia es a igualarse70,71 o al predominio de los varones72-75. La hipótesis de que las hormonas femeninas podrían resultar «protectoras» frente al hígado graso se fundamenta en que la HGNA es 2 veces más frecuente en mujeres posmenopáusicas que en premenopáusicas y en que, entre las primeras, aquellas que reciben tratamiento hormonal sustitutivo tienen un riesgo menor de padecer la hepatopatía que quienes no la reciben37. La HGNA se ha documentado en todos los grupos de edad, aunque la mayor proporción en el momento del diagnóstico se sitúa en la quinta década de la vida (tabla II). No obstante, es de particular interés la incidencia creciente en población infantil63, en coherencia con el incremento tanto de la obesidad como de la diabetes tipo 2 en ese grupo de edad76. Dos series de 1277 y 3678 casos, con edad media de 12 a 14 años, muestran predominio masculino (58-67%), un porcentaje de obesos del 83-100% y de diabéticos del 0-11%. El 60% de los adolescentes con elevación de aminotransferasas tienen sobrepeso79 y se estima que uno de cada 4 adolescentes obesos y alrededor del 2% de todos los adolescentes12 padecen HGNA. Esta evolución demográfica ha motivado que el perfil epidemiológico típico descrito originalmente por Ludwig et al10 (esto es, mujer en la quinta o sexta décadas de la vida, con un importante sobrepeso y alteraciones metabólicas asociadas, como la diabetes mellitus tipo 2 y la dislipemia) deba ampliarse37,72.
En cuanto a etnias, se ha indicado una mayor prevalencia en caucásicos e hispanos43,80,81 y menor en afroamerica-nos81,82. No obstante, esas cifras son controvertidas37, ya que pueden reflejar un sesgo por el uso de diferentes patrones de referencia. Así, en los estudios del grupo de Clark37-39 sobre los datos de la NHANES III, tras ajuste por edad e IMC, tanto los individuos de raza negra no hispanos como los descendientes de mexicanos tenían mayor probabilidad de desarrollar HGNA (el 8,1 y el 14,9%, respectivamente) que los individuos de raza blanca no hispanos (7,1%; p < 0,001).
Es frecuente el agrupamiento familiar tanto de la obesidad83 como de la diabetes84, por motivos tanto genéticos como ambientales. Por ello no debe sorprender cierto agrupamiento familiar en la HGNA, incluyendo casos de EHNA y cirrosis85,86. En un serie de 90 pacientes con EHNA, el 18% tenía un familiar de primer grado afectado86. Aunque en la HGNA se han definido ciertas alteraciones genéticas87, no se ha encontrado ningún patrón hereditario concreto, sino sólo la coincidencia de factores de riesgo5.
HISTORIA NATURAL
La mayoría de los estudios que analizan la historia natural de la HGNA son retrospectivos y con un seguimiento a corto o medio plazo. No existen investigaciones prospectivas y longitudinales que aborden con rigor esta cuestión, en ocasiones porque no es habitual realizar biopsias a pacientes con sospecha clínica de un simple hígado graso (y mucho menos biopsias seriadas), en otros casos por la ausencia de consenso sobre las diferentes formas y estadios histológicos, y en otros al no marcarse como objetivos finales los estandarizados en las investigaciones sobre historia natural de las enfermedades del hígado, como son la tasa de fallecimiento global, la de fallecimiento por causa hepática, la de necesidad de trasplante y la de desarrollo de carcinoma hepatocelular.
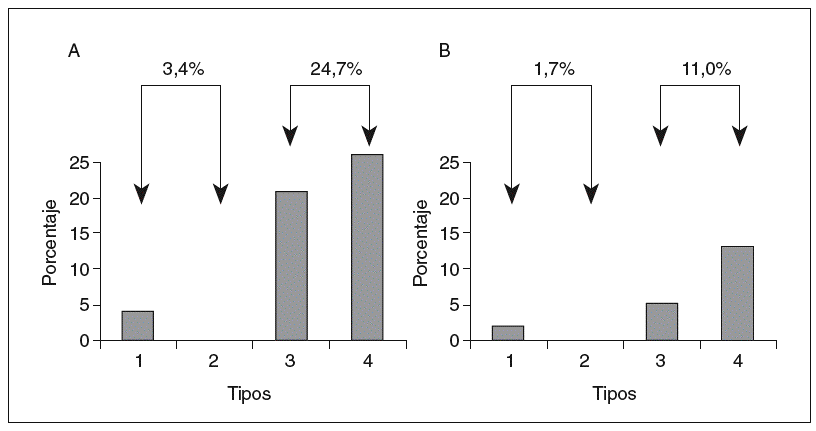
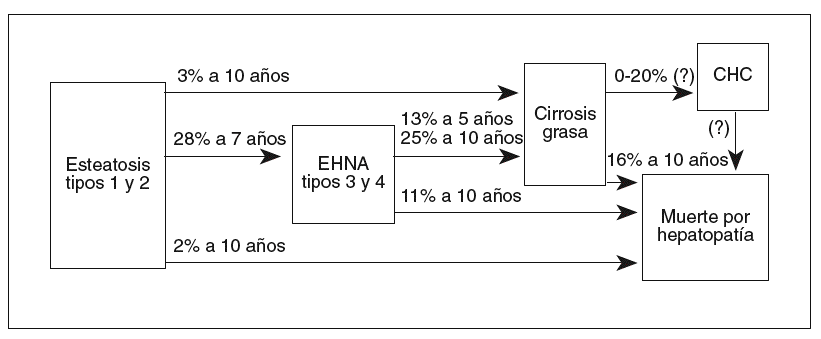
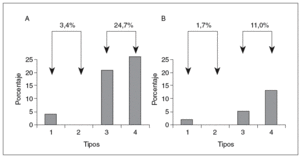
Aunque la evolución y el pronóstico no estén definidos, parecen relacionarse con la intensidad de la lesión histológica en el momento del diagnóstico2,49 y, por ello, la escala histopatológica que se utilice resulta de gran relevancia. Como podemos advertir en la tabla II, del 15 al 57% (con media en torno al 35%) presentan una fibrosis avanzada con puentes en la biopsia diagnóstica9-11,64-72,74,75 y un 7-17% tiene cirrosis establecida11,66,68,72,88. En alguna de esas series se exigen unos criterios histológicos estrictos para el diagnóstico de EHNA, lo que incluye balonización hepatocelular y/o fibrosis, mientras que en otras los criterios son menos rigurosos, esto es, presencia de esteatosis junto a inflamación inespecífica. Esta diferenciación puede parecer puramente académica, pero no lo es desde que Matteoni et al70 publicaron un estudio retrospectivo sobre 132 casos seguidos hasta 18 años (98 pacientes con seguimiento completo durante 10 años). Estos autores clasificaron a los pacientes en 4 tipos histológicos: tipo 1, esteatosis simple; tipo 2, esteatosis con inflamación lobulillar; tipo 3, esteatosis con degeneración balonizante, y tipo 4, esteatosis con fibrosis con/sin hialina de Mallory. La evolución a cirrosis a los 10 años (fig. 1) fue más frecuente en los tipos 3 y 4 (24,7%) que en los tipos 1 y 2 (3,4%). Aunque no se observaron diferencias significativas en cuanto a la mortalidad global, sí las hubo en cuanto a la mortalidad relacionada con el hígado (fig. 1), que fue del 11% en los tipos 3 y 4 y sólo del 1,7% en los tipos 1 y 2. Estos resultados apuntan a que el pronóstico de la HGNA diagnosticada en fases tempranas es benigno, mientras que en los casos con lesión hepatocelular y/o fibrosis la evolución a cirrosis en un plazo de 10 años es significativa y con repercusión en las tasas de supervivencia.
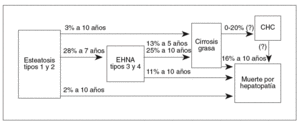
Fig. 1. Porcentaje de progresión a cirrosis (a) y de mortalidad relacionada con el hígado (b), tras 10 años de seguimiento, de los diferentes tipos histológicos de la hepatopatía grasa no alcohólica en 132 pacientes, según Matteoni et al70.
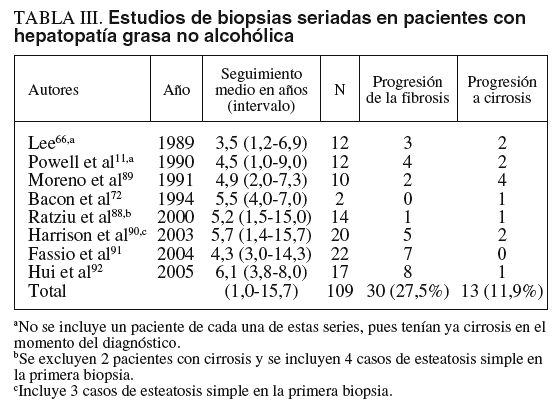
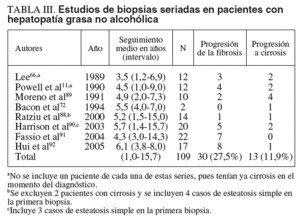
Hasta la fecha la evaluación de la historia natural de la HGNA ha consistido en: a) examen retrospectivo del seguimiento clínico de una cohorte de pacientes, y b) análisis de biopsias seriadas. Ejemplo de los primeros son el ya referido de Matteoni et al70 y otros que revisaremos más adelante. Sin embargo, resultan sin duda más clarificadores los segundos. Como podemos observar en la tabla III, se han publicado 8 series de biopsias seriadas que totalizan 109 pacientes con un intervalo entre la biopsia índice y la control de uno a 15,7 años11,66,72,88-92. De esa recopilación hemos excluido la serie de 3 casos de Nagore y Scheuer93, al ser sólo pacientes diabéticos; la de Teli et al73, al practicar una segunda biopsia sólo a 12 pacientes seleccionados (p. ej., excluyen a aquéllos con aminotransferasas en límites normales), y por último, la de 7 casos de Evans et al94, al excluir tanto a aquéllos con enzimas normales como a los que presentaban signos clínicos de cirrosis. En el conjunto de las 8 series analizadas, con un seguimiento medio en torno a los 5 años, el 39,4% de los pacientes evidencian progresión de la fibrosis (27,5%) o evolución a cirrosis hepática (11,9%).
Progresividad lesional (fig. 2)
Fig. 2. Esquema de la posible historia natural de la hepatopatía grasa no alcohólica, según los datos discutidos en el texto. EHNA: esteatohepatitis no alcohólica; CHC: carcinoma hepatocelular.
Los estudios transversales indican que la mayoría de individuos con HGNA tienen una esteatosis simple en el momento del diagnóstico10,65 y existe cierta convicción entre los clínicos de que la progresión de ese estadio al de esteatohepatitis es algo inhabitual. Teli et al73, en 12 pacientes con esteatosis simple a quienes realizaron una nueva biopsia por persistencia de hipertransaminasemia, informan de la inexistencia de cambios histológicos en un seguimiento de hasta 19 años. Ratziu et al88 rebiopsian a 4 pacientes con esteatosis simple tras una media de 7,2 años y no observan cambios morfológicos en ningún caso. Harrison et al90 practican biopsia control a 3 casos tras 7,7 años y encuentran 2 con incremento del grado de inflamación y del estadio de fibrosis. Estas 2 últimas series histológicas, sin selección de pacientes para la segunda biopsia, muestran evolución de hígado graso a EHNA en 2 de 7 casos (28%) en un seguimiento medio en torno a 7 años. Por otro lado, en cuanto al seguimiento clínico, en el estudio de referencia de Matteoni et al70 se observó progresión a cirrosis clínica en el 3% de 59 pacientes con esteatosis simple en un seguimiento medio de 10 años, y recientemente una serie de 109 pacientes mostró la evolución de sólo uno de ellos a cirrosis en 9,2 años95. Esa posibilidad evolutiva lesional desde fases iniciales a otras tardías, con necroinflamación y fibrosis, se ha observado también en el injerto tras trasplante96 y en pacientes tras reducción intensa de peso por dieta muy hipocalórica97, derivación yeyunoileal98 o gastroplastia99.
Los individuos con EHNA presentan un potencial mayor y mejor definido de progresividad lesional y, por ello, un peor pronóstico que aquéllos con esteatosis simple. Los estudios con biopsias seriadas resumidos en la tabla III muestran que el 12% de los pacientes desarrollan cirrosis hepática histológica tras un seguimiento medio de unos 5 años. En la serie de Moreno et al89 se observó una relación significativa del tiempo transcurrido entre las 2 biopsias con la variación del estadio histológico, lo que sin duda confirma la progresividad lesional, que en ocasiones puede ser rápida, como en 2 de los 20 casos de Harrison et al90. Así, en el estudio de Fassio et al91 para el total de la serie la velocidad de progresión de la fibrosis fue de 0,059 unidades/año, mientras que para el subgrupo de pacientes en que aumentó la fibrosis ésta lo hizo a una velocidad de 0,12 unidades/año, ritmo similar al de la hepatitis crónica por el virus C100. Por otro lado, el 25% de los pacientes seguidos de forma retrospectiva por Matteoni et al70 cumplían criterios clínicos de cirrosis hepática tras 10 años de seguimiento medio. Una prueba adicional de la naturaleza evolutiva de la HGNA son los estudios que demuestran, con evidencias epidemiológicas, que hasta el 80% de las cirrosis criptogenéticas son fases terminales del hígado graso37,38,41-44 que han perdido sus cambios esteatósicos y necroinflamatorios típicos.
Datos recientes apuntan a que el hepatocarcinoma puede ser una complicación final de la cirrosis grasa101-103 e incluso, en modelo animal, la neoplasia puede desarrollarse sobre hígados grasos no cirróticos104. En series de carcinoma hepatocelular se ha observado, de forma retrospectiva, una prevalencia de cirrosis criptogenética con rasgos fenotípicos de HGNA desde el 9 al 29%105,106. Si bien en la actualidad asistimos a un fuego cruzado entre autores que defienden un potencial carcinogénico de la HGNA bien definido y similar a la cirrosis por el virus C107 y otros que niegan ese potencial108, voces autorizadas afirman que el síndrome metabólico debe considerarse hoy día un factor de riesgo de primer orden para el desarrollo de carcinoma hepatocelular y podría explicar la tendencia creciente en la incidencia de esta neoplasia en la población norteamericana109.
Factores pronósticos
No disponemos en la actualidad de ningún modelo matemático validado que, mediante datos clínicos y/o analíticos, cuantifique la probabilidad de enfermedad histológica avanzada o la de evolución de una fase histológica a otra. En especial, carecemos de investigaciones que examinen posibles factores predictivos de progresividad lesional. Los estudios se han centrado, por el momento, en señalar ciertas circunstancias que hacen más probable la existencia de una enfermedad hepática avanzada en el momento de la biopsia inicial, si bien es admisible que esos factores indiquen también cierta probabilidad pronóstica evolutiva12.
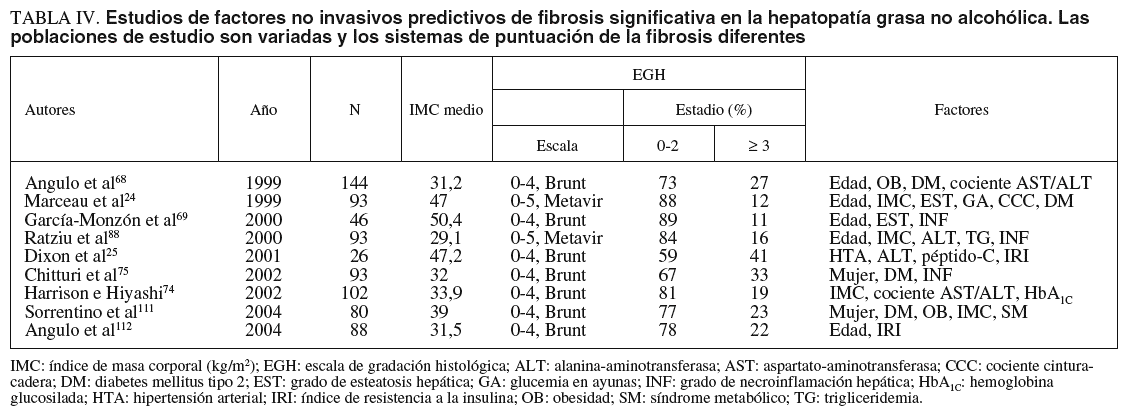
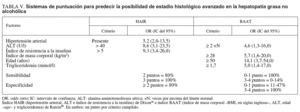
Existe suficiente consenso en que la edad, la obesidad y la diabetes tipo 2 son los predictores más importantes de fibrosis12,49,61,110. La tabla IV recoge los estudios más representativos que analizan los factores predictivos de lesión hepática avanzada en el momento del diagnóstico en la HGNA24,25,68,69,74,75,88,111,112. El hecho de que la edad igual o superior a 40-50 años, con diferentes puntos de corte en ese intervalo9,24,68,69,71,88,112, sea un factor relacionado con la posibilidad de fibrosis avanzada y/o cirrosis parece reflejar que, cuanto más tiempo dure la infiltración grasa, más tiempo está sometido el hepatocito al riesgo de «segundos impactos»110. Además, tiene un notable interés a la luz de la creciente incidencia de obesidad infantil, pues la aparición de esteatosis hepática en fases tempranas de la vida podría favorecer la evolución a cirrosis en edades más jóvenes. También son factores predictivos de fibrosis contrastados el mayor grado de obesidad y/o de esteatosis hepática24,29,68,69,74,86,88,91,111 y la existencia de diabetes tipo 2 manifiesta y/o resistencia periférica a la insulina24,25,29,68,74,75,111-113, lo que quizá traduzca una mayor intensidad de ciertos mecanismos fisiopatológicos.
Se han propuesto otros índices sobre los que no existe el mismo consenso. Entre ellos figuran otros procesos asociados al síndrome metabólico, como la hipertensión arterial25,86 y la hipertrigliceridemia88, además de las cifras de aminotransferasas, en especial una ALT superior a 2 veces el límite superior de referencia25,88,90, un cociente AST/ALT por encima de la unidad68,71,74,114 y su traducción histológica en un mayor grado de actividad necroinflamatoria hepática29,69,75,88. Sobre determinados aspectos los pareceres son encontrados, como con el sexo femenino, considerado por algunos como predictor de enfermedad avanzada75,111 y protector para otros39. Pero tal vez los factores más controvertidos sean los del metabolismo férrico. Un 20-60% de los pacientes tienen elevado el valor de ferritina sérica68,72,75,115-117 y un 5-20% el índice de saturación de la transferrina68,72,75,88,117,118, aunque el índice de hierro hepático y la concentración hepática de hierro suelen situarse en límites normales68,72,117-121. Así, se ha planteado que la HGNA es la causa más frecuente de hiperferritinemia y/o sobresaturación de la transferrina122, que la situación heterocigótica para el gen de la hemocromatosis puede ser más prevalente en pacientes con HGNA que en la población general116,118,120 y que la sobrecarga férrica del hígado se asocia a una hepatopatía más grave118,120. Sin embargo, los datos clínicos extraídos de series amplias no han demostrado que exista una relación inequívoca68,75,88,117,119,123 y la evidencia hoy disponible apunta más bien a que la hiperferritinemia en la HGNA, al menos en su fase de esteatohepatitis, es una consecuencia inespecífica de la necroinflamación hepática124,125, reflejando su función como reactante de fase aguda.
Muy recientemente se han estudiado ciertos índices validados en diversas hepatopatías crónicas, como los marcadores del metabolismo del colágeno y de la matriz extracelular. Laine et al126 han mostrado que, entre 173 pacientes, ninguno con ácido hialurónico sérico inferior a 35 µg/l padecía fibrosis significativa; además, ninguno de aquéllos con cifras superiores pero con un cociente transferrina deficiente en hidratos de carbono/transferrina total menor de 0,9 presentaba fibrosis en estadios 3 o 4 (escala Metavir). Rosenberg et al127, tras análisis discriminante, han propuesto el siguiente algoritmo para obtener el estadio de fibrosis (escala de Scheuer):
0,014 LN (edad, años) + 0,616 LN (ácido hialurónico, en ng/ml) + 0,586 LN (propéptido aminoterminal del colágeno tipo III, en ng/ml) + 0,472 LN (inhibidor tisular de la metaloproteinasa 1, en ng/ml) 6,38
Los autores señalan que la aplicación de dicho algoritmo tiene una sensibilidad del 89% y una especificidad del 96% para la detección de fibrosis estadios 3 o 4 en la HGNA. Con anterioridad a éste, ya se habían tratado de establecer sistemas matemáticos para mejorar la sensibilidad y especificidad de los factores pronósticos25,68,88,128. Klain et al128, tras análisis multivariante, propusieron el índice K para la estimación de esteatosis simple (K < 100) o cambios necroinflamatorios y/o fibróticos (K > 100) en la hepatopat&iacutneral> K = 1,49 edad [años] 13,0 sexo [1 = varón; 2 = mujer] + 0,42 sobrepeso [% sobre el de referencia] + 0,26 ALT [en U/l] + 0,09 trigliceridemia [en mg/dl] 0,61
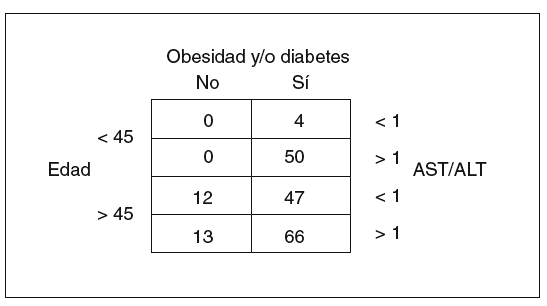
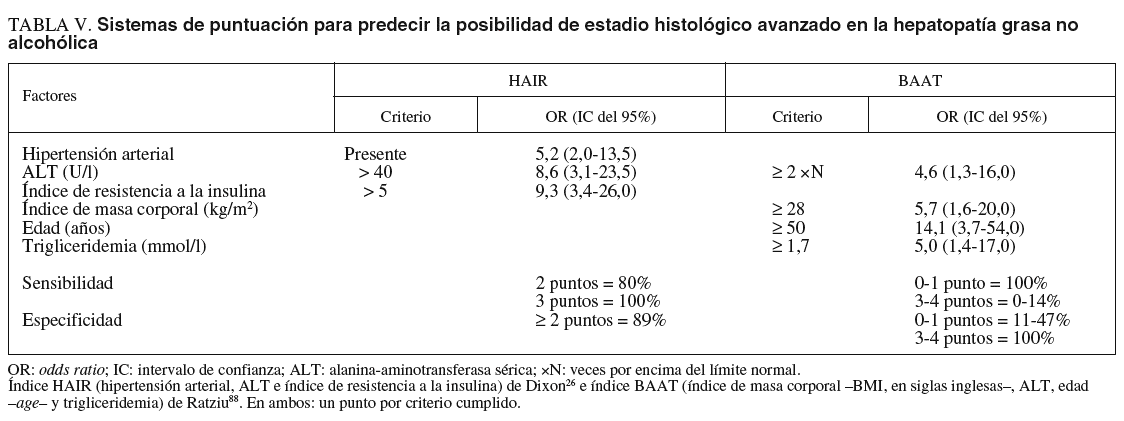
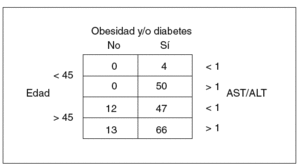
En un paciente concreto la probabilidad de clasificarlo adecuadamente es del 73%. Angulo et al68 estudiaron a 144 pacientes, 39 con fibrosis en puentes o cirrosis, y obtuvieron como factores pronósticos la edad, el cociente AST/ALT, la obesidad y la diabetes tipo 2. Estos autores cuantifican la probabilidad de fibrosis avanzada mediante la combinación de esos 4 factores, lo que se expone en la figura 3. Dixon et al25 evaluaron a pacientes con obesidad mórbida sometidos a cirugía bariátrica y encontraron 3 factores pronósticos (hipertensión arterial, cifra de ALT e índice de resistencia a la insulina), que componen el índice HAIR (tabla V), con una sensibilidad del 80% y una especificidad del 85% para el diagnóstico de EHNA. Por último, Ratziu et al88, tras el examen de 93 pacientes, puntuaron 4 factores (IMC, edad, cifra de ALT y trigliceridemia) para completar el índice BAAT (tabla V). La existencia de un solo factor o ninguno tiene una sensibilidad del 100% para el diagnóstico de fibrosis avanzada, pero una especificidad del 47 y el 11%, respectivamente; en cambio, la presencia de los 4 factores tiene una sensibilidad nula y una especificidad del 100%. En nuestro conocimiento, ninguno de estos índices ha sido validado por otros autores de manera prospectiva.
Fig. 3. Predicción del riesgo de lesión histológica avanzada en la hepatopatía grasa no alcohólica, según Angulo et al68. Los números representan el porcentaje de pacientes con fibrosis significativa tras estratificación según los factores de edad, cociente de aminotransferasas aspartato-aminotransferasa/alanina-aminotransferasa (AST/ALT) y la presencia o no de obesidad con/sin diabetes mellitus tipo 2.
Mortalidad
Muchas circunstancias pueden contribuir a la mortalidad en la HGNA. Es el caso de la coexistencia de obesidad y/o de diabetes y sus respectivas complicaciones y comorbilidades; de las dependientes de la propia hepatopatía, esto es, el desarrollo de insuficiencia hepatocelular, las complicaciones de la cirrosis (p. ej., la insuficiencia renal o la hemorragia por rotura de varices esofágicas), y el carcinoma hepatocelular. Sin embargo, se desconocen la incidencia exacta de esos posibles eventos y su contribución a la mortalidad.
En las series retrospectivas publicadas con anterioridad a 199910,11,64-67,129,130 se notificaron un total de 11 fallecimientos entre 299 pacientes (3,1%), lo que vendría a indicar una baja mortalidad en esta hepatopatía. Sin embargo, otras series han puesto en duda esa apreciación. Ya en 1995, en el estudio de una cohorte de 30 pacientes con EHNA seguidos durante más de 10 años y publicado en forma resumida22, la supervivencia a los 5 y 10 años fue de sólo el 67 y el 59%, respectivamente; aunque la mortalidad global no fue diferente de la de una población pareada por edad y sexo, sí lo fue la mortalidad relacionada con el hígado. Sin embargo, fue el grupo de Matteoni, en su serie de referencia publicada en 199970, el primero en señalar que la historia natural de la cirrosis grasa podría ser similar a la de otras causas de cirrosis. La mortalidad relacionada con la hepatopatía en pacientes con esteatosis y fibrosis en el momento del diagnóstico fue del 13% tras un seguimiento de 10 años, cifra que no es mejor que la de otras causas de cirrosis en situación compensada, como la alcohólica131. En un estudio japonés132, la relación entre las muertes observadas frente a las esperadas fue superior por cirrosis que por enfermedad cardiovascular entre diabéticos tipo 2. Ratziu et al107 han demostrado incluso que el hígado graso es un factor de riesgo independiente, pues la mortalidad acumulada a los 30 meses fue 5 a 6 veces más alta en pacientes obesos con cirrosis criptogenética que en otras causas identificadas de cirrosis, como por el virus C.
Así, aunque la mayoría de los pacientes con HGNA sin fibrosis en puentes o cirrosis tienen un riesgo muy bajo de fallecimiento en un seguimiento de 5 a 10 años, aquéllos con formas más avanzadas tienen una mortalidad por causa hepática similar a la de otras causas de cirrosis37,61. No obstante, todas las series citadas son retrospectivas, y de ahí la importante necesidad de estudios prospectivos sobre este aspecto. Tal es el caso del de Hui et al108 sobre 23 pacientes con cirrosis grasa, que se compararon con una cohorte de 46 con cirrosis por el virus C (no tratada o resistente a tratamiento antiviral), pareada por edad y sexo, y con un seguimiento medio de 84 meses. La probabilidad de supervivencia libre de morbilidad en pacientes con cirrosis grasa fue del 83, el 77 y el 48% al año, 3 y 10 años, respectivamente, mientras que la probabilidad de supervivencia fue del 95, el 90 y el 84%, respectivamente. Estos valores no difirieron de los obtenidos en pacientes con cirrosis por el virus C.
CONCLUSIONES
En el presente trabajo llevamos a cabo una revisión sobre el impacto clínico de la HGNA, entendido como la suma de prevalencia y pronóstico. La prevalencia en la población general no es bien conocida pero, por estudios con técnicas de imagen y encuestas epidemiológicas de salud sobre población general, autopsias de accidentados y de acuerdo con la Asociación Americana para el Estudio de las Enfermedades del Hígado, podemos establecerla en el 20 y el 2,5% para la esteatosis simple y la EHNA, respectivamente, en países desarrollados y al final del pasado siglo. Ello supone que en España unos 9 millones de individuos serían portadores de esta hepatopatía. Aunque ya hoy día se considera la causa más frecuente de hipertransaminasemia persistente y de cirrosis criptogenética, su diagnóstico va en aumento en paralelo al incremento en la población de otros componentes del síndrome metabólico, en especial de la obesidad. Además, su perfil demográfico se ha ampliado al afectar por igual a ambos sexos y a cualquier grupo de edad.
La historia natural tampoco está suficientemente definida. Si bien la esteatosis simple parece tener una evolución relativamente benigna, la EHNA es una hepatopatía de claro potencial progresivo, con una evolución y mortalidad semejantes a las de otras causas de enfermedad crónica del hígado. La progresividad depende, en particular, del estadio histológico en el momento del diagnóstico, y los factores predictivos de lesión avanzada mejor contrastados son la edad superior a 40 años y la coexistencia de obesidad y/o diabetes mellitus tipo 2. En términos generales, la esteatosis simple evoluciona a EHNA en el 28% de los casos a los 7 años, mientras que la EHNA lo hace a cirrosis en el 13% a los 5 años y en el 25% a los 10 años. De mayor relevancia es que el 1,7% de los pacientes con esteatosis simple y el 11% de aquéllos con EHNA, esto es, unas 250.000 personas en nuestro país, podrían fallecer por esta hepatopatía durante los próximos 10 años.