El tratamiento de la hepatitis crónica B antígeno e negativa (HCB HBeAg negativa) con antivíricos orales (AO) suele prolongarse de forma indefinida debido a que la pérdida del antígeno de superficie como objetivo para su suspensión es un hecho infrecuente. Recientemente han aparecido las primeras evidencias que sugieren finalizar la terapia con AO en casos seleccionados.
ObjetivosAnalizar la tasa de rebote virológico en pacientes con HCB Age negativa que suspendieron el tratamiento con AO.
Material y métodosEstudio retrospectivo observacional que incluyó 140 casos de HCB HBeAg negativa. Veintidós pacientes, que recibieron exclusivamente AO, los suspendieron por diversos motivos realizándose un seguimiento posterior. Todos presentaban transaminasas normales, ADN indetectable y ausencia de cirrosis o comorbilidades importantes al finalizar el tratamiento.
ResultadosDoce pacientes presentaron rebote virológico (54,54%), transcurriendo una media de 6,38 meses (±1,9) desde la suspensión hasta el rebote (el 75% dentro de los 12 primeros meses tras la suspensión). Cinco recibieron adefovir, uno lamivudina más adefovir, uno tenofovir y 5 lamivudina. La duración media del tratamiento, desde el inicio hasta la suspensión, fue de 38,5 meses (±4,5). El grupo con respuesta sostenida presentaba una edad media y duración del tratamiento superior a los sujetos con rebote, si bien estas diferencias no resultaron estadísticamente significativas.
ConclusionesLos resultados sugieren que es posible suspender la terapia con AO en casos seleccionados de HCB Age negativa, siempre que no exista cirrosis, se cumpla un tiempo mínimo de tratamiento, las transaminasas sean normales y el ADN indetectable de forma mantenida. En estos casos, se debe realizar un seguimiento estrecho durante el primer año y posteriormente de forma indefinida.
Treatment of HBeAg-negative chronic hepatitis B (CHB) with nucleos(t)ide analogues (NA) is usually indefinite, since the loss of HBsAg, as a criterion for its discontinuation, is a rare event. Recent evidence suggests that discontinuing NA therapy may be feasible in selected patients.
ObjectivesTo analyze the rate of virological relapse in patients with HBeAg-negative CHB who discontinued treatment with NAs.
MethodsWe performed a single-center observational study that included 140 patients with HBsAg-negative CHB. Twenty-two patients, who received only NAs, discontinued treatment for different reasons and were subsequently monitored. All had normal ALT and AST, undetectable DNA and absence of cirrhosis or significant comorbidities before stopping treatment.
ResultsTwelve patients showed virologic relapse (54.54%). The mean interval between discontinuation and relapse was 6.38 months (±1.9) (75% relapsed during the first 12 months after discontinuation). Five received adefovir, 1 lamivudine and adefovir, 1 tenofovir and 5 lamivudine alone. The mean treatment duration in this group was 38.5 months (±4.5). The sustained response group had a higher mean age and longer treatment duration than patients with virologic relapse but these differences were not statistically significant.
ConclusionsThe results suggest that NA treatment can be stopped in selected patients with CHB as long as they are not cirrhotic, have completed a minimum period of treatment, have normal ALT and sustained undetectable DNA. These patients should be closely monitored during the first year and then indefinitely.
El conocimiento de la historia natural de la hepatitis crónica B (HCB) y su respuesta al tratamiento evolucionan conforme aumenta la experiencia con los distintos fármacos antivirales. Las guías actuales de práctica clínica recomiendan el uso de tenofovir, entecavir o interferón en monoterapia como primera opción terapéutica1,2. Los antivirales orales (AO) son mejor tolerados que el interferón, presentando además una potente acción antiviral y bajas tasas de resistencia. No obstante, dado que la pérdida del antígeno de superficie (HBsAg) es un hecho infrecuente (sobre todo en los pacientes con HCB HBeAg negativa), en la mayoría de los casos el tratamiento se mantiene de forma indefinida.
Recientemente han aparecido las primeras evidencias que cuestionan la utilización a largo plazo de los AO en determinados grupos de pacientes3-7. Su elevado coste y la aparición de potenciales efectos adversos, hacen que la posibilidad de suspender el tratamiento cobre cada día mayor interés. No obstante, en la actualidad no existe información suficiente para establecer los requisitos mínimos necesarios para adoptar esta medida, por lo que sería conveniente disponer de mayor evidencia científica a este respecto.
El objetivo principal de nuestro trabajo es determinar la tasa de rebote virológico en los pacientes con HCB HBeAg negativa en los que por diversos motivos se suspendió el tratamiento con AO. Secundariamente se realizó un análisis comparativo de las características clínicas y la respuesta al tratamiento recibido en estos pacientes.
Material y métodosDiseño y población de estudioSe llevó a cabo un estudio observacional retrospectivo que incluyó 506 casos de HCB diagnosticados entre 1990 y junio de 2014. Todos los pacientes fueron valorados y seguidos en una consulta monográfica perteneciente al servicio de Gastroenterología del Hospital Ramón y Cajal de Madrid.
Ciento cuarenta pacientes con HCB HBeAg negativa fueron tratados con interferón o AO durante este periodo. Se excluyeron los casos de coinfección por el virus Delta, virus C y VIH, así como aquellos en los que el tratamiento se inició en el contexto de la administración de fármacos inmunosupresores o quimioterapia durante un periodo de tiempo limitado. Finalmente se analizó la evolución de 22 pacientes con HCB HBeAg negativa que recibieron exclusivamente AO, y en los que la terapia fue suspendida por diversas razones: deseo de gestación (2 casos), decisión propia (2 casos) o intolerancia a fármacos (2 casos: uno a lamivudina y posteriormente a adefovir, y otro a tenofovir) entre otros motivos.
En el momento de suspender la medicación, debían cumplirse los siguientes requisitos: transaminasas normales, ADN VHB indetectable y ausencia de datos de cirrosis o comorbilidades importantes. Además, los pacientes tenían que estar de acuerdo en realizar un seguimiento estrecho tras suspender el tratamiento y debían haber recibido AO durante al menos 3 años (este último requisito no se cumplió en los 2 casos de intolerancia a fármacos, ni en el de una paciente que lo suspendió al quedarse embarazada).
Se realizó un control periódico cada 4-6 meses, que incluía, entre otros parámetros, la determinación de transaminasas, ADN VHB y HBsAg.
VariablesSe analizaron variables demográficas (sexo, fecha de nacimiento y comorbilidades principales), clínicas (tratamientos recibidos, fecha de inicio y discontinuación, rebote virológico, parámetros analíticos, resultado de biopsia y elastografía) y virológicas (genotipo si estaba disponible, serología y carga viral).
Los marcadores del virus B: HBsAg, HBeAg y anticuerpos HBc, HBs, y HBe, se determinaron mediante inmunoanálisis automatizado (ELISA) AXSYM y posteriormente mediante Architect I-2000 (Abbott Diagnostics, Chicago, EE. UU.).
El ADN del VHB se cuantificó mediante PCR en tiempo real con un rango de sensibilidad de 0-170.000.000UI/Ml (Taqman, Roche Diagnostics, New Jersey, EE. UU.). El genotipo (A-H) y el estudio de mutaciones se llevó a cabo por hibridación reversa (INNO-LIPA HBV DR v2 y INNO-LIPA HBV DR v3, Innogenetics, N.V. Gante, Bélgica).
Análisis estadísticoSe realizó con el programa STATA versión 13. Las variables contínuas de distribución normal se representaron con la media±desviación estándar; en caso contrario, con la mediana y el rango. Las diferencias entre medias se analizaron con la prueba bilatearal de t-de Student o Mann-Withney según la distribución. Las variables categóricas se describieron mediante porcentajes, y las pruebas de significación se realizaron con el test de χ2 y exacto de Fisher.
Definiciones4Remisión virológica: descenso del ADN-VHB hasta valores indetectables o <2.000IU/mL (mediante PCR en tiempo real).
Rebote virológico: aumento del ADN viral superior a 2.000UI/mL o≥1Log 10 desde el nadir, en 2 determinaciones consecutivas separadas al menos 3 meses.
Respuesta sostenida: ADN VHB indetectable o<2.000IU/mL, y GPT inferior al límite alto de la normalidad (40U/L) hasta el final del seguimiento.
Rebote bioquímico: aumento de los niveles de GPT por encima de 1,2 veces el límite alto de la normalidad.
ResultadosEl grupo de estudio estaba compuesto por 22 pacientes, 14 de los cuales (63,63%) eran varones. La edad media en el momento de suspender el tratamiento fue de 47,09 años (±2,72).
Los fármacos prescritos inicialmente fueron lamivudina (13 pacientes, 59,10%), adefovir (8, 36,36%) y tenofovir (1, 4,55%). Más tarde se realizaron 8 cambios de tratamiento (7 pacientes) debidos en su mayoría a la aparición de resistencias: se añadió adefovir a lamivudina en 2 pacientes, se cambió lamivudina por adefovir en 4, y por tenofovir en 2. Nueve (40,9%) recibieron AO durante más de 4 años.
En el momento de su suspensión, 11 pacientes tomaban adefovir, 2 lamivudina más adefovir, 3 tenofovir y 6 lamivudina.
La mediana de duración del tratamiento desde su inicio hasta la suspensión fue de 46,5 meses (rango 5-108).
Las principales comorbilidades asociadas a la HCB fueron: hipotiroidismo, hipertensión arterial, diabetes mellitus, prolapso mitral, obesidad, colitis ulcerosa, hiperuricemia, epitelioma basocelular y glomerulopatía IgA.
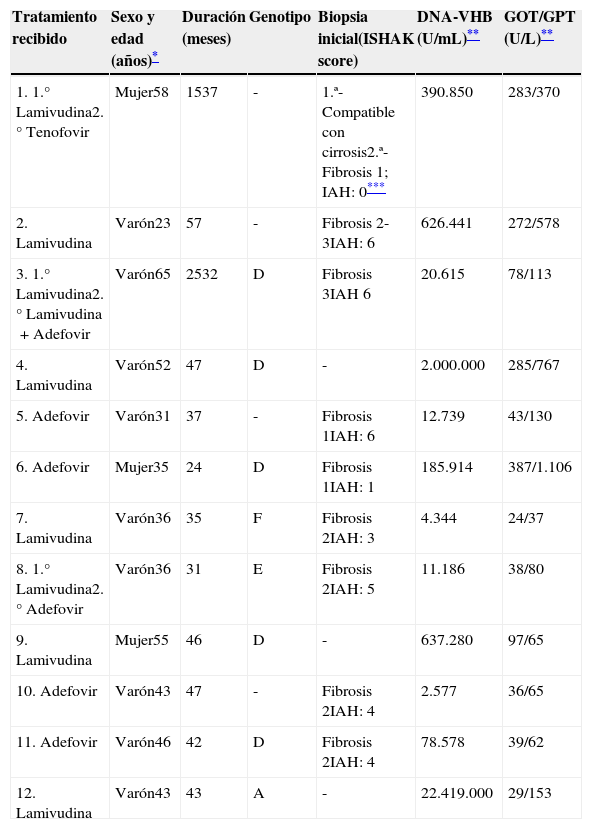
Grupo de pacientes que presentaron rebote virológico (tabla 1)En total, se objetivaron 12 casos de rebote virológico (54,54%), transcurriendo una media de 6,83 meses (±1,922) desde la suspensión hasta el rebote (rango 1-22 meses). El 75% lo hicieron durante los 12 primeros meses tras la suspensión y el 100% en los 2 primeros años.
Características de los pacientes que presentaron rebote virológico
| Tratamiento recibido | Sexo y edad (años)* | Duración (meses) | Genotipo | Biopsia inicial(ISHAK score) | DNA-VHB (U/mL)** | GOT/GPT (U/L)** |
|---|---|---|---|---|---|---|
| 1. 1.° Lamivudina2.° Tenofovir | Mujer58 | 1537 | - | 1.ª- Compatible con cirrosis2.ª- Fibrosis 1; IAH: 0*** | 390.850 | 283/370 |
| 2. Lamivudina | Varón23 | 57 | - | Fibrosis 2-3IAH: 6 | 626.441 | 272/578 |
| 3. 1.° Lamivudina2.° Lamivudina+Adefovir | Varón65 | 2532 | D | Fibrosis 3IAH 6 | 20.615 | 78/113 |
| 4. Lamivudina | Varón52 | 47 | D | - | 2.000.000 | 285/767 |
| 5. Adefovir | Varón31 | 37 | - | Fibrosis 1IAH: 6 | 12.739 | 43/130 |
| 6. Adefovir | Mujer35 | 24 | D | Fibrosis 1IAH: 1 | 185.914 | 387/1.106 |
| 7. Lamivudina | Varón36 | 35 | F | Fibrosis 2IAH: 3 | 4.344 | 24/37 |
| 8. 1.° Lamivudina2.° Adefovir | Varón36 | 31 | E | Fibrosis 2IAH: 5 | 11.186 | 38/80 |
| 9. Lamivudina | Mujer55 | 46 | D | - | 637.280 | 97/65 |
| 10. Adefovir | Varón43 | 47 | - | Fibrosis 2IAH: 4 | 2.577 | 36/65 |
| 11. Adefovir | Varón46 | 42 | D | Fibrosis 2IAH: 4 | 78.578 | 39/62 |
| 12. Lamivudina | Varón43 | 43 | A | - | 22.419.000 | 29/153 |
La duración media del tratamiento en este grupo fue de 38,5 meses (±4,5). Nueve eran hombres (75%) y la edad media resultó de 42,83 años (±3,5).
Tras la reactivación se inició tratamiento con tenofovir en 7 casos, entecavir en 2, y adefovir en 3. En estos últimos, se cambió posteriormente adefovir por tenofovir por seguridad. Todos los pacientes respondieron rápidamente a la reintroducción del fármaco y en ningún caso el rebote tuvo consecuencias clínicas (ictericia, coagulopatía ni otros datos de insuficiencia hepática).
Solo una de las biopsias hepáticas realizadas presentaba datos compatibles con cirrosis. Se trataba de una paciente que recibió tratamiento con lamivudina y posteriormente con tenofovir durante 3 años antes de decidir suspenderlo por voluntad propia. No obstante, otra biopsia realizada poco antes de la suspensión mostró únicamente fibrosis portal leve sin actividad citolítica significativa, y una elastografía reciente fue compatible con F0-F1 (3,5KPa). En este caso, el rebote virológico se produjo a los 4 meses de la suspensión y desde entonces recibe tratamiento con tenofovir.
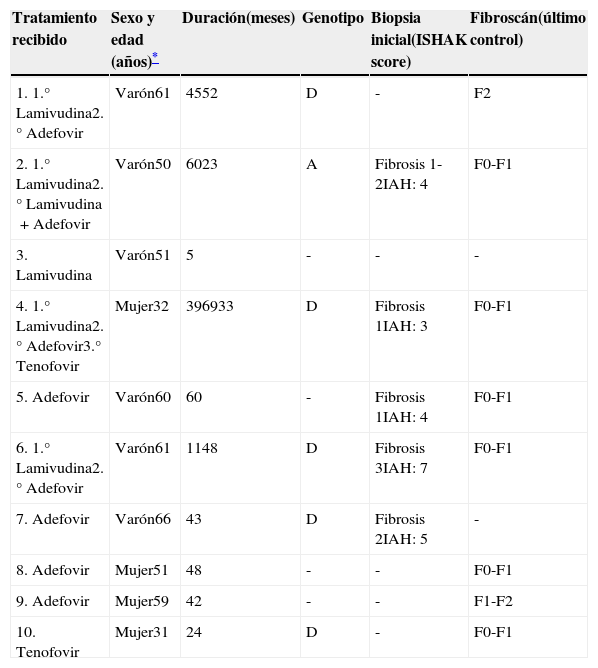
Grupo de pacientes con respuesta sostenida (tabla 2)Los 10 sujetos (45,5%) con respuesta sostenida, mantuvieron un ADN VHB indetectable o<2.000IU/mL y GPT inferior al límite alto de la normalidad (40U/L) hasta el final del seguimiento. No se objetivó en ningún caso la pérdida del HBsAg. En el último control, se realizó una elastografía a 8 de estos pacientes, mostrando 2 de ellos un grado de fibrosis compatible con F2 y el resto (80%) F0-F1.
Características de los pacientes con respuesta sostenida
| Tratamiento recibido | Sexo y edad (años)* | Duración(meses) | Genotipo | Biopsia inicial(ISHAK score) | Fibroscán(último control) |
|---|---|---|---|---|---|
| 1. 1.° Lamivudina2.° Adefovir | Varón61 | 4552 | D | - | F2 |
| 2. 1.° Lamivudina2.° Lamivudina+Adefovir | Varón50 | 6023 | A | Fibrosis 1-2IAH: 4 | F0-F1 |
| 3. Lamivudina | Varón51 | 5 | - | - | - |
| 4. 1.° Lamivudina2.° Adefovir3.° Tenofovir | Mujer32 | 396933 | D | Fibrosis 1IAH: 3 | F0-F1 |
| 5. Adefovir | Varón60 | 60 | - | Fibrosis 1IAH: 4 | F0-F1 |
| 6. 1.° Lamivudina2.° Adefovir | Varón61 | 1148 | D | Fibrosis 3IAH: 7 | F0-F1 |
| 7. Adefovir | Varón66 | 43 | D | Fibrosis 2IAH: 5 | - |
| 8. Adefovir | Mujer51 | 48 | - | - | F0-F1 |
| 9. Adefovir | Mujer59 | 42 | - | - | F1-F2 |
| 10. Tenofovir | Mujer31 | 24 | D | - | F0-F1 |
El tiempo medio de seguimiento tras la suspensión fue de 60 meses (±9,4) y durante el mismo fueron reevaluados de forma semestral o cuatrimestral (el 70% han sido seguidos durante más de 4 años desde la suspensión). La duración media del tratamiento en este grupo fue 56,9 meses (5-108).
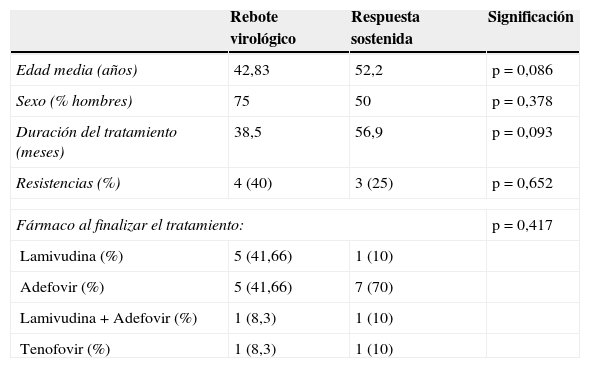
Aunque los pacientes con respuesta sostenida presentaban una edad media y un tiempo de tratamiento mayor que los sujetos con rebote virológico, las diferencias no resultaron estadísticamente significativas (tabla 3).
Análisis comparativo entre los grupos con y sin respuesta sostenida
| Rebote virológico | Respuesta sostenida | Significación | |
|---|---|---|---|
| Edad media (años) | 42,83 | 52,2 | p=0,086 |
| Sexo (% hombres) | 75 | 50 | p=0,378 |
| Duración del tratamiento (meses) | 38,5 | 56,9 | p=0,093 |
| Resistencias (%) | 4 (40) | 3 (25) | p=0,652 |
| Fármaco al finalizar el tratamiento: | p=0,417 | ||
| Lamivudina (%) | 5 (41,66) | 1 (10) | |
| Adefovir (%) | 5 (41,66) | 7 (70) | |
| Lamivudina+Adefovir (%) | 1 (8,3) | 1 (10) | |
| Tenofovir (%) | 1 (8,3) | 1 (10) | |
Uno de los pacientes tratado inicialmente con lamivudina recidivó a los 7 meses de suspenderla por iniciativa propia. Tras el rebote virológico se reinició de nuevo lamivudina y posteriormente se cambió a adefovir por aparición de resistencias. Tras 52 meses con adefovir se suspendió el tratamiento y actualmente se encuentra en remisión completa (respuesta sostenida).
DiscusiónEl objetivo del tratamiento en la HCB es la pérdida del antígeno de superficie, sin embargo este hecho es infrecuente, sobre todo en los pacientes con HCB HBeAg negativa (0,12-2,38% al año)8-9.
La pérdida del HBsAg mejora significativamente el pronóstico de los pacientes y disminuye además el riesgo de desarrollar carcinoma hepatocelular. No obstante este riesgo, aunque bajo, es superior al de la población no infectada10.
Las guías clínicas actuales establecen que la suspensión del tratamiento con AO es posible en los siguientes supuestos1,2,11,12:
- -
Pacientes HBeAg positivos que logran la seroconversión antie y tienen unos niveles de DNA indetectables 6 o 12 meses tras la seroconversión.
- -
Pacientes HBeAg positivos o HBeAg negativos que eliminan el antígeno de superficie.
En el resto de los casos, se recomienda continuar el tratamiento farmacológico de forma indefinida. Únicamente la Guía de la asociación Asia-Pacífico11 sugiere considerar la suspensión de los antivirales en pacientes HBeAg negativos que hayan sido tratados durante más de 2 años y mantengan unos niveles indetectables de ADN VHB en al menos 3 determinaciones consecutivas separadas 6 meses.
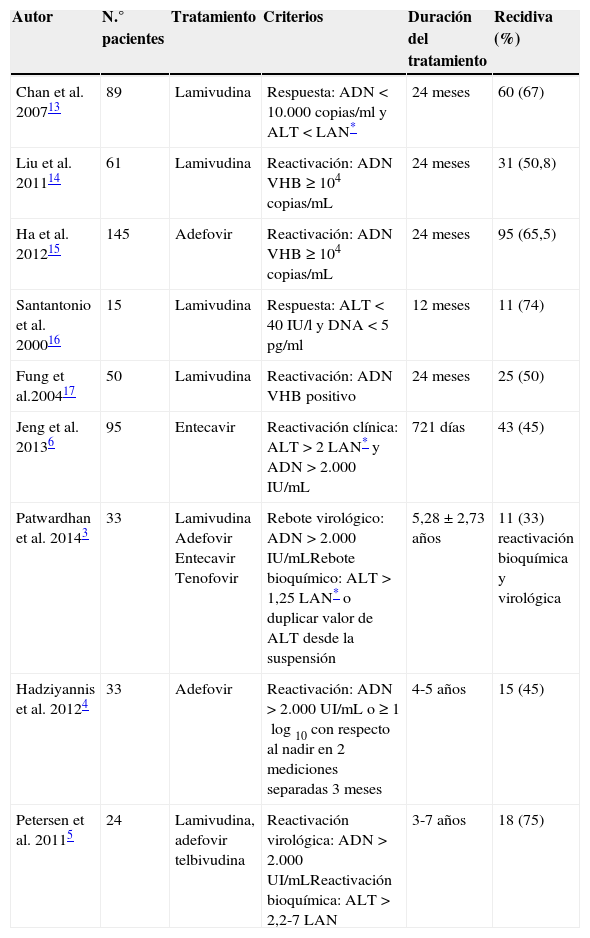
La evidencia científica disponible hasta la fecha es limitada en cuanto a los resultados a largo plazo de la suspensión de los AO en la HCB HBeAg negativa. No obstante, en los últimos años ha aumentado de forma significativa el número de estudios centrados en este tema3–6,13–17 (tabla 4). Hadziyannis et al. realizaron un estudio prospectivo observacional en el que siguieron durante 5,5 años a 33 pacientes HBeAg negativos que suspendieron el tratamiento con adefovir transcurridos 4-5 años desde su inicio. Todos presentaban transaminasas normales y ADN-VHB negativo. Durante los primeros meses, se produjo un rebote virológico en todos los casos y bioquímico en el 76%. No obstante, durante el seguimiento, 18 pacientes (55%) alcanzaron una respuesta viral sostenida (ADN-VHB<2.000IU/L y GPT persistentemente normal), y entre ellos, 13 (72,2%) eliminaron el antígeno de superficie3.
Resumen comparativo de los estudios realizados acerca de la suspensión del tratamiento en pacientes HBeAg negativos
| Autor | N.° pacientes | Tratamiento | Criterios | Duración del tratamiento | Recidiva (%) |
|---|---|---|---|---|---|
| Chan et al. 200713 | 89 | Lamivudina | Respuesta: ADN<10.000 copias/ml y ALT<LAN* | 24 meses | 60 (67) |
| Liu et al. 201114 | 61 | Lamivudina | Reactivación: ADN VHB≥104 copias/mL | 24 meses | 31 (50,8) |
| Ha et al. 201215 | 145 | Adefovir | Reactivación: ADN VHB≥104 copias/mL | 24 meses | 95 (65,5) |
| Santantonio et al. 200016 | 15 | Lamivudina | Respuesta: ALT<40IU/l y DNA<5pg/ml | 12 meses | 11 (74) |
| Fung et al.200417 | 50 | Lamivudina | Reactivación: ADN VHB positivo | 24 meses | 25 (50) |
| Jeng et al. 20136 | 95 | Entecavir | Reactivación clínica: ALT>2LAN* y ADN>2.000IU/mL | 721 días | 43 (45) |
| Patwardhan et al. 20143 | 33 | Lamivudina Adefovir Entecavir Tenofovir | Rebote virológico: ADN>2.000IU/mLRebote bioquímico: ALT>1,25 LAN* o duplicar valor de ALT desde la suspensión | 5,28±2,73 años | 11 (33) reactivación bioquímica y virológica |
| Hadziyannis et al. 20124 | 33 | Adefovir | Reactivación: ADN>2.000UI/mL o≥1log 10 con respecto al nadir en 2 mediciones separadas 3 meses | 4-5 años | 15 (45) |
| Petersen et al. 20115 | 24 | Lamivudina, adefovir telbivudina | Reactivación virológica: ADN>2.000UI/mLReactivación bioquímica: ALT>2,2-7LAN | 3-7 años | 18 (75) |
El trabajo más reciente ha sido presentado por Patwardhan et al.3 quienes durante 3 años siguieron a 33 pacientes que suspendieron el tratamiento con lamivudina, adefovir, entecavir y tenofovir (3, 14, 4 y 12 pacientes respectivamente). La duración media de la terapia antiviral fue de 5,28±2,73 años, y al finalizar el estudio se constató reactivación virológica (ADN VHB>2.000UI/L) en 21 casos (63%) y bioquímica (ALT>1,25 veces el límite normal o el doble del valor en el momento de suspender la medicación) en 16 (48%). Once pacientes (33%) cumplieron ambos requisitos (reactivación virológica y bioquímica) y 16 (48%) tuvieron que reiniciar el tratamiento.
La tabla 4 muestra cómo los porcentajes de reactivación varían entre el 33 y el 75% según los diversos autores, si bien los diferentes criterios de reactivación, el empleo de distintos antivirales y la duración variable del tratamiento, hacen que los estudios sean difícilmente comparables entre sí.
Nuestro trabajo muestra una tasa de rebote virológico dentro del rango estimado en otras publicaciones, si bien no se produjo la pérdida del HBsAg en ningún paciente. Este dato contrasta con los resultados obtenidos por Hadziyannis, quien muestra un porcentaje de pérdida de dicho antígeno del 39% con una duración y tiempo de seguimiento similares a los nuestros4. Chen et al.18 también objetivaron la pérdida del antígeno de superficie en el 30,3% de sus pacientes a los 6 años de la suspensión del tratamiento con lamivudina. No obstante, otros autores no han podido contrastar estas elevadas tasas de aclaramiento antigénico13, y por nuestra parte, no descartamos que con una mayor duración del seguimiento se produzca en nuestra cohorte algún caso de seroconversión del antígeno de superficie.
Los resultados que obtuvimos sugieren que el rebote virológico es más frecuente en los sujetos más jóvenes, con menor duración del tratamiento y mayores tasas de resistencias. No obstante, estos resultados no alcanzaron significación estadística, en parte debido probablemente al pequeño tamaño de la muestra analizada.
Tampoco encontramos diferencias significativas con respecto a los distintos fármacos utilizados, si bien el porcentaje de rebote virológico en los pacientes tratados con lamivudina fue superior al del resto.
Las principales limitaciones de nuestro estudio son las que se derivan de su diseño retrospectivo y del pequeño tamaño muestral. La utilización de diferentes AO (algunos no considerados de primera elección en la actualidad) y durante periodos de tiempo variables, limita también la generalización de los resultados. Por otra parte, hubiera sido interesante disponer de los valores del HBsAg a lo largo del seguimiento8,18-20. Este dato podría haber proporcionado información pronóstica relevante para decidir la conveniencia de interrumpir del tratamiento, si bien la mayoría de los pacientes incluidos fueron valorados en los años previos a la aparición de las primeras evidencias sobre el papel de la cuantificación del antígeno de superficie en la monitorización de la HCB21–25.
La posibilidad de suspender los AO en casos seleccionados de HCB HBeAg negativa, podría convertirse en realidad en los próximos años26. Desde nuestro punto de vista, estos pacientes deberían cumplir unos criterios estrictos de selección que incluyeran: duración mínima del tratamiento 3-5 años, transaminasas normales y DNA VHB indetectable de forma reiterada en varias determinaciones consecutivas, ausencia de cirrosis y de comorbilidades importantes (para evitar una mayor repercusión de la recidiva). Los pacientes deben comprometerse a realizar un seguimiento inicial estrecho para detectar precozmente el rebote (el 100% de las recidivas se produjeron durante los primeros 24 meses), e indefinido, ya que el riesgo de hepatocarcinoma con respecto a la población general sigue siendo mayor en estos casos.
No obstante, la evidencia disponible hasta la fecha, no permite establecer con exactitud el subgrupo de pacientes con mayores probabilidades de éxito. Es necesario, por tanto, disponer de más información procedente de ensayos clínicos aleatorizados y con mayor número de pacientes para determinar los factores predictivos de respuesta viral sostenida tras la suspensión del tratamiento.
Responsabiliades éticasConfidencialidad de los datosHemos seguido los protocolos de nuestro centro de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.