Los agentes antifactor de necrosis tumoral alfa (TNF-α) son efectivos en el tratamiento de la enfermedad inflamatoria intestinal. Su perfil de efectos adversos es bien conocido y son seguros, adecuadamente utilizados. En la práctica su riesgo más importante son las infecciones. Otras reacciones adversas son también posibles, pero mucho menos frecuentes. Sin embargo, la generalización del uso de estos agentes hace que sus efectos adversos menos frecuentes también puedan aparecer en la práctica clínica. Presentamos el caso de uno de ellos, la esclerosis múltiple, infrecuente pero muy relevante por sus consecuencias. Ante la aparición de síntomas neurológicos durante el tratamiento con un anti-TNF-α, es necesario descartar activamente un proceso desmielinizante. Su manejo diagnóstico y terapéutico, dirigido por el neurólogo con nuestra colaboración, obliga a suspender definitivamente los anti-TNF-α. La azatioprina, el interferón e incluso natalizumab serán las alternativas en aquellos casos que lo requieran.
Anti-tumor necrosis factor alpha (TNF-α) agents have been a great advantage in the treatment of inflammatory bowel disease. The safety profile of these agents is well-known and they can be considered safe when properly used. In clinical practice, the most important adverse events are infections. Other adverse effects are also possible but are much less frequent. However, because of the widespread use of these drugs, these uncommon adverse effects may also occur in clinical practice. We report one of these infrequent adverse events, multiple sclerosis, which is rare but important because of its severity. When neurological symptoms appear during treatment with anti-TNF-α, multiple sclerosis must be ruled out. The diagnosis and therapeutic management of this entity, led by a neurologist with our collaboration, required permanent cessation of anti-TNF-α therapy. Azathioprine, interferon, and even natalizumab, may be used as alternatives in patients who require therapy.
Los agentes antifactor de necrosis tumoral alfa (TNF-α) han supuesto sin duda un gran avance terapéutico en la enfermedad inflamatoria intestinal (EII). Aunque estos fármacos se utilizan especialmente ante la resistencia a la terapia habitual1, un uso más precoz en casos concretos está justificado. Llevamos utilizándolos más de una década (13 años en lo que se refiere a infliximab [IFX]), lo que nos permite afirmar que, utilizados adecuadamente, son seguros y con un perfil de efectos adversos bien conocido, a corto y a medio plazo2,3. Indudablemente los más importantes son las infecciones, por su especial gravedad y frecuencia, tanto oportunistas como no4,5. Conforme se utilizan más estos agentes, han ido apareciendo otros efectos adversos más infrecuentes como los cuadros lupus-like, el empeoramiento de la insuficiencia cardiaca preexistente o una enfermedad desmielinizante, entre otros. Presentamos el caso de una paciente con enfermedad de Crohn (EC), que tras 5 meses del inicio de tratamiento con IFX, fue diagnosticada de enfermedad desmielinizante del sistema nervioso central (SNC), tipo esclerosis múltiple (EM).
Observación clínicaSe trata de una paciente de 47 años de edad, sin antecedentes médico-quirúrgicos de interés, seguida en nuestra consulta monográfica por una EC diagnosticada hace 15 años, compleja, de localización ileocólica y de patrón inflamatorio. Inicialmente presentó un curso dependiente de corticoides y fue controlada con inmunosupresores tiopurínicos (azatioprina). Posteriormente, a pesar de utilizar dosis plenas de este fármaco, comenzó con un eritema nudoso como manifestación esencial, además de cierto aumento en el número de las deposiciones e incluso alguna rectorragia aislada, sin dolor abdominal. Analíticamente presentaba ferropenia, sin elevación de reactantes de fase aguda ni otras anomalías bioquímicas. Antes de tomar una decisión terapéutica decidimos practicar una colonoscopia que mostró lesiones importantes, con úlceras profundas en colon. Por ello, ante la demostración de enfermedad activa a pesar de azatioprina en dosis plenas, se decidió iniciar terapia biológica, concretamente IFX. Tras el estudio previo pertinente (incluía anamnesis que reflejaba ausencia de enfermedades neurológicas previas) se administraron 3 dosis de IFX de 5mg/kg en las semanas 0, 2 y 6, obteniendo una rápida mejoría subjetiva, encontrándose en remisión clínica a las 8 semanas y desaparecido el eritema nudoso. Una colonoscopia practicada en ese momento demostró respuesta mucosa, con cicatrización completa de las lesiones previas. El plan terapéutico fue mantener tratamiento combinado con IFX y azatioprina durante unos meses, para retirar posteriormente esta última.
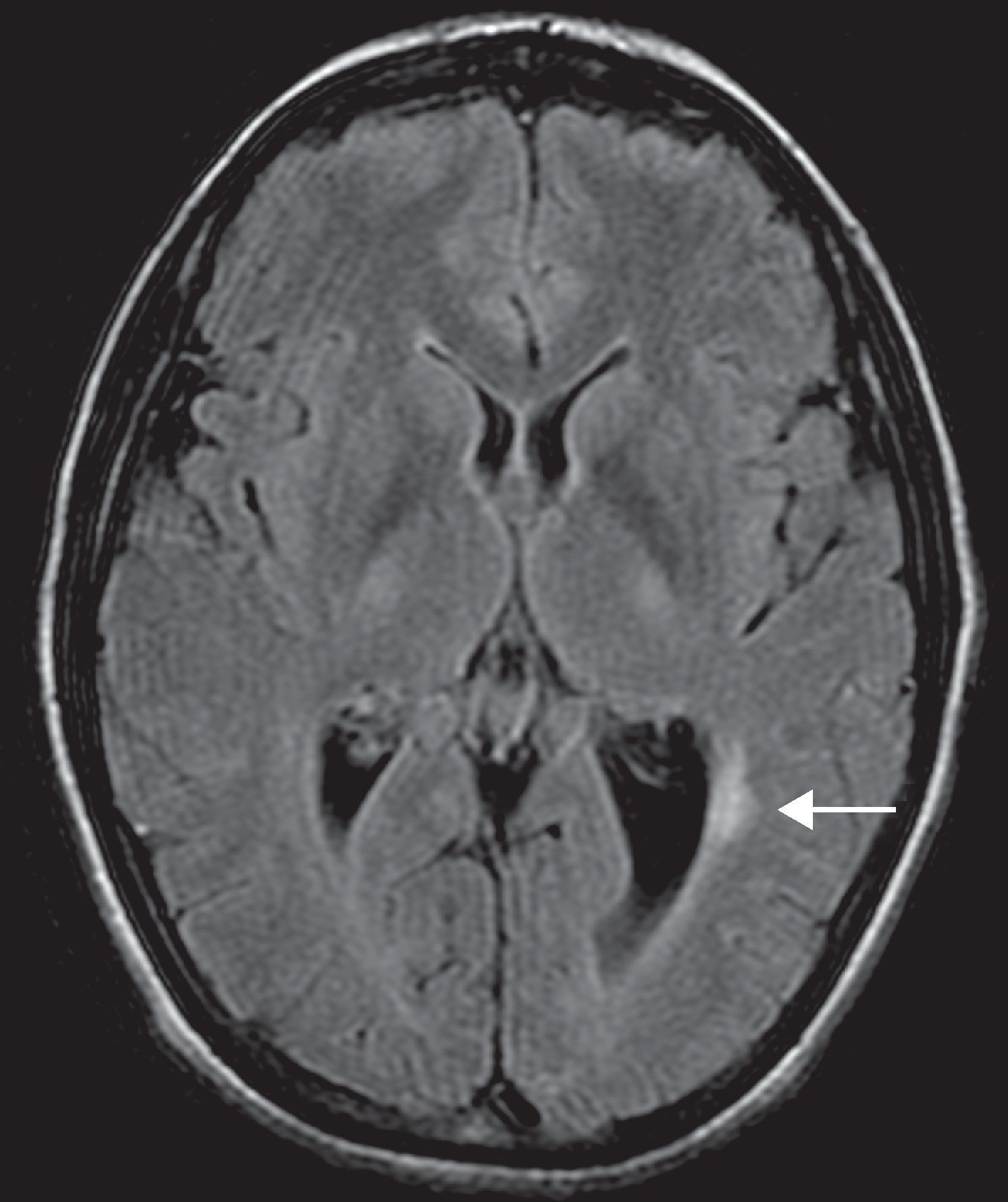
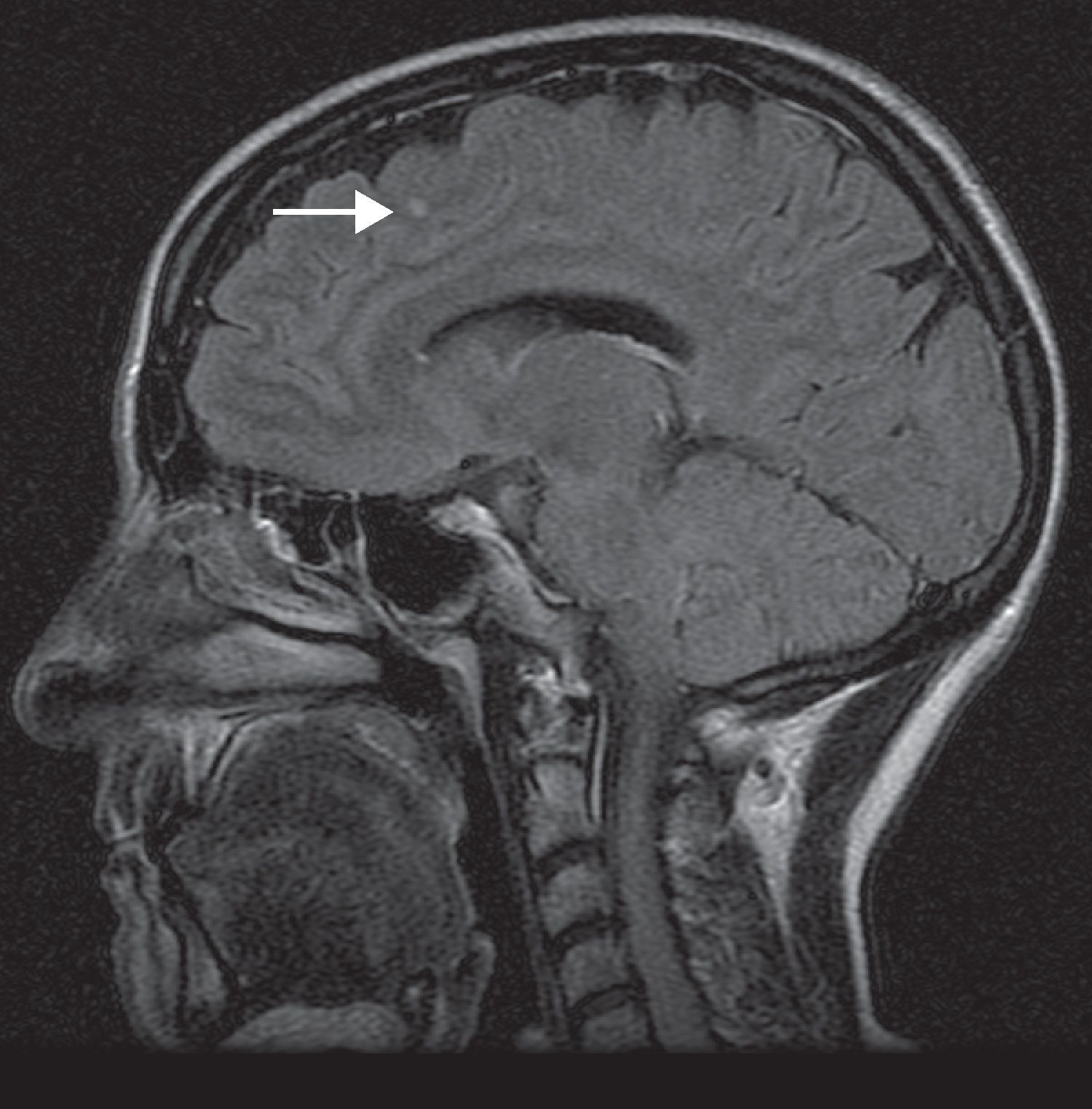
Después de la cuarta infusión de IFX, a los 5 meses de iniciado el tratamiento, presentó un episodio de hipoestesia braquiocervical izquierda, fosfenos y dudosa afectación de la agudeza visual, sin dolor ocular, ni cefalea que duró varias semanas. No presentó fiebre ni otros síntomas. Nunca antes había presentado sintomatología similar. Acudió a urgencias, desde donde se envió a consultas de traumatología, donde se solicitó una resonancia magnética (RM) cervical. Dicha exploración mostró protrusión discal en C5-C6 y C6-C7, sin afectación medular, a lo que se atribuyeron los síntomas. Valorada entonces en nuestra consulta consideramos ya otras alternativas diagnósticas, aunque el diagnóstico establecido por traumatología parecía razonable. Teniendo en cuenta además que la paciente se encontraba asintomática en ese momento, y con una excelente respuesta a IFX, se decidió mantener una actitud expectante, con vigilancia activa, pero manteniendo el tratamiento. Tras la séptima dosis, casi 12 meses de iniciado el tratamiento con IFX, presentó parálisis e hipoestesia de hemifacies derecha, acudiendo nuevamente a urgencias, donde fue interpretada como parálisis facial periférica. Desde ese momento decidimos suspender el tratamiento con IFX, solicitamos una RM cerebral y valoración por neurología, para descartar una enfermedad desmielinizante. La exploración más detallada realizada por neurología puso de manifiesto una hipoestesia parcheada en hemifacies derecha y en extremidad superior izquierda. La RM mostró 6-7 lesiones hiperintensas en sustancia blanca, una de ellas periventricular y el resto subcorticales (figs. 1 y 2). El neurólogo amplió el estudio mediante unos potenciales provocados y finalmente una punción lumbar para análisis del líquido cefalorraquídeo (LCR). Los potenciales provocados mostraron un leve aumento de la latencia bilateral, con amplitud normal, compatible con neuropatía óptica desmielinizante. En el LCR aparecieron bandas oligoclonales positivas y un índice de IgG de 0,81 (compatible con el diagnóstico de EM). Se realizó también una serología de virus JC en sangre y PCR del virus en LCR, ambas negativas. Ante la clínica y los hallazgos en las pruebas complementarias se estableció el diagnóstico de enfermedad desmielinizante tipo EM, con curso remitente recurrente. Suspendimos definitivamente el tratamiento con IFX, así como contraindicamos el uso de cualquier otro agente anti TNF-α. De forma consensuada con neurología mantuvimos el tratamiento con azatioprina, como terapia para su EM (y para su EC, la que había controlado previamente, al menos durante unos años). En el momento actual, 13 meses después de la suspensión de IFX, la paciente no presenta síntomas neurológicos, aunque sí nuevamente cierto aumento en el número de sus deposiciones y ocasionales molestias abdominales.
El perfil de seguridad del tratamiento con agentes anti-TNF-α en la EII está bien establecido, a partir de los ensayos clave que llevaron a su aprobación6,7 y de los datos poscomercialización, procedentes de series de centros con experiencia8, estudios de registro9, casos aislados publicados e incluso del uso de estos agentes en enfermedades reumatológicas. Sin duda, sus efectos secundarios más frecuentes son mejor conocidos y los que más tenemos en cuenta en la práctica. En este sentido, antes de hablar del efecto adverso acontecido en nuestra paciente, queremos recalcar que cuando un enfermo en tratamiento con terapia anti-TNF-α presenta un efecto secundario, debemos tener siempre presentes las infecciones. Esto es así por su frecuencia y especial gravedad. Sin embargo, además de las infecciones, también son posibles y potencialmente graves otros efectos adversos. De hecho, el empleo cada día más frecuente de estas terapias hace que podamos enfrentarnos también a sus efectos secundarios infrecuentes. En el caso que nos ocupa se trata de uno de ellos: una enfermedad desmielinizante del SNC. Recordemos también que los pacientes con EII pueden presentar ocasionalmente síntomas neurológicos en absoluto relacionados con sus tratamientos, esencialmente neuropatía por déficit de vitamina B12 o un cierto incremento del riesgo de eventos vasculares, asociado a procesos inflamatorios crónicos10. Además, algunos estudios indican una mayor incidencia de EM en la EII, tanto en pacientes sin tratamiento como con terapias no biológicas11.
En las enfermedades desmielinizantes existe un proceso patológico dirigido contra la mielina, proteína presente en los axones, tanto del SNC como periférico. La más frecuente y conocida es sin duda la EM. Suele aparecer en adultos jóvenes y puede seguir distintos cursos evolutivos12; lo más habitual es en forma de brotes (déficit neurológicos con recuperación espontánea, pero sin deterioro neurológico (curso remitente recurrente). Con el tiempo, a medida que la enfermedad avanza, se suele observar un deterioro neurológico entre cada brote (curso secundariamente progresivo), en muchas ocasiones con deterioro funcional. Otros cursos menos frecuentes son el primariamente progresivo y el progresivo recurrente, ambos con pronóstico sombrío. La inflamación en la EM puede afectar a cualquier parte del encéfalo, lo que hace que la sintomatología de aparición sea muy variada13. El síntoma de comienzo más habitual es la alteración sensitiva (45%), consistente en parestesias o acorchamiento de uno o más miembros, o del tronco, indicativo de afectación del haz espinotalámico y sensación de banda constrictiva en tronco o miembros, por afectación de los cordones posteriores. La alteración motora también es frecuente (40%), caracterizada por pérdida de fuerza o fatiga, evidenciando en la exploración paresias o plejias, hiperreflexia tendinosa y signo de Babinski. Los signos producidos por disfunción troncoencefálica, como disartria, diplopía, disfagia o vértigo, son menos frecuentes (25%), al igual que las alteraciones visuales14, también características pero algo más infrecuentes (20%) como primer síntoma. El cerebelo se afecta inicialmente con menos frecuencia pero en la evolución da manifestaciones hasta en el 75% de los pacientes. Otras alteraciones son la disfunción esfinteriana y el deterioro cognitivo. En lo referido a los tratamientos para la EM podríamos clasificarlos como de base inmunológica, sintomático y rehabilitador. Entre los primeros incluimos el tratamiento del brote agudo, inicialmente con corticoterapia intravenosa u oral y de rescate con plasmaféresis para brotes graves, y el tratamiento modificador de la historia natural o de fondo, con un escalado terapéutico que incluye fármacos de primera línea (interferón beta, acetato glatiramero y con menor grado de evidencia azatioprina), y fármacos de segunda línea (natalizumab, mitoxantrona y más recientemente fingolimod, primer fármaco oral aprobado para esta enfermedad). El natalizumab está también autorizado como tratamiento de primera elección en casos de EM remitente recurrente de evolución rápida y agresiva.
Se han publicado varias EM en pacientes tratados con agentes anti-TNF-α. Así, en los ensayos clínicos se comunicaron los primeros casos. Posteriormente han aparecido algunos más durante el uso en la práctica clínica, tanto en EII como en enfermedad reumática, y tanto con IFX como con otros anti-TNF-α15,16. No obstante, como podemos ver, el riesgo de aparición de EM, complicación de la terapia anti-TNF-α es muy bajo. Además, es necesario recordar que la EM puede aparecer sin relación con el tratamiento con estos fármacos, tanto en la población general como quizá algo más frecuentemente en la EII, por lo que la relación causal o como desencadenante no es definitiva. No obstante, su preexistencia en un paciente se acepta como contraindicación absoluta para su uso. La patogenia de la enfermedad es mal conocida, compleja y quizá incluso variable en las fases temprana y tardía (la inmunidad celular predominaría en la fase remitente-recurrente y la humoral en la secundaria progresiva). Podría estar implicado el TNF-α como producto potencialmente tóxico producido por los macrófagos/microglía estimulados (junto con el óxido nítrico, los radicales libres y las proteincinasas), ejerciendo algún papel en la desmielinización actuando directamente contra la mielina o contra los oligodendrocitos. Por este motivo, en los años 1990 se intentó tratar la EM de curso primariamente progresivo con agentes anti-TNF-α, objetivando paradójicamente un empeoramiento clínico y radiológico que obligó a suspender la terapia17,18. En el caso que presentamos, se trata de una EM tipo remitente recurrente, con 2 brotes sensitivos que no requirieron tratamiento. Como terapia de fondo, se decidió conjuntamente con neurología continuar con azatioprina19. Si la EM no se controlara o la EC se reactivara a pesar del uso de azatioprina, deberíamos considerar el uso de natalizumab. Este anticuerpo monoclonal bloquea las integrinas α4, moléculas de adhesión que se expresan en la superficie linfocitaria, impidiendo la migración de los linfocitos desde la sangre periférica hacia el órgano de actuación, en este caso el SNC. Varios ensayos clínicos han demostrado su eficacia en la EM20,21, pero la aparición inesperada de un efecto adverso cerebral muy grave y sin tratamiento, denominado leucoencefalopatía multifocal progresiva (LMP), obligó a paralizar temporalmente su comercialización (actualmente aprobado solo para casos muy concretos de EM). La LMP está causada por la reactivación del virus JC (poliomavirus humano), ampliamente distribuido en la población sana de forma latente y que natalizumab puede reactivar22. El riesgo de presentar LMP se ha estratificado de acuerdo con algunos factores (entre ellos la serología previa a virus JC) y podría servir para individualizar algunas decisiones terapéuticas23. Natalizumab también ha demostrado su eficacia en la EC y parece que lo es en la inducción de la remisión y en el tratamiento de mantenimiento tras la pérdida de respuesta o intolerancia al IFX24,25. En nuestra paciente, la serología del virus JC fue negativa, lo que haría más seguro el uso de este fármaco.
Resumiendo, la aparición de síntomas neurológicos en pacientes tratados con agentes anti-TNF-α, a veces difíciles de interpretar, obliga a considerar la posibilidad de una enfermedad desmielinizante. La sospecha clínica es esencial y debe ser seguida de una rápida consulta con el neurólogo. Si se confirma el diagnóstico, el tratamiento anti-TNF-α debe ser suspendido y contraindicado el uso de cualquier otro agente del grupo, dado que se trata de un efecto adverso «de clase». El tratamiento, dirigido por neurología, probablemente incluirá como primera línea azatioprina en este escenario concreto. Si no resulta eficaz, bien para el control de su EM o de su EC, habrá que valorar el uso de natalizumab, agente eficaz en ambas enfermedades.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.