se discute la necesidad de efectuar sistemáticamente una segunda gastroscopia de control tras el diagnóstico inicial de una úlcera gástrica benigna.
Métodorevisamos 226 casos consecutivos de úlcera gástrica. Analizamos la sensibilidad (S), la especificidad (E), el valor predictivo positivo y negativo (VPP, VPN) y la precisión de la primera exploración: gastroscopia con biopsias, de modo global y según la experiencia del primer explorador (médico de plantilla o MIR). Comparamos la precisión diagnóstica entre la primera y la segunda endoscopia. Calculamos el número necesario de segundas exploraciones (NNE) para diagnosticar un nuevo caso de úlcera maligna y su coste, tanto global como según la experiencia del explorador.
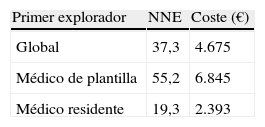
Resultadosregistramos 178 (79%) úlceras benignas y 48 (21%) malignas. La primera exploración fue efectuada por un médico de plantilla (74%) y MIR (26%): S 87,2%, E 100%, VPP 100%, VPN 96,7% y precisión 96,7%. La precisión del médico de plantilla fue superior (98,2%) a la del MIR (94,8%) (p=0,18). La segunda exploración de control tuvo una precisión del 100%, mejorando significativamente a la primera (p=0,035) y diagnosticando 3 nuevos linfomas MALT y 3 carcinomas tratados con intención curativa. El NNE y el coste de un nuevo diagnóstico de lesión maligna fueron los siguientes: global, 37,3 (4.675 euros); médico de plantilla, 55,2 (6.845 euros), y MIR, 19,3 (2.393 euros).
Conclusionesla primera exploración obtuvo una elevada precisión diagnóstica, ligeramente menor para los MIR. La segunda endoscopia de control mejora significativamente los resultados, confirmando su beneficio clínico al diagnosticar lesiones malignas potencialmente curables. El coste medio de cada nuevo diagnóstico de malignidad ascendió a 4.675 euros, siendo 3 veces inferior si la primera exploración la efectúa un médico con menos experiencia.
We analyzed the need to routinely perform a second gastroscopy after an initial diagnosis of benign gastric ulcer.
MethodA total of 226 consecutive cases of gastric ulcer were reviewed. Sensitivity (S), specificity (Sp), positive and negative predictive value (PPV and NPV) and the accuracy of the initial gastroscopy plus biopsy were analyzed, both overall and according to the initial endoscopist's experience (attending or resident physician). The diagnostic accuracy of the initial and second-look gastroscopies was compared. The number of second endoscopies required to diagnose a new case of malignant gastric ulcer and their cost was calculated, both overall and according to the endoscopist's experience.
ResultsThere were 178 benign ulcers (79%) and 48 malignant ulcers (21%). The initial gastroscopy (S: 87.2%; Sp: 100%; PPV: 100%; PNV: 96.7%; accuracy: 96.7%) was performed by an attending physician in 74% of the patients and by a resident physician in the remaining 26%. Diagnostic accuracy was higher for attending physicians than for residents (98.2% vs. 94.8%; p=0.18). The accuracy of second-look endoscopy was 100%, with a significant improvement when compared with the initial procedure (p=0.035). Three new cases of MALT lymphoma and three new cases of gastric adenocarcinoma were diagnosed and could be treated with curative intent. The number of second gastroscopies required to diagnose a new case of malignant gastric ulcer and their economic cost was: 37.3 (4,675 Euros) for the whole group, 55.2 (6,845 Euros) for attending physicians and 19.3 (2,393 Euros) for residents.
ConclusionsInitial gastroscopy showed high diagnostic accuracy, which was slightly lower when performed by resident physicians. Second-look gastroscopy significantly improved the results, confirming the clinical benefit of this procedure in diagnosing potentially curable malignant lesions. The mean cost of each new diagnosis of malignancy was 4,675 Euros, which was three times lower if the initial gastroscopy was performed by a less experienced endoscopist.
Las úlceras gástricas son mayoritariamente de etiología péptica, y se producen como consecuencia del desequilibrio entre factores protectores y agresivos sobre la mucosa del estómago1. Sus causas más frecuentes son la infección por Helicobacter pylori y la toma de fármacos gastrolesivos como los antiinflamatorios no esteroideos (AINE)2–7.
El cáncer gástrico puede presentarse macroscópicamente como una lesión polipoide, ulcerada, crateriforme o infiltrativa. Un 40–50% de las neoplasias gástricas tienen un mayor o menor grado de ulceración, que abarca desde el tumor ulcerado hasta una úlcera muy semejante a la lesión péptica. Esta lesión ulcerada maligna puede constituir la forma de presentación del cáncer precoz8. Igualmente, los linfomas gástricos pueden producir lesiones ulceradas gástricas, únicas o múltiples9.
La endoscopia es la técnica de elección para el diagnostico de las úlceras gástricas, y es más sensible y específica que la radiología8. Además, permite la realización de biopsias y citologías, así como la aplicación, si fuera necesario, de procedimientos terapéuticos en el caso de lesiones sangrantes. Aunque se han descrito rasgos endoscópicos que orientan hacia la benignidad o malignidad de la lesión, es obligado que en toda úlcera gástrica se tomen biopsias múltiples para efectuar un estudio histológico que defina su naturaleza.
Ante la posibilidad de que una ulceración gástrica pueda corresponder a una lesión tanto benigna como maligna, es necesario aplicar una metodología de estudio que nos asegure el diagnóstico y por tanto el tratamiento más adecuado en cada caso.
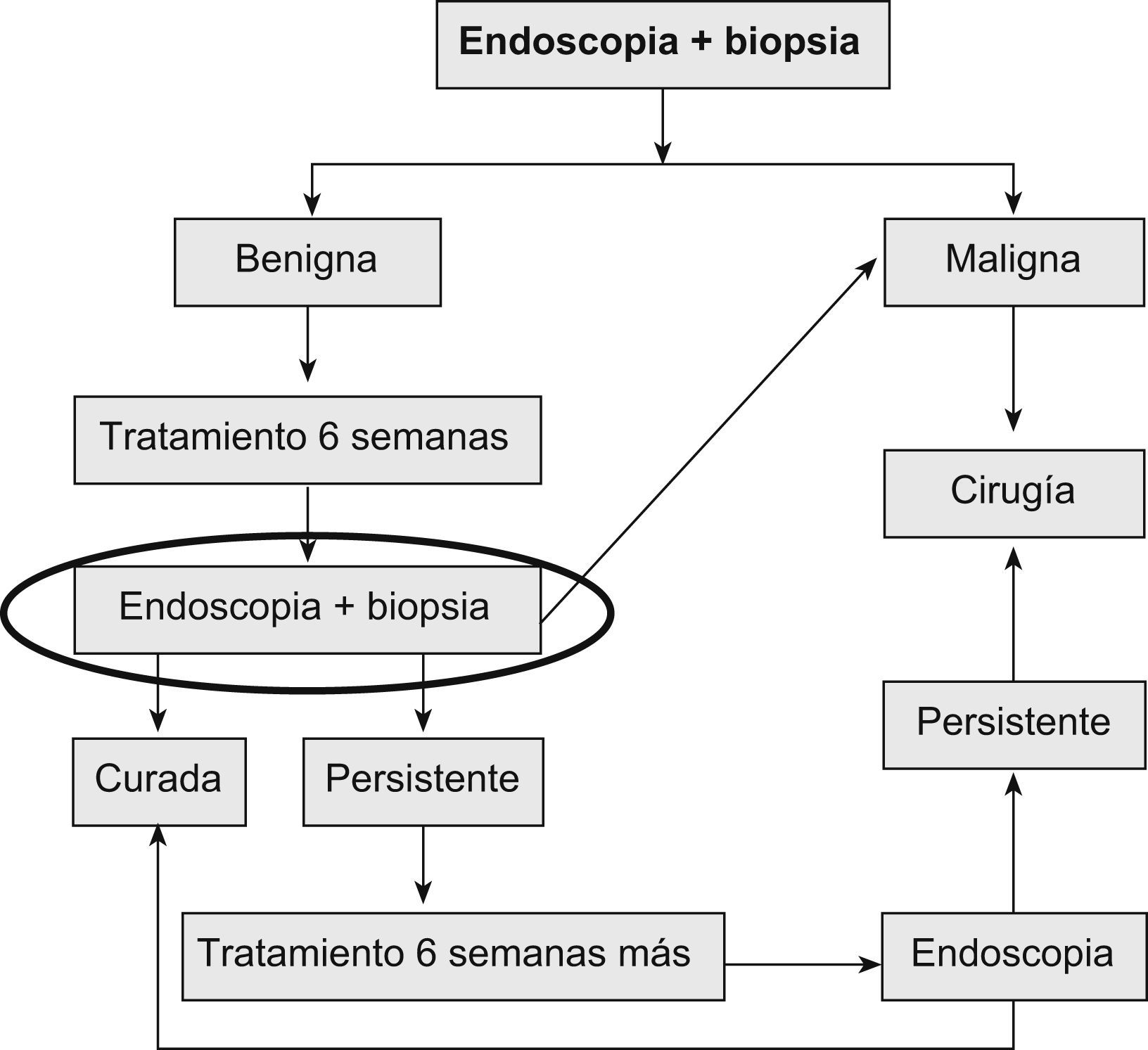
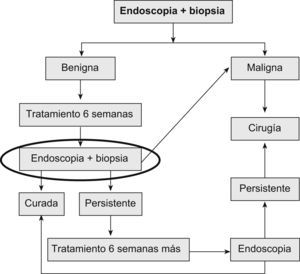
El algoritmo que se ha aconsejado desde 1988 en las Guías de Práctica Clínica de la Asociación Americana de Endoscopia10 para el diagnóstico y el seguimiento de las úlceras gástricas se representa en la figura 1.
En la última década se ha llegado a cuestionar la necesidad de repetir sistemáticamente la endoscopia en las úlceras gástricas aparentemente benignas11, abriéndose un debate sobre su utilidad. En la revisión bibliográfica efectuada, son escasos los trabajos dirigidos a cuantificar el beneficio clínico que supone la práctica sistemática de una segunda gastroscopia en el control evolutivo11–17. Tampoco disponemos de datos referentes a la influencia que pueda ejercer sobre los resultados el grado de experiencia del primer explorador que efectuó la endoscopia, ni su repercusión en términos de coste/efectividad. Por todo ello, hemos querido revisar el rendimiento diagnóstico de la primera gastroscopia con toma de biopsias para el diagnóstico de la úlcera gástrica maligna, de modo global y dependiendo de la experiencia del explorador. Adicionalmente, pretendemos analizar la mejoría de la precisión diagnóstica, en cuanto a la benignidad o malignidad, que se obtiene al realizar una segunda exploración endoscópica con toma de biopsias, para valorar la necesidad de llevarla a cabo de manera sistemática, efectuando un estudio de coste-efectividad de cada nuevo diagnóstico de úlcera maligna obtenido mediante la práctica sistemática de una segunda gastroscopia de control.
Material y métodosEstudiamos retrospectivamente 226 pacientes diagnosticados de modo consecutivo, mediante gastroscopia y biopsias, de úlcera gástrica en nuestro servicio de aparato digestivo, en el período comprendido entre enero de 2001 y diciembre de 2006. Se excluyeron los tumores gástricos ulcerados y las úlceras del canal pilórico.
En los casos considerados como úlcera maligna tras la primera exploración, este diagnóstico se confirmó mediante el estudio de la pieza quirúrgica y/o el control evolutivo posterior del paciente con seguimiento clínico y de las pruebas de imagen. Las úlceras diagnosticadas inicialmente como benignas fueron sometidas a una segunda gastroscopia de control para confirmar su cicatrización. En el caso de constatarse una lesión residual (persistencia de la úlcera o imagen de cicatriz o confluencia de pliegues), se procedió a tomar unas segundas biopsias para su estudio anatomopatológico.
Los diagnósticos positivos o negativos de malignidad tras la primera gastroscopia con toma de biopsias se compararon con el diagnóstico final, calculando la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión diagnóstica, con sus intervalos de confianza (IC) del 95%. Se ha estudiado el rendimiento diagnóstico global de nuestra serie y dividido según la experiencia del primer explorador: MIR o médico de plantilla.
Finalmente, analizamos el rendimiento diagnóstico de la segunda exploración de control, efectuada en las úlceras consideradas inicialmente como benignas, comparando sus resultados con el diagnóstico definitivo.
Calculamos el número necesario de segundas exploraciones (NNE) para poder diagnosticar un caso adicional de úlcera maligna. Empleamos la fórmula: NNE=1/RAR (reducción absoluta del riesgo). El NNE se determinó de modo global y según la experiencia del explorador en la primera gastroscopia.
Una vez calculado el NNE, se ha estimado el coste del diagnóstico de un nuevo caso de úlcera maligna (Coste=NNE×importe de la segunda exploración). El importe económico de la segunda exploración se ha fijado según el actual contrato-programa establecido entre el servicio de salud de nuestra comunidad autónoma y el hospital: gastroscopia con toma de biopsias=124 euros.
Para el estudio estadístico se utilizaron los tests de la U de Mann-Whitney, de la χ2 y de Fisher, determinando la odds ratio (OR), y el IC del 95%. Se consideraron significativos unos valores de p<0,05.
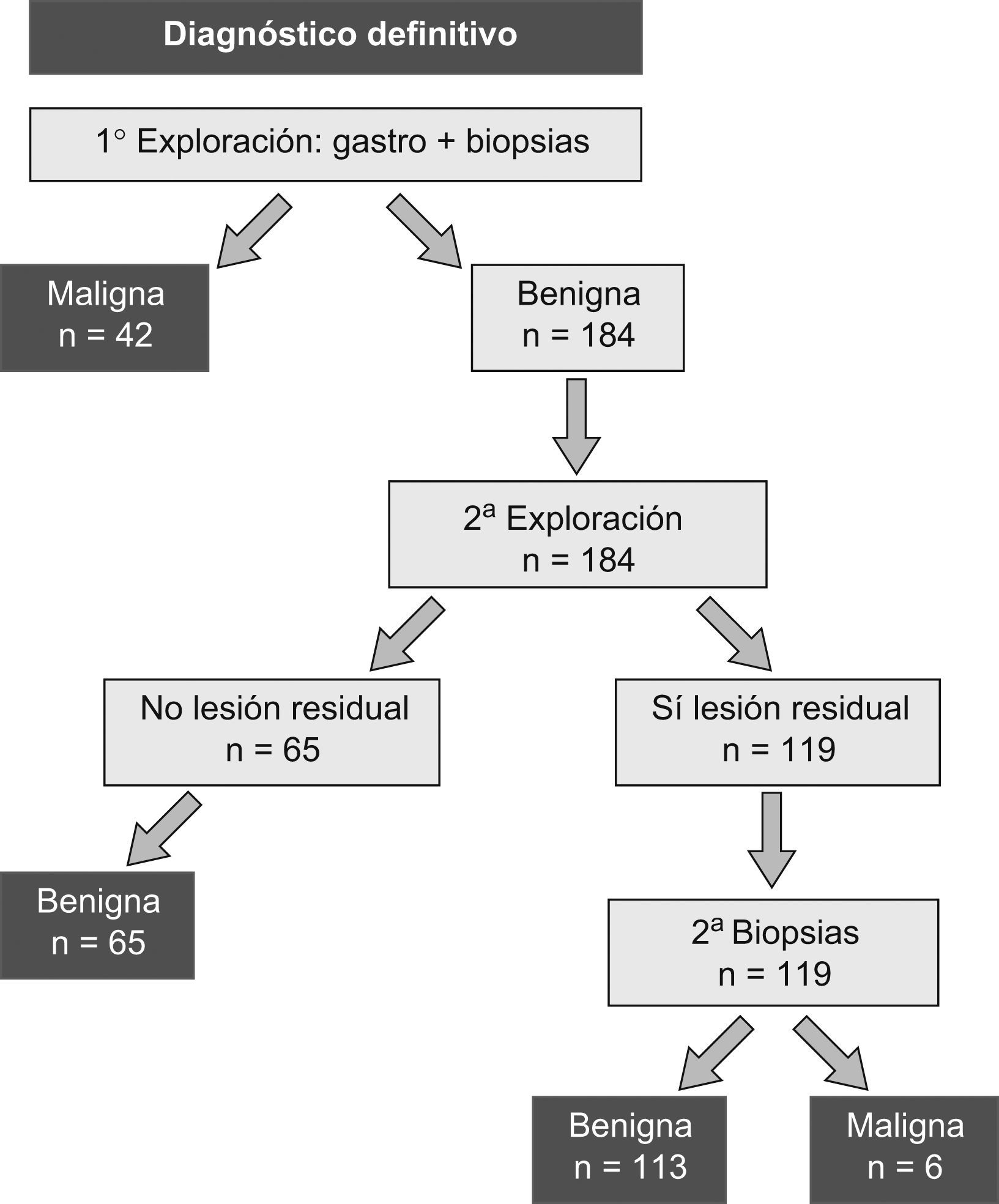
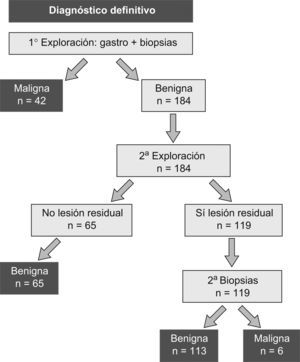
ResultadosAnalizando los resultados con respecto al diagnostico final, 178/226 (78,76%) de las úlceras fueron benignas y 48/226 (21,23%) correspondieron finalmente a lesiones malignas (fig. 2). Los casos de malignidad se clasificaron histológicamente en 33/48 (68,75%) carcinomas, y 15/48 (31,25%) linfomas. Entre los linfomas registramos 14/15 (29,16%) casos de linfoma MALT y un linfoma no hodgkiniano de células B, de alto grado (2,08%).
En el global de nuestra serie, la primera gastroscopia fue efectuada por un médico de plantilla en 167/226 casos (73,9%) y en 59 (26,1%) por un médico residente.
El diagnóstico obtenido tras la primera gastroscopia con toma de biopsias de la úlcera coincidió con el definitivo en 218/224 casos, registrándose 6 falsos negativos de malignidad, sin falsos positivos (tabla 1).
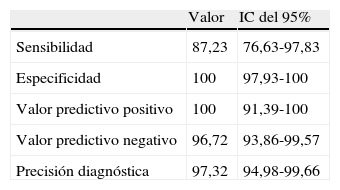
En la tabla 2 se representan los datos de sensibilidad, especificidad, valor predictivo positivo y negativo y precisión diagnóstica de la primera exploración.
Rendimiento diagnóstico global de la gastroscopia con toma de biopsias
| Valor | IC del 95% | |
| Sensibilidad | 87,23 | 76,63-97,83 |
| Especificidad | 100 | 97,93-100 |
| Valor predictivo positivo | 100 | 91,39-100 |
| Valor predictivo negativo | 96,72 | 93,86-99,57 |
| Precisión diagnóstica | 97,32 | 94,98-99,66 |
IC: intervalo de confianza.
Al comparar la precisión diagnóstica de la primera exploración según la experiencia del endoscopista, observamos que la precisión obtenida por los médicos de plantilla (98,19; IC del 95%, 94,81-99,63) fue ligeramente superior a la de los MIR (94,83; IC del 95%, 85,83-98,92), sin alcanzarse significación estadística entre ambas (p=0,18).
La segunda exploración de control después del tratamiento (gastroscopia con toma de biopsias si se apreciaba lesión residual), se realizó tras un período medio de 67,9±22,8 días. La totalidad de los resultados obtenidos en esta segunda exploración han sido correctos, sin registrarse falsos positivos ni falsos negativos de malignidad (tabla 3).
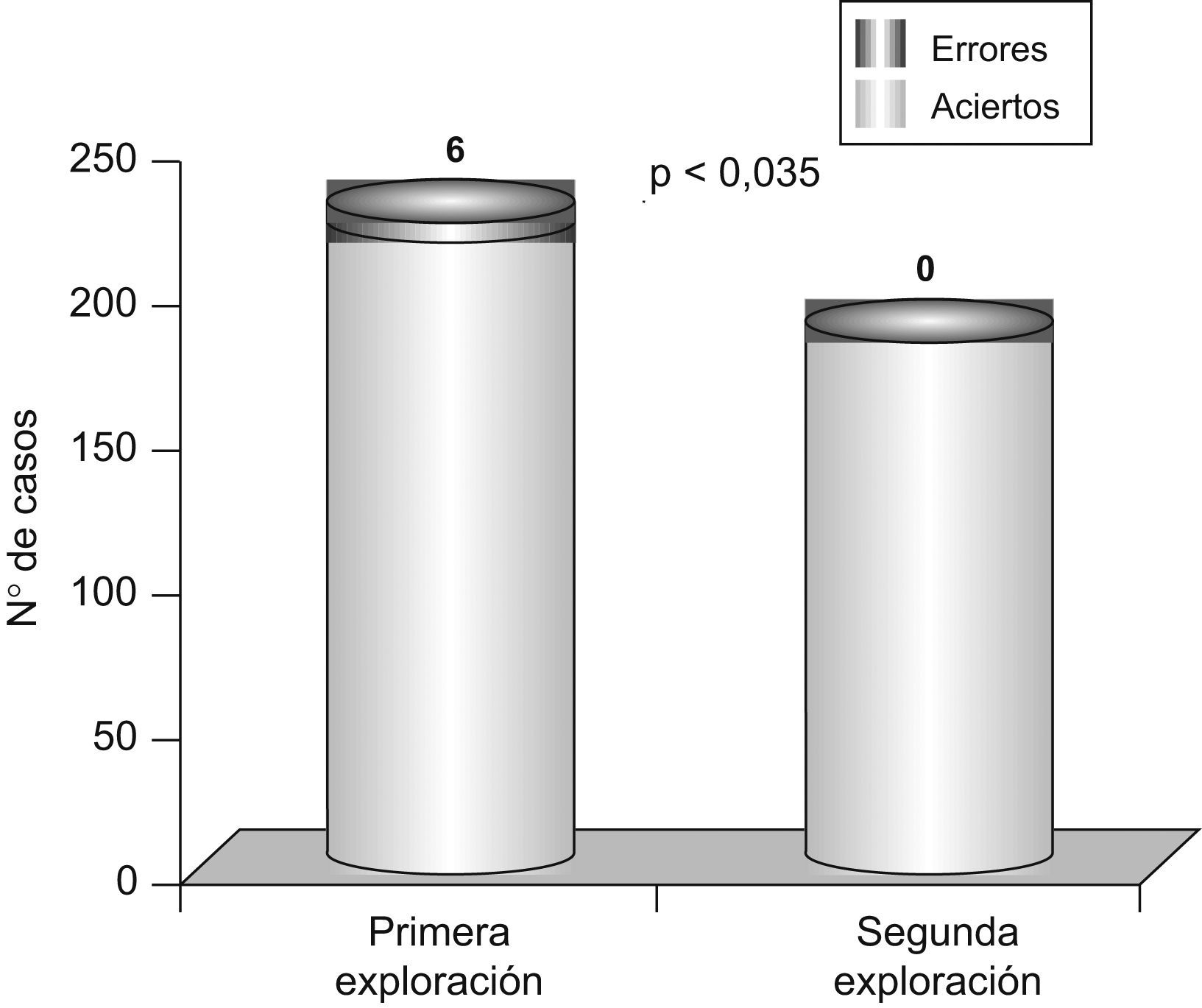
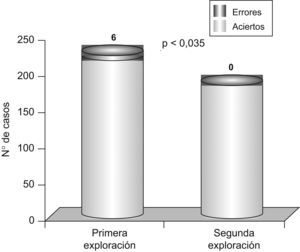
La precisión diagnóstica de la segunda exploración (184/184 aciertos) resultó significativamente superior a la de la primera (220/226) (p=0,035) (fig. 3).
La segunda exploración diagnosticó 6 nuevos casos de úlceras malignas: 3 linfomas MALT de bajo grado, estadio E-I-1, que presentaron remisión total tras la erradicación de H. pylori y 3 carcinomas. Tras la operación se confirmó que 2 de ellos eran carcinomas in situ y el tercero presentaba un estadio I (pT2,No,Mo), todos ellos con buena evolución posquirúrgica.
Tras un diagnóstico inicial de benignidad, hemos calculado el número de segundas exploraciones necesarias (NNE) para diagnosticar un nuevo caso de ulcera gástrica maligna, así como el coste de alcanzar dicho diagnóstico. En la tabla 4 se resumen los resultados obtenidos, tanto para el global de la serie como teniendo en cuenta el grado de experiencia del primer explorador (médico de plantilla o MIR).
DiscusiónA diferencia de las úlceras duodenales, los ulcus gástricos plantean el problema de que pueden corresponder tanto a lesiones benignas como a procesos malignos.
El patrón de referencia para el diagnóstico de las úlceras gástricas es la gastroscopia, asociada a la obtención de biopsias para su estudio anatomopatológico8,11,18. Ante la posibilidad de errores diagnósticos en la primera exploración, fundamentalmente falsos negativos, las guías de práctica clínica aconsejan repetir la endoscopia en las úlceras consideradas inicialmente como benignas, para poder descartar lesiones malignas previamente inadvertidas10. La evidencia científica acerca de la utilidad de la práctica sistemática de una segunda endoscopia en las úlceras benignas es limitada y contradictoria, por lo que se necesitan más estudios para poder llegar a unas conclusiones definitivas19.
En la revisión que hemos efectuado de nuestros casos de úlceras gástricas confirmamos la clara mayor frecuencia de lesiones benignas, que alcanza un 79% de los casos. Las úlceras malignas han correspondido básicamente a carcinomas, aunque hemos encontrado un 31% de linfomas, todos menos uno linfomas MALT de bajo grado. La proporción de linfomas suele oscilar entre el 3 y el 6% de todos los procesos malignos gástricos, considerados globalmente20. La alta frecuencia de linfomas que hemos registrado se explica porque sólo hemos considerado las úlceras, excluyendo del estudio las neoplasias vegetantes y los tumores ulcerados, lo que reduce la proporción de carcinomas y aumenta la de linfomas MALT, que habitualmente se presentan como lesiones ulceradas, únicas o múltiples9.
En general, la precisión del diagnóstico alcanzado tras una primera gastroscopia con toma de biopsias es muy elevada. No obstante, se registran unas considerables variaciones entre las series publicadas11–17 que oscilan entre el 99% de diagnósticos correctos11 y tan sólo el 88% alcanzado en un estudio ruso21. Se ha referido que la toma previa de fármacos que reducen la secreción ácida gástrica, especialmente los inhibidores de la bomba de protones, dificulta el diagnóstico en los casos de carcinoma gástrico precoz ulcerado22. Limitándonos al cáncer gástrico precoz, el rendimiento diagnóstico de la gastroscopia con toma de biopsias es inferior, con valores del 90%8. Asimismo, la exploración realizada en los casos de hemorragia digestiva se acompaña de un aumento de los casos de falso negativo para malignidad11.
En conjunto, los trabajos muestran unas mínimas frecuencias de falsos positivos de malignidad, con unas cifras de falsos negativos que se aproximan al 4%12–17. Nuestros resultados globales son coincidentes con los de la bibliografía, alcanzando una precisión diagnóstica para la primera gastroscopia con toma de biopsias del 97,32%. En nuestra serie hemos registrado una frecuencia del 2,68% de falsos negativos, sin ningún caso de falso positivo, por lo que la especificidad y el valor predictivo positivo ha sido del 100%.
Los «errores» en cuanto al diagnóstico de la naturaleza benigna o maligna de una úlcera gástrica pueden deberse al endoscopista, que obtiene unas biopsias inadecuadas, o al anatomopatólogo, que las interpreta incorrectamente. En un estudio realizado en Escocia, se llega a la conclusión de que en los casos de falso negativo 3 de cada 4 errores son atribuibles al endoscopista23. En nuestro hospital todas las biopsias endoscópicas son examinadas por un único patólogo especializado, por lo que nos hemos centrado en estudiar la posible influencia del endoscopista sobre nuestros resultados. Al presentar sus conclusiones, los autores suelen resaltar la alta precisión diagnóstica obtenida «por un explorador experimentado». Sin embargo, en la revisión bibliográfica efectuada, no hemos podido encontrar trabajos que analicen el grado de experiencia del endoscopista en relación con los resultados alcanzados.
La proporción de casos en que la primera gastroscopia fue realizada por un especialista en formación (26,1%) concuerda con el volumen de trabajo que desarrollan nuestros MIR en la unidad de endoscopias. La precisión de la primera exploración practicada por los MIR fue del 94,83%. Esta cifra, aunque elevada y situada dentro del rango de lo publicado, fue inferior a la registrada por los médicos de plantilla, que ascendió al 98,19%, sin alcanzar diferencias significativas.
En los últimos años, se está registrando una clara disminución de la incidencia del cáncer gástrico en el mundo occidental8,24,25, y un progresivo aumento de la prescripción de antiinflamatorios no esteroideos (AINE), con el consiguiente incremento secundario de úlceras benignas. Finalmente, hay que tener en cuenta el elevado coste del seguimiento endoscópico, sobre todo en algunos países, como Estados Unidos. Por todo ello, se ha llegado a cuestionar la necesidad de repetir sistemáticamente la endoscopia en las úlceras gástricas aparentemente benignas11.
Algunos estudios realizados en Canadá y el Reino Unido muestran que tan sólo se hace un seguimiento endoscópico en aproximadamente un 50% de las úlceras gástricas17,19. En uno de estos trabajos19 se concluyó que las causas más frecuentes por las que los especialistas no repitieron la exploración fueron que el paciente tomase inicialmente AINE (83%) y el mal estado de salud del paciente (63%). Por el contrario, el motivo para efectuar una segunda gastroscopia fue asegurar la cicatrización de la lesión (86%) y confirmar la benignidad (80%).
En un intento de selección de los pacientes, se ha considerado como de mayor riesgo de presentar malignidad a los del sexo masculino, que vivan en regiones con alta incidencia de cáncer gástrico, con historia familiar positiva y con úlcera de gran tamaño. La toma de AINE, la edad inferior a 50 años, la ausencia de H. pylori y la presencia simultánea de ulcus duodenal parecen reducir el riesgo de que la úlcera sea maligna26,27. En estos casos estaría menos indicado el control endoscópico evolutivo, al igual que en los pacientes con imposibilidad de soportar un tratamiento quirúrgico si se les diagnosticase un cáncer gástrico. Por último, es imprescindible repetir la exploración si por cualquier motivo el primer endoscopista no queda satisfecho con las biopsias que ha obtenido, o si el estudio histológico muestra la presencia de displasia28,29.
En nuestra serie, la práctica sistemática de una segunda exploración en las úlceras inicialmente consideradas como benignas ha mostrado una sensibilidad, una especificidad, un valor predictivo positivo y negativo y una precisión diagnostica del 100%. Lógicamente, todo resultado del 100% debe interpretarse con precaución y tan sólo refleja lo obtenido en una serie concreta de pacientes. Tanto la literatura médica como nuestra experiencia acumulada muestran casos en los que han sido necesarias más de dos exploraciones para poder llegar a un diagnóstico correcto en las lesiones ulceradas, especialmente en los linfomas gástricos20,30–32. En cualquier caso, observamos que en nuestra serie la segunda exploración sistemática mejora significativamente los resultados de la primera y, por tanto, es rentable en cuanto al beneficio clínico obtenido y se aconseja su realización.
Otro argumento que se ha empleado en contra del control endoscópico sistemático es la posible falta de repercusión de los nuevos casos diagnosticados de malignidad sobre el pronóstico de los pacientes. Aunque algunos trabajos defienden lo contrario15,16 parece que el seguimiento endoscópico permite el diagnóstico de lesiones malignas con un mayor grado de diferenciación, en un estadio tumoral menos avanzado y, por tanto, con mayores posibilidades de resección quirúrgica y de supervivencia17,33. Se sabe que la mortalidad en el cáncer gástrico está directamente relacionada con el estadio en el que se diagnostica el tumor, y se alcanzan unas supervivencias a los 5 años del 91,5% en los pacientes con estadio I, frente al 5,1% del estadio IV8. Comparando las características de los cánceres descubiertos en el seguimiento endoscópico con las del resto de los cánceres gástricos diagnosticados en ese mismo período, se confirmó que los primeros correspondían al estadio I en el 33 frente al 6,4%, se puede efectuar cirugía radical en el 50 frente al 30% y se obtiene una supervivencia prolongada en el 46 frente al 16%17.
En nuestro estudio la práctica sistemática de una exploración de control nos ha permitido diagnosticar 6 nuevos casos de úlcera maligna. En los 3 linfomas MALT de bajo grado, estadio E-I-1, se aplicó un tratamiento erradicador de H. pylori que, como suele ser habitual34, obtuvo una remisión total de la lesión. De los 3 carcinomas diagnosticados en el control, 2 correspondían a cánceres precoces y el restante presentó un estadio I, y se pudo efectuar a todos ellos una resección quirúrgica aparentemente curativa. Por tanto, observamos que el beneficio clínico obtenido con la segunda exploración no sólo es estadísticamente significativo en cuanto al número de nuevos diagnósticos, sino que ha permitido efectuar tratamientos aparentemente curativos, lo que justifica plenamente su realización.
Una vez confirmado el beneficio clínico que ha supuesto la segunda exploración de control, hemos querido estimar el coste que supone en nuestro medio cada nuevo diagnóstico de úlcera maligna. Los cálculos realizados para nuestra serie muestran que es necesario efectuar 37,3 exploraciones de control para obtener un nuevo diagnóstico. Aplicado el importe de cada exploración, variable según los centros, en nuestro hospital se estima un coste de 4.675 euros por cada nueva úlcera maligna diagnosticada. Al analizar este importe según la experiencia del explorador, observamos que si el primer endoscopista fue un MIR, el coste final desciende a 2.393 euros, multiplicándose por tres (6.485 euros) si la primera gastroscopia fue realizada por un explorador más experimentado, que había obtenido una mayor precisión diagnóstica inicial.
Tras conocer el coste de alcanzar un diagnóstico más precoz, en fase potencialmente curable, de una úlcera maligna, podría especularse sobre la conveniencia de efectuar un seguimiento endoscópico sistemático, o limitarlo a determinadas circunstancias, entre la cuales se incluiría el grado de experiencia del primer explorador. Este tipo de determinaciones sobrepasan nuestro ámbito clínico de decisión y corresponden a criterios de priorización en la asignación de recursos públicos que deberían establecer las Administraciones Sanitarias.
Dadas las importantes diferencias de los costes entre los diferentes países y sistemas sanitarios, resulta muy difícil establecer comparaciones. Por ello, nos limitaremos a mencionar que, en términos económicos de intervenciones sobre cáncer gástrico, se han publicado en Gran Bretaña unos costes de 6.646-8.438 euros por año de vida ganado, según la edad a la que se efectúe la erradicación de H. pylori35,36. Más recientemente, en un estudio efectuado en Taiwán, se estima en 11.111 euros el coste por año de vida ganado mediante erradicación de H. pylori y de 19.438 euros si se sigue una campaña de vigilancia con determinaciones del pépsinógeno sérico y gastroscopias en personas de alto riesgo de cáncer gástrico37. En Estados Unidos se acepta un coste de 50.000 dólares por año de vida ganado38, aunque lógicamente esta cifra resulta inasumible para otros países menos desarrollados. Si pudiéramos extrapolar estos costes a nuestro medio, y aunque no hemos podido precisar el beneficio obtenido en cuanto a prolongación de la supervivencia en nuestros casos, también el control endoscópico sistemático en las úlceras gástricas podría considerarse aceptable en términos de coste/efectividad.