El hamartoma de glándulas de Brunner es una lesión polipoidea que histológicamente se caracteriza por una hiperplasia de estas glándulas junto con una proporción variable de músculo liso. Generalmente, cursa de forma silente y se comporta como una tumoración benigna. Ocasionalmente su crecimiento puede generar sintomatología digestiva que junto con la posibilidad de transformación maligna obliga a su resección tras realizar un amplio diagnóstico diferencial de masa duodenal. Tanto la clínica como los estudios radiológicos con frecuencia son inespecíficos y no permiten establecer su diagnóstico. El estudio endoscópico básico (gastroscopia) junto con una adecuada caracterización de la lesión mediante ecoendoscopia alta permiten establecer un diagnóstico de sospecha y determinar la mejor opción terapéutica (endoscópica o quirúrgica).
Presentamos un caso de hamartoma de glándulas de Brunner gigante que debutó a modo de anemia ferropénica sin evidencia de sangrado. El estudio mediante ecoendoscopia alta permitió, tras adecuada caracterización de la lesión, su completa y segura resección endoscópica evitando un tratamiento quirúrgico más invasivo.
Brunner's gland hamartoma is a polypoid lesion typically composed of an increased quantity of normal-appearing Brunner's glands, accompanied by a variable proportion of smooth muscle. Most of these masses are asymptomatic and behave as benign tumors. Occasionally tumoral growth can provoke gastrointestinal problems which, together with the possibility of malignant transformation, will require resection after a broad differential diagnosis has been made with solitary duodenal mass. Both clinical and radiographic studies are nonspecific and often do not allow diagnosis of these tumors. Basic endoscopic studies (upper endoscopy) with adequate characterization of the lesion by endoscopic ultrasound (EUS) can establish a high diagnostic suspicion and determine the best therapeutic option (endoscopy or surgery).
We present a case of giant Brunner's gland hamartoma. The initial manifestation was iron-deficiency anemia with no evidence of bleeding. After adequate characterization of the lesion, EUS allowed complete and safe endoscopic resection, avoiding more invasive surgical treatment.
El hamartoma de glándulas de Brunner, también llamado adenoma de glándulas de Brunner o brunneroma, fue descrito por primera vez en 1876 por Cruveilhier. Supone aproximadamente el 5% de todos los tumores duodenales y se localiza más frecuentemente en los tramos de duodeno proximal, disminuyendo su incidencia de forma inversa al incremento en la distancia del orificio pilórico1. Se trata de tumores benignos y que cursan generalmente de forma silente; en los pacientes sintomáticos la clínica más frecuente son los síntomas obstructivos y la hemorragia digestiva alta de intensidad variable. Muestran escaso potencial de malignidad, si bien se han recogido en la literatura casos con diferentes grados de displasia, y por lo tanto, posibilidad de transformación maligna, lo que plantea la obligatoriedad de su resección. Su sospecha clínica debe de ser establecida dentro del diagnóstico diferencial de masa duodenal2.
El diagnóstico previo a su tratamiento se ve dificultado por la frecuente indeterminación de las biopsias locales y la escasa especificidad de los métodos de imagen. Mumtaz et al3, en 2002, mostraron en un caso clínico que la ecoendoscopia alta era una adecuada modalidad de imagen para su diagnóstico.
La elección de un tratamiento de la lesión quirúrgico o endoscópico debe de plantearse en función del tamaño, la localización de la lesión y la existencia o no de pedículo, o signos sugestivos de malignidad, si bien y dada su condición benigna con escaso potencial de malignización la resección endoscópica debería de ser la primera opción que se debe plantear.
Presentamos un caso de hamartoma de glándulas de Brunner gigante que debutó a modo de anemia ferropénica sin evidencia de pérdidas hemáticas. El estudio mediante ecoendoscopia alta permitió su completa y segura resección endoscópica, evitando un tratamiento quirúrgico más agresivo.
Observación clínicaPaciente varón de 63 años, hipertenso en tratamiento con bisoprolol y diagnosticado de cardiopatía isquémica revascularizada mediante by-pass femoral derecho y angioplastia coronaria, en tratamiento con clopidogrel. Diagnosticado 3 años antes de adenocarcinoma de recto T3 N+, tratado mediante quimiorradioterapia neoadyuvante, resección anterior de recto y cuatro ciclos adicionales de quimoterapia adyuvante. En revisiones periódicas desde entonces con los servicios de oncología y cirugía general, que incluyen colonoscopias de control de forma anual. Acudió a nueva revisión refiriendo astenia de reciente instauración. Se realizó una analítica que detectó una hemoglobina de 8,5mg/dl y un hematocrito del 28,6%. No refería sintomatología digestiva asociada ni evidencia de sangrado. No presentaba síndrome constitucional asociado.
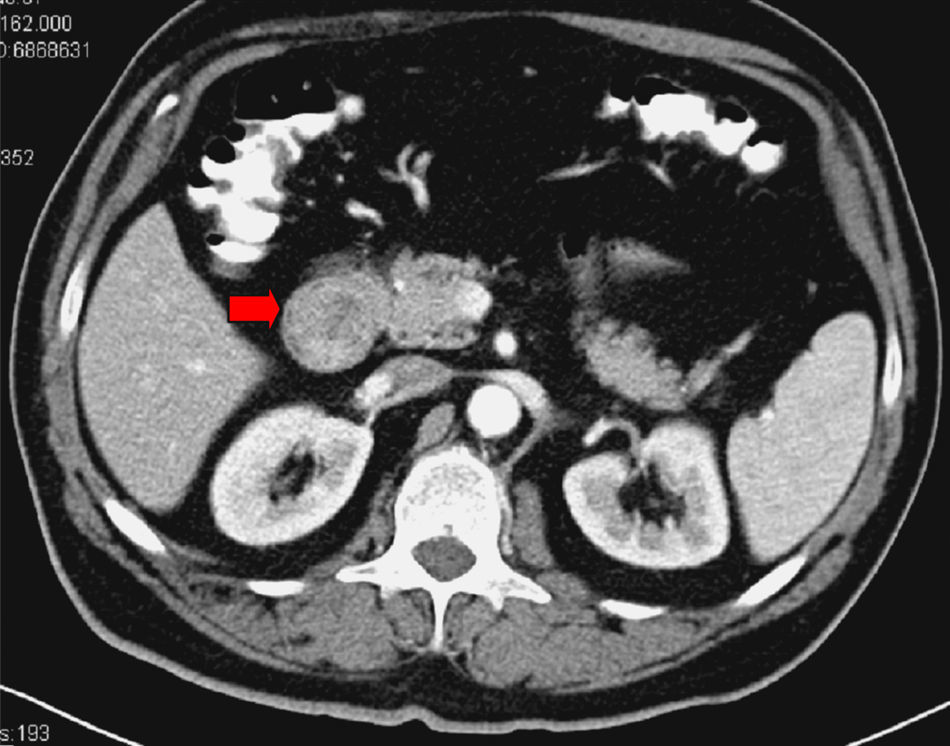
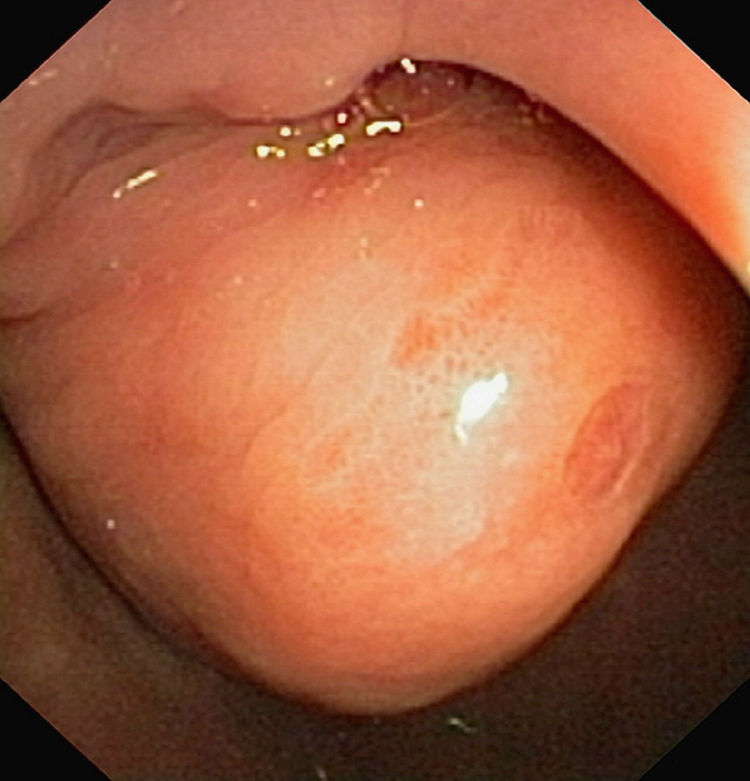
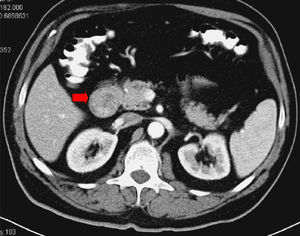
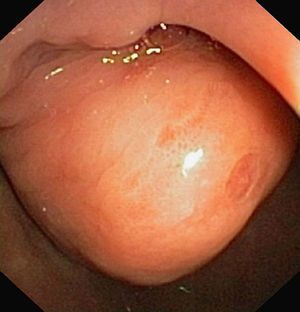
Inicialmente, por sus antecedentes neoplásicos, se procedió a realizar una TC abdominal con administración por vía oral e intravenosa de contraste yodado. En esta exploración radiológica se observó un defecto intraluminal, de aspecto polipoideo entre el bulbo y la segunda porción duodenal (fig. 1). Se realizó una gastroscopia con el fin de confirmar la imagen descrita radiológicamente, observando, a nivel de la vertiente duodenal del canal pilórico, una lesión submucosa de aspecto polipoideo, erosionada en su ápice, pediculada y que se prolapsaba con facilidad hacia la segunda porción duodenal (fig. 2).
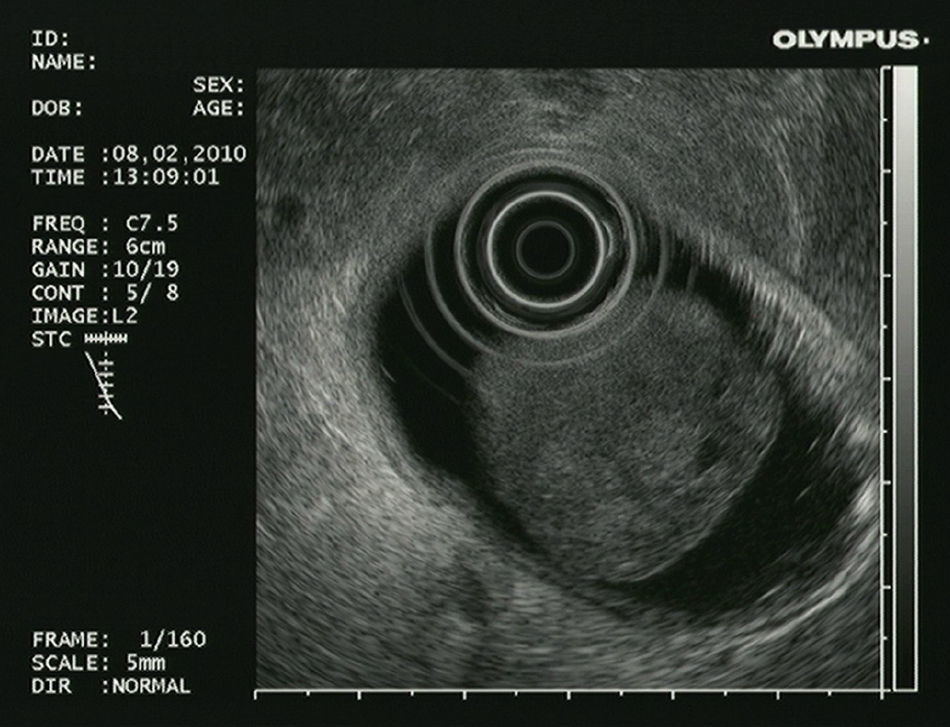
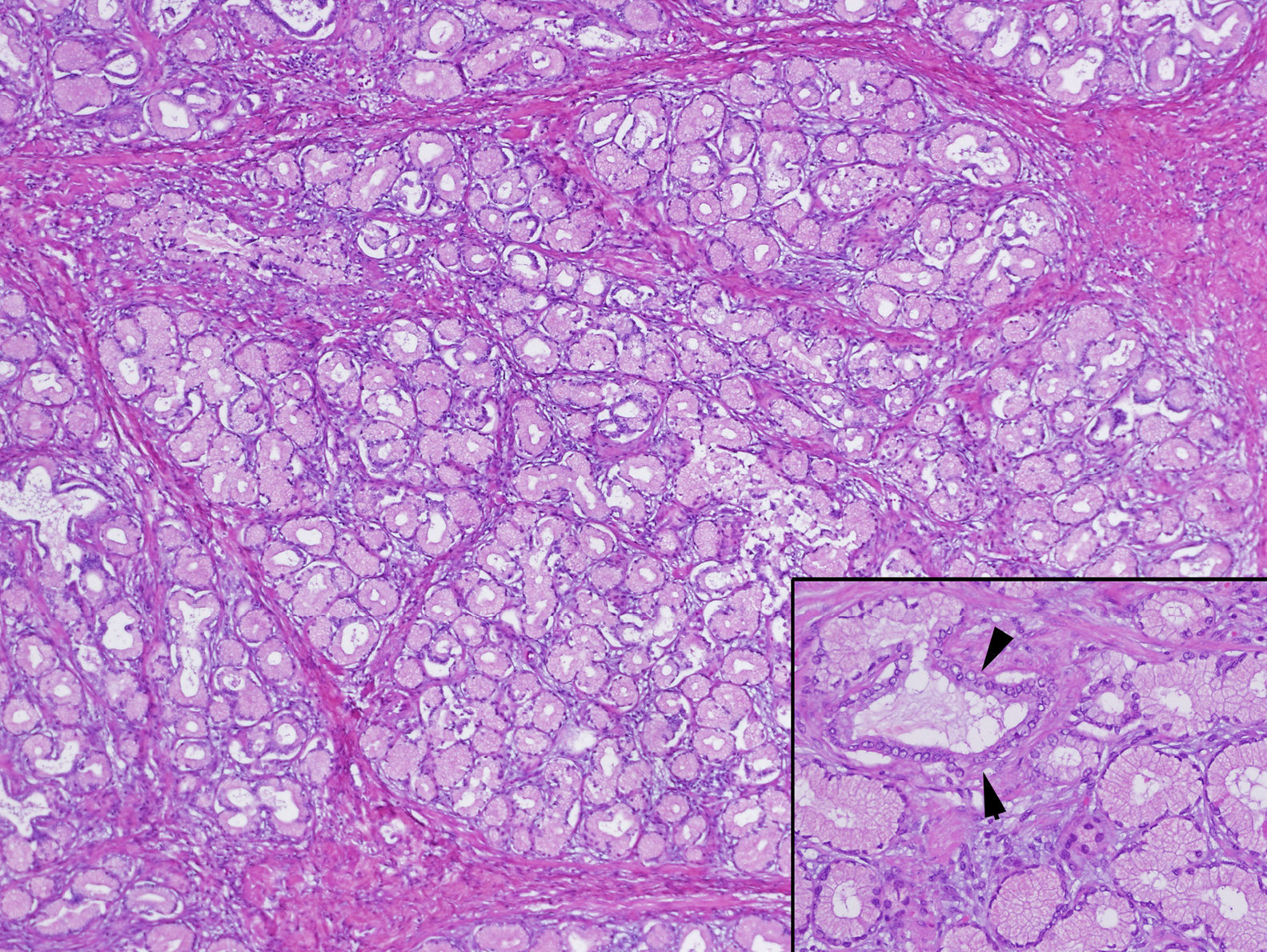
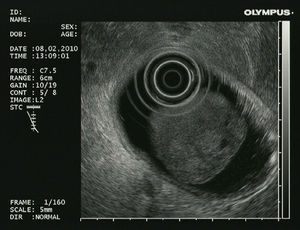
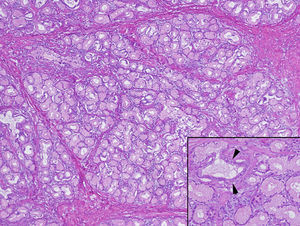
En un segundo tiempo, previa retirada del tratamiento antiagregante y con el paciente en régimen hospitalario, se decidió realizar una ecoendoscopia alta para completar el estudio de la lesión. Se observó una lesión polipoidea pediculada, dependiente de la submucosa, de unos 40mm de diámetro, de parénquima homogéneo y vascularizado y que respetaba la muscular propia (fig. 3). Debido a la existencia de criterios de resección endoscópica, se procedió a la misma tras inyectar en el pedículo 4ml de suero fisiológico con adrenalina (dilución 1/20.000). Posteriormente, se colocó un endoloop en la base del pedículo de forma profiláctica. La resección endoscópica se realizó de forma completa y sin sangrado inmediato. El estudio histológico mostró una lesión de 4,2 x 2,3cm de diámetro, con diagnóstico anatomopatológico de hamartoma de glándulas de Brunner sin displasia (fig. 4).
Las glándulas de Brunner histológicamente se caracterizan por encontrarse localizadas en la submucosa duodenal. Muestran una específica morfología ramificada y se encargan de la secreción alcalina, que protege a la porción proximal del intestino delgado del ácido gástrico, y de crear un pH óptimo para la actuación intestinal de las enzimas pancreáticas4.
Los hamartomas derivados de las glándulas de Brunner son lesiones polipoideas con frecuencia pediculadas, localizadas en el duodeno proximal y que histológicamente se caracterizan por una hiperplasia de estas glándulas junto con una proporción variable de músculo liso5. Son tumoraciones benignas infrecuentes, con una incidencia estimada en autopsias menor de 0,01%6. Representan el 5-10% de todos los tumores de intestino delgado y se diagnostican más frecuentemente entre la quinta y la sexta décadas de la vida, sin predominio de sexo ni raza7. Generalmente se localiza en el bulbo duodenal (57% de las ocasiones), aunque también han sido descritos en la segunda (27%) y tercera porción duodenal (5%), el canal pilórico (5%), yeyuno (2%) e íleon proximal (2%)1,8.
Su patogenia se desconoce y se ha relacionado con el crecimiento compensatorio de las glándulas de secreción alcalina frente a la hipersecreción gástrica ácida o a la infección por Helicobacter pylori9.
En la mayoría de las ocasiones cursa de forma silente sin producir problemas clínicos y cuando los produce suelen estar en relación con el tamaño de la lesión siendo los síntomas más frecuentemente descritos la obstrucción por intususcepción (37%) o la hemorragia digestiva alta oculta o masiva (37%)1,10. Otra sintomatología recogida en la literatura, aunque de forma anecdótica, son la pancreatitis recurrente11, la ictericia obstructiva12 y la fístula biliar13.
Aunque se consideran tumoraciones benignas, hay publicados en la literatura casos aislados de hamartoma de glándulas de Brunner con potencial maligno (displasia)14,15 o incluso malignización16,12.
A pesar de estos datos, su escaso potencial de malignidad permite plantear en los casos sintomáticos y dependiendo del tamaño, localización de la lesión y de la presencia o no de pedículo su resección endoscópica6. Sin embargo, si la resección endoscópica fracasa, o se sospecha malignidad por los datos morfológicos o radiológicos (tamaño, lesión sésil, o ulcerada) debe plantearse la resección quirúrgica17.
Es evidente que su hallazgo mediante métodos de imagen (TC abdominal, resonancia magnética abdominal) puede plantear un amplio diagnóstico diferencial y su diagnóstico en ocasiones se ve dificultado por la longitud de su pedículo que no permite una adecuada localización de la lesión ni una adecuada sospecha diagnóstica.
Además, y puesto que las biopsias de la lesión mediante endoscopia convencional son típicamente indeterminadas, la realización de una ecoendoscopia alta previa al tratamiento que demuestre su origen submucoso, su heterogeneidad histológica con componente sólido y quístico, y su carácter no invasivo aporta información adicional asegurando una adecuada y completa resección endoscópica18.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.