El cáncer de endometrio (CE) es la neoplasia ginecológica maligna más frecuente y representa aproximadamente el 6% de todos los cánceres en mujeres1. Al menos el 75% de los casos se diagnostican en estadios precoces (I/II), en los que el tratamiento quirúrgico ofrece altas tasas de curación2. En las recurrencias y en los estadios avanzados, la enfermedad suele extenderse locorregionalmente en la pelvis y en el peritoneo y provocar metástasis en los ganglios linfáticos pélvicos, paraaórticos o intrabdominales, y en los órganos a distancia. La afectación del tubo digestivo es infrecuente y el recto es el órgano habitualmente afectado por invasión local3. Exponemos un raro caso de CE con metástasis en el intestino delgado que se presentó en forma de hemorragia digestiva recidivante de origen incierto. La paciente fue tratada con acetato de medroxiprogesterona, lo que permitió controlar la clínica hemorrágica y obtener una supervivencia significativa.
OBSERVACIÓN CLÍNICAMujer de 77 años de edad, que ingresó en el Servicio de Aparato Digestivo en diciembre de 2004 tras presentar rectorragia y hematoquecia. Como antecedentes personales destacaban: hipertensión arterial, alcoholismo crónico y síndrome ansioso-depresivo. En el año 2002 había sido diagnosticada de un adenocarcinoma endometrial de tipo endometroide, que se extendía por todo el miometrio, llegando hasta la serosa, sin alcanzar ésta, con invasión del endocérvix que infiltraba el estroma subyacente (estadio IIb). Fue tratada mediante histerectomía, doble anexectomía, extirpación del manguito vaginal y quimioterapia y radioterapia adyuvantes. Posteriormente, se había encontrado asintomática y seguía tratamiento habitual con antidepresivos y benzodiacepinas. En los 15 días previos a su ingreso notaba un dolor abdominal cólico, emisión de heces sanguinolentas, hematoquecia y, el día de su ingreso, una rectorragia significativa. Había perdido algo de peso en los últimos meses pero presentaba un buen estado general. En la exploración física mostraba una presión arterial de 130/70 mmHg, una frecuencia cardíaca de 110 lat/min y palidez mucocutánea. La exploración cardiorrespiratoria era normal. El abdomen era blando, con una cicatriz de laparotomía infraumbilical y un leve dolor a la palpación en ambas fosas ilíacas. Se palpaba un nódulo periumbilical redondeado, de 4 cm, duro, adherido a los planos profundos y doloroso a la movilización. El tacto rectal solo detectó sangre oscura en la ampolla. En los análisis destacaba: hemoglobina (Hb) de 5,7 g/dl, hematocrito del 31%, 9.820 leucocitos/dl y ferritina de 24 mg/dl. Los análisis básicos de coagulación, la bioquímica completa, la velocidad de sedimentación y la radiografía de tórax fueron normales. La paciente fue tratada inicialmente con transfusión de varios concentrados de hematíes, sueroterapia y analgesia. Una gastroscopia sólo detectó una hernia de hiato de mínimo tamaño y una gastritis crónica atrófica, sin restos de sangre en el estómago ni en el duodeno. Durante el ingreso se realizaron 3 colonoscopias completas, con una adecuada preparación, que sólo mostraron restos hemáticos oscuros con algún coágulo y pequeños divertículos en el sigma, no complicados, sin lesiones vasculares ni puntos sangrantes. Una ileoscopia de unos 20-25 cm de profundidad no detectó ninguna afección, aunque había algún resto de sangre en la luz intestinal. Se practicó una enteroscopia por pulsión, que permitió explorar aproximadamente 60-70 cm del yeyuno proximal, sin que se observasen lesiones ni restos de sangre. Un tránsito intestinal baritado no observó alteraciones significativas. Se solicitó una tomografía computarizada (TC) axial (fig. 1) que mostró los siguientes hallazgos: a) implantes tumorales localizados entre la pared abdominal anterolateral derecha y el borde externo del hígado, el mayor de ellos de 5,2 µ 2,4 cm; b) una adenopatía retrocrural derecha de 1,9 cm, adenopatías retroperitoneales intercavaaóticas de 2,1 cm y periureterales izquierdas de 4,8 µ 4 cm; c) masa en la pared abdominal anterior, próxima a la línea media, de 3,4 µ 2,3 cm, de contorno mal definido, y d) masa abdominopélvica de 4,7 µ 3,7 cm en íntimo contacto con la plastia vaginal. No se demostró líquido libre intraabdominal y el diagnóstico era compatible con recidiva extensa, linfática, abdominal y pélvica por adenocarcinoma de endometrio. En el servicio de cirugía general se practicó una biopsia con anestesia local del nódulo periumbilical. El análisis histológico detectó un tejido fibroadiposo infiltrado por formaciones glandulares y papilares atípicas, revestidas por células de núcleos grandes, irregulares y cromáticos, algunos con mitosis. Mediante inmunohistoquímica las células eran positivas para citoqueratina 7, estrógenos y progesterona y negativas para citoqueratina 20. El diagnóstico patológico fue de tejido fibroadiposo infiltrado por adenocarcinoma de origen endometrial (fig. 2). En las siguientes 2 semanas la paciente presentó hematoquecia y melenas recidivantes e intermitentes, con deterioro del estado general y algún episodio de hipotensión, que requirió politransfusión de hemoderivados. Se solicitó una gammagrafía con hematíes marcados con tecnecio-99. En dicha prueba se observaba, desde la imagen precoz y la imagen obtenida a los 60 min, una captación patológica en el hemiabdomen derecho, en un asa del intestino delgado. En las imágenes más tardías, persistía la captación patológica, que variaba de forma debido al peristaltismo intestinal. El estudio fue informado como compatible con sangrado intestinal procedente de un asa de intestino delgado (fig. 3). Se practicaron 2 arteriografías abdominales que no detectaron vaso sangrante ni fuga de contraste, por lo que no fue posible llevar a cabo una embolización terapéutica. En el servicio de cirugía se desaconsejó una intervención quirúrgica dada la extensión de la enfermedad. Como única alternativa se inició tratamiento con acetato de medroxiprogesterona oral (Megefren®) en una dosis de 320 mg/día. A los pocos días de iniciado el tratamiento desapareció la clínica hemorrágica y la paciente presentó una mejoría progresiva del estado general y de las cifras de Hb y hematocrito, por lo que no fueron necesarias nuevas transfusiones. Fue dada de alta en febrero de 2005 con una Hb de 10,7, bajo tratamiento hormonal y hierro intravenoso en el hospital de día. La evolución posterior fue favorable, no se volvió a repetir la clínica hemorrágica y pudo suspenderse el tratamiento con hierro en pocas semanas al alcanzarse cifras de Hb y ferritina normales. Se repitió una TC en octubre de 2005, que mostró una clara mejoría en el número y el tamaño de las adenopatías intraabdominales, con un descenso significativo en el tamaño de los implantes peritoneales y una desaparición casi completa de la masa pélvica, aunque persistía apenas modificada la masa de partes blandas en la pared abdominal (fig. 4).
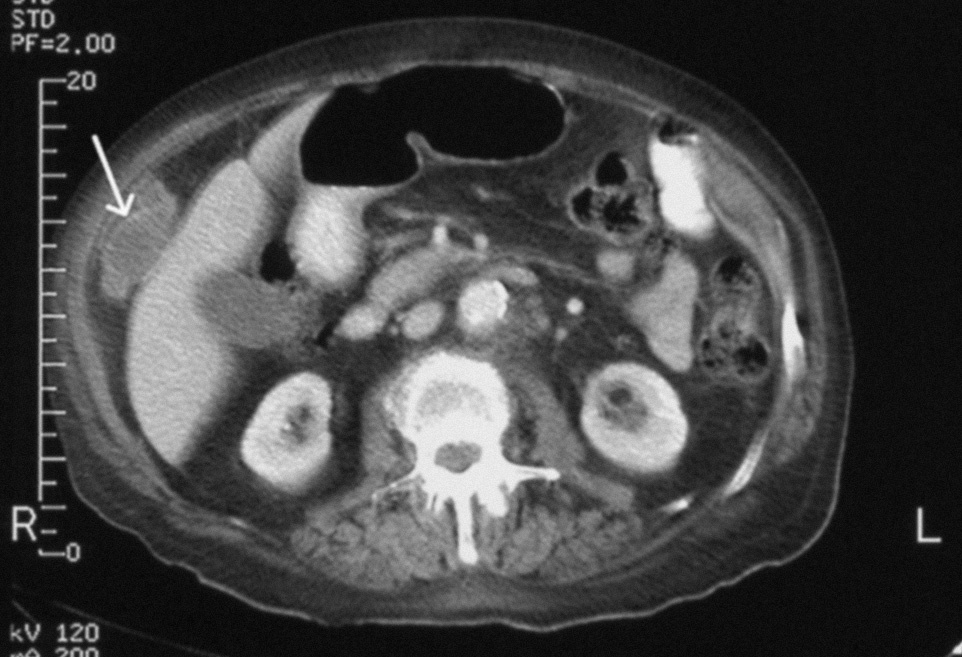
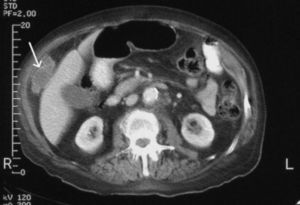
Fig. 1. Tomografía computarizada abdominal. La flecha señala un implante tumoral de gran tamaño situado entre la pared abdominal anterolateral derecha y el borde externo del hígado.
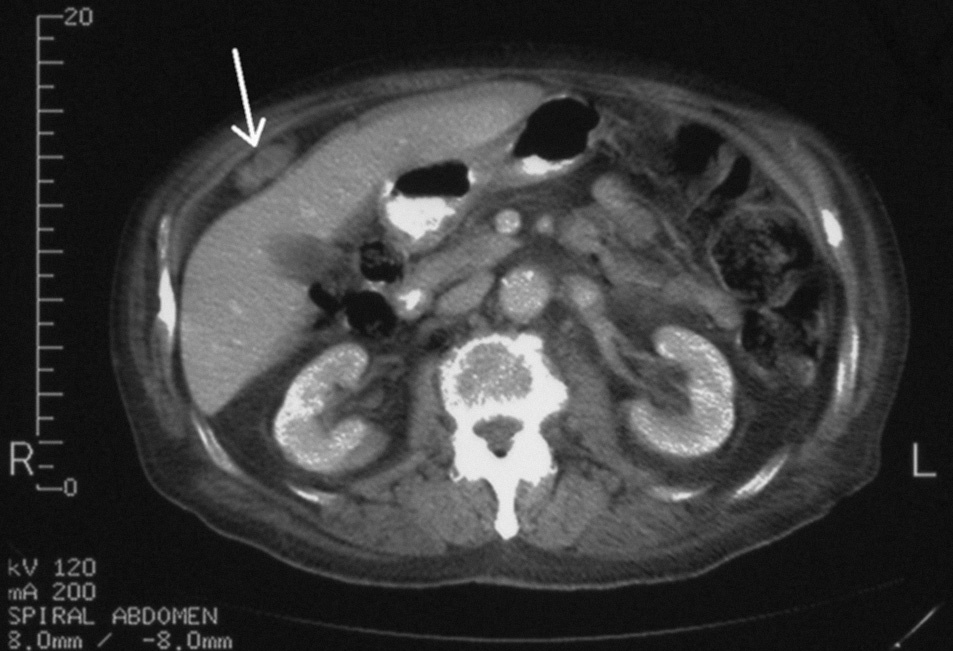
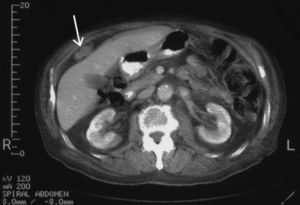
Fig. 2. Tomografía computarizada abdominal, 9 meses después de iniciado el tratamiento con acetato de medroxiprogesterona. En comparación con la figura 1, se aprecia una significativa reducción en el tamaño del implante tumoral.
Como complicación del tratamiento hormonal, la paciente presentó una trombosis venosa superficial en el miembro inferior izquierdo, que respondió adecuadamente a una reducción transitoria de la dosis de progesterona y heparina subcutánea. La paciente falleció finalmente a los 22 meses a causa de una progresión de su enfermedad, pero sin reaparición de la clínica de hemorragia digestiva.
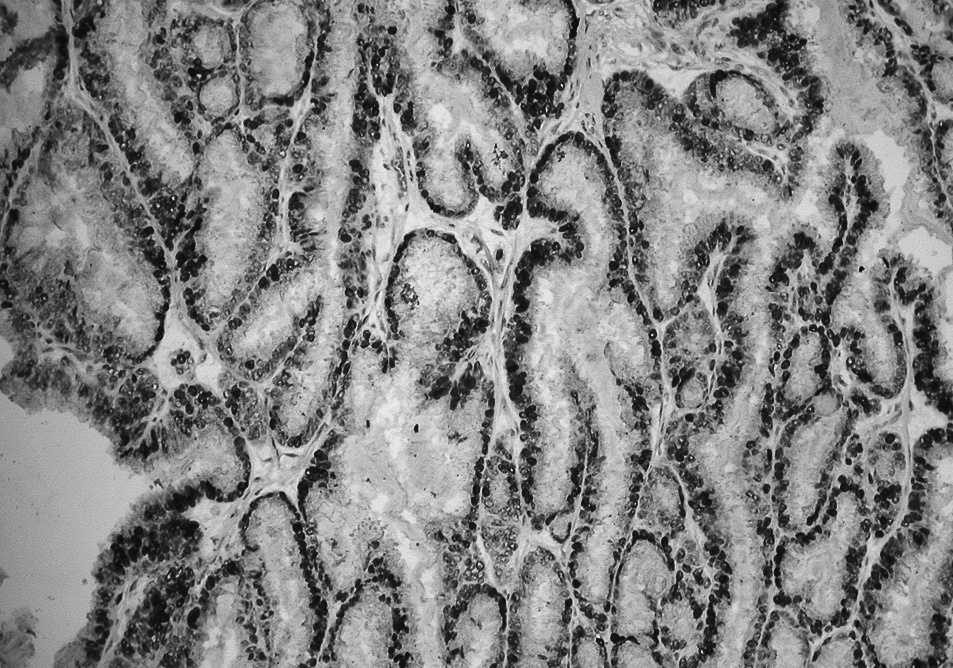
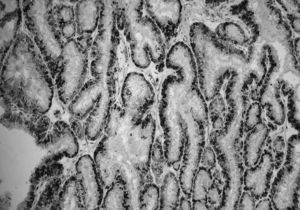
Fig. 3. Biopsia del nódulo tumoral subcutáneo en la pared abdominal. Inmunohistoquímica para receptores de progesterona. Se aprecia un tejido fibroadiposo infiltrado por un adenocarcinoma de origen endometrial, cuyas células muestran una intensa positividad para receptores de progesterona.
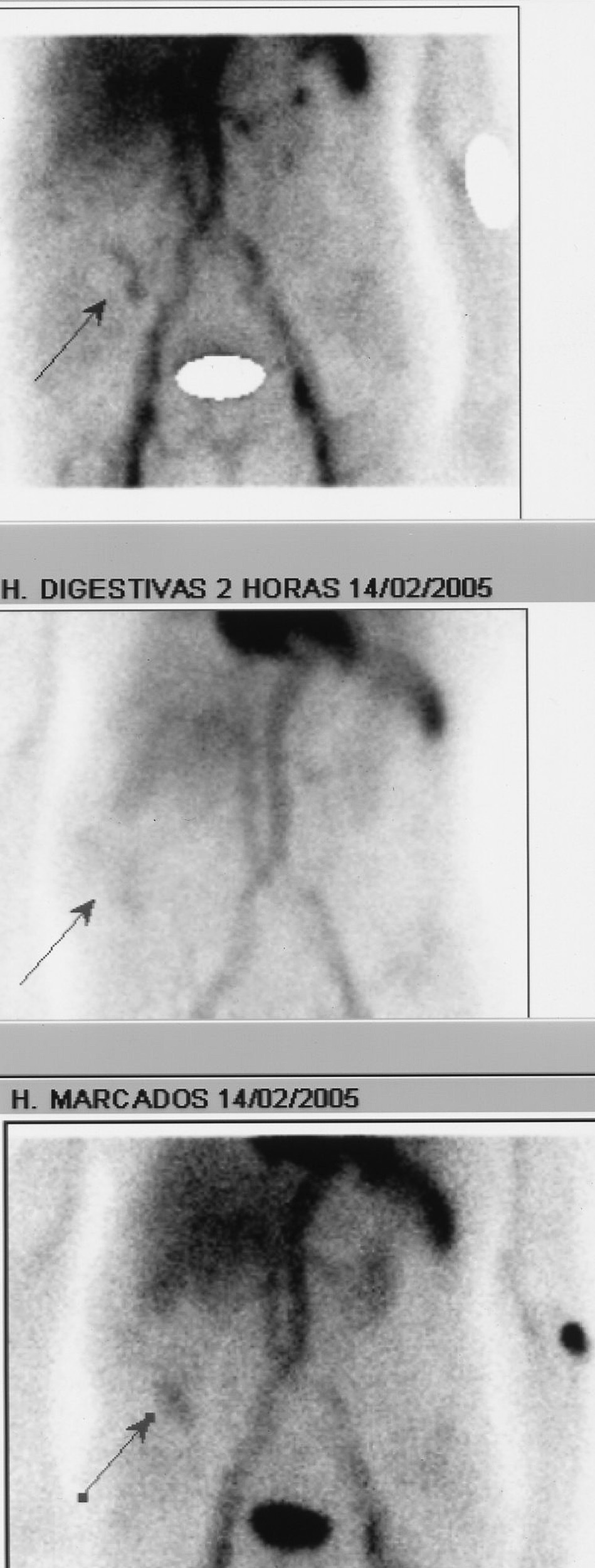
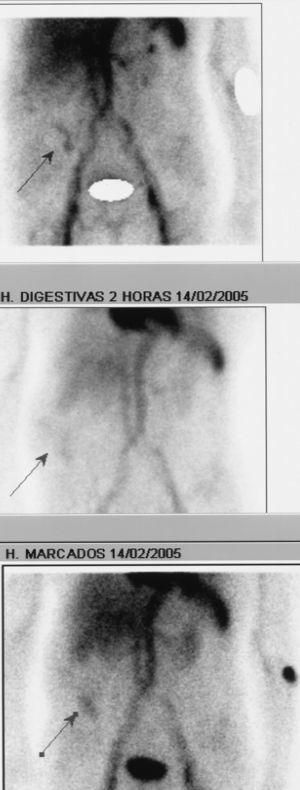
Fig. 4. Gammagrafía con hematíes marcados con tecnecio-99. Las flechas señalan un depósito del isótopo en el hemiabdomen derecho tanto en la fase precoz como a los 60 y 120 min, compatible con un sangrado intestinal procedente de un asa de intestino delgado.
DISCUSIÓNLa afectación del tubo digestivo en el CE es poco frecuente y suele limitarse a la invasión local del recto en estadios muy avanzados. Se han descrito casos de CE localizados en tramos más proximales del colon, pero en la mayoría de ellos la neoplasia se desarrolla a partir de focos previos de endometriosis colónica4-6. Asimismo, el CE puede aparecer asociado al cáncer colorrectal y a otras neoplasias en el síndrome del cáncer colorrectal no asociado a poliposis7. La afectación del intestino delgado por el CE es extraordinariamente infrecuente. Sólo hemos encontrado 5 casos descritos en la literatura médica de metástasis-in-vasión en el intestino delgado, 3 localizados en el íleon y 4 en el duodeno8-12. Sólo uno de los casos se presentó en forma de hemorragia digestiva8. En los otros 4 la forma de presentación fue: recidiva en la pared abdominal con invasión ganglionar y del íleon9, fístula ileouterina10, ictericia por metástasis en la papila duodenal11 y hallazgo incidental de metástasis en el íleon durante la laparotomía12. En nuestro caso, se presentó en forma de hemorragia digestiva intermitente 2 años después de haber sido tratada la paciente de un adenocarcinoma de endometrio en estadio IIb. El estudio endoscópico descartó un punto de origen de la hemorragia en el recto, el colon, el íleon terminal, el estómago, el duodeno y el yeyuno proximal. Aunque no pudimos obtener una imagen endoscópica del punto sangrante, los resultados de la TC, de la biopsia del nódulo subcutáneo metastásico en la pared abdominal y de la gammagrafía con hematíes marcados con tecnecio99 son altamente compatibles con una hemorragia procedente del intestino delgado por afectación-invasión del CE. La buena respuesta que la paciente experimentó al recibir acetato de medroxiprogesterona apoya aún más este diagnóstico. En el caso descrito por Scheneider et al8, una paciente con CE recurrente presentaba una hemorragia digestiva provocada por la erosión y la invasión de la tercera porción del duodeno a partir de un conglomerado adenopático metastásico, situado en la cadena paraaórtica en la raíz del mesenterio. La paciente fue tratada quirúrgicamente de forma paliativa, con lo que se obtuvo una supervivencia de 4 meses. Es posible que en nuestro caso uno de los numerosos implantes tumorales peritoneales que presentaba la paciente fuese el responsable de la erosión y la invasión, con una ulterior hemorragia, de algún punto en el intestino delgado situado entre el íleon terminal y el yeyuno proximal. Aunque poco frecuente, la metástasis-invasión de la pared del tubo digestivo por un adenocarcinoma de endometrio debe tenerse en cuenta en el diagnóstico diferencial de las pacientes con hemorragia digestiva de origen incierto que presenten antecedentes previos de CE. El tratamiento hormonal con análogos de la progesterona es una opción terapéutica bien establecida para casos seleccionados de CE avanzado o recurrente13. El desarrollo de CE esta fuertemente asociado con un exceso de producción estrogénica, ya sea de origen endógeno o bien a partir de una exposición exógena14,15. Aunque no se conocen con exactitud los mecanismos antineoplásicos de la progesterona, esta hormona posee efectos sobre el control de la proliferación celular, facilita la diferenciación celular y, probablemente, regula la capacidad de invasión de las células endometriales16. Las tasas de respuesta al tratamiento hormonal se sitúan en torno a un 15-30%, con una supervivencia media de 7-12 meses17-19. Las mujeres con tumores bien diferenciados y que expresan receptores para estrógenos y progesterona, como era el caso del tumor de nuestra paciente, tienen mayores posibilidades de respuesta al tratamiento hormonal17. Aunque la mayor parte de las respuestas a la progesterona son parciales y de corta duración, este tratamiento tiene la ventaja respecto a los regímenes de quimioterapia de ser bien tolerado y tener pocos efectos secundarios. El efecto adverso más frecuente es la trombosis venosa periférica, que aparece en aproximadamente el 5% de los casos17. En el caso que presentamos, la presencia de hemorragia recidivante y el deterioro de la paciente desaconsejaban el empleo de un esquema agresivo de quimioterapia. Por otra parte, dada la extensión de la enfermedad, una opción quirúrgica probablemente hubiese supuesto un riesgo considerable de morbimortalidad. El tratamiento con acetato de medroxiprogesterona oral se mostró eficaz a la hora de controlar la clínica hemorrágica, obtuvo una notable disminución del tamaño de los implantes tumorales (como queda de manifiesto en la TC realizada 9 meses después) y permitió lograr una supervivencia significativa con una aceptable calidad de vida.
Correspondencia: A. Ibáñez Pinto. Río Umia, 12, 1.º. 36005 A Caeira, Poio (Pontevedra). España. Correo electrónico: carthagoo@hotmail.com
Recibido el 18-4-2007; aceptado para su publicación el 20-6-2007.