Sr. Director: El propiltiouracilo (PTU), fármaco perteneciente al grupo de las tioureas, se ha empleado ampliamente en la práctica clínica como fármaco antitiroideo desde su aparición en 1947, y presenta escasas reacciones adversas graves1,2. Puede originar una elevación transitoria y asintomática de las enzimas hepáticas en 1 15-28%3 de los casos; sin embargo, la hepatotoxicidad grave constituye un evento poco frecuente: la serie más extensa, publicada en 2003, incluye 83 casos4. Presentamos un nuevo caso de hepatitis aguda colestásica secundaria a tratamiento con PTU en un paciente diagnosticado de hipertiroidismo.
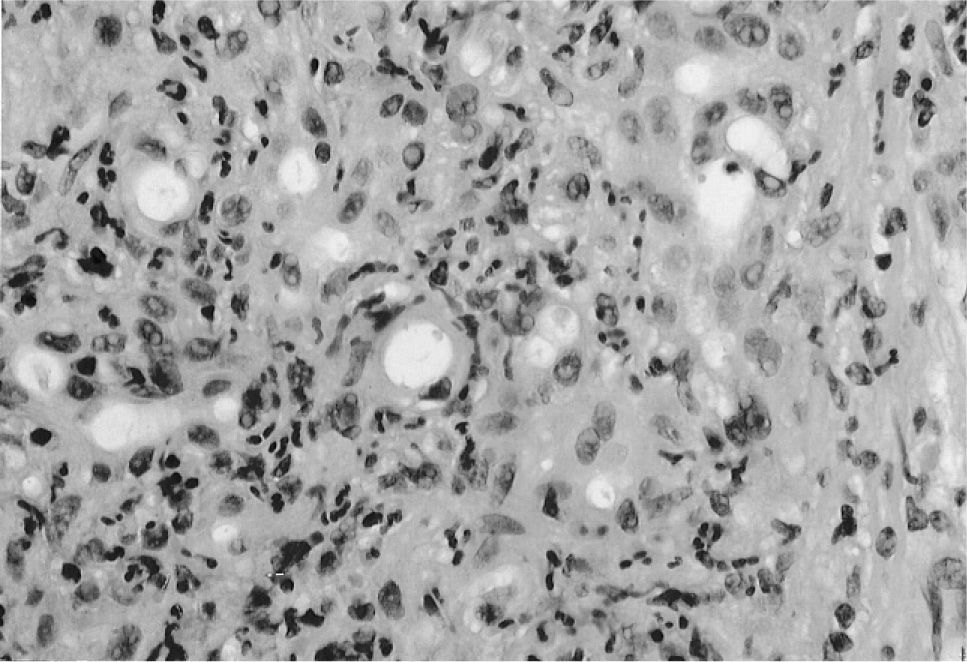
Varón de 51 años de edad, natural de Bulgaria, sin alergias medicamentosas conocidas, fumador de 1 paquete/día y sin antecedentes de ingesta alcohólica. Había sido diagnosticado hacía 5 años de una hepatitis B crónica, por lo que siguió tratamiento con interferón pegilado al que respondió favorablemente. Presentó una serología al ingreso con HBsAg negativo, anti-HBc positivo y anti-HBs positivo. Diagnosticado de hipertiroidismo autoinmune 4 años antes del ingreso, había abandonado el tratamiento con PTU por prescripción médica desde hacía 2 meses. A raíz de este hecho, presenta un cuadro progresivo de malestar general, episodios de sudoración profusa y palpitaciones, diarreas líquidas diarias y pérdida de 15-20 kg de peso. Ante este cuadro, se decide reinstaurar el tratamiento antitiroideo; pocos días después mejora el proceso diarreico pero inicia una ictericia progresiva asociada a prurito intenso, coluria y acolia, sin presentar fiebre, dolor abdominal ni ninguna otra sintomatología. La analítica al ingreso mostró: hemograma normal, GOT 76 U/l, GPT 92 U/l, FA 228 U/l, GGT 235 U/l, bilirrubina total 17,9 mg/dl, bilirrubina directa 8,67 mg/dl, albúmina 2,76 g/dl, T. Quick 77,9%. En la ecografía abdominal el hígado era homogéneo sin presencia de lesiones focales, con vesícula biliar normal y sin dilatación de la vía biliar. Durante el ingreso se realizaron las siguientes exploraciones: serologías para el resto de virus hepatotropos (VHA, VHC, CMV, VEB y herpesvirus), que fueron negativas, autoanticuerpos (ANA, AMA, AAML, anti-LKM), con resultados negativos, y una colangio-RM, que reveló un hígado homogéneo sin presencia de lesiones focales ni dilatación de las vías biliares. Se completó el estudio de hepatopatía con la determinación de alfa-1-antitripsina, ceruloplasmina y perfil férrico en sangre, que fueron normales. Ante la ausencia de diagnóstico, se realizó una punción-biopsia hepática, cuya anatomía patológica mostró signos de colangitis aguda y colestasis compatible con una hepatitis tóxica de perfil colestásico (fig.1). Tras 45 días de la retirada del tratamiento con PTU se inició una progresiva normalización de los parámetros de colestasis: GOT 46 U/l, GPT 36 U/l, FA 161 U/l, GGT 50 U/l, bilirrubina total 4,2 mg/dl, bilirrubina directa 1,8 mg/dl, albúmina 3,89 g/dl, T. Quick 82%. Se produjo una franca mejoría del prurito y de la sintomatología hipertiroidea tras la instauración de tratamiento con fármacos antihistamínicos y bloqueadores beta. Dos meses después del alta, el paciente permanecía asintomático y sin alteraciones en los parámetros de función hepática, y está pendiente de la aplicación de tratamiento con I131.
La incidencia de hepatitis aguda inducida por PTU es del 0,1-1,2% de los pacientes tratados5. Esta tasa es muy superior a la observada en el contexto de la toxicidad hepática inmunoalérgica en general (de 1/10.000 a 1/100.000)5 y muy inferior a la de los casos de elevación asintomática de las transaminasas durante la primera semana de tratamiento con PTU (el 28% de los casos). La incidencia de hepatotoxicidad grave es de un 1%, y la mortalidad6 es superior al 25%; en la literatura médica tan sólo se han descrito 28 casos de estas características4. Por otra parte, no parece haber mayor toxicidad en relación con la edad y, a diferencia de nuestro caso, suele presentar un predominio en el sexo femenino. La hepatotoxicidad por PTU suele ser idiosincrásica, no suele tener relación con la dosis de fármaco administrada y tiene un tiempo de aparición de 6-12 meses tras el inicio del tratamiento, sin que se requiera una continuidad en dicho tratamiento6. Además, la presencia de lesiones hepáticas previas, como en el caso de este paciente, puede condicionar una mayor dificultad en la capacidad de recuperación del daño hepático ocasionado tras la ingesta del fármaco7. Dado que las manifestaciones clínicas son inespecíficas, el diagnóstico deberá sospecharse ante el antecedente de la toma de PTU, la ausencia de otras etiologías que pueda justificar la lesión hepática aguda, así como la recuperación posterior tras suspender el tratamiento3. Las alteraciones histopatológicas que más frecuentemente encontraremos en las muestras de biopsia será una necrosis hepatocelular inespecífica de gravedad variable con o sin componente de colangitis y colestasis6, hallazgos similares a los encontrados en este paciente. Por otra parte, hay que tener en cuenta que se han descrito cambios en los tests de función hepática hasta en un 60% de los pacientes con hipertiroidismo8, antes y después de iniciar el tratamiento hipertiroideo, cuya fisiopatología ese poco conocida. Puede atribuirse a una etiología multifactorial: congestión hepática, incremento en el consumo de oxígeno hepático, reducción en la síntesis de ácidos biliares e inhibición de la glucuroniltransferasa. Sin embargo, la presencia o ausencia de estas anormalidades no predice la futura aparición de toxicidad hepática por PTU8,9. El tratamiento definitivo para los pacientes que en esta situación se encuentren en estado de hipertiroidismo será el 131I.
Esta observación clínica, a semejanza de las ya descritas en la literatura médica, alerta sobre el riesgo de desarrollar lesiones hepatocelulares graves en pacientes hipertiroideos en tratamiento con PTU. El diagnóstico será de exclusión, descartando todas las etiologías infecciosas, autoinmunes y metabólicas, junto con la existencia de un patrón temporal compatible entre el inicio del tratamiento y la aparición de las alteraciones bioquímicas10. Una vez detectadas las alteraciones en los parámetros enzimáticos de función hepática, será necesaria una retirada inmediata del tratamiento y un seguimiento riguroso, ya que al tratarse de un proceso de evolución subaguda, el deterioro de la función hepática puede progresar tras la retirada del PTU, llegando incluso a precisar un trasplante hepático en determinados casos graves6. Finalmente, será necesario estimar la normalización de dichas alteraciones tras la retirada del fármaco.