El acetato de glatirámero (AG) es un polipéptido inmunomodulador utilizado para el tratamiento de primera línea de la esclerosis múltiple remitente recurrente (EMRR). Este fármaco retrasa la evolución de la enfermedad y disminuye el número de recaídas1. EL AG tiene buena tolerancia y sus efectos adversos son a menudo leves, siendo los más frecuentes las reacciones locales en el punto de inyección y una reacción sistémica consistente en palpitaciones, disnea y náuseas a los pocos minutos de la administración. Excepcionalmente se ha descrito algún caso de hepatitis autoinmune desencadenada por AG y también hepatitis tóxica2,3. Se describe un caso de hepatitis medicamentosa asociada a AG.
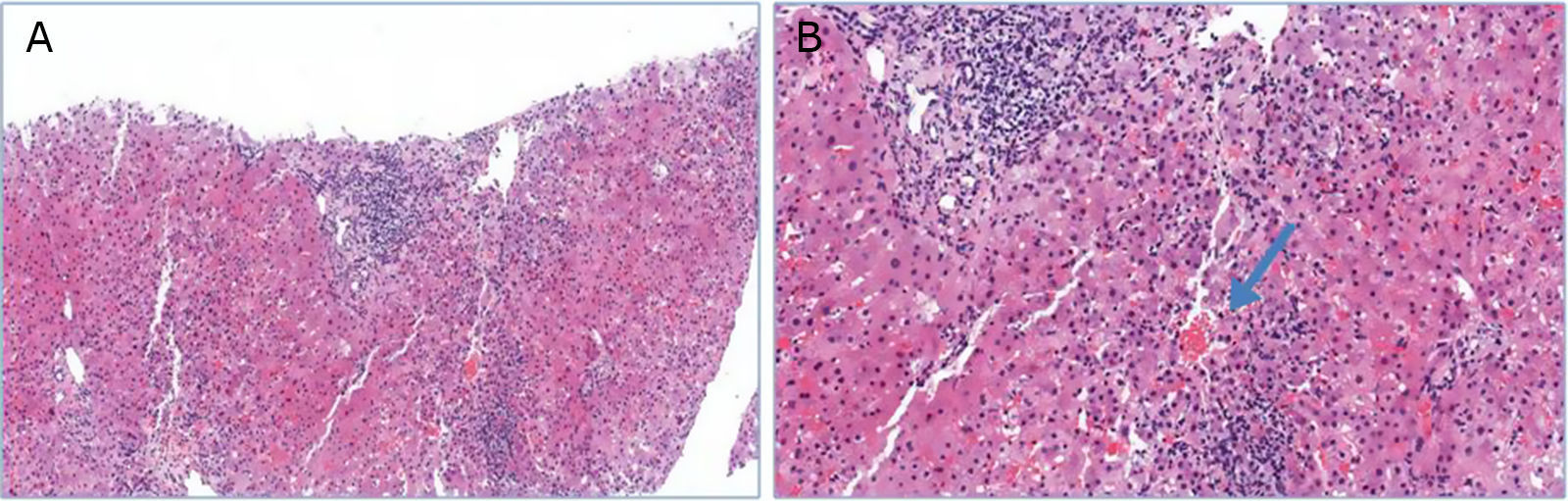
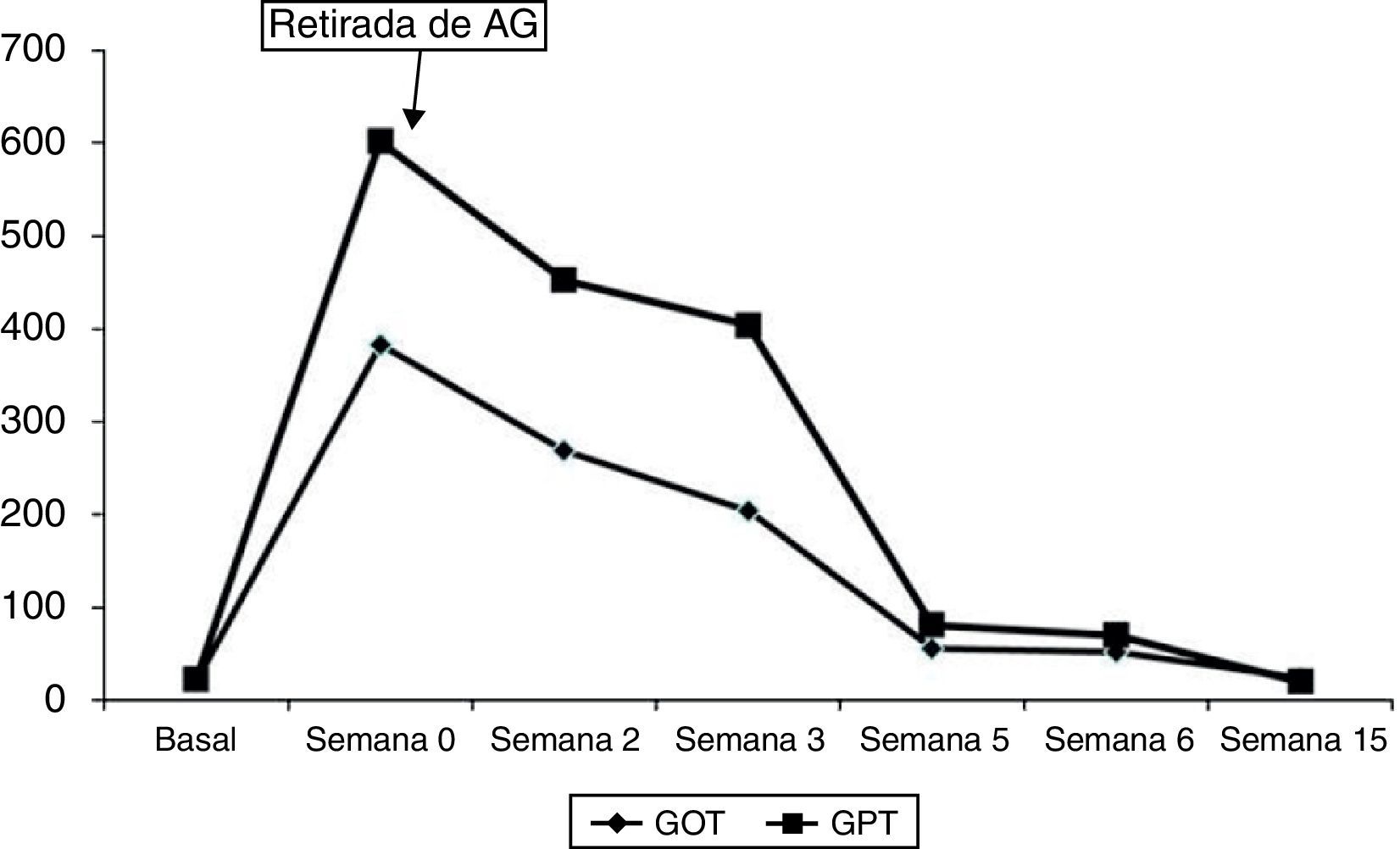
Mujer de 42 años diagnosticada de esclerosis múltiple en 2011. No tenía hábitos tóxicos ni otros antecedentes personales de interés. Recibió tratamiento con interferón beta desde octubre de 2011 hasta agosto de 2012, siendo suspendido por elevación de las transaminasas. En los análisis de control se normalizaron dichas alteraciones. Posteriormente comienza tratamiento con AG 20mg al día por vía subcutánea, con buena tolerancia. A los 6 meses de iniciar el tratamiento presenta de nuevo elevación de las transaminasas. La paciente no había recibido ninguna otra medicación en el último año y no presentaba ningún síntoma. El examen físico era normal, sin presencia de signos de hepatopatía crónica. Los datos analíticos mostraban: aspartato aminotransferasa (AST):383UI/ml (VN:10-35UI/l), alanina aminotransferasa (ALT):602UI/l (VN: 0-33UI/l) y bilirrubina total (BT):2,2mg/dl (VN:0,1-0,9mg/dl). El hemograma y el resto de determinaciones bioquímicas no presentaban anomalías. La serología de los virus de la hepatitis A, B, C, E y de citomegalovirus, virus de Epstein-Barr, herpes simple y toxoplasma fueron todos negativos. Igualmente el estudio de autoinmunidad: antinucleares (ANA), antimúsculo liso, antimitocondriales, anticitoplasma de neutrófilos, anti-LKM, anti-DNA, anti-LC1 y anti-SLA resultaron negativos, y las inmunoglobulinas estaban en cifras normales. En la ecografía abdominal no había lesiones hepáticas y se descartaron alteraciones obstructivas de la vía biliar. Se practicó una biopsia hepática que reveló la existencia de un infiltrado inflamatorio compuesto por eosinófilos y células plasmáticas alrededor de las venas centrolobulillares y pérdida de hepatocitos y presencia de cuerpos apoptóticos. No había signos de hepatitis de interfase, colestasis, esteatosis o hialina de Mallory. Con tinciones especiales no se observaba depósito de hierro, gotas hialinas PAS-diastasa positivas ni fibrosis. El resultado era sugestivo de hepatitis tóxica medicamentosa (fig. 1). Tras un mes sin AG las pruebas de función hepática retornaron a la normalidad (fig. 2), aunque los ANA se hicieron positivos a título de 1/640.
A) Se aprecia la arquitectura hepática conservada y el aumento de infiltrado inflamatorio en espacio porta y alrededor de vena centrolobulillar (hematoxilina-eosina 40×). B) A mayor aumento, el infiltrado inflamatorio compuesto por linfocitos y células plasmáticas. Existe pérdida de hepatocitos y presencia de cuerpos apoptóticos. La flecha señala la vena centrolobulillar y el infiltrado inflamatorio rodeándola (hematoxilina-eosina 100×).
La EMRR es la forma más frecuente de presentación de la EM, suponiendo en España hasta el 65% de los casos. El tratamiento de primera línea es el interferón beta, utilizándose AG en casos de falta de respuesta al interferón o toxicidad. La tolerancia en general es buena y los efectos adversos más frecuentes suelen ser las reacciones locales en el punto de inyección y en menor medida reacciones alérgicas sistémicas.
Se han descrito casos de exacerbación de enfermedad autoinmune como miastenia gravis4, hipertiroidismo5 y hepatitis autoinmune2,6. En este sentido, se ha comprobado que el AG es un potente inductor de linfocitos Th2 supresores7, y su estructura antigénica, similar a la proteína básica de la mielina, puede provocar una reacción cruzada que aumenta la expresión de citocinas antiinflamatorias8. Además, la propia transformación de linfocitos Th1 a Th2, o incluso la acción del manitol existente en la formulación comercial del AG (Copaxone®) podrían originar una alteración en la respuesta inmune.
En nuestro caso, los autoanticuerpos inicialmente eran negativos y posteriormente se positivizaron los ANA a título de 1/640, por lo que probablemente el mecanismo de toxicidad hepática pudo ser de base inmune. De todas formas, la negatividad del resto de anticuerpos, los valores normales de inmunoglobulinas, la ausencia de datos histológicos compatibles con hepatitis autoinmune y la normalización de todos los parámetros bioquímicos al suspender el fármaco descartaban la posibilidad de una hepatitis autoinmune desencadenada por el AG.
En la revisión de la literatura, se han comunicado únicamente 3 casos de hepatitis tóxica en relación con AG3,9,10. En ellos se describe una hepatotoxicidad subaguda, que sucede en los primeros 3-4 meses de tratamiento. Nuestra paciente, sin embargo, presenta una toxicidad hepática algo más tardía, si bien la ausencia de datos analíticos disponibles antes de los 6 meses no descarta que pudiese comenzar con anterioridad. De cualquier modo, debería valorarse la realización de determinaciones periódicas de los parámetros de función hepática en los pacientes en tratamiento con este fármaco, dada la posibilidad de hepatotoxicidad a más largo plazo.
Al igual que en otra publicación9, también nuestra paciente presentó toxicidad hepática previa por interferón beta, pudiendo ser ello un marcador que podría relacionarse con un aumento de sensibilidad a la toxicidad del AG.