La enfermedad hepática inducida por fármacos o hepatotoxicidad representa un desafío frecuente para la práctica médica, tanto por su presentación clínica heterogénea como por su evolución potencialmente impredecible1. Los factores de riesgo y los mecanismos fisiopatológicos involucrados en el desarrollo de esta reacción adversa a medicamentos son mayoritariamente desconocidos1. Describimos el caso de una paciente que presentó hepatitis toxica inducida por albendazol.
Mujer de 15 años, con asma leve tratado con salbutamol. En control con parasitología de otro centro hospitalario, entre 2009 y 2011 recibió 4 tratamientos con albendazol (400mg cada 12h durante 7 días), por eosinofilia moderada asociada a IgG Toxocara canis positiva, asintomática, con estudio radiológico, ecocardiográfico y oftalmológico negativo. Usuaria de anticonceptivo combinado inyectable mensual desde noviembre de 2013. Negaba consumo de otros fármacos, hierbas, alcohol y drogas. No refería viajes ni mascotas. Sin antecedentes familiares de hepatopatía.
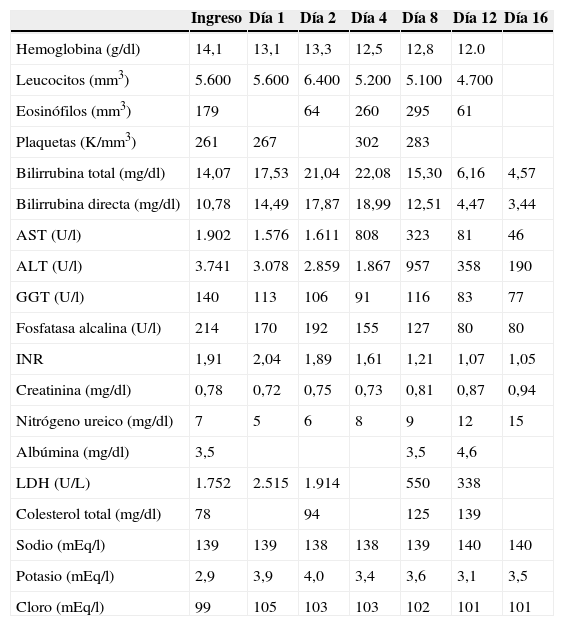
En diciembre de 2013, se detectó eosinofilia moderada durante un control, prescribiéndose nuevamente albendazol 400mg cada 12h durante 7 días ante la sospecha de reactivación asintomática de toxocariasis. A los 12 días de completado el tratamiento antiparasitario, consulta en nuestro servicio de urgencia por cuadro de una semana de evolución de ictericia, coluria y anorexia, náuseas y malestar epigástrico de carácter sordo. Ingresa hemodinámicamente estable, afebril, ictérica, sin estigmas de daño hepático crónico, sin evidencias de sangrado, examen abdominal y neurológico normal. Del laboratorio destacan hiperbilirrubinemia de predominio directo, elevación de las transaminasas, coagulopatía e hipokaliemia (tabla 1).
Pruebas de laboratorio desde el ingreso hasta el alta hospitalaria
| Ingreso | Día 1 | Día 2 | Día 4 | Día 8 | Día 12 | Día 16 | |
|---|---|---|---|---|---|---|---|
| Hemoglobina (g/dl) | 14,1 | 13,1 | 13,3 | 12,5 | 12,8 | 12.0 | |
| Leucocitos (mm3) | 5.600 | 5.600 | 6.400 | 5.200 | 5.100 | 4.700 | |
| Eosinófilos (mm3) | 179 | 64 | 260 | 295 | 61 | ||
| Plaquetas (K/mm3) | 261 | 267 | 302 | 283 | |||
| Bilirrubina total (mg/dl) | 14,07 | 17,53 | 21,04 | 22,08 | 15,30 | 6,16 | 4,57 |
| Bilirrubina directa (mg/dl) | 10,78 | 14,49 | 17,87 | 18,99 | 12,51 | 4,47 | 3,44 |
| AST (U/l) | 1.902 | 1.576 | 1.611 | 808 | 323 | 81 | 46 |
| ALT (U/l) | 3.741 | 3.078 | 2.859 | 1.867 | 957 | 358 | 190 |
| GGT (U/l) | 140 | 113 | 106 | 91 | 116 | 83 | 77 |
| Fosfatasa alcalina (U/l) | 214 | 170 | 192 | 155 | 127 | 80 | 80 |
| INR | 1,91 | 2,04 | 1,89 | 1,61 | 1,21 | 1,07 | 1,05 |
| Creatinina (mg/dl) | 0,78 | 0,72 | 0,75 | 0,73 | 0,81 | 0,87 | 0,94 |
| Nitrógeno ureico (mg/dl) | 7 | 5 | 6 | 8 | 9 | 12 | 15 |
| Albúmina (mg/dl) | 3,5 | 3,5 | 4,6 | ||||
| LDH (U/L) | 1.752 | 2.515 | 1.914 | 550 | 338 | ||
| Colesterol total (mg/dl) | 78 | 94 | 125 | 139 | |||
| Sodio (mEq/l) | 139 | 139 | 138 | 138 | 139 | 140 | 140 |
| Potasio (mEq/l) | 2,9 | 3,9 | 4,0 | 3,4 | 3,6 | 3,1 | 3,5 |
| Cloro (mEq/l) | 99 | 105 | 103 | 103 | 102 | 101 | 101 |
Ingresó en la unidad de cuidados intensivos para monitorización, tratamiento de soporte y vitamina K endovenosa. Se interconsultó al centro de derivación de trasplantes, quienes sugirieron monitorizar e iniciar estudio pretrasplante. El estudio de agentes etiológicos de hepatitis se muestra en la tabla 2. La ecografía abdominal mostró un hígado de morfología normal; colapso de la vesícula biliar sugerente de enfermedad inflamatoria hepática; vía biliar de calibre normal; sin otros hallazgos patológicos.
Estudio etiológico de daño hepático realizado a nuestra paciente
| Estudio etiológico | Resultado (rango normal) |
|---|---|
| Inmunoglobulina M virus hepatitis A | Negativo |
| HBsAg | Negativo |
| Anticuerpo virus hepatitis C | Negativo |
| Anticuerpos VIH | Negativo |
| Inmunoglobulina M citomegalovirus | Negativo |
| Inmunoglobulina M virus Epstein-Barr | Negativo |
| Anticuerpos antinucleares | Negativo |
| Anticuerpos anti-musculo liso | Negativo |
| Anticuerpos anti-LKM1 | Negativo |
| Ceruloplasmina | 26 (19-57) |
| Inmunoglobulina A (mg/dl) | 148 (52-193) |
| Inmunoglobulina G (mg/dl) | 2.100 (697-1.593) |
| Inmunoglobulina M (mg/dl) | 122 (47-331) |
Presentó una evolución favorable, con rápida remisión de su sintomatología, sin encefalopatía, mejoría progresiva del perfil hepático y las pruebas de coagulación (tabla 1). Considerando lo anterior, sumado al estudio negativo para otras etiologías, se desestimó realizar una biopsia hepática. Recibió alta hospitalaria luego de 16 días de monitorización. Se le recomendó suspender futuras inyecciones de anticonceptivos. Se controló ambulatoriamente en un mes, asintomática y con normalización del perfil hepático, no ha utilizado nuevamente anticonceptivos hormonales.
El diagnóstico de hepatotoxicidad idiosincrática es complejo, tanto por la diversidad de presentaciones clínicas como por la carencia de marcadores específicos, siendo necesaria una evaluación cuidadosa de otras causas de daño hepático. Se descartaron en esta paciente otras causas de hepatitis aguda con elevación de transaminasas sobre 10 veces el límite superior al normal, incluyendo: infecciones virales, enfermedades autoinmunes, hepatitis isquémica y enfermedad de Wilson. Adicionalmente, la hepatotoxicidad suele manifestarse entre los 5 y 90 días postexposición a un medicamento2. Aunque nuestra paciente inicio tratamiento con albendazol y con anticonceptivos conjugados dentro de este rango temporal, el patrón hepatocelular hace improbable una hepatitis inducida por estrógenos, asociada clásicamente a un patrón colestásico1. La paciente presentó una mejoría espontanea del perfil hepático en ausencia del medicamento, apoyando el diagnóstico de hepatitis tóxica por albendazol. Intentando objetivar nuestro diagnóstico, realizamos la escala cuantitativa Council for International Organizations of Medical Sciences (CIOMS), método de mayor validez y reproducibilidad para valorar la relación entre el potencial agente causal y la hepatotoxicidad2. Nuestra paciente presentó una puntuación CIOMS de 6, indicando una asociación probable entre consumo de albendazol y desarrollo de hepatitis.
El albendazol es un antiparasitario de amplio espectro, utilizado para tratar infecciones por helmintos3. Se han descrito escasas reacciones adversas a este medicamento, siendo las más comunes la intolerancia digestiva y el prurito4. Alteraciones leves de las pruebas hepáticas secundarias a la ingesta de este fármaco han sido reportadas como una complicación infrecuente asociada a tratamientos con dosis altas y por períodos prolongados3.
Existen escasos reportes de hepatitis tóxica inducida por albendazol4–9. Similar a nuestro caso, todos fueron cuadros de hepatitis con patrón hepatocelular sin encefalopatía4–9. La mayoría presentó nula o escasa alteración de coagulación4–8, mientras que nuestra paciente manifestó una coagulopatía significativa. Cuatro reportes precedentes también señalaron el antecedente de hepatitis atribuibles al consumo de albendazol4,7–9. Desafortunadamente, nuestra paciente no contó con controles previos de función hepática. Las biopsias hepáticas realizadas en 2 casos demostraron patrones histológicos distintos y escasa utilidad diagnóstica6,7.
Se desconoce el mecanismo mediante el cual albendazol produce hepatotoxicidad. Reportes anteriores han sugerido que pudiesen estar involucrados distintos polimorfismos de nucleótido simple del gen CYP3A4, asociados a reacciones idiosincráticas5,8. También han planteado reacciones alérgicas o autoinmunes como responsables de su hepatotoxicidad5,7,8, siendo este último mecanismo sugerido en nuestra paciente por una elevación de inmunoglobulina G. Se han descrito alteraciones en la funcionalidad de hepatocitos secundarias a modificaciones en la expresión y distribución de componentes del citoesqueleto en modelos experimentales de hepatitis alcohólica10. El albendazol teóricamente pudiese deteriorar la función hepática por este mecanismo, al inhibir la polimerización y ensamblaje de microtúbulos3.
Recalcamos la importancia de recordar la hepatotoxicidad idiosincrática como un efecto adverso del albendazol, la necesidad de controlar la función hepática en pacientes tratados con este fármaco, y considerar antiparasitarios alternativos en pacientes con alteraciones del perfil hepático en tratamientos anteriores.
Conflicto de interesesLos autores declaran no tener relaciones personales o financieras que pudieran dar lugar a conflictos de intereses..
Consentimiento informadoLa tutora legal de la paciente firmó un consentimiento informado, autorizando la revisión de la historia clínica y la publicación del caso clínico con fines científicos, cumpliendo el protocolo establecido por el comité de ética local.