El hígado graso no alcohólico (HGNA) se caracteriza por la acumulación de ácidos grasos libres y triglicéridos en el citoplasma de los hepatocitos, preferentemente en forma de grandes vacuolas de grasa, en pacientes sin un consumo tóxico de alcohol (≤3UBE/d en hombres y ≤2UBE/d en mujeres) y no asociado a otras enfermedades hepáticas1. Aunque, en general, el HGNA sigue un curso benigno, un subgrupo de estos pacientes pueden presentar una esteatohepatitis no alcohólica (EHNA), que se caracteriza por la presencia de degeneración hidrópica de los hepatocitos e inflamación lobular con o sin fibrosis perisinusoidal, que puede progresar a cirrosis y carcinoma hepatocelular y puede ser causa de muerte por hepatopatía2.
El HGNA es la primera causa de hepatopatía en el mundo occidental, con una prevalencia del 20-30% según los criterios utilizados en los diferentes estudios3–5 y va en aumento en relación con el incremento de la obesidad y de la diabetes tipo 2.
EtiologíaLos factores etiológicos que se asocian a la presencia de HGNA se clasifican en primarios, que son los más importantes, y están relacionados con los diferentes componentes que conforman el síndrome metabólico (SM): obesidad, diabetes tipo 2 y dislipidemia6–9. El HGNA sería el componente hepático del SM. La resistencia a la insulina (RI) sería la alteración determinante de la esteatosis y esta, con el concurso de otros elementos, de los trastornos inflamatorios (IL-6, TNFα), estrés oxidativo, disfunción mitocondrial, de la aparición de EHNA y fibrosis10–14. Los factores secundarios son menos frecuentes, y están relacionados con el consumo de ciertos fármacos (corticoides, estrógenos, amiodarona, tamoxifeno), entre otros, cirugía bariátrica, nutrición parenteral, enfermedades metabólicas congénitas y otros tóxicos6,7. En la práctica clínica muchos pacientes con HGNA tienen obesidad, diabetes tipo 2 o dislipidemia como factor etiológico, siendo frecuente la asociación de diversos factores.
Manifestaciones clínicas y de laboratorioEn general es una enfermedad asintomática y habitualmente se manifiesta como astenia, debilidad y, ocasionalmente, pueden referir molestias y/o dolor en el hipocondrio derecho. La exploración física puede ser normal o bien detectar obesidad o hepatomegalia blanda e indolora y, en los pacientes con fibrosis avanzada y cirrosis, signos de hipertensión portal como ascitis, esplenomegalia o ictericia15.
Analíticamente la mayoría de los enfermos presentan una alteración discreta de las pruebas de función hepática cuando se solicita una analítica general por cualquier motivo. La hipertransaminasemia leve o moderada es el principal hallazgo en los pacientes con HGNA16. A veces cursan con una elevación discreta de los marcadores de colestasis, especialmente la GGT, lo que varios estudios han relacionado con la diabetes, la obesidad y más específicamente con la RI17. Entre un 21 y un 40% de los pacientes cursan con un aumento moderado de la ferritina y del índice de saturación de la transferrina sin que se haya demostrado un aumento paralelo en la concentración intrahepática de hierro18.
Otras veces la enfermedad se manifiesta ante las alteraciones ecográficas cuando se solicita la realización de ecografía por la alteración de la analítica o por cualquier otro motivo.
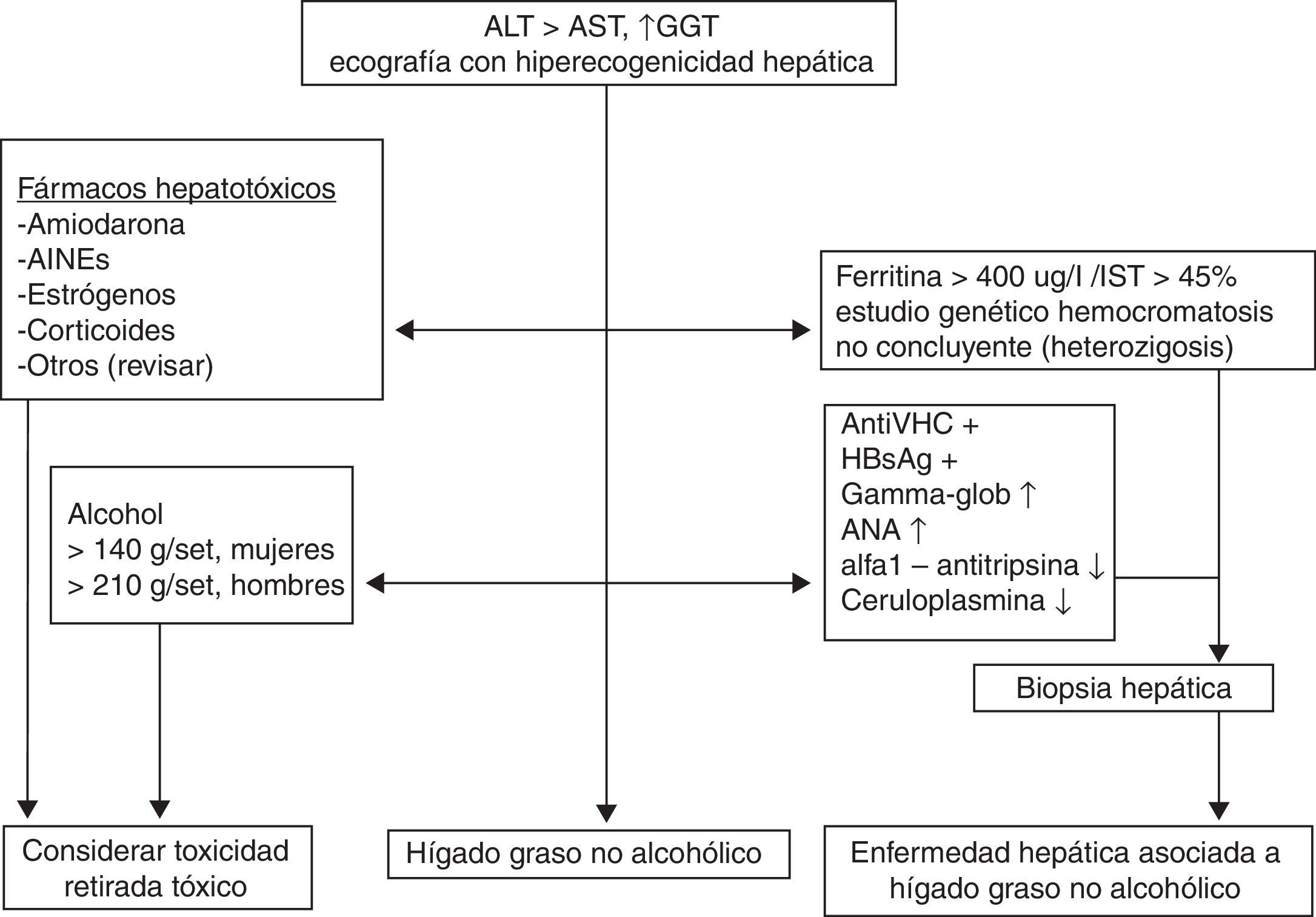
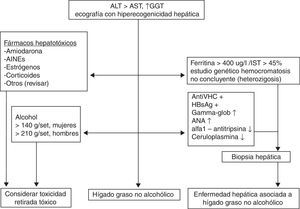
Diagnóstico (fig. 1)Ante una persona con alteración de la ALT y la presencia de esteatosis en la ecografía abdominal en el contexto de un paciente con SM, tendremos que descartar siempre la presencia de otras hepatopatías, tales como tóxicas, víricas, autoinmunes y metabólicas6. En caso de descartar estas hepatopatías, estaremos ante un paciente con un probable HGNA. En estos casos, lo más adecuado es adoptar una serie de medidas higienicodietéticas durante 4 a 6 meses y ver cómo evoluciona la analítica. De manera que, si el paciente mejora haremos controles periódicos y en caso de continuar igual se le tendrá que derivar para hacer una biopsia o, mediante las herramientas diagnósticas actuales, estudiar si el paciente presenta fibrosis y, en función de la gravedad de la misma, plantear si tiene que hacerse un seguimiento especializado.
Diagnóstico del HGNA. AINE: antiinflamatorios no esteroideos; ALT: alanino aminotransferasa; ANA: anticuerpos antinucleares; AST: aspartato aminotransferasa; GGT: gamma glutamiltransferasa; HBsAg: antígeno de superficie de la hepatitis B; HGNA: hígado graso no alcohólico; IST: índice de saturación de la transferrina; VHC: virus de la hepatitis C.
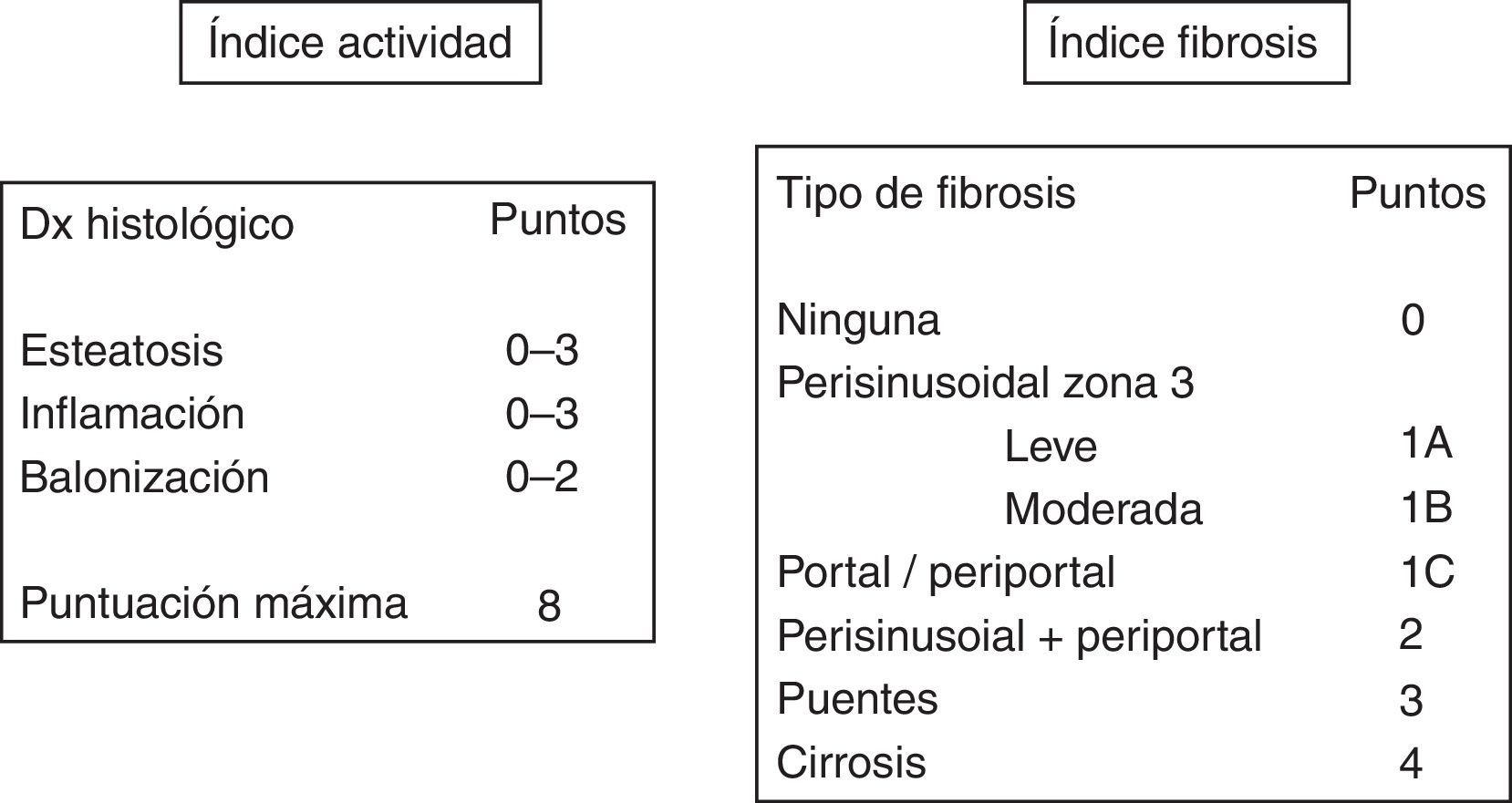
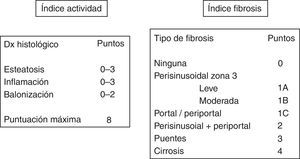
La biopsia hepática sigue siendo el método de elección para diagnosticar el HGNA y el único capaz de distinguir entre el hígado graso simple y la EHNA. Además, permite clasificar la enfermedad de acuerdo al grado de actividad (grado de inflamación y de daño celular) y la intensidad de la fibrosis, lo que permitirá establecer el pronóstico6. Para unificar criterios un grupo de expertos establecieron un índice de actividad (NAS score)19 que incluye la esteatosis (0-3), la inflamación lobular (0-3) y la degeneración hidrópica celular (0-2), de manera que un índice≥5 permite el diagnóstico de certeza de EHNA, mientras que un índice≤3 lo excluye. Dado que la fibrosis es la lesión que más condiciona el pronóstico, también se ha establecido una gradación en 4 estadios de fibrosis: 1 pericelular, 2 portal, 3 con puentes y 4 cirrosis (fig. 2).
La biopsia hepática tiene una serie de inconvenientes o limitaciones como son el error de muestreo, el tamaño de la biopsia, la variabilidad en la interpretación por parte del patólogo, el coste y, aunque baja, la morbilidad inherente a todo procedimiento invasivo.
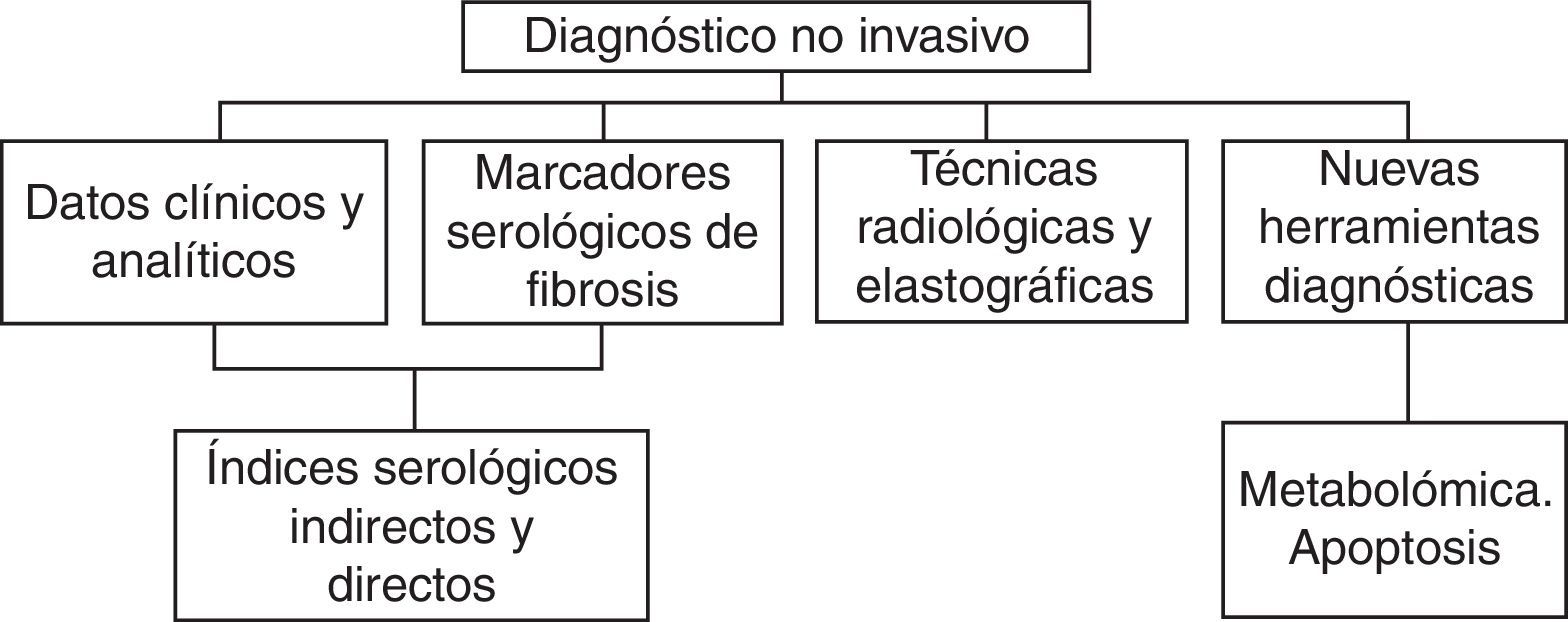
Diagnóstico no invasivo (fig. 3)En los últimos años se han desarrollado diferentes pruebas de imagen y elastográficas y numerosos marcadores serológicos que pretenden diagnosticar y cuantificar el HGNA, así como poder predecir la existencia de EHNA o fibrosis avanzada20. Un buen marcador debe ser fácil de realizar, tener un bajo coste y una sensibilidad y especificidad apropiadas, siendo la mejor manera de evaluar el test el análisis de las curvas ROC y el área bajo la curva (AUROC), que evalúa la probabilidad de encontrar un resultado positivo verdadero frente a un resultado positivo falso. Cuando el AUROC es superior a 0,80 se considera que tiene una buena precisión.
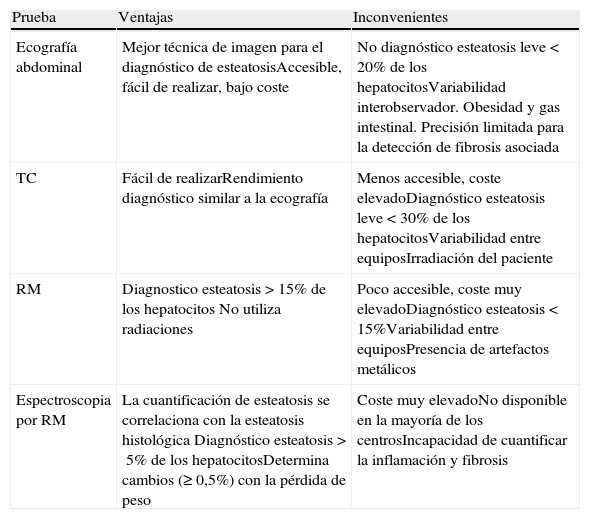
Pruebas de imagenPruebas de imagen convencionales. Las pruebas de imagen convencionales (ecografía [US], tomografía computarizada [TC] y resonancia magnética [RM]) son de utilidad para visualizar los cambios en la morfología hepática secundarios a la acumulación de grasa en el hígado y permiten evidenciar con alta especificidad los cambios relacionados con cirrosis en caso de EHNA en evolución cirrótica. Por otro lado, ninguna de ellas hasta la fecha permite diferenciar de forma segura la esteatosis simple de la EHNA (tabla 1).
Pruebas de imagen en el diagnostico del HGNA
| Prueba | Ventajas | Inconvenientes |
| Ecografía abdominal | Mejor técnica de imagen para el diagnóstico de esteatosisAccesible, fácil de realizar, bajo coste | No diagnóstico esteatosis leve<20% de los hepatocitosVariabilidad interobservador. Obesidad y gas intestinal. Precisión limitada para la detección de fibrosis asociada |
| TC | Fácil de realizarRendimiento diagnóstico similar a la ecografía | Menos accesible, coste elevadoDiagnóstico esteatosis leve<30% de los hepatocitosVariabilidad entre equiposIrradiación del paciente |
| RM | Diagnostico esteatosis>15% de los hepatocitos No utiliza radiaciones | Poco accesible, coste muy elevadoDiagnóstico esteatosis<15%Variabilidad entre equiposPresencia de artefactos metálicos |
| Espectroscopia por RM | La cuantificación de esteatosis se correlaciona con la esteatosis histológica Diagnóstico esteatosis>5% de los hepatocitosDetermina cambios (≥0,5%) con la pérdida de peso | Coste muy elevadoNo disponible en la mayoría de los centrosIncapacidad de cuantificar la inflamación y fibrosis |
HGNA: hígado graso no alcohólico; RM: resonancia magnética; TC: tomografía computarizada.
US. Es la prueba de imagen de primer nivel en caso de sospecha diagnóstica de HGNA debido a su bajo coste, seguridad, accesibilidad y posibilidad de repetición. Los signos diagnósticos de esteatosis incluyen: a) aspecto hiperecogénico (brillante) del hígado, que resulta más evidente en comparación con el aspecto del parénquima renal o esplénico; b) atenuación de la transmisión de los ultrasonidos a los segmentos posteriores del hígado y c) disminución de visualización de las paredes del árbol vascular intrahepático y de la vesícula biliar. El rendimiento de la US para diagnosticar esteatosis varía considerablemente entre estudios (sensibilidad: 60-94%; especificidad: 66-95%)21–23, principalmente a causa de su baja sensibilidad para diagnosticar esteatosis leve (<20% de los hepatocitos)24. Por otra parte, la US con contraste permite confirmar la presencia de depósito focal de grasa y hacer el diagnóstico diferencial de lesiones focales.
TC. Permite diagnosticar esteatosis hepática sin emplear medio de contraste. La TC tiene un buen rendimiento para diagnosticar esteatosis>30% (sensibilidad 73-100% y especificidad 95-100%), siendo similar al de la US25.
RM. No utiliza radiación ionizante y tiene pocas contraindicaciones. El estudio, que en la actualidad es muy rápido y no requiere administración de contraste, permite diagnosticar esteatosis>15% con alta fiabilidad26. Sin embargo, la técnica es subóptima para diagnosticar esteatosis<15%.
Espectroscopia por RM del hidrógeno. Esta técnica es la más exacta disponible hasta la fecha para cuantificar de forma no invasiva la esteatosis hepática. La cuantificación de la esteatosis obtenida por esta técnica se correlaciona estrechamente con la esteatosis histológica y puede diagnosticar niveles de contenido hepático en triglicéridos>5%; además, es fiable para determinar los cambios (≥0,5%) en el grado de esteatosis después de la disminución del peso27.
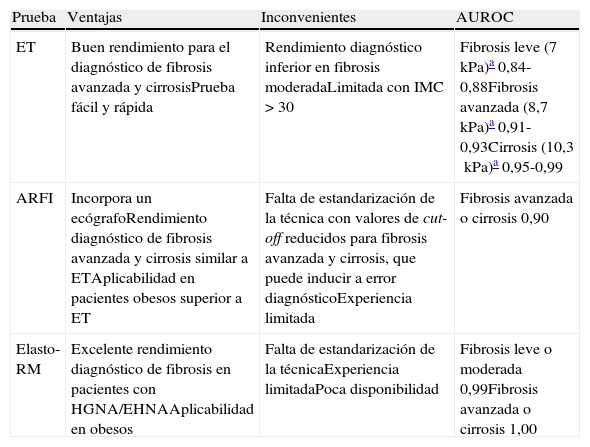
Métodos elastográficos. Los métodos elastográficos permiten cuantificar la rigidez de los tejidos, cuyo componente principal en el hígado es la fibrosis (tabla 2).
Pruebas elastográficas en el diagnóstico de fibrosis en el HGNA
| Prueba | Ventajas | Inconvenientes | AUROC |
| ET | Buen rendimiento para el diagnóstico de fibrosis avanzada y cirrosisPrueba fácil y rápida | Rendimiento diagnóstico inferior en fibrosis moderadaLimitada con IMC>30 | Fibrosis leve (7kPa)a 0,84-0,88Fibrosis avanzada (8,7kPa)a 0,91-0,93Cirrosis (10,3kPa)a 0,95-0,99 |
| ARFI | Incorpora un ecógrafoRendimiento diagnóstico de fibrosis avanzada y cirrosis similar a ETAplicabilidad en pacientes obesos superior a ET | Falta de estandarización de la técnica con valores de cut-off reducidos para fibrosis avanzada y cirrosis, que puede inducir a error diagnósticoExperiencia limitada | Fibrosis avanzada o cirrosis 0,90 |
| Elasto-RM | Excelente rendimiento diagnóstico de fibrosis en pacientes con HGNA/EHNAAplicabilidad en obesos | Falta de estandarización de la técnicaExperiencia limitadaPoca disponibilidad | Fibrosis leve o moderada 0,99Fibrosis avanzada o cirrosis 1,00 |
ARFI: acoustic radiation force impulse imaging; AUROC: área bajo la curva ROC: EHNA: esteatohepatitis no alcohólica; ET: elastografía de transición; HGNA: hígado graso no alcohólico; IMC: índice de masa corporal; RM: resonancia magnética.
La elastografía de transición (ET, FibroScan®, Echosens, Francia) mide por ultrasonidos la velocidad de propagación de una onda mecánica expresada en kilo Pascales (kPa). A mayor velocidad de propagación, mayor rigidez del tejido. A nivel hepático, la velocidad de propagación del área explorada (1cm de diámetro y 2-4cm de longitud) se relaciona con el grado de fibrosis presente en el parénquima28.
En pacientes con HGNA/EHNA la ET tiene una aplicabilidad menor que en otras hepatopatías debido a la elevada prevalencia de obesidad en esta población: se han reportado fallos técnicos en el 10-16% de los sujetos, en gran parte debido a la atenuación de la onda elástica por parte de la grasa subcutánea en pacientes con un IMC>3029. Los resultados procedentes de los estudios con la sonda XL, que permite una mayor penetración de la onda, muestran una mejora del rendimiento diagnóstico y permitirá poder hacer la ET en estos enfermos30. El rendimiento diagnóstico para diagnosticar fibrosis significativa (definida como fibrosis al menos perisinusoidal y portal/periportal) es inferior a la reportada en pacientes con hepatopatía por otras etiologías (AUROC: 0,84-0,88). En cambio, el rendimiento es bueno para diagnosticar fibrosis avanzada (AUROC: 0,91-0,93), y óptimo para diagnosticar cirrosis (AUROC: 0,95-0,99)7. Los valores de corte aceptados, según los resultados de varios estudios, en pacientes con HGNA son 7,0kPa para fibrosis significativa; 8,7kPa para fibrosis avanzada y 10,3kPa para cirrosis29,31-33. Los valores de corte para evaluar la fibrosis son inferiores a los de los enfermos con infección crónica del virus de la hepatitis C34,35. Por estos motivos, hemos de recomendar prudencia ya que estos valores pueden variar considerablemente en diferentes poblaciones y se necesitan estudios de validación en nuestra población para ver cuáles serían los mejores valores.
Acoustic radiation force impulse imaging (ARFI). Este método de sonoelastografía se implementa en un equipo ecográfico tradicional (Siemens ACUSON S2000), y permite posicionar la zona de interés bajo control visual36. Su aplicabilidad en pacientes obesos es superior a la de la ET; en los estudios disponibles hasta hoy su fiabilidad para diagnosticar fibrosis avanzada o cirrosis en pacientes con HGNA parece similar a la de la ET (AUROC: 0,90)37.
Elastografía por resonancia magnética. Es un nuevo método capaz de estudiar las propiedades elásticas en una región de interés del parénquima hepático. Por medio de una secuencia específica, esta técnica permite medir la propagación de las ondas mecánicas (vibraciones de baja frecuencia generadas externamente por un driver y transmitidas al paciente a través de una banda posicionada en la parte derecha del tórax), que se visualizan en forma de un elastograma cuantitativo (expresado en kPa). La fiabilidad de esta técnica para diagnosticar fibrosis hepática avanzada es superior al 85% y próxima al 100% para descartar la existencia de fibrosis. Además, la medición simultánea de rigidez hepática y esplénica se ha demostrado de utilidad para diagnosticar hipertensión portal. En un estudio llevado a cabo en 58 pacientes con HGNA, la rigidez hepática fue significativamente diferente en pacientes con HGNA, EHNA sin fibrosis y EHNA con fibrosis, y la técnica tuvo una óptima capacidad para discriminar entre HGNA y EHNA con fibrosis (AUROC=0,93; mejor valor de corte: 2,74kPa sensibilidad 94% y especificidad 73%)38.
Controlled attenuation parameter (CAP). Es una nueva aplicación de la ET disponible en los aparatos de última generación, que permite estimar de forma inmediata y no invasiva la esteatosis; la medición es contemporánea a la de rigidez hepática y por tanto sufre de las mismas limitaciones. El CAP mide el grado de atenuación de la onda de ultrasonidos transmitida a través del hígado, que es proporcional a la cantidad de grasa hepática39. Los datos publicados hasta la fecha indican que el CAP es capaz de diagnosticar esteatosis incluso en estadios leves (>11%), y que puede discriminar entre esteatosis leve y grave, ya que tiene una buena correlación con el grado de esteatosis40.
Marcadores serológicos (tabla 3)Marcadores de HGNALa presencia de factores de riesgo coexistentes como diabetes, SM y obesidad con elevación de las transaminasas (sobre todo la ALT) aumenta las posibilidades de presentar HGNA como causa del aumento de la ALT. No obstante, aunque la ALT es un test útil no es válido para predecir la presencia de HGNA dado que puede cursar con ALT normal41. La combinación de marcadores serológicos y alguna técnica de imagen mejoran el rendimiento diagnóstico.
Marcadores serológicos del HGNA
| Test | Marcadores | Objetivo |
| OWL Liver Test | Perfil metabólico (lípidos) | Distinción entre HGNA y EHNA |
| CK-18 | Fragmentos de citoqueratina | Distinción entre HGNA y EHNA |
| EFL score | AH, TIMP-1, P3NP | Distinción fibrosis |
| NAFLD Fibrosis Score | Edad, IMC, glucemia, plaquetas, albúmina y cociente AST/ALT | Distinción fibrosis |
AH: ácido hialurónico; ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; CK-18: fragmentos de citoqueratina 18; EFL: Enhanced Liver Fibrosis; EHNA: esteatohepatitis no alcohólica; HGNA: hígado graso no alcohólico; IMC: índice de masa corporal; P3NP: péptido terminal del procolágeno 3; TIMP-1: inhibidor de las metaloproteinasas.
La diferenciación entre HGNA y EHNA tiene implicaciones pronósticas y no se pueden diferenciar mediante los signos clínicos y los síntomas, por lo que se han evaluado numerosos marcadores séricos para predecir la existencia de EHNA, como marcadores inflamatorios que incluyen la proteína C reactiva, interleucina 6, ácido hialurónico, TNFα, o marcadores de estrés oxidativo, como lipoproteína de baja densidad oxidizada, entre otros. Sin embargo, tanto unos como otros han sido evaluados en series cortas o estudios pilotos y con resultados contradictorios por lo que, de momento, no son recomendables en la práctica clínica diaria.
Es bien conocido que la apoptosis desempeña un papel fundamental en la patogenia de la EHNA. Entre los diferentes marcadores de apoptosis, la citoqueratina 18 (CK-18) es uno de los biomarcadores más prometedores en la detección no invasiva de la EHNA. Los niveles plasmáticos de la CK-18 están significativamente aumentados en pacientes con EHNA en comparación con pacientes con HGNA42. Estas observaciones se han podido reproducir en otros estudios y en un reciente metaanálisis se ha observado que los niveles plasmáticos de CK-18 tienen una sensibilidad del 78%, una especificidad del 86% y una AUROC de 0,82 para identificar EHNA en pacientes con HGNA7, lo que hace que la CK-18 sea el parámetro sencillo más consistente para diferenciar el HGNA de la EHNA. No obstante, este análisis no está disponible comercialmente. De hecho, la AASLD aún no lo recomienda en la práctica clínica diaria.
Recientemente un grupo español ha desarrollado un test no invasivo basado en la metabolómica que permite evaluar la progresión del HGNA, el OWL Liver Test43. Los autores estudiaron el perfil metabólico de 467 pacientes con biopsia hepática (90 normal, 246 con HGNA y 131 con EHNA), y observaron que el perfil metabólico dependía del IMC, evidenciando que el mecanismo patogénico del HGNA podía ser diferente según el nivel individual del grado de obesidad, y que permitía diferenciar entre EHNA y HGNA. Mediante un modelo multivariante pudieron separar a los pacientes con y sin EHNA con una buena especificidad y sensibilidad. El test ya esta validado y comercializado y en estos momentos se encuentra en fase de difusión.
Marcadores de fibrosis avanzadaAunque se han evaluado biomarcadores sencillos para predecir la presencia de fibrosis significativa y/o cirrosis como el ácido hialurónico o el colágeno S tipo iv, los 2 test más prometedores y estudiados son el Enhanced Liver Fibrosis (ELF Score) y el NAFLD Fibrosis Score (NFS).
El ELF Score se evaluó en más de 1.000 pacientes, incluyendo 61 con HGNA, combinando la edad y la determinación de los niveles de 3 proteínas del recambio de la matriz celular (ácido hialurónico, TIMP-1 y P3NP). El AUROC para fibrosis avanzada fue de 0,87, aumentando a 0,9 cuando el mismo sistema de puntuación, excluyendo la edad, se aplicó a 196 pacientes44. La limitación de este estudio es la cohorte relativamente pequeña estudiada de pacientes con HGNA.
El NFS es el sistema de puntuación más estudiado45. El índice incluye 6 variables fáciles de obtener (edad, IMC, glucemia, recuento de plaquetas, albúmina y la relación AST/ALT) y se calcula utilizando la fórmula publicada (http://nafldscore.com). En un metaanálisis de 13 estudios incluyendo 3.064 pacientes, el NFS presentó una AUROC de 0,85 en la predicción de fibrosis avanzada (fibrosis en puentes o cirrosis), de modo que una puntuación<−1,455 tuvo una sensibilidad del 90% y una especificidad del 60% para excluir fibrosis avanzada, mientras que una puntuación>0,676 tuvo una sensibilidad del 67% y una especificidad del 97% para identificar la presencia de fibrosis avanzada7. Más recientemente en otro estudio el NFS discriminó bien a los pacientes con HGNA según el grado de fibrosis (leve, moderada o grave) en la predicción de complicaciones relacionadas con la enfermedad hepática, así como con la probabilidad de trasplante o fallecimiento46.
Hígado graso no alcohólico y enfermedad cardiovascularEl HGNA se relaciona de forma muy estrecha con la enfermedad cardiovascular (ECV)47–49, sobre todo con el engrosamiento de la capa íntima-media de la arteria carótida como manifestación de la presencia de ateromatosis subclínica50. El HGNA se presenta como un problema de salud cada vez más importante en la población general, tanto por su alta incidencia como por su morbimortalidad, especialmente en los pacientes que tienen una EHNA50. La elevada incidencia y prevalencia se debe a su estrecha relación con el SM, de manera que existen una serie de factores de riesgo comunes, como la diabetes, la obesidad, la RI y la dislipidemia, implicados en el desarrollo tanto de la ECV como del HGNA51, si bien algunos estudios sugieren que el HGNA podría ser un factor de riesgo independiente del SM.
Fisiopatológicamente, la obesidad abdominal da lugar a una inflamación crónica del hígado aumentando el estrés oxidativo, la presencia de esteatosis y la aparición de RI. Ello, junto con la presencia de SM, provoca la disfunción endotelial constituyendo el primer paso en el HGNA del proceso aterosclerótico asociado a él. La aterosclerosis es la manifestación inicial del desarrollo de la enfermedad cardiovascular. Es un proceso lento, desarrollándose de manera silente y estando muy avanzada cuando aparecen los síntomas. Por ello, el diagnóstico precoz ha de hacerse en la fase de ateromatosis subclínica, cuando es posible modificar la evolución de la enfermedad y disminuir el riesgo cardiovascular48,52. Las pruebas más útiles para el diagnóstico precoz son la ecografía carotidea (medición de la capa íntima-media de la pared de las carótidas)53, el índice tobillo-brazo54; también puede ser de utilidad la ecografía del eje arterial aorto-ilíaco-femoral para la identificación de placas55,56. La TC para la detección de placas calcificadas coronarias y cerebrales, y la RM para estudio del parénquima cerebral (lesiones de la sustancia blanca secundaria a vasculopatía) son métodos útiles de segundo nivel57. También se han documentado marcadores biológicos como la elevación de la concentración plasmática de algunos factores proinflamatorios y proaterogénicos como la PCR ultrasensible, el fibrinógeno o el plasminógeno activador-inhibidor (PAI-1), o bien una disminución de las adipocinas inflamatorias como la adiponectina58.
Recientemente, un metaanálisis ha demostrado una clara asociación entre el HGNA y la ECV, aunque se desconoce si esta estrecha relación se acompaña de una mayor mortalidad7. Así, algunos autores sugieren que, para que ello suceda los pacientes deben de estar en fase de EHNA mientras que otros concluyen que el simple hecho de padecer un HGNA es suficiente59. Más recientemente, diversos estudios han demostrado que si bien existe una estrecha asociación esta no se traduce en una mayor mortalidad60,61. Será necesario diseñar estudios controlados, con un amplio número de pacientes y un seguimiento lo suficientemente largo para ver si la asociación de HGNA y ECV se traslada a una mayor tasa de mortalidad.
No obstante estas limitaciones, la asociación de HGNA con la ECV se ha de tener en cuenta y debe tener una traducción en la práctica clínica diaria. La detección de un sujeto con HGNA nos debe alertar sobre la existencia de un mayor riesgo cardiovascular y debemos ser más activos en la búsqueda de la prevención primaria, lo que implica realizar pruebas de detección de la arteriosclerosis subclínica.
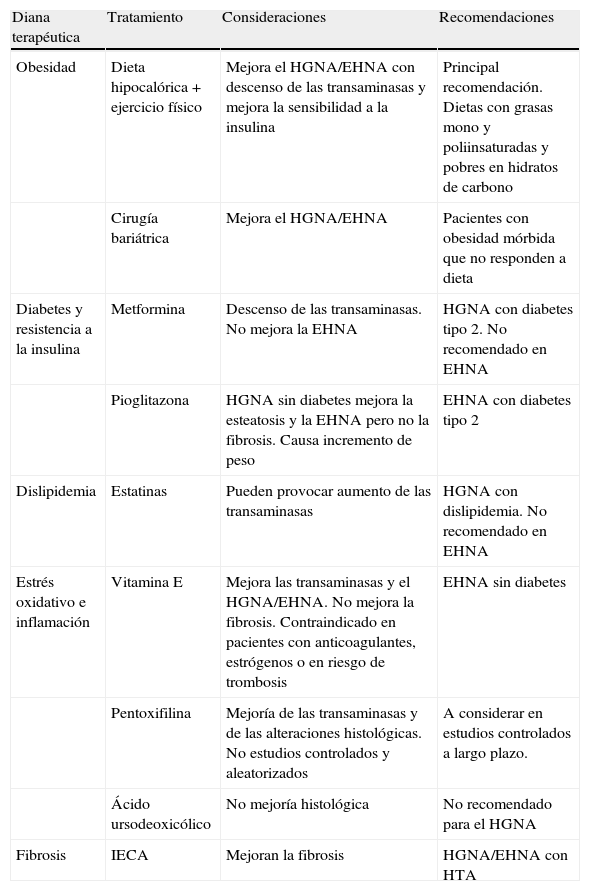
Tratamiento del hígado graso no alcohólico (tabla 4)Dado que no se conoce del todo la patogenia de la enfermedad no hay un tratamiento específico. Por ello se han de aplicar medidas generales relacionadas con los cambios de estilo de vida (dietéticos y actividad física) y tratar los factores asociados7,62–64.
Tratamiento del HGNA
| Diana terapéutica | Tratamiento | Consideraciones | Recomendaciones |
| Obesidad | Dieta hipocalórica+ejercicio físico | Mejora el HGNA/EHNA con descenso de las transaminasas y mejora la sensibilidad a la insulina | Principal recomendación. Dietas con grasas mono y poliinsaturadas y pobres en hidratos de carbono |
| Cirugía bariátrica | Mejora el HGNA/EHNA | Pacientes con obesidad mórbida que no responden a dieta | |
| Diabetes y resistencia a la insulina | Metformina | Descenso de las transaminasas. No mejora la EHNA | HGNA con diabetes tipo 2. No recomendado en EHNA |
| Pioglitazona | HGNA sin diabetes mejora la esteatosis y la EHNA pero no la fibrosis. Causa incremento de peso | EHNA con diabetes tipo 2 | |
| Dislipidemia | Estatinas | Pueden provocar aumento de las transaminasas | HGNA con dislipidemia. No recomendado en EHNA |
| Estrés oxidativo e inflamación | Vitamina E | Mejora las transaminasas y el HGNA/EHNA. No mejora la fibrosis. Contraindicado en pacientes con anticoagulantes, estrógenos o en riesgo de trombosis | EHNA sin diabetes |
| Pentoxifilina | Mejoría de las transaminasas y de las alteraciones histológicas. No estudios controlados y aleatorizados | A considerar en estudios controlados a largo plazo. | |
| Ácido ursodeoxicólico | No mejoría histológica | No recomendado para el HGNA | |
| Fibrosis | IECA | Mejoran la fibrosis | HGNA/EHNA con HTA |
EHNA: esteatohepatitis no alcohólica; HGNA: hígado graso no alcohólico; HTA: hipertensión arterial; IECA: inhibidores de la enzima convertidora de la angiotensina.
El tratamiento de la obesidad se ha mostrado eficaz en el HGNA tanto en adultos como en adolescentes. Es importante perder peso, ya que se ha comprobado que esta medida mejora la RI y reduce la cifra de transaminasas65. Consiste en una pérdida progresiva mediante una dieta equilibrada con el objetivo de perder un 10% del peso corporal en los primeros 6 meses a un ritmo de 0,5-1kg por semana6. Una pérdida de peso excesivamente rápida mediante una dieta muy estricta es contraproducente, ya que se produce una movilización de los ácidos grasos libres del tejido adiposo al hígado, el cual también se ve privado de proteínas y otros nutrientes esenciales, provocando un aumento de la esteatosis y empeoramiento de las lesiones66–68.
Los ácidos grasos poliinsaturados (PUFA), tipo n3PUFA y los ácidos grasos monoinsaturados (aceite de oliva, pescado azul, frutos secos, verduras entre otros) tienen un papel protector importante para la prevención y tratamiento de la EHNA69 y, por tanto, los suplementos de n3PUFA en la dieta tienen un efecto protector en el HGNA, aunque su dosis óptima no se conoce70. Por el contrario, los n6PUFA (aceite de girasol, algunas semillas, algunos frutos secos, especialmente las nueces) se relacionan con HGNA, de manera que una relación n6PUFA/n3PUFA aumentada podría estar implicada en promover la necroinflamación en estos pacientes71.
Un consumo excesivo de proteínas, especialmente procedentes de la carne, se ha relacionado con el HGNA y elevación de la ALT, y un consumo excesivo de hidratos de carbono, superior al 54% del aporte calórico de la dieta, se ha evidenciado que aumenta el riesgo de EHNA. En este sentido, un reciente estudio ha mostrado cómo la dieta mediterránea, constituida en un 40% de ácidos grasos monoinsaturados y un 40% de hidratos de carbono, ha supuesto un descenso importante de la grasa intrahepática en comparación con una dieta pobre en grasas y rica en hidratos de carbono. Si bien no parece que la pérdida de peso sea más significativa, el descenso de la grasa intrahepática mejora el riesgo no solo de enfermedad hepática sino también del riesgo cardiovascular asociado en estos enfermos72.
Habitualmente los pacientes con sobrepeso y obesidad suelen consumir productos aditivos tales como azúcar, fructosa, bebidas light que provocan un aumento de los triglicéridos73, pueden inducir RI74, aumento de la permeabilidad intestinal favoreciendo la endotoxinemia75 y, por tanto, provocar inflamación y empeoramiento de la esteatosis, siendo por tanto una buena medida desaconsejar su consumo.
En general se recomienda abstinencia de alcohol si bien algunos estudios sugieren que un consumo muy moderado de vino, menos de un vaso al día, podría tener un efecto protector, ya que parece mejorar la RI y los factores relacionados con el SM76.
La reducción del peso corporal es, hasta la actualidad, la única medida eficaz para mejorar el HGNA pero presenta una importante limitación, ya que el 50% de los pacientes es incapaz de conseguir el objetivo ponderal deseado. Para ello, es importante recalcar al paciente la importancia de los efectos beneficiosos de un descenso ponderal, aunque este sea discreto, y de la incorporación de una dieta saludable independientemente de la pérdida de peso. No existe una dieta óptima para todos los pacientes y esta debería adaptarse a las características particulares de cada paciente, siendo lo más importante conseguir la adherencia del paciente a la misma. Una dieta baja en grasas e hidratos de carbono de absorción rápida y con aumento del contenido de fibra y control del consumo de proteínas, especialmente las procedentes de la carne, parecería una primera aproximación adecuada.
Actividad físicaLa actividad física tiene un efecto beneficioso sobre la grasa hepática, puesto que mejora la RI incluso en ausencia de pérdida de peso o con un descenso mínimo. La intensidad y la duración de la actividad física requeridas para disminuir la grasa hepática no están establecidas77,78. Parecería razonable recomendar la práctica de un ejercicio aeróbico, es decir, caminar o correr durante un periodo de tiempo entre 30-45min al menos 4 días por semana. Para ello debemos de insistir, sobre todo, en el abandono del sedentarismo y convencer al paciente de los beneficios sobre la salud de aumentar la actividad física aunque sea discreta.
Tratamiento farmacológicoObesidadHay pocos estudios con orlistat y sus resultados no demuestran un beneficio evidente79. En cambio, en los enfermos con obesidad mórbida sometidos a cirugía bariátrica se ha observado una mejora de los parámetros tanto analíticos como histológicos que se mantiene si no recuperan el peso80. La colocación de un balón intragástrico también provoca una mejoría, si bien suele ser transitoria en la mayoría de los casos81.
DislipidemiaLas estatinas son medicamentos seguros para pacientes con enfermedades hepáticas, incluyendo el hígado graso ya sea con esteatosis o esteatohepatitis. Aunque las estatinas pueden provocar elevaciones en las enzimas hepáticas, en muy pocas ocasiones son causa de toxicidad hepática. En cambio, son muy eficaces en el tratamiento de la dislipidemia y, por tanto, su uso está indicado en pacientes dislipidémicos con hígado graso6,8. No hay estudios que demuestren su eficacia en el HGNA sin dislipidemia asociada. Las mismas consideraciones se pueden aplicar a los fibratos para pacientes con hipertrigliceridemia aislada82.
Diabetes mellitus tipo 2 y resistencia a la insulinaLa frontera entre la RI y la aparición de diabetes mellitus tipo 2 (DM2) es tenue. En pacientes con hígado graso y con glucemias basales por encima de la normalidad sin mejoría con dieta, hay que establecer con precisión el diagnóstico de diabetes e iniciar tratamiento con hipoglucemiantes. No obstante, la evolución de la enfermedad hepática dependerá sobre todo del control adecuado de la glucemia independientemente del tratamiento que se utilice. Los fármacos más estudiados son la metformina y las glitazonas (tiazolidindionas). No hay evidencia suficiente para tratar la RI sin diabetes.
La metformina puede mejorar la alteración de las enzimas hepáticas pero no tiene eficacia sobre las lesiones histológicas, por lo que debería restringirse a pacientes con DM2 y por esta indicación83,84.
Las glitazonas son antidiabéticos que actúan incrementando la sensibilidad a la insulina y en pacientes con hígado graso sin DM2 mejoran los niveles de transaminasas, la esteatosis y la esteatohepatitis, pero no tienen efecto sobre la fibrosis85,86. La pioglitazona ha sido recomendada por la AASLD para pacientes con EHNA sin DM2 ni ninguna otra enfermedad hepática concomitante6. Sin embargo, esta recomendación debería ser matizada ya que no tiene en cuenta la duración de tratamiento, que debería ser indefinida, ni que la evidencia no se basa en estudios con gran número de pacientes. Por otra parte, hay que considerar que en la mayoría de los estudios en pacientes con hígado graso sin DM2, la pioglitazona se asocia a un incremento de peso considerable en los pacientes tratados85,86. La rosiglitazona se estudió con resultados similares a los de la pioglitazona pero en el 2010 se retiró del mercado por su riesgo cardiovascular.
Estrés oxidativo, inflamación y fibrosisLa pentoxifilina es un fármaco con efecto anti-TNF y es uno de los pocos tratamientos específicos para la hepatitis alcohólica grave. Por este motivo, se ha ensayado en pacientes con HGNA. La administración de pentoxifilina se asocia a una mejoría de los niveles de las enzimas hepáticas y también de las alteraciones histológicas inflamatorias. Recientemente se han publicado los resultados de un estudio en fase 2 en donde se demuestra que la pentoxifilina mejora la esteatosis y la degeneración hidrópica celular; sin embargo, los cambios globales en relación con los parámetros bioquímicos y hallazgos histológicos no fueron significativos con relación al grupo control87. Tampoco se conoce cuál es el mecanismo de acción en estos pacientes porque su administración no se asocia a una disminución de los niveles de IL-6 ni de TNFα6,86,88,89. Se necesitan estudios con un número amplio de pacientes para determinar su verdadera utilidad.
La vitamina E administrada a dosis de 800mg/día durante 96 semanas se asocia a mejora de las enzimas hepáticas, de la esteatosis e inflamación en pacientes con HGNA con EHNA, pero no mejora la fibrosis63,85,90. Estos resultados están en consonancia con los hallazgos de otros estudios previos, aunque no tan extensos86. La AASLD recomienda este tratamiento en pacientes con EHNA, sin diabetes y con ausencia de enfermedad hepática avanzada6. No debe administrarse en personas que tomen anticoagulantes, estrógenos o con algún riesgo de trombosis. Tampoco se conocen bien los riesgos y beneficios de la administración prolongada de vitamina E. Por tanto, su indicación debería ser en pacientes con EHNA confirmada por biopsia, con control estricto por la posibilidad de efectos adversos y retirándola si aparece cualquier otra enfermedad. Por otro lado, no se debe de prolongar su administración si en una biopsia de seguimiento (12-18 meses) no hay mejoría clara de los parámetros histológicos6,86.
El ácido ursodeoxicólico, ya sea considerado como hepatoprotector o antioxidante, no ha demostrado eficacia sobre parámetros histológicos en estudios suficientemente bien diseñados en pacientes con HGNA91,92. En la actualidad no debe considerarse útil para el tratamiento de esta enfermedad6,86,88.
Finalmente, se ha probado el uso de losartán y del telmisartán por la implicación del sistema renina-angiotensina en el desarrollo de la fibrosis hepática que se asocia a la EHNA. Aunque se han tratado pocos enfermos parece que su administración mejora la fibrosis93 y su indicación estaría recomendada en pacientes con HGNA e hipertensión arterial82.
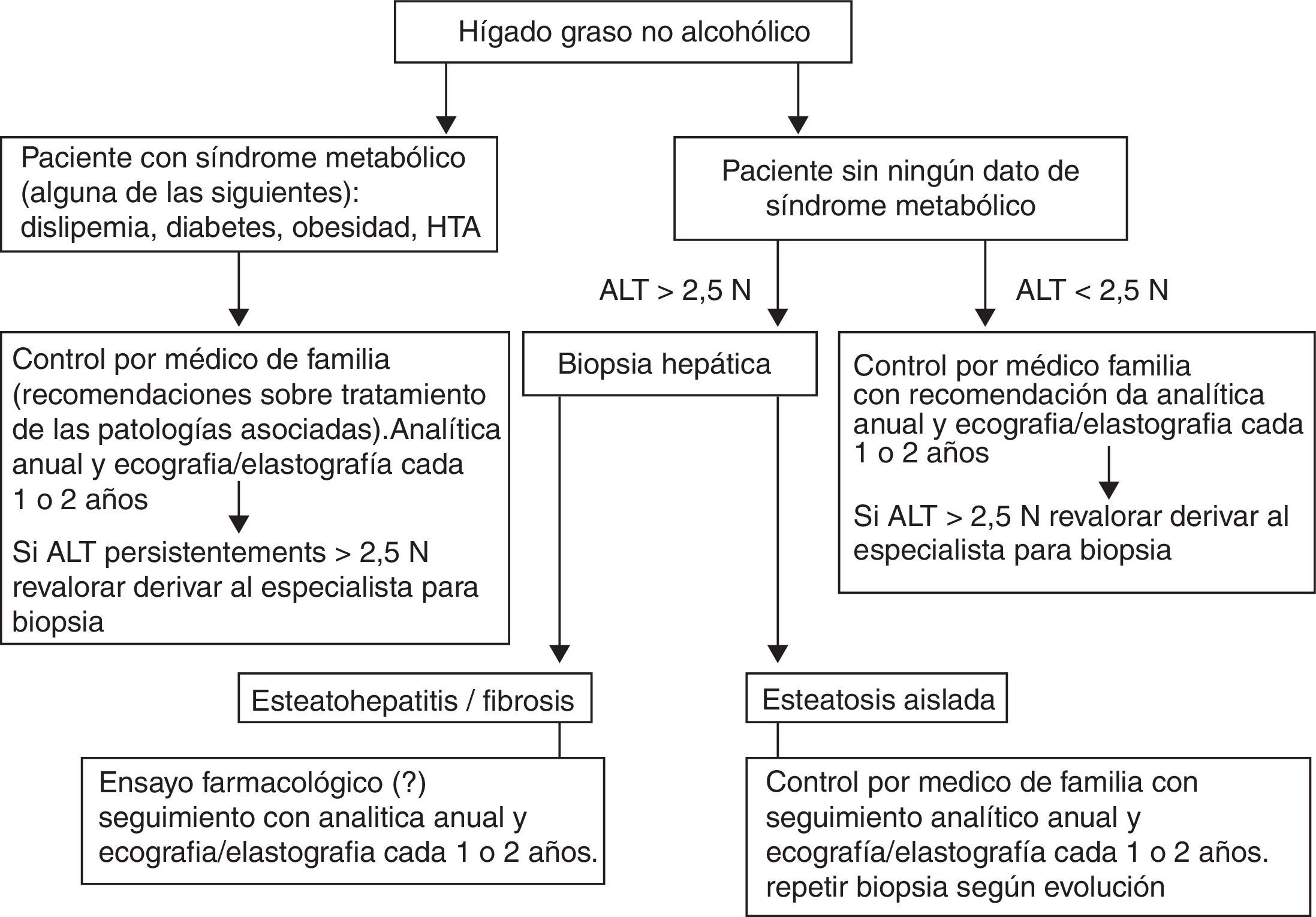
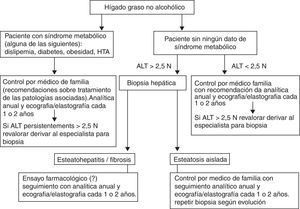
Actitud y seguimiento ante un enfermo con hígado graso no alcohólico (fig. 4)Una vez hecho el diagnóstico de la enfermedad, la actitud a seguir dependerá de la gravedad de la misma. Esta viene determinada por las cifras de las transaminasas, especialmente de la ALT. En general, estos enfermos deben ser controlados en la asistencia primaria haciendo controles analíticos anuales y pruebas de imagen, ecografía y/o elastografía (en caso de ser accesible) cada uno o 2 años. Cuando las cifras de ALT son superiores a 2,5 veces el valor normal, se deben de derivar al especialista para plantear la práctica de biopsia hepática. El control por parte del especialista ha de considerar el seguimiento histológico según la evolución o según respuesta a diferentes ensayos terapéuticos. Por otro lado, es importante no centrarse únicamente en la enfermedad hepática sino que es necesario estudiar la probable ECV, especialmente la aterosclerosis subclínica, a los enfermos con HGNA con ALT alta y presencia de algún componente de SM, mediante la ecografía de la pared de la carótida y el índice tobillo-brazo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.