INTRODUCCION
Cuando se evalúa una nueva técnica, antes de decidir si es realmente válida o no en una indicación y, sobre todo, si incide en el manejo de los pacientes, deben investigarse diferentes aspectos relacionados con ella. Fineberg et al1 propusieron en 1977 la evaluación de los siguientes aspectos, que fueron modificados posteriormente por Mackenzie et al2 en 1995:
1. Capacidad técnica.
2. Prestaciones en cuanto a sensibilidad, especificidad, valores predictivos positivo y negativo y precisión global.
3. Impacto diagnóstico.
4. Impacto terapéutico.
5. Impacto en el pronóstico y otros acontecimientos en la evolución del paciente.
6. Implicaciones económicas.
Obviamente, el hecho de que exista evidencia científica a favor de la técnica en uno de estos aspectos no implica necesariamente que exista en los demás, por lo que se requieren estudios específicamente diseñados para cada nivel de conocimiento.
El presente trabajo pretende revisar la evidencia científica que existe en el momento actual para la ultrasonografía endoscópica (USE) y la punción aspirativa guiada por USE (USE-PAAF) en el cáncer de esófago en cada uno de estos niveles de evaluación. Puesto que no hay duda acerca de la capacidad técnica ni de la precisión de la USE y USE-PAAF en el diagnóstico de extensión de la neoplasia de esófago, la revisión se centrará en el impacto diagnóstico y terapéutico de esta técnica, en cómo influye en el manejo de los pacientes y en su valor predictor de los distintos acontecimientos de la evolución de la enfermedad. Se revisarán también los datos existentes en cuanto a coste-efectividad de la técnica en esta indicación. El objetivo final es conseguir una revisión crítica para tener un conocimiento más práctico de la utilidad real de esta técnica, así como identificar los aspectos que aún deben ser explorados o estudiados más exhaustivamente.
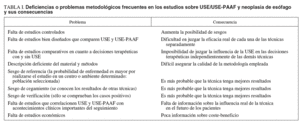
Hasta la fecha se han publicado 2 revisiones sistemáticas3,4, en las que se evalúa no sólo la eficacia diagnóstica de la USE en el cáncer de esófago, sino su impacto en la estadificación y el pronóstico de los pacientes, así como el coste económico que supone. Ambas revisiones detectan una serie de deficiencias metodológicas que se detallan en la tabla I. A pesar de todo, las 2 concluyen a favor de la USE como técnica de elección en la estadificación de la neoplasia de esófago en los siguientes términos:
La USE es altamente eficaz en el diagnóstico de extensión del carcinoma de esófago, especialmente para discriminar entre estadios T1/T2 y T3/T4.
Aunque no hay mucha evidencia científica al respecto, parece que la precisión diagnóstica de la USE es menor para la neoplasia de cardias que para la de esófago. La causa más probable sería la anatomía de la zona que predispone a cortes ecográficos oblicuos.
La presencia de estenosis no superable representa la mayor limitación a esta técnica, puesto que disminuye la precisión de la USE. No hay evidencia sobre si dicha disminución justifica el riesgo de una dilatación.
Los estudios realizados con minisondas demuestran un alto rendimiento de las mismas en la diferenciación entre afección neoplásica exclusivamente mucosa o mucosa y submucosa. Sin embargo, no se dispone de datos sobre el potencial impacto de este hecho.
Los sesgos más prevalentes son el blinding bias, o sesgo de cegamiento, y el sesgo de verificación (sólo hay un patrón de referencia de los casos positivos), pero no se encuentra relación significativa entre la presencia de dichos sesgos y los resultados de los estudios, ni en cuanto a la estadificación T ni a la N.
El número de pacientes incluido en los estudios (usualmente bajo) tiene un efecto significativo sobre la eficacia diagnóstica de la técnica, que es mayor cuando se incluye un mayor número de pacientes.
Hay poca información respecto a la influencia de la USE y USE-PAAF sobre parámetros importantes de evolución clínica, debido a falta de estudios prospectivos que hayan hecho un seguimiento clínico homogéneo de los pacientes.
Los estudios económicos con relación a la técnica son muy escasos y se basan en modelos teóricos. Su principal limitación es el hecho de usar suposiciones o asumir ciertas premisas que pueden no concordar con la realidad.
A continuación se comentan los datos sobre impacto de la USE y la USE-PAAF en la neoplasia de esófago aparecidos en los últimos 4 años, desde la publicación de las 2 revisiones sistemáticas, cuyas conclusiones se han expuesto anteriormente.
IMPACTO DE LA USE Y USE-PAAF EN EL DIAGNOSTICO DE EXTENSION DE LA NEOPLASIA DE ESOFAGO
Tal como se deduce de lo antes expuesto, la valoración de la revisión sistemática publicada en 1998 no es muy optimista en cuanto a la absoluta fiabilidad de los resultados de la mayoría de estudios, por la presencia de sesgos y la falta de estudios comparativos controlados4. En efecto, para valorar si la realización de USE y USE-PAAF modifica el estadio del cáncer de esófago determinado por otras técnicas de imagen, se requiere de estudios comparativos con tomografía computarizada (TC), resonancia magnética (RM) y tomografía por emisión de positrones (PET), que utilicen como patrón de referencia la pieza quirúrgica. Desafortunadamente, este tipo de estudio lleva implícita una serie de problemas que hace que sea difícil llevarlos a cabo en la práctica clínica: complejidad de diseño (múltiples exploraciones a un mismo paciente), dificultad para mantener la condición de «ciego» por la participación en el estudio de numeroso personal, o posible sesgo a favor de una de las técnicas debido a que habitualmente el grupo de trabajo que diseña el estudio suele ser el más experto.
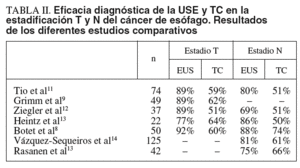
Los resultados de los estudios comparativos publicados hasta el momento muestran que la USE es más eficaz que la TC en la estadificación T del cáncer de esófago con unas cifras del 85% (rango, 59-92) frente al 40-50%, respectivamente5-10. La USE es también algo superior a la TC en la estadificación N: 79% (rango, 50-90) frente al 54% (rango, 48-71), respectivamente. Por otro lado, se ha demostrado que la prevalencia de las metástasis ganglionares aumenta con el estadio T (T1, 0%; T2, 56%; T3, 78%; T4, 100%) y se correlaciona con la eficacia diagnóstica de la USE para el estadio N (T1, 50%; T2, 66%; T3, 78%; T4, 80%). En la tabla II se muestran los datos referentes a la eficacia diagnóstica de la USE y TC obtenidos en los diferentes estudios comparativos realizados hasta el momento.
Por su rigurosidad metodológica, la inclusión de la USE-PAAF como método diagnóstico para evaluar, además de la USE y la TC, y el elevado número de enfermos incluido, merece especial comentario el estudio de Vázquez-Sequeiros et al16. En este estudio, se evaluó prospectivamente y de forma ciega de una a otra técnica, con TC helicoidal USE y USE-PAAF, una cohorte de 125 pacientes consecutivos diagnosticados de neoplasia de esófago y candidatos a cirugía. Los resultados de dicho estudio demostraron que la USE-PAAF es la mejor técnica para la estadificación N de la neoplasia de esófago (sensibilidad y precisión diagnóstica del 83 y el 87% frente al 29 y el 51% para la TC, y del 71 y el 74% para la USE). Además, y más importante, la USE-PAAF alteró el manejo del 77% de los pacientes, en la mayoría de casos hacia un tratamiento más intensivo: multimodal (tratamiento neoadyuvante + cirugía) en lugar de cirugía aislada.
IMPACTO DE LA USE Y USE-PAAF EN EL MANEJO TERAPÉUTICO DE LA NEOPLASIA DE ESOFAGO
A continuación se comentan otros estudios que han evaluado el impacto de la USE y USE-PAAF en el manejo terapéutico de los pacientes con cáncer de esófago.
Giovannini et al17 evaluaron retrospectivamente el impacto de la USE-PAAF en pacientes con cáncer de esófago en los que el resultado de una citología positiva cambiaría la actitud terapéutica. Con este objetivo realizaron una punción de los ganglios localizados a distancia del tumor e independientemente de su tamaño, forma y ecogenicidad. En este estudio, la USE-PAAF cambió el manejo clínico en el 60% de los pacientes que cumplían los criterios de inclusión (adenopatías a distancia del tumor inicial que podían representar un estadio M1a), lo que corresponde al 12% del total de pacientes con neoplasia de esófago. Este resultado es muy similar al publicado en otro estudio en el que se evalúa el mismo tipo de pacientes y en el que se registraron un 13% de cambios18.
Por su parte, Preston et al19 evaluaron el efecto de la USE (sin PAAF) en el manejo de 100 pacientes con cáncer de esófago y de la unión esofagogástrica. Después de revisar la historia clínica de estos pacientes, se elaboró un resumen de cada uno de ellos en el que se excluyó el resultado de la USE y que fue asignado de forma aleatoria a cada uno de un grupo de 3 cirujanos que tenía que decidir el tratamiento más adecuado en cada caso. Después de esto, se facilitó la información de la USE y los cirujanos volvieron a decidir el tratamiento más adecuado y, en una escala lineal, cómo había influido el resultado de la USE en el manejo de cada paciente. La información de la USE fue útil en la toma de decisiones en un 87, 65 y 63% de los casos según cada cirujano. Además, lo más novedoso de este estudio fue que la información aportada por la USE aumentó un 3-9% la concordancia entre los 3 cirujanos.
En un estudio prospectivo publicado en forma de resumen y con un diseño similar, la USE indujo cambios en el manejo terapéutico de los pacientes en el 24% de las ocasiones, mayoritariamente hacia un tratamiento más intenso20. La adición de la USE-PAAF cambió la estrategia terapéutica sólo en un 8% adicional. El bajo impacto de la USE-PAAF se justifica, según los autores, porque la mayoría de pacientes con ganglios metastásicos presentaban estadios T avanzados detectados previamente por USE habiéndose ya modificado el tratamiento por este motivo. La alta experiencia de los ecoendoscopistas de la institución en este tipo de patología es otro factor que podría haber influido en los resultados. En cualquier caso, resulta obvio que el impacto clínico de la USE-PAAF habría sido mucho mayor si se hubiera evaluado conjuntamente con la USE. En este estudio, a diferencia del previamente comentado, la encuesta para el cálculo del impacto se realizó no sólo a cirujanos sino a gastroenterólogos, oncólogos y radioterapeutas, y se evaluó también la concordancia entre sus respectivas decisiones. El nivel de concordancia fue sólo moderado, lo cual no es tan sorprendente como pudiera parecer, pues el sesgo debido a la especialidad del médico ha sido reconocido previamente en la bibliografía como uno de los factores que distorsionan la implementación de las recomendaciones basadas en la evidencia científica21. Otro de los resultados interesantes y novedosos de este estudio es que la información aportada por la USE y la USE-PAAF aumenta la concordancia entre las decisiones de los diferentes especialistas en cuanto al tratamiento de los pacientes con cáncer de esófago. Cabe señalar también que en este estudio se excluyeron los pacientes con metástasis a distancia. Si se hubieran incluido, el impacto de la USE y la USE-PAAF hubiera sido mucho menor, en favor de la TC.
Llama la atención la discordancia de resultados entre los diferentes estudios en cuanto a la proporción de pacientes en quienes la USE-PAAF cambia el manejo terapéutico. De nuevo, estas diferencias deben atribuirse a la heterogeneidad de la metodología empleada. Mientras en el estudio de Vázquez-Sequeiros et al16 la evaluación del impacto se hace a través de un cálculo estadístico analizando si las diferencias entre el diagnóstico de extensión realizado por TC, USE y USE-PAAF se asocian al tipo de tratamiento administrado, en el de Giovannini et al17 son los mismos autores quienes hacen una aproximación sobre el impacto de la técnica, mientras que en los 2 trabajos restantes la evaluación del impacto se hace a través de una encuesta a los médicos encargados del tratamiento de los pacientes.
Finalmente, un estudio retrospectivo realizado por Shumaker et al22 en 188 pacientes con cáncer de esófago, partiendo de la base de que si no se dispusiera de USE el tratamiento estándar tendría que ser la terapia combinada, evalúa cuántos pacientes son diagnosticados como T1 y M1a por esta técnica y, por tanto, pueden ahorrarse el tratamiento neoadyuvante. El 26% de los pacientes es identificado por USE como T1 o M1a y, por tanto, se asume que esta cifra es indicativa del impacto de la técnica. Obviamente, este estudio parte de una premisa inicial totalmente errónea, que es la de asumir que, en ausencia de USE, todos los pacientes con cáncer de esófago recibirían tratamiento multimodal.
Las adenopatías de la región celíaca requieren un comentario adicional por su significado pronóstico en el cáncer de esófago, tal como indica el hecho de que determinan un estadio M1a. En este sentido, Parmar et al23 han comparado la eficacia de la USE-PAAF y la TC en la identificación de metástasis en los ganglios celíacos en 40 pacientes con cáncer de esófago y evalúan el impacto de la USE-PAAF en ellos. Los resultados de este estudio muestran que la USE-PAAF es superior a la TC en el diagnóstico de metástasis a este nivel (sensibilidad del 100 frente al 50%; especificidad del 100 frente al 50%, y eficacia del 100 frente al 35%). Sin embargo, este estudio tiene la limitación de que la muestra es pequeña y que se considera patrón de referencia el propio resultado de la USE-PAAF. Otra limitación que hay que tener en cuenta es la imposibilidad de generalizar los resultados a todos los pacientes con cáncer de esófago, ya que en los casos que presentan una estenosis esofágica no se puede valorar la región celíaca a no ser que se practique dilatación previa.
En otro estudio realizado en 48 pacientes, la USE documentó tanto estadios T4 como metástasis en los ganglios celíacos en un 25% de los casos, mientras que la TC helicoidal no fue capaz de identificar a ninguno de ellos24.
IMPACTO DE LA USE Y USE-PAAF EN EL PRONOSTICO, SUPERVIVENCIA Y OTROS PARAMETROS DE EVOLUCION EN LA NEOPLASIA DE ESOFAGO
El hecho de que la USE-PAAF tenga una mayor precisión diagnóstica que las demás técnicas, o incluso que cambie el manejo de una alta proporción de pacientes con neoplasia de esófago, no implica que influya en la evolución de la enfermedad. Para investigar este aspecto, se requieren estudios que correlacionen los hallazgos de la técnica con parámetros de importancia clínica, como la respuesta a tratamiento, la supervivencia libre de recidiva, la supervivencia global o la calidad de vida.
Harewood et al25 estudiaron el impacto de la USE-PAAF en la estimación de la supervivencia y el tiempo libre de recidiva comparando los datos de los pacientes antes y después de la introducción de la USE-PAAF. Los datos de 60 pacientes diagnosticados de neoplasia de esófago en 1998 y sin metástasis a distancia, a quienes no se había practicado USE por no estar disponible la técnica en aquel momento, se compararon con los de 107 pacientes de similares características que sí disponían de la exploración. La USE-PAAF se asoció con un riesgo reducido de recidiva e incluso, después de «ajustar» por edad, sexo, estadio tumoral y localización del tumor, a una reducción de la mortalidad, presumiblemente debido al uso apropiado del tratamiento neoadyuvante en el grupo de pacientes con enfermedad localmente avanzada. Sin embargo, este estudio tiene importantes limitaciones, como la heterogeneidad de tratamientos administrados y su carácter retrospectivo y no controlado. Por tanto, mientras no se confirme en estudios bien diseñados para este fin, sus resultados deben contemplarse con cautela.
Eloubeidi et al26 evaluaron el impacto de la USE en el estudio de las adenopatías celíacas en pacientes con neoplasia de esófago. Para ello, estudiaron retrospectivamente a un grupo de 182 pacientes con cáncer de esófago no estenótico y adenopatías celíacas. La supervivencia a los 5 años del grupo de pacientes en quienes la USE detectó nódulos celíacos fue del 13% (intervalo de confianza [IC] del 95%, 5-21), mientras que en los pacientes sin ellos fue del 30% (IC del 95%, 21-40) (p = 0,007). Al ajustar el modelo estadístico por raza y tipo de tratamiento administrado, los pacientes con adenopatías celíacas o un estadio tumoral más avanzado por USE presentaron una peor supervivencia (p < 0,05). Además, tanto el tamaño de los ganglios celíacos como el número de ellos con características metastásicas por criterios ecográficos tienen impacto sobre el pronóstico, como demuestra el estudio de Natsugoe et al27, en el que se obtienen unas cifras de supervivencia a los 5 años de 53, 34, 17 y 0%, según existan 0, 1-3, 4-7 o más de 8 ganglios, respectivamente.
Por lo que se refiere a la utilidad de la USE y la USE-PAAF en la predicción de la respuesta al tratamiento, Swisher et al28 estudiaron la utilidad de la USE para predecir la respuesta patológica y la supervivencia después de la quimioradioterapia preoperatoria. Del resultado de su estudio se concluye que la extensión mucosa tumoral é 1 cm evaluada por USE antes del tratamiento se correlaciona con la respuesta patológica, pero no identificaron ningún factor predictivo de supervivencia. En otro estudio muy reciente, Willis et al29 comprobaron que los cambios observados con USE después del tratamiento neoadyuvante (reducción de la cross-sectional área) tienen un valor predictivo de 80% para respuesta patológica. Asimismo, Ota et al30 demostraron que la medida del má-ximo diámetro tumoral por USE antes y después de ra-dioquimioterapia identificaba correctamente el 80% de pacientes no respondedores y el 94% de los respondedores. Sin embargo, dada la ya conocida baja rentabilidad de la USE tras tratamiento con radioquimioterapia, y antes de asumir estos resultados como definitivos, debería demostrarse su reproducibilidad. Finalmente, el estudio de Argawal et al31 evalúa si la USE después de la quimiorradioterapia permite identificar a los pacientes que se beneficiarán de la cirugía, y demuestra que la persistencia de ganglios metastásicos por USE se asocia con un peor pronóstico.
En la actualidad no hay ningún estudio que haya evaluado el impacto de la USE en la calidad de vida de los pacientes con cáncer de esófago.
IMPACTO ECONOMICO DE LA USE Y USE-PAAF EN EL CANCER DE ESOFAGO
La conclusión de la revisión sistemática publicada en Health Technology Assessment4 sobre el coste-eficacia de la USE en el cáncer de esófago es desalentadora: no hay estudios bien diseñados sobre el tema de cuyos resultados se puedan extraer conclusiones en ningún tipo de cáncer del tracto gastrointestinal. Desde entonces, sin embargo, se han publicado tres estudios con el objetivo de responder a esta cuestión.
Shumaker et al22 diseñaron un estudio retrospectivo para evaluar la proporción de los diferentes estadios de cáncer de esófago en un grupo de pacientes remitido para estadificación preoperatoria. La hipótesis de los autores era que la USE permitiría identificar una elevada proporción de pacientes en estadios I y IV no identificados con otras técnicas de imagen que, por consiguiente, no serían tratados con tratamiento combinado sino sólo con cirugía los primeros y con quimioterapia paliativa los segundos con el consiguiente ahorro económico (unos 3.443 dólares por paciente según las tarifas de Medicare del año 2000). De nuevo, el diseño de este estudio tiene una deficiencia muy importante y es que se asume que sin el resultado de la USE todos los pacientes habrían recibido un tratamiento combinado.
Un estudio prospectivo realizado por Chang et al32 parte de la premisa opuesta: después de descartar a los pacientes con enfermedad metastásica por TC, considera a los demás potencialmente candidatos a cirugía (en total 60 pacientes). Todos los pacientes con un estadio I y II fueron sometidos a cirugía, así como un 25% de los pacientes en estadio III, mientras que en el resto de los de estadio III y todos los IV se optó por algún tipo de tratamiento no quirúrgico. Con este esquema de tratamiento, los autores calculan que el ahorro de los pacientes que deciden no someterse a una toracotomía es de 12.340 dólares por paciente.
Por otro lado, Harewood et al33 realizaron un estudio de análisis de decisión para comparar los costes de la USE-PAAF, PAAF guiada por TC (TC-PAAF) y cirugía en el manejo de los pacientes con cáncer de esófago. Para ello, usaron un modelo de análisis de coste-minimización con 3 grupos de actuación para equilibrar el coste relativo de la adición de la USE-PAAF al estudio preoperatorio de pacientes con un cáncer de esófago aparentemente resecable por TC. La USE-PAAF fue la estrategia menos cara, debido a que evitó 16 intervenciones quirúrgicas innecesarias por cada 100 pacientes evaluados y ello fue debido, en gran parte, a la detección de ganglios celíacos metastásicos. Sin embargo, en este estudio no se menciona la evolución a largo plazo de los pacientes ni la calidad de vida.
Hadzijahic et al34 realizaron también un análisis de coste-minimización utilizando un modelo de análisis de decisión, para evaluar si es más barato iniciar el estudio para descartar enfermedad a distancia con una TC o USE. La USE fue la estrategia inicial menos cara cuando se cumplieron una serie de condiciones: a) la probabilidad de detectar enfermedad a distancia por USE era superior al 30%; b) la probabilidad de detectar una enfermedad a distancia por TC era inferior al 20%, o c) el coste de la USE era inferior a 3,5 veces el de la TC. En estas circunstancias, la USE encontró enfermedad avanzada más frecuentemente que la TC (el 44 frente al 13%) y fue menos cara. A pesar de estos resultados, la TC sigue con siderándose la técnica de elección para descartar me tástasis. En otro estudio en el que se compara TC, USE-PAAF, PET y laparoscopia, se demuestra que la TC combinada con USE-PAAF es la estrategia inicial más económica. Sin embargo, los años ajustados por calidad de vida fueron mejores con la combinación PET y USE-PAAF, por lo que los autores recomiendan esta última combinación como mejor estrategia en todos los pacientes con neoplasia de esófago si hay disponibilidad de ambas técnicas35.
CONCLUSIONES MAS RELEVANTES
Los estudios suficientemente bien diseñados como para aumentar la evidencia científica en este campo son muy escasos.
Las limitaciones metodológicas más frecuentes son debidas al diseño no controlado y retrospectivo, lo que aumenta enormemente los sesgos y, por tanto, disminuye la validez de los resultados. Los sesgos más frecuentes son el de cegamiento, verificación y referencia.
A menudo falta información sobre las características de la población estudiada o el diseño del estudio para que el lector pueda hacer una interpretación crítica de los resultados.
La USE y la USE-PAAF son las técnicas más eficaces en el diagnóstico de extensión locorregional de esta neoplasia, y mejores que la TC helicoidal.
La USE-PAAF es mejor que la USE en el diagnóstico de extensión N.
USE y USE-PAAF son más precisas que la TC en la detección de adenopatías celíacas y este hecho tiene significado pronóstico de supervivencia. Hacen falta más estudios que evalúen el impacto de la detección de adenopatías en otras regiones sobre la supervivencia de estos pacientes.
Hay evidencia científica de que la USE y la USE-PAAF tienen impacto sobre el manejo terapéutico de esta enfermedad, aunque el porcentaje de pacientes en que esto ocurre varía de un estudio a otro, según la metodología empleada.
Hay datos que indican que la USE puede ser un instrumento eficaz tanto en la predicción como en la medición de la respuesta al tratamiento neoadyuvante, aunque no está definida cuál es la variable ecoendoscópica que mejor se relaciona con estos 2 aspectos.
No hay información acerca del impacto de la USE en la calidad de vida de estos pacientes.
Algunos datos de estudios realizados con modelos teóricos de análisis de decisión sugieren que USE/USE-PAAF son coste-eficaces en la neoplasia de esófago, pero hacen falta estudios económicos reales que corroboren estos resultados.