ANTECEDENTES HISTÓRICOS
Owen et al1, estudiando los grupos sanguíneos del ganado vacuno, describieron el fenómeno de free-martin en la especie bovina. Consiste en partos dobles de gemelos dicigóticos, no idénticos, que comparten la circulación placentaria; como consecuencia, se produce un intercambio de la sangre entre ambos individuos durante la etapa fetal y, al nacer, resultan quimeras hematopoyéticas. Los trasplantes de piel realizados de un individuo a otro se toleraban, cuando en principio deberían rechazarse al tratarse de hermanos con distinto complejo de histocompatibilidad (MHC).
El grupo de Medawar2, en Oxford, llevó esta observación al laboratorio, y comprobó que la inyección de esplenocitos de una cepa de ratón a un embrión o ratón recién nacido de otra cepa de haplotipo distinto convertía a este animal receptor de la transfusión en tolerante a un injerto de piel del mismo haplotipo que el donante. Este fenómeno lo denominaron tolerancia neonatal, que sólo era operativa durante la etapa embrionaria y posnatal temprana, ya que una intervención similar en animales adultos inducía sensibilización en vez de tolerancia. Este mismo grupo descubrió que el rechazo primario de aloinjertos estaba mediado por linfocitos, y así sentaron la base inmunológica del rechazo de los injertos3. Tras un primer rechazo, un segundo injerto de piel del mismo haplotipo era rechazado de una forma más agresiva. Es decir, las células T sensibilizadas en la primera exposición al antígeno guardaban memoria inmunológica. Además, la transferencia de estas células a ratones naïve que nunca habían recibido un injerto confería a éstos la capacidad de rechazar de forma más rápida y eficiente.
De esta manera, el grupo de Medawar demostró que el componente hematopoyético era un elemento clave no sólo en la inducción de la tolerancia, sino también la causa última del rechazo de los órganos.
En París, el grupo de Le Douarin4, que trabajaba en un modelo de trasplante neuronal xenogénico de codorniz a pollo, observó que los injertos de tejido neural de cordorniz a pollo, realizados en el huevo durante la etapa embrionaria, se rechazaban en los pollos tras el nacimiento, una vez que había madurado su sistema inmunológico. Este rechazo podía prevenirse si se realizaban xenoinjertos de codorniz simultáneos de timo embrionario a pollo5. Este resultado indicaba que la presencia del timo prevenía el rechazo, y se ponía de manifiesto la importancia del epitelio tímico en el proceso de inducción de tolerancia. Este fenómeno observado en las aves podía reproducirse igualmente en ratones. Así, ratones nude atímicos (sin timo, inmunoincompetentes) injertados con timo alogénico eran capaces de generar células T y recuperar la inmunocompetencia. Además, estos ratones presentaban tolerancia específica de donante; aceptaban injertos de piel del mismo haplotipo que el del timo y rechazaban injertos de un tercero6.
LA MEDICACIÓN INMUNODEPRESORA, SU RETIRADA Y LA TOLERANCIA
El paciente trasplantado necesita recibir tratamiento con fármacos inmunodepresores para mantener la función del injerto de por vida y, así, evitar que su respuesta inmunitaria ataque al injerto. Sin embargo, la administración de fármacos inmunodepresores a largo plazo en el paciente trasplantado es responsable de la aparición de graves efectos secundarios. En este sentido, es necesario profundizar en el conocimiento de la respuesta inmunitaria al aloinjerto y establecer protocolos de acondicionamiento (inducción y mantenimiento de la tolerancia) del receptor que permitan a corto o medio plazo la retirada total de la inmunodepresión, o bien su reducción hasta los niveles más bajos posibles7. No obstante, existen experiencias clínicas en trasplante hepático en que se ha podido retirar de forma progresiva y definitiva la medicación inmunodepresora8-13.
Para lograr este objetivo tan deseable, es importante investigar todos aquellos factores que influyen en la supervivencia de los injertos y adaptar las pautas de inmunodepresión a cada paciente dependiendo de factores como la disparidad de MHC entre donante y receptor, la función del injerto, el desarrollo de efectos secundarios resultado de la administración de fármacos inmunodepresores, etc. Igualmente, es necesario determinar los parámetros de la respuesta inmunitaria predictivos de la aparición de un rechazo para poder actuar con los mínimos riesgos posibles en aquellos pacientes en que pudiera estar indicada la retirada de la medicación inmunodepresora.
CONCEPTO DE TOLERANCIA ESPECÍFICA DE DONANTE FRENTE A INMUNOINCOMPETENCIA
Un concepto importante que es necesario definir es el de tolerancia específica de donante, que es diferente del concepto de inmunoincompetencia. En general, los individuos tratados con una pauta de inmunodepresión durante un período prolongado de tiempo se encuentran inmunodeprimidos y son incapaces de elaborar una respuesta inmunitaria frente al injerto. Como consecuencia de ello, son también incapaces de defenderse de forma adecuada frente a los microorganismos patógenos, de modo que son más susceptibles a las infecciones oportunistas. Tras la retirada de la inmunodepresión, el individuo debe recuperar su inmunocompetencia y capacidad de reaccionar frente a antígenos foráneos, pero al mismo tiempo debe mostrar una tolerancia específica frente a los antígenos histoincompatibles presentes en el injerto, que se debe caracterizar por la ausencia de una respuesta de base humoral y celular reacción mixta de linfocitos y linfocitos T citotóxicos (CTL) frente al MHC del aloinjerto.
BASE INMUNOLÓGICA DE LA TOLERANCIA
Para explicar este fenómeno tan complejo se admite la existencia de varios mecanismos que operan en el timo durante la diferenciación de las células T, así como mecanismos periféricos mediados principalmente por células T reguladoras y células dendríticas.
Tolerancia central tímica: selección positiva y negativa de los linfocitos T en el timo
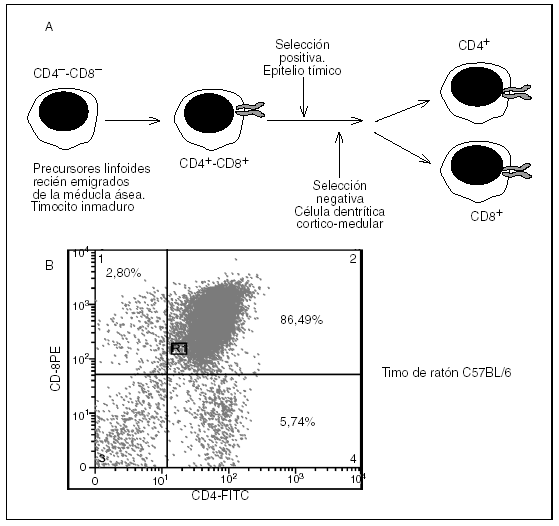
Los precursores linfoides de la médula ósea migran al timo, donde se diferencian a linfocitos T αβ, T γδ y células citolíticas T (células citolíticas natural killer con marcadores típicos de las células T). Este proceso de diferenciación y generación de células T maduras se conoce como timopoyesis (fig. 1).
Fig. 1. Diferenciación y maduración de las células T: timpopoyesis. Diferenciación tímica (A): selección positiva (estroma tímica, cortical), selección negativa (unión corticomedular, células dendríticas) y médula tímica con las células T maduras. Citometría de flujo (B) que muestra la diferenciación de las células T en el timo (células dobles positivas para CD4 y CD8, células maduras CD4 positivas y células maduras CD8 positivas). FC: ficoeritrina; FITC: isotiocianato de fluorosceína.
Durante el proceso de diferenciación de las células T, los precursores linfoides CD4CD8 se convierten en células T dobles positivas CD4+CD8+ y, en este momento, la reactividad de estas células es cribada a través de un proceso de selección positiva y negativa que las convierte en linfocitos T CD4 (ayudadores) y CD8 (citotóxicos) maduros. En las etapas iniciales de la diferenciación de los linfocitos T, las células T inmaduras, a través de su receptor (TCR), interaccionan con un péptido propio presentado en el contexto del MHC propio expresado en células epiteliales tímicas (selección positiva), de tal forma que los TCR con afinidad alta o intermedia por el péptido propio pasan la criba y se dirigen a la unión corticomedular, donde se van a encontrar con las células dendríticas, que igualmente presentan péptidos propios en el contexto del MHC propio. Así, las células T cuyo TCR presenta alta afinidad por péptidos propios se eliminan por deleción clonal (selección negativa) y sólo los linfocitos T cuyo TCR presenta afinidad intermedia y que, por tanto, son incapaces de desencadenar una reacción autoinmunitaria salen al torrente circulatorio y colonizan los órganos linfoides. Se admite, sin embargo, que un cierto número de linfocitos T autorreactivos pueden escapar a la periferia (puede que no todos los antígenos propios se expresen en el timo), y por eso es necesario contemplar la existencia de mecanismos reguladores naturales periféricos que puedan controlar este tipo de autorreactividad. Estos mecanismos reguladores, que han recobrado recientemente gran interés en la investigación sobre trasplante y autoinmunidad, están mediados por células T reguladoras y células dendríticas tolerogénicas.
Tolerancia periférica. Papel central de las células T reguladoras y células dendríticas inmaduras en el control de la autoinmunidad y alorreactividad
Sakaguchi et al14,15 describieron por primera vez la existencia de las células T reguladoras y reconocieron al timo como el órgano encargado de su producción. Realizando timectomías de ratones neonatos entre los días 2-4 observaron que estos animales, al alcanzar la edad adulta, desarrollaban diversas enfermedades autoinmunitarias y presentaban una deficiencia de un tipo particular de células T CD4 caracterizadas por la expresión constitutiva del receptor de la interleucina (IL) 2. Debido a la dificultad de clonar estas células in vitro, muchos investigadores dudaron de su existencia durante mucho tiempo. Sin embargo, recientemente han recobrado un enorme interés al conseguirse una mejor caracterización de las mismas. Además de los marcadores comentados anteriormente, también expresan los receptores CTLA4 y GITR.
En la especie murina, las células T reguladoras CD4+CD25+, junto con las células citolíticas T16, aparecen de forma espontánea durante el desarrollo y ejercen su actividad inmunorreguladora de manera innata, y seguramente su efecto no es dependiente del antígeno. Existe además un segundo tipo de células T reguladoras adaptativas muy heterogéneas, que requieren la presencia de antígeno para desarrollarse. Experimentos de tolerancia oral mediante administración de la proteína básica de la mielina en un modelo de encefalitis autoinmunitaria permitieron identificar una población de células T que denominaron células Th3 reguladoras, capaces de secretar factor transformador del crecimiento beta, las cuales se inducían en presencia de antígeno y eran capaces de controlar células T autorreactivas frente a la proteína de la mielina17. Una segunda población de células reguladoras adaptativas son las células T reguladoras Tr1, que se caracterizan por la elevada producción de IL-10 y factor transformador del crecimiento beta. Estas últimas además pueden diferenciarse in vitro a partir de células T naïve en presencia de IL-1018. En la especie humana se han definido, de forma similar a la especie murina, poblaciones de células T con actividad reguladora CD4+CD25+, Tr1 y una población de células19 T CD8β+CD28CD27+.
Las células dendríticas en su estado inmaduro no expresan moléculas coestimuladores capaces de transmitir la señal 2 a los linfocitos T activados, con lo cual los linfocitos T, tras ser estimulados por células dendríticas inmaduras (incapaces de coestimular), entran en un estado de anergia (no responden al aloantígeno). Experimentos realizados con células dendríticas inmaduras diferenciadas de la médula ósea con factor estimulador de colonias de granulocitos y macrófagos e inyectadas en ratones prolongan la supervivencia de los injertos cardíacos y hepáticos del mismo haplotipo que el que presentan las células dendríticas inyectadas20,21. Células dendríticas transfectadas con genes que codifican para proteínas con ligandos en las células T alorreactivas que sean capaces de inhibir su capacidad efectora representarían herramientas muy útiles para inhibir la respuesta inmunitaria22.
Mazariegos et al23 han observado que la ratio de células plasmacitoides de fenotipo pDC2:pDC1 se encontraba significativamente más elevada en los pacientes a los que se les retiraba la inmunodepresión de forma exitosa que en aquellos que recibían inmunodepresión de forma continuada.
ESTRATEGIAS EXPERIMENTALES PARA LA INDUCCIÓN DE TOLERANCIA CENTRAL
En modelos murinos existen 2 enfoques experimentales que permiten inducir tolerancia central muy estable y robusta, pero ambos son de difícil aplicación clínica: por una parte, el trasplante alogénico de timo y, por otra, el trasplante de médula ósea.
Trasplante alogénico de timo
Consiste en el trasplante alogénico de timo fetal o neonatal en un receptor que se ha timectomizado y se ha deplecionado de sus células T CD4 y CD8 con anticuerpos monoclonales. Sin timo y sin células T, el receptor del trasplante tímico queda a merced de las células T que se generan de novo en el injerto tímico alogénico, las cuales van a ser educadas para reconocer como propios los péptidos alogénicos y los péptidos propios. Así se consigue generar un repertorio de células T tolerantes frente a lo propio y lo alogénico, e incapaces de rechazar un injerto alogénico del mismo haplotipo que el timo24.
Trasplante alogénico de médula ósea. Creación de quimeras hematopoyéticas
El grupo de Sachs y Sykes25-27, de la Universidad de Harvard, ha investigado ampliamente en modelos animales la posibilidad de utilizar el trasplante alogénico de médula ósea para la inducción de tolerancia en el animal adulto mediante la creación de quimeras hematopoyéticas. El abordaje experimental consiste en el trasplante de médula ósea alogénica deplecionada de células T para prevenir la reacción del injerto frente a huésped en el receptor. Este último, por otra parte, debe someterse a un protocolo de acondicionamiento para prevenir el rechazo del aloinjerto de la médula ósea. Para ello se necesita eliminar las células T CD4 y CD8 mediante la administración de anticuerpos monoclonales deplecionantes, e igualmente se requiere la administración de una dosis baja de irradiación no mieloablativa e irradiación tímica para generar espacio en el compartimiento hematopoyético que facilite el injerto de la médula ósea del donante. De esta manera, se consiguen establecer quimeras hematopoyéticas en ratones adultos que son tolerantes a injertos del mismo haplotipo que el de la médula ósea donante.
Sin embargo, este abordaje es de difícil aplicación clínica por su toxicidad, derivada de la necesidad de irradiar al receptor del injerto de médula ósea y de la utilización de anticuerpos monoclonales deplecionantes. En un intento de reducir al máximo el protocolo de acondicionamiento del receptor, se ha podido sustituir el uso de los anticuerpos monoclonales deplecionantes anti-CD4 y anti-CD8 por anticuerpos anti-CD40L (bloquean la interacción CD40-CD40L, necesaria para la maduración de las células dendríticas) y por la proteína de fusión CTLA4-Ig (inhibe la interacción de CD80 y CD86 con CD28, que actúa bloqueando la coestimulación), aunque este protocolo todavía necesita una dosis de irradiación no mieloablativa y depleción de linfocitos T CD828. Recientemente, sin embargo, se ha publicado que la administración de médula ósea en dosis 10 veces mayores que en el trasplante estándar, junto con la utilización del anticuerpo anti-CD40L, es suficiente para inducir una quimera hematopoyética sin necesidad de irradiación, y los receptores así tratados toleran injertos de piel del mismo haplotipo que el de la médula ósea25.
El fundamento de esta estrategia de inducción de tolerancia mediante trasplante de médula ósea se basa en el establecimiento de un quimerismo hematopoyético mixto que permita la colonización del timo del receptor por células dendríticas del donante, para así lograr quimerismo central en el timo. Esto último es fundamental para que se pueda establecer una tolerancia específica de donante a injertos del mismo haplotipo que el de la médula ósea alogénica. De esta manera, durante el proceso de diferenciación de las células T en el timo, las células dendríticas del donante, diferenciadas de la médula ósea injertada y migradas al timo del receptor, podrían participar en la purga de linfocitos T alorreactivos a través de selección negativa o deleción clonal, y así generar un repertorio de células T tolerantes frente a lo propio y a los aloantígenos del donante.
ESTRATEGIAS DE INDUCCIÓN DE TOLERANCIA PERIFÉRICA
Aparte de los procedimientos de inducción de tolerancia central mostrados anteriormente, se puede abordar la inducción de la tolerancia actuando en la periferia y sin necesidad de someter al receptor del injerto a manipulaciones tan agresivas y de difícil manejo clínico como puede ser un trasplante de médula ósea.
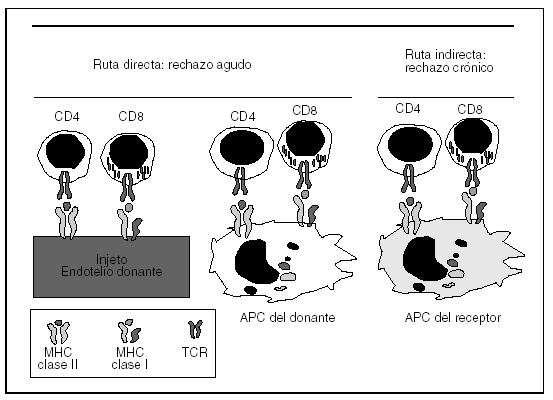
Las células dendríticas son las células especializadas en la presentación de antígenos y las únicas capaces de estimular a las células T naïve. Así, las células dendríticas presentes en el injerto del donante (ruta directa de presentación) y las células dendríticas del receptor, que captan péptidos alogénicos del MHC del aloinjerto (ruta indirecta de presentación antigénica), son capaces de presentar el antígeno a las células T del receptor (señal primaria de activación) (fig. 2). Esto se sigue de una señal secundaria de coestimulación y proliferación que permite que se expandan y se diferencien a células T efectoras (CD4 o CD8) capaces de atacar el órgano diana.
Fig. 2. Rutas directas e indirectas de presentación antigénica en trasplantes. Los aloantígenos del donante son presentados a las células T del receptor vía directa a través de las células dendríticas pasajeras presentes en el aloinjerto que migran al ganglio linfático del receptor, así como el propio parénquima del injerto. Por otra parte, las células dendríticas del receptor van a captar aloantígeno del complejo de histocompatibilidad (MHC) del donante, lo van a procesar y a presentar a sus propias células. Esto se conoce como ruta indirecta de presentación antigénica.TCR: receptor del antígeno de los linfocitos T; APC: células presentadoras de antígeno.
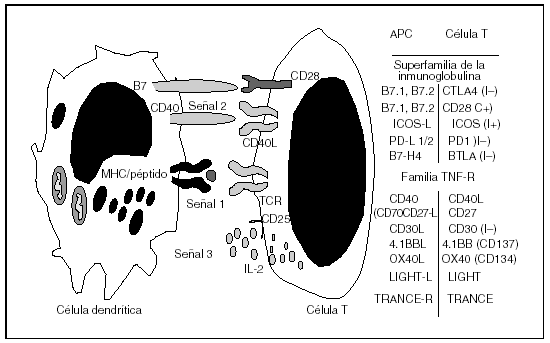
Por lo tanto, se puede bloquear la respuesta inmunitaria actuando en la periferia e interfiriendo con la comunicación que es necesario que se establezca entre la célula T y la célula dendrítica, lo que conduciría a las células T a un estado de incapacidad de respuesta denominado anergia (fig. 3). Así, por ejemplo, se ha podido demostrar en modelos de trasplante alogénico cardíaco que la administración de la proteína de fusión CTLA4-Ig, que impide que CD28 se pueda unir a las moléculas B7.1 (CD80) y B7.2 (CD86), combinada con la administración de un anticuerpo monoclonal anti-CD40L (CD40-CD40L es una interacción que facilita la maduración de la célula dendrítica y afecta positivamente a su capacidad de presentar el antígeno de forma eficiente), es una estrategia muy potente para prevenir el rechazo de órganos vascularizados en modelos murinos, e incluso es capaz de inducir tolerancia inmunológica específica del donante29. Si además se combina con la administración de rapamicina, que inhibe la proliferación de las células T mediada por citocinas, entonces se logra un estado de tolerancia robusta específica del donante, incluso en trasplante de piel, modelo animal muy refractario a los procedimientos de inducción de tolerancia30. Por lo tanto, las estrategias que permiten que se produzca la señal 1 de activación, pero que previenen la señal 2 de coestimulación y afectan a la señal 3 de proliferación o expansión clonal, son mecanismos muy potentes capaces de afectar a la respuesta inmunitaria y facilitar el establecimiento de la tolerancia inmunológica al inducir apoptosis de las células T tras su activación.
Fig. 3. La activación y la proliferación de las células T necesita varias señales (paradigma de las 3 señales).Las células, para activarse, replicarse y diferenciarse, necesitan recibir 3 tipos de señales. La señal 1, de activación, consiste en la interacción del alopéptido anclado en el complejo de histocompatibilidad (MHC) con el receptor de la célula T. Posteriormente, necesita recibir una segunda señal de coestimulación (señal 2) y una tercera de proliferación (señal 3) para que pueda transformarse en una célula T efectora capaz de atacar al injerto. El bloqueo de estas señales forma la base científica sobre la cual se pueden diseñar estrategias que prevengan la respuesta inmunitaria y faciliten el proceso de inducción de tolerancia.IL: interleucina; TCR: receptor del antígeno del linfocito T; APC: células presentadoras de antígeno; TNF-R: receptor del factor de necrosis tumoral.
Recientemente, el grupo de Strom31,32, de la Universidad de Harvard, ha propuesto una estrategia muy original y efectiva para bloquear la respuesta inmunitaria. Se basa en la administración de 2 proteínas de fusión quiméricas, una de ellas formada por IL-2 unida al fragmento Fc de la inmunoglobulina G2a, y otra que contiene la IL-15 mutada unida al fragmento Fc de la inmunoglobulina G2a. Este tratamiento se combina con rapamicina. La primera proteína de fusión, al unirse al receptor de la IL-2, induce proliferación y, al ser capaz de fijar complemento, elimina las células T activadas que expresan el receptor para la IL-2. Por otra parte, la IL-15 mutada se une a su receptor y es capaz de antagonizar la señalización de supervivencia mediada a través de la IL-15. Igualmente podría producir la lisis de las células que expresan el receptor de la IL-15. De esta forma han conseguido demostrar en trasplante de órgano vascularizado un potente efecto inmunodepresor que facilita el establecimiento de un estado de tolerancia específica de donante.
LA REDUCCIÓN DEL TAMAÑO DEL REPERTORIO DE CÉLULAS T ALORREACTIVAS ES INDISPENSABLE PARA FACILITAR LA INDUCCIÓN DE TOLERANCIA
La frecuencia de células T alorreactivas preexistentes en un individuo normal no sensibilizado (no sometido a trasplante o a transfusiones) es muy alta, del orden de una de cada 20 células T periféricas, mientras que frente a un antígeno normal33 es de una en 1 x 106. Por tanto, las intervenciones que reduzcan la frecuencia de células T alorreactivas a través de su depleción facilitarían la inducción de tolerancia.
Los tratamientos que bloquean el rechazo agudo en modelos experimentales basados en el bloqueo de las señales de coestimulación, que se combinan con el fármaco inmunodepresor rapamicina, muestran efectos sinérgicos. Las células T alorreactivas de los receptores así tratados reducen su supervivencia de 10 a 1.000 veces, lo que facilita el establecimiento de la tolerancia. Para que esta estrategia desencadene el efecto deseado, es necesario que la célula T se active (es decir, reciba la señal 1), entre en ciclo replicativo y, posteriormente, se muera por apoptosis (muerte celular inducida por activación o muerte celular pasiva).
La reducción del número de células T alorreactivas preexistentes en el individuo normal es necesaria para que los mecanismos inmunorreguladores puedan operar y controlar las células T alorreactivas residuales que permanezcan.
TRASPLANTE HEPÁTICO EN MODELOS ANIMALES. MECANISMOS DE INDUCCIÓN DE TOLERANCIA
El trasplante alogénico hepático entre individuos de distinto MHC se acepta de forma espontánea en algunas especies (roedores y cerdo), pero no en las especies humana o canina. Además, los animales que han aceptado un hígado aceptan igualmente un injerto de piel del mismo individuo, es decir, el hígado posee capacidad de inducir tolerancia específica de donante34. Para explicar este fenómeno se han postulado diversos mecanismos, entre los cuales los linfocitos del donante presentes en el injerto serían los principales elementos de este efecto protector. Entre los leucocitos pasajeros del donante se incluyen linfocitos, células dendríticas y células de Kupffer. Starzl et al35 han demostrado que los leucocitos del donante migran a distintas localizaciones del receptor y su presencia después del trasplante se ha asociado con el éxito de éste (microquimerismo, quimerismo geneneralmente demostrado por técnicas moleculares, pero no detectable por citometría), aunque otros autores creen que esta observación no es la causa, sino simplemente un epifenómeno. Lo que sí parece claro es que la presencia de los leucocitos pasajeros en el injerto podría contribuir a facilitar la aceptación de un aloinjerto hepático y la inducción de tolerancia36. En favor de esta hipótesis cabe destacar que la eliminación de las células hematopoyéticas del injerto hepático antes de su implantación reduce notablemente la capacidad del hígado para inducir tolerancia y protegerse del rechazo. Igualmente se ha demostrado que las células del parénquima hepático, a través de los antígenos MHC solubles secretados, podrían contribuir de forma complementaria a la inducción de tolerancia36,37.
Durante la etapa fetal, los precursores hematopoyéticos colonizan el hígado antes de migrar de forma definitiva a la médula ósea. Como consecuencia de ello, se sabe que en la edad adulta, y ante situaciones extremas de aplasia de la médula ósea, este órgano puede desarrollar cierta actividad hematopoyética que puede contribuir a un estado de microquimerismo protector del injerto. Además, el hígado en los individuos adultos presenta una enorme capacidad regenerativa que le permite recuperarse después de una lesión grave. Esto confiere al trasplante hepático ciertas ventajas cuando se le compara con el de otros órganos sólidos.
TRASPLANTE HEPÁTICO CLÍNICO: EL TRATAMIENTO IMUNODEPRESOR ESPECÍFICO BASADO EN EL UTILIZACIÓN DE ANTICUERPOS MONOCLONALES
La idea anteriormente señalada sobre la necesidad de reducir el repertorio de células T alorreactivas como estrategia que facilite el proceso de inducción de tolerancia ha inspirado numerosos ensayos clínicos en marcha en la actualidad.
Desde hace algunos años se dispone en la clínica de anticuerpos contra la cadena alfa del receptor de la IL-2 (basiliximab y daclizumab), que previenen la unión de la IL-2 tan importante para que el linfocito T pueda multiplicarse. Estos anticuerpos se utilizan combinados con fármacos inmunodepresores en las etapas iniciales del trasplante para facilitar la inducción de tolerancia, con resultados esperanzadores38.
Se han introducido anticuerpos deplecionantes de células T dirigidos frente al antígeno CD3 que se expresa en linfocitos T, los cuales poco a poco han ido sustituyendo a los sueros policlonales antilinfocitos o timocitos. En ensayos preclínicos, el anticuerpo monoclonal anti-CD3 acoplado a la toxina diftérica (FN18-CRM9) y administrado a monos antes del trasplante renal prolonga enormemente la supervivencia del trasplante, en ausencia de cualquier tipo de inmunodepresión39.
El Campath-1 es un anticuerpo anti-CD52 humanizado con potente capacidad deplecionante de las células T y B, sin afectar a la médula ósea. La administración inicial, en tratamiento inductor, del anticuerpo permite reducir la dosis de ciclosporina de mantenimiento en trasplante renal, y existen datos preliminares prometedores en trasplante intestinal y hepático35,40.