El uso de infliximab (IFX) en enfermedad inflamatoria intestinal (EII) se ha asociado con un riesgo de 1-6% de reacciones a la infusión. La utilidad de premedicación con corticoides, paracetamol y/o antihistamínicos es controvertido.
ObjetivoEvaluar si en pacientes con EII que utilizan IFX hay diferencias en las reacciones secundarias a infusión entre aquellos que utilizan o no premedicación.
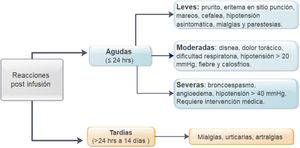
MétodosEstudio descriptivo, observacional, retrospectivo en pacientes con EII, que han utilizado IFX entre enero 2009 y julio 2019. Se definieron como reacciones agudas aquellas ocurridas en las primeras 24 hrs.postinfusión y tardías después de ese período, clasificándose en leves, moderadas y severas. Se usó estadística descriptiva y de asociación (χ2; p < 0,05).
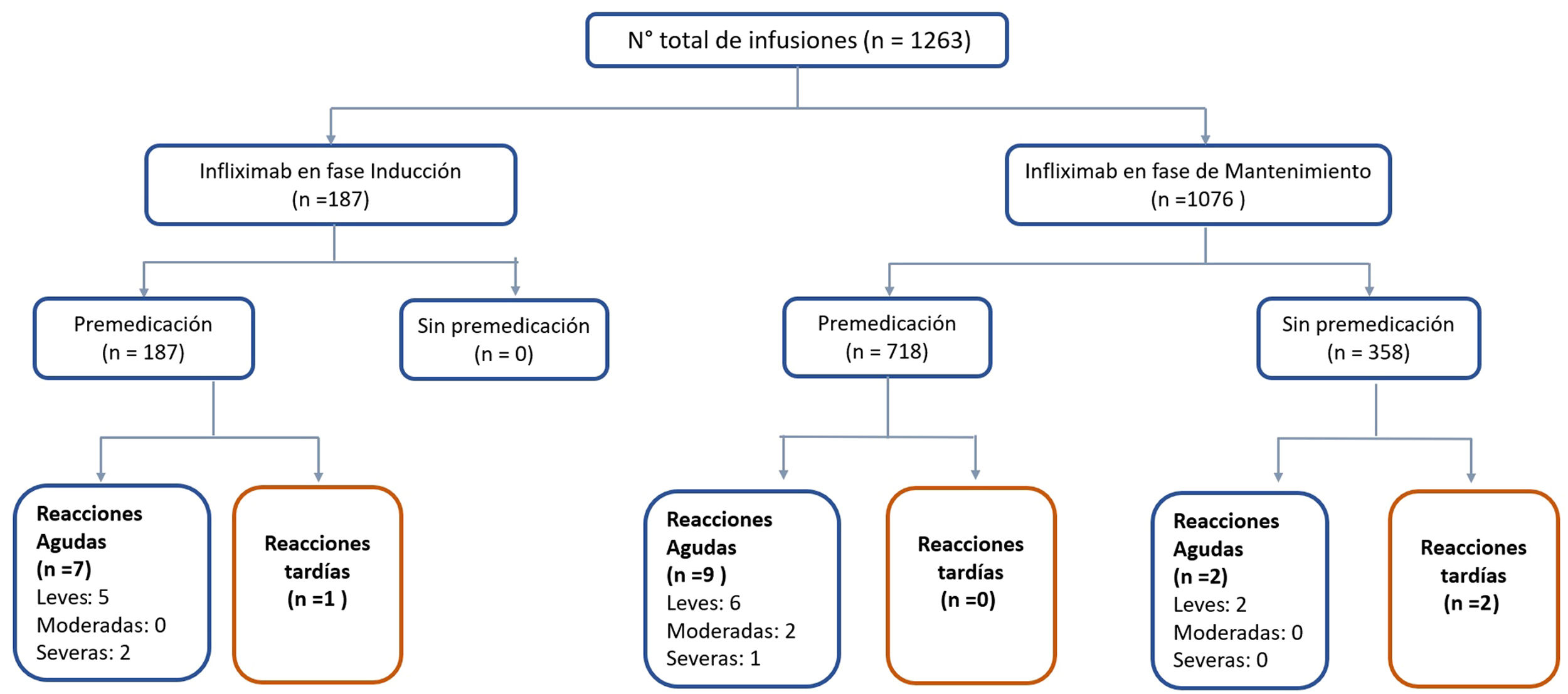
ResultadosSe incluyeron 1.263 infusiones en un total de 64 pacientes, 52% hombres. Mediana de infusiones por paciente 22 (2-66). El 100% de las infusiones en inducción fueron con premedicación y en mantenimiento el 57%. La premedicación fue realizada con hidrocortisona, clorfenamina y paracetamol. La mayoría de las reacciones fueron agudas, de gravedad leve a moderada y ningún paciente necesitó descontinuar IFX. En mantenimiento hubo 9/718 (1,2%) reacciones a la infusión con premedicación y 4/358 (1,1%) sin ésta, sin diferencias significativas (p = 0,606). En inducción hubo 8/187 (4,3%) reacciones a la infusión, significativamente mayor al compararlas con ambos grupos de mantenimiento.
ConclusiónEn esta cohorte de pacientes, el no usar premedicación en fase de mantenimiento de IFX no aumentó el número de eventos adversos a este fármaco. Estos resultados sugieren que su indicación no sería necesaria.
The use of infliximab (IFX) in inflammatory bowel disease (IBD) has been associated with a 1-6% risk of infusion reactions. The usefulness of premedication with corticosteroids, paracetamol and /or antihistamines is controversial.
AimThe aim of this study is to assess, in IBD patients on IFX, whether there are differences in secondary reactions to the infusion between those who use premedication or not.
MethodsA retrospective cohort study was performed identifying patients with a diagnosis of IBD who received IFX at our institution between January 2009 and July 2019. Acute reactions were defined as those that occurred in the first 24 hours postinfusion and late reactions for more than 24 hours. Infusion reactions were classified as mild, moderate and severe. Descriptive and association statistics were used (χ2; p < 0.05).
ResultsSixty-four patients were included with 1,263 infusions in total, 52% men. Median infusions per patient was 22 (2-66). All induction infusions were administered with premedication, and in maintenance in 57% of them. Premedication was given with hydrocortisone, chlorphenamine and paracetamol. Most of reactions were acute, mild or moderate in severity and no patient needed to discontinue IFX. In the maintenance group, there were 9/718 (1.2%) infusion reactions with premedication and 4/358 (1.1%) without it (p = 0.606). In the induction group, there were 8/187 (4.3%) infusion reactions, significantly higher when compared with both maintenance groups.
ConclusionsIn this group, premedication use during maintenance was not effective at reducing the rate of infusion reactions. These results suggest that premedication would not be necessary.
La llegada de la terapia biológica ha sido un avance fundamental en el tratamiento de los pacientes con enfermedades inflamatorias mediadas por el sistema inmune, incluida la enfermedad inflamatoria intestinal (EII), artritis reumatoide, espondilitis anquilosante, psoriasis y artritis psoriática1. El primer anti-Tumor Necrosis Factor (anti-TNF) disponible como estrategia terapéutica en la EII fue infliximab, un anticuerpo IgG1 κ quimérico de administración intravenosa dirigido contra TNF-α2.
Sin embargo, la administración de este biológico se ha asociado con un riesgo de reacciones postinfusión las cuales pueden ser agudas o tardías3,4. Las primeras se presentan dentro de las 24 horas postadministración y ocurren aproximadamente en el 5-29% de los pacientes y hasta en 6% de las infusiones3-9. Los síntomas pueden variar desde reacciones leves como eritema, prurito, urticaria, fiebre, escalofríos, mialgias, parestesias e hipotensión asintomática, hasta reacciones graves que incluyen cuadros de anafilaxia, convulsiones e hipotensión sintomática3,9. Los mecanismos que llevan a estas reacciones agudas aún no han sido aclarados4,10-13. Se ha descartado reacciones por hipersensibilidad tipo 1 dado que niveles de IgE contra IFX se encuentran normales en pacientes que han presentado reacciones agudas postinfusión11, sin embargo, la premedicación sigue siendo ampliamente utilizada en la práctica clínica para evitar reacciones agudas14-17. Esta estrategia incluye generalmente el uso de corticoesteroides (prednisona, dexametasona, hidrocortisona o metilprednisolona), agentes antihistamínicos (difenilhidramina, loratadina o cetirizina) y antipiréticos (paracetamol)7,8,15,18-21. Además, algunos han asociado antieméticos (ondansetron) y prehidratación (suero fisiológico)22,23. En una encuesta que incluyó 376 gastroenterólogos adultos y pediátricos, el 70% informó haber indicado un antihistamínico, 64% paracetamol y 48% un corticoesteroide antes de cada infusión de IFX16.
Por otra parte, las reacciones tardías se manifiestan entre las 24 horas y 14 días después de la administración del biológico y ocurren hasta en el 3% de las infusiones3,4,9. Los síntomas más frecuentes son erupciones pruriginosas, fiebre, mialgias y artralgias3. La patogenia de estas reacciones se debe a una variedad de respuestas inflamatorias locales y sistémicas causadas por la fijación y activación del complemento que se desencadenarían por la unión de IFX a los anticuerpos anti-IFX4. Ante la falta de evidencia que sustente el uso de premedicación o que defina con claridad a qué grupo de pacientes beneficiaría esta estrategia, estudios han cuestionado su efectividad sobre todo en pacientes que se encuentran en terapia de mantenimiento7,8,22-25.
El objetivo de este estudio es evaluar la efectividad de la premedicación en la prevención de reacciones adversas agudas y tardías postinfusión de IFX, tanto en fase de inducción como en mantenimiento.
Pacientes y métodosEstudio observacional, descriptivo, transversal y analítico, realizado en pacientes ≥ 18 años de edad con diagnóstico confirmado de Enfermedad de Crohn (EC), Colitis Ulcerosa (CU) o EII no clasificable que recibieron IFX entre enero 2009 y julio 2019, en fase de inducción y/o mantenimiento y que estuviesen incluidos en el Programa de Enfermedad Inflamatoria Intestinal de Clínica Las Condes. Se excluyeron los pacientes que se administraran el biológico en otro centro.
Las variables demográficas (edad, género y hábito tabáquico) y clínicas [diagnóstico, clasificación de Montreal, años de evolución de la enfermedad, años de ingreso al Programa de EII, tratamiento actual con mesalazina, tiopurínicos (azatioprina/6-mercaptopurina) y metotrexato, fase de inducción o mantenimiento con IFX (dosis, tiempo durante el cual se administró la infusión y el número de semanas de la infusión anterior), niveles de IFX (medición por ELISA con límite superior > 12 μg/mL) y anticuerpos contra IFX, requerimientos de optimización de terapia ya sea necesidad de aumentar dosis o acortar frecuencia de administración de IFX), antecedentes de uso previo de IFX (razón de la suspensión, incluyendo pérdida de respuesta, falta de adherencia, retiro de biológico por remisión clínica y curación mucosa), antecedentes de cirugía por la EII y alergias a medicamentos] fueron obtenidas del Registro con fines de Investigación de pacientes con EII de Clínica Las Condes, el cual fue aprobado por el Comité de Ética local en abril de 2012.
Al inicio del tratamiento con IFX, los pacientes recibieron 5 mg/kg a la semana 0,2 y seis semanas (fase de inducción). En caso de CU grave corticorefractaria, según criterio del gastroenterólogo tratante, se indicó un esquema optimizado (dosis de 10 mg/kg y/o administración semanal 0,1 y cuatro). Durante la fase de mantenimiento, la dosis administrada fue 5 mg/kg cada ocho semanas. Los ajustes en las dosis (10 mg/kg) e intervalos (cada cuatro o seis semanas) en esta fase fueron realizados según actividad clínica y en caso de estar disponibles con niveles de infliximab y anticuerpos contra el fármaco.
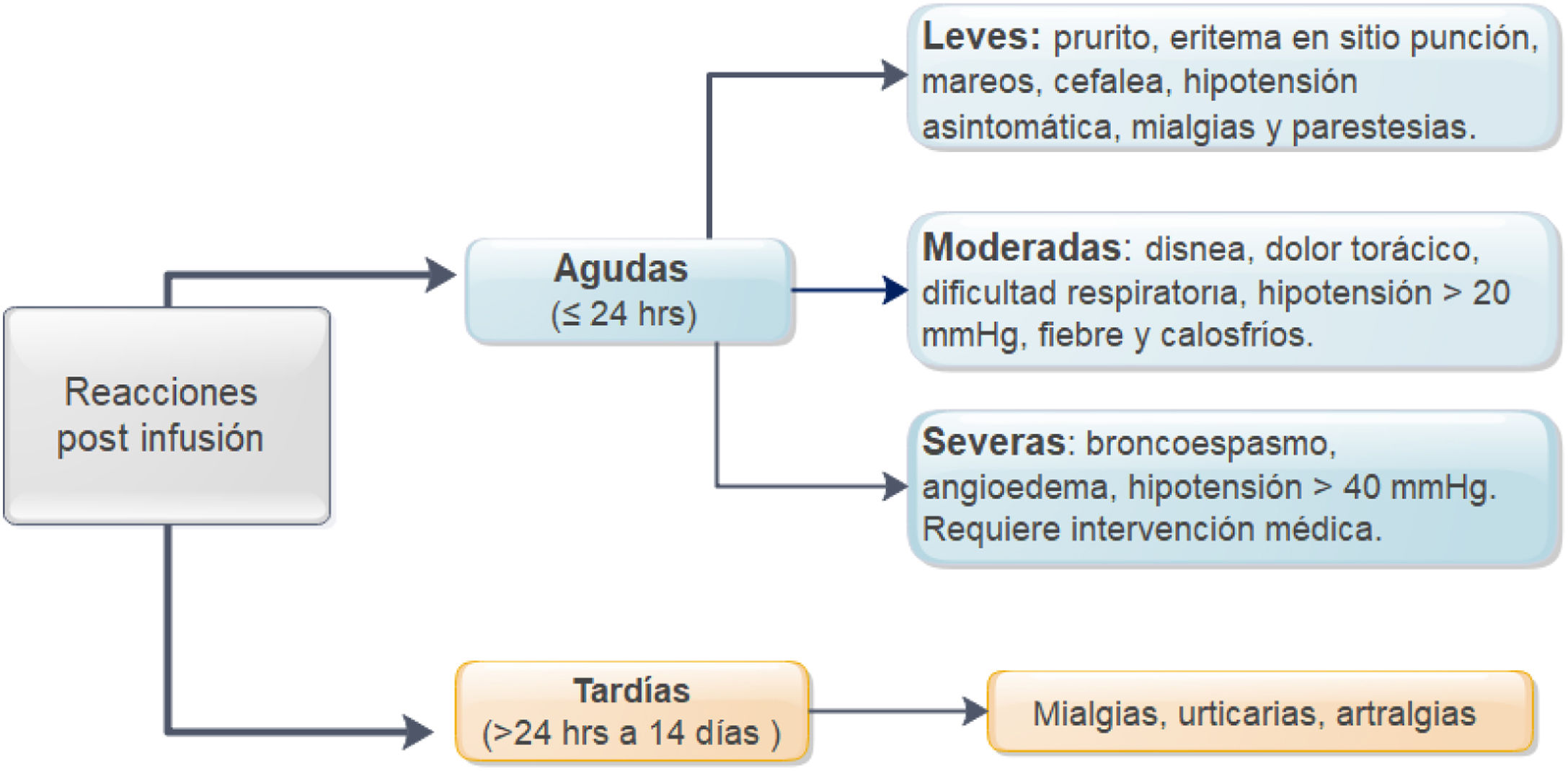
En relación a la premedicación, se incluyó el tipo de fármaco utilizado (hidrocortisona, prednisona, paracetamol, clorfenamina u otro tipo), incluido su dosis y vía de entrega. Se registraron todas las reacciones agudas postinfusión de infliximab. Estas incluyeron los síntomas, tratamiento proporcionado27, necesidad de evaluación médica de emergencia, hospitalización y desensibilización. La severidad de la reacción se clasificó de acuerdo a las definiciones identificadas como leves, moderadas o graves (fig. 1)3,9. En pacientes que presentaron reacciones tardías (1 a 14 días), se registraron los síntomas y el tratamiento requerido27. Se definió como pacientes de alto riesgo de reacción postinfusión a aquellos pacientes que tenían el antecedente de reacción previa a IFX, retraso en las infusiones (≥ 10 semanas desde la infusión anterior) o reintroducción del biológico después de un período de suspensión (≥ 20 semanas entre las infusiones)24,26-29. Los pacientes de bajo riesgo fueron aquellos que no presentaban ninguna de las características mencionadas.
Este estudio fue aprobado por el Comité de Ética de la institución y se realizó manteniendo los principios de la Declaración de Helsinki.
Análisis estadísticoDado que una reacción podría ocurrir en una infusión y posteriormente no volver a presentarse en el mismo paciente, cada administración de infliximab se consideró un evento único y se determinó tanto la estratificación de riesgo como frecuencia de reacción por infusión. Los resultados del estudio fueron analizados mediante el programa R Commander. Las variables categóricas se analizaron a través de frecuencia absoluta y porcentual. Las variables continuas se describieron con medidas de tendencia central y dispersión según la distribución de los datos (promedio y desviación estándar si distribuyeron normal y mediana y rango si no distribuyeron normal). Las variables continuas se compararon usando Mann-Whitney o t-test según distribución. Para variables categóricas se utilizó frecuencia relativa porcentual y para el análisis estadístico comparativo chi-cuadrado. Se determinó significancia estadística a un valor de p ≤ 0,05.
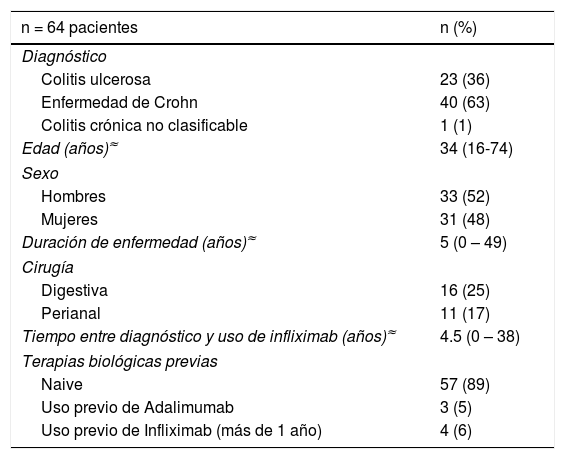
ResultadosPacientesSe incluyeron 1.263 infusiones de IFX en un total de 64 pacientes. Los datos demográficos y clínicos de los pacientes se presentan en la tabla 1. Cuarenta pacientes con diagnóstico de EC, 23 de CU y uno con EII no-clasificable participaron en este estudio, 52% hombres, con una mediana de edad de 34 años (rango 16-74), y una mediana de duración de enfermedad de cinco años (rango 0-49). Sesenta y dos pacientes habían estado en algún momento con terapia combinada (IFX más tiopurínicos/metotrexato). En relación a IFX, el 89% de los pacientes no había usado otro biológico y en cuatro pacientes se reintrodujo como estrategia después de un año de la última dosis (por razones extra-médicas). Ningún paciente tenía antecedentes de atopía, alergia o anafilaxia a algún fármaco.
Características Clínicas y demográficas de los pacientes con infliximab
| n = 64 pacientes | n (%) |
|---|---|
| Diagnóstico | |
| Colitis ulcerosa | 23 (36) |
| Enfermedad de Crohn | 40 (63) |
| Colitis crónica no clasificable | 1 (1) |
| Edad (años)≈ | 34 (16-74) |
| Sexo | |
| Hombres | 33 (52) |
| Mujeres | 31 (48) |
| Duración de enfermedad (años)≈ | 5 (0 – 49) |
| Cirugía | |
| Digestiva | 16 (25) |
| Perianal | 11 (17) |
| Tiempo entre diagnóstico y uso de infliximab (años)≈ | 4.5 (0 – 38) |
| Terapias biológicas previas | |
| Naive | 57 (89) |
| Uso previo de Adalimumab | 3 (5) |
| Uso previo de Infliximab (más de 1 año) | 4 (6) |
≈ (mediana; rango)
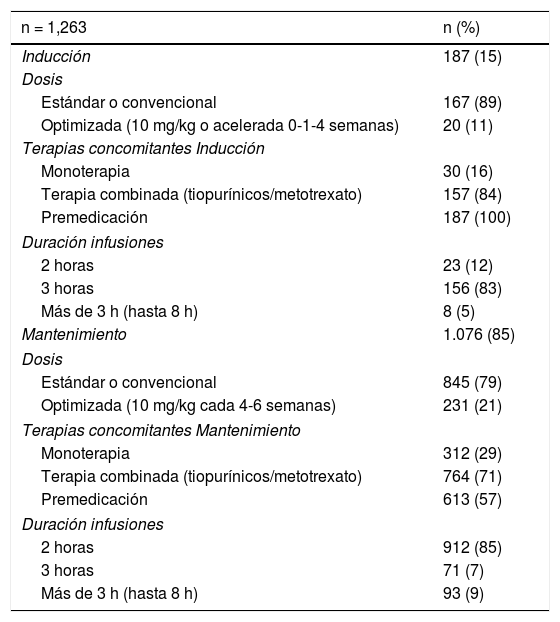
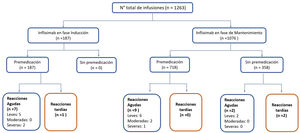
La mediana de infusiones por paciente fue de 22 (rango 2-66). Todos los pacientes recibieron el IFX original (Remicade®). El 85% de las infusiones se realizó durante la fase de mantenimiento. Tanto en inducción como en mantenimiento, la dosis de IFX más utilizada fue 5 mg/kg (89 y 79% respectivamente) (tabla 2). Las infusiones de IFX se administraron en tres horas en el 74% de las infusiones, 18% en dos horas y 8% en más de tres horas (hasta ocho horas). En dos pacientes se realizó una desensibilización de IFX por programa4,30, administrándose el biológico en ocho horas en uno de ellos. El 100% de las infusiones en inducción fueron con premedicación y en mantenimiento el 57%. La premedicación fue realizada con hidrocortisona (100 mg en 95% y 200 mg 5%), clorfenamina (10 mg) y paracetamol (1 g) en todos los pacientes. Ningún paciente recibió durante la premedicación prehidratación (suero fisiológico o ringer lactato) o antieméticos (ondansetron o domperidona).
Características de las infusiones infliximab
| n = 1,263 | n (%) |
|---|---|
| Inducción | 187 (15) |
| Dosis | |
| Estándar o convencional | 167 (89) |
| Optimizada (10 mg/kg o acelerada 0-1-4 semanas) | 20 (11) |
| Terapias concomitantes Inducción | |
| Monoterapia | 30 (16) |
| Terapia combinada (tiopurínicos/metotrexato) | 157 (84) |
| Premedicación | 187 (100) |
| Duración infusiones | |
| 2 horas | 23 (12) |
| 3 horas | 156 (83) |
| Más de 3 h (hasta 8 h) | 8 (5) |
| Mantenimiento | 1.076 (85) |
| Dosis | |
| Estándar o convencional | 845 (79) |
| Optimizada (10 mg/kg cada 4-6 semanas) | 231 (21) |
| Terapias concomitantes Mantenimiento | |
| Monoterapia | 312 (29) |
| Terapia combinada (tiopurínicos/metotrexato) | 764 (71) |
| Premedicación | 613 (57) |
| Duración infusiones | |
| 2 horas | 912 (85) |
| 3 horas | 71 (7) |
| Más de 3 h (hasta 8 h) | 93 (9) |
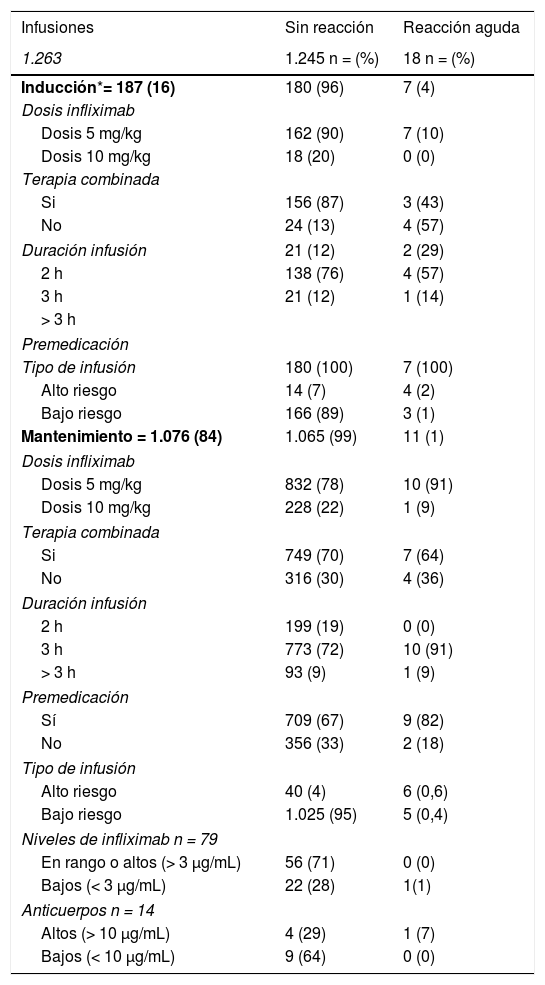
De las 1.263 infusiones analizadas en este estudio, 64 (5%) fueron definidas como de alto riesgo. Cincuenta y dos por antecedente de una reacción aguda postadministración de infliximab, ocho por un retraso en las infusiones y cuatro por una reintroducción del biológico después de un tiempo > 10 semanas de la última infusión. En este grupo, 46 dosis fueron administradas durante la fase de mantenimiento y la dosis de infliximab fue de 10 mg/kg en el 57%. La premedicación fue indicada en 85% de las infusiones de este grupo. Se presentaron 10 (16%) reacciones agudas postinfusión (cuatro en inducción y seis en mantenimiento) todos con premedicación. Todos los eventos adversos ocurridos en la fase de inducción se produjeron en la segunda dosis de IFX, estando los pacientes premedicados. En mantenimiento tres eventos ocurrieron pese a que los pacientes habían recibido premedicación (tabla 3).
Reacciones agudas postinfusión
| Infusiones | Sin reacción | Reacción aguda |
|---|---|---|
| 1.263 | 1.245 n = (%) | 18 n = (%) |
| Inducción*= 187 (16) | 180 (96) | 7 (4) |
| Dosis infliximab | ||
| Dosis 5 mg/kg | 162 (90) | 7 (10) |
| Dosis 10 mg/kg | 18 (20) | 0 (0) |
| Terapia combinada | ||
| Si | 156 (87) | 3 (43) |
| No | 24 (13) | 4 (57) |
| Duración infusión | 21 (12) | 2 (29) |
| 2 h | 138 (76) | 4 (57) |
| 3 h | 21 (12) | 1 (14) |
| > 3 h | ||
| Premedicación | ||
| Tipo de infusión | 180 (100) | 7 (100) |
| Alto riesgo | 14 (7) | 4 (2) |
| Bajo riesgo | 166 (89) | 3 (1) |
| Mantenimiento = 1.076 (84) | 1.065 (99) | 11 (1) |
| Dosis infliximab | ||
| Dosis 5 mg/kg | 832 (78) | 10 (91) |
| Dosis 10 mg/kg | 228 (22) | 1 (9) |
| Terapia combinada | ||
| Si | 749 (70) | 7 (64) |
| No | 316 (30) | 4 (36) |
| Duración infusión | ||
| 2 h | 199 (19) | 0 (0) |
| 3 h | 773 (72) | 10 (91) |
| > 3 h | 93 (9) | 1 (9) |
| Premedicación | ||
| Sí | 709 (67) | 9 (82) |
| No | 356 (33) | 2 (18) |
| Tipo de infusión | ||
| Alto riesgo | 40 (4) | 6 (0,6) |
| Bajo riesgo | 1.025 (95) | 5 (0,4) |
| Niveles de infliximab n = 79 | ||
| En rango o altos (> 3 μg/mL) | 56 (71) | 0 (0) |
| Bajos (< 3 μg/mL) | 22 (28) | 1(1) |
| Anticuerpos n = 14 | ||
| Altos (> 10 μg/mL) | 4 (29) | 1 (7) |
| Bajos (< 10 μg/mL) | 9 (64) | 0 (0) |
Por otra parte, 1.199 (95%) infusiones se clasificaron como de bajo riesgo para una reacción aguda postadministración de infliximab; 169 (14%) fueron dosis de inducción y la dosis fue de 5 mg/kg en el 97%. El 100% de estas recibieron premedicación, ocurriendo ocho reacciones agudas postadministración de IFX (tres en inducción y cinco en mantenimiento).
Los niveles de IFX fueron medidos en 79 infusiones, en un total de 32 pacientes (tabla 3). Nueve pacientes tenían dos mediciones y 13 más de tres mediciones durante el período de estudio. El rango de los niveles fue de 0.01 a 52.4 μg/mL. La presencia de anticuerpos contra IFX se midió en 14 infusiones, dos pacientes tenían dos mediciones. Los niveles de anticuerpos tuvieron un valor elevado en cinco infusiones (mediana 45,6 μg/mL, rango 26,5-125).
Reacciones agudasDieciocho reacciones agudas se presentaron en este estudio (1,4% de las infusiones), las cuales se desarrollaron en nueve pacientes (14%), siete de ellas en pacientes con EC. La descripción de estos eventos, su severidad y manejo se aprecian en la tabla 4. Al clasificar la severidad de las reacciones agudas, 13 de los episodios fueron leves, dos moderados y tres graves. Estos tres últimos eventos ocurrieron en el grupo que había recibido premedicación (fig. 2), en uno de estos pacientes se debió suspender temporalmente el biológico y en dos se realizó desensibilización por programa con buena respuesta4,30. Siete de las reacciones agudas ocurrieron en la fase de inducción, seis después de la segunda dosis. Las otras 11 reacciones se presentaron durante la fase de mantenimiento, nueve de éstas en pacientes que habían recibido premedicación (fig. 2). Las estrategias más frecuentes en el manejo de las reacciones agudas fueron disminuir la velocidad de infusión y detener su administración en 62 y 17% respectivamente (tabla 4). En ningún paciente fue necesario suspender IFX y cambiar de biológico.
Reacciones agudas postinfusión
| n = 18 | n (%) |
|---|---|
| Síntomas descritos | |
| Palpitaciones | 4 (22) |
| Mareos | 3 (17) |
| Hipotensión asintomática | 3 (17) |
| Rash cutáneo | 3 (17) |
| Mialgias | 2 (11) |
| Dificultad respiratoria | 1 (5) |
| Hipotensión severa | 1 (5) |
| Anafilaxis | 1 (5) |
| Severidad de síntomas | |
| Leve | 13 (72) |
| Moderado | 2 (11) |
| Severo | 3 (17) |
| Tratamiento | |
| Disminución velocidad de infusión | 11 (62) |
| Detener infusión | 3 (17) |
| Volemización | 2 (11) |
| Oxígeno | 1 (5) |
| Servicio de urgencia | 1 (5) |
Al realizar un análisis univariado, ser de alto riesgo se asoció a mayores reacciones agudas tanto en inducción (p < 0,0001) como en mantenimiento (p = 0,00007). Por otra parte, el uso de inmunomoduladores, se asoció a una menor frecuencia de reacciones adversas, aunque solo en la fase de inducción (p = 0,0014) (tabla 3).
Reacciones tardíasEn este estudio se observaron solo tres reacciones tardías (0,2% de las infusiones). En inducción, un paciente refirió mialgia. Los otros dos eventos ocurrieron durante la fase de mantenimiento, un paciente que recibió premedicación presentó artralgias y el otro, sin premedicación, urticaria. Todos los pacientes recibieron clorfenamina y paracetamol como tratamiento de estas reacciones tardías. Solo en un paciente se disminuyó la dosis de IFX de 10 mg/kg a 5 mg/kg cada ocho semanas. Ninguno paciente tenía niveles elevados de anticuerpos contra IFX.
En forma global, en la fase de mantenimiento hubo 9/718 (1,2%) reacciones postinfusión de infliximab con premedicación y 4/358 (1,1%) sin ésta, sin diferencias significativas (p = 0,606). Por otra parte, en la fase de inducción hubo 8/187 (4,3%) reacciones a la infusión, significativamente mayor al compararlas con ambos grupos de mantenimiento (grupo sin premedicación p = 0,02 y grupo con premedicación p = 0,008).
DiscusiónEn las últimas décadas, el tratamiento de la EII ha ido evolucionando con la llegada de la terapia biológica (anti-TNF, anti-integrinas y anti-p40 IL-12/23) y últimamente por las moléculas pequeñas, lo que ha permitido modificar la evolución de la enfermedad y con ello la calidad de vida de estos pacientes31. Específicamente IFX, en esquema de inducción y mantenimiento, ha demostrado ser altamente eficaz en reducir la inflamación, lograr la remisión clínica y endoscópica, reduciendo el número de hospitalizaciones y cirugía32,33. Además, se ha demostrado que el uso precoz de IFX puede cambiar la evolución de la EII34.
Aunque son infrecuentes3-9, las reacciones postinfusión de IFX preocupan tanto al paciente como al equipo tratante, por el riesgo de suspender la terapia considerando las limitadas estrategias terapéuticas aún disponibles en el manejo de la EII. Nuestros resultados confirman la baja frecuencia de reacciones agudas dentro de las primeras 24 horas (1,4% de las infusiones, 14% de los pacientes) y de reacciones tardías entre las 24 h y 14 días (0,2% de las infusiones, 4,7% de los pacientes).
Al clasificar la severidad de las reacciones agudas, el 87% de los eventos fueron leves a moderados, muy similar a lo descrito por otros9,14,23. En el estudio de Gold et al.23, el cual incluyó 7.090 infusiones, el 83% de las reacciones fueron leves a moderadas. Sin embargo, el porcentaje de eventos leves fue mayor en nuestro estudio (72 vs. 57%). El número de pacientes incluidos y por lo tanto la cantidad de infusiones, pueden explicar estás diferencias. Recientemente un estudio que incluyó pacientes que recibieron la administración de IFX en un centro ambulatorio, confirmó que el porcentaje de reacciones graves es bajo (11,5% de las reacciones, 0,2% de todas las infusiones)9. Los síntomas postinfusión más frecuentes en nuestro estudio fueron palpitaciones, mareos, hipotensión asintomática y rash cutáneo. Otros han mencionado además prurito, disnea, mialgia, náuseas, urticaria, y cefalea, entre otros7,9,23.
El 39% de las reacciones agudas postinfusión ocurrieron durante la fase de inducción. Otros han señalado que este porcentaje puede llegar a un 100% de los eventos, sobre todo después de la segunda dosis3,14. En nuestro estudio, seis de las siete reacciones agudas durante la fase de inducción también se produjeron después de la segunda dosis.
En este estudio 5% de las infusiones fueron definidas como de alto riesgo, seis de 64 (9%) presentaron una reacción aguda. En un estudio que incluyó 986 infusiones de alto riesgo, solo el 5,4% presentó una reacción aguda postinfusión, sin tener relación con el uso de premedicación, independiente del tipo de fármaco utilizado como estrategia23. Sin embargo, en nuestro estudio, se presentó un mayor porcentaje de reacciones agudas postinfusión tanto en inducción como en mantenimiento en el grupo de alto riesgo. Estudios prospectivos y con un mayor número de pacientes podrán definir la efectividad de la premedicación en este escenario. Por otra parte, estudios han mostrado que la premedicación no tendría un efecto protector en el grupo de bajo riesgo, donde solo se observó reacción adversa postinfusión en el 1%23. Nuestros resultados confirman esta tendencia, solo 1% de las infusiones en este grupo presentó una reacción aguda.
La terapia combinada de IFX con tiopurínicos/metotrexato ha sido sugerida como una estrategia para disminuir la probabilidad de reacciones postinfusión4,35. Nuestros resultados muestran que el uso asociado de inmunomoduladores durante la fase de inducción se asoció a menos eventos adversos. Por otro lado, estudios han demostrado que pacientes que desarrollan anticuerpos contra IFX tienen un riesgo dos veces mayor de desarrollar una reacción aguda y hasta seis veces de presentar un evento grave postinfusión del biológico13,37. En un estudio randomizado controlado, se demostró que, aunque la premedicación con hidrocortisona disminuyó la formación de anticuerpos contra IFX, no eliminó el riesgo de desarrollar reacciones postadministración del biológico22. Sin embargo, otros estudios no han podido confirmar este efecto en pacientes que se encontraban en tratamiento con IFX en esquema de mantenimiento36. En nuestro estudio solo uno de los pacientes que presentaron anticuerpos tuvieron una reacción postinfusión. Es importante mencionar, que la técnica utilizada para evaluar la presencia de anticuerpos, solo permitió medirlos cuando los niveles de IFX fueron bajos o ausentes38.
Aunque no existen guías específicas para el manejo de las reacciones agudas postadministración de IFX, de acuerdo a recomendaciones terapéuticas basadas en estudios de casos3,8,9,23, y opinión de expertos4,39, la disminución de la velocidad de infusión, la suspensión temporal de administración del biológico, el uso de suero fisiológico o ringer lactato y el uso de fármacos son las medidas más sugeridas, similar a las que fueron utilizadas en nuestros pacientes. A diferencia de otros estudios9,14,39, ningún paciente requirió suspender la terapia biológica de manera definitiva.
Las reacciones tardías postadministración de IFX solo se presentaron en tres oportunidades (0,2% de las infusiones), confirmando la baja frecuencia mostrada en otros estudios3,4,9. En el estudio de Cheifetz et al.3 solo el 0,6% de los pacientes desarrolló una reacción tardía dentro de los 14 días postadministración de infliximab. Similar a lo descrito3,4,9, lo síntomas más frecuentes fueron urticaria, artralgias y mialgias. El tratamiento sugerido para estas reacciones es paracetamol y antihistamínico3,4,9, el cual fue utilizado en nuestros pacientes.
Aunque la premedicación con corticoides, antihistáminicos y antipiréticos se utiliza con frecuencia para evitar el desarrollo de reacción postinfusión de IFX, estas carecen de una validación adecuada16. Nuestro estudio confirma que la premedicación con corticoesteroides, paracetamol y clorfenamina durante la fase de mantenimiento no disminuiría el riesgo de desarrollar una reacción aguda postinfusión (nueve de los 11 eventos se presentaron en el grupo que había recibido premedicación previa a la administración de IFX). Estudios han demostrado que el uso de premedicación con hidrocortisona22 o la combinación de esteroides intravenoso, antihistamínicos y paracetamol no previenen el desarrollo de reacciones agudas postinfusión de IFX7,9. Al clasificar a los grupos según riesgo, nuestros resultados tampoco demuestran que el uso de premedicación reduzca el riesgo de desarrollar una reacción aguda postinfusión en el grupo de alto riesgo, confirmando lo señalado por otros23. Además, el riesgo de desarrollar una reacción aguda severa no disminuiría en el grupo con premedicación, similar a lo descrito por otros40. Por otra parte, las tres reacciones agudas severas se presentaron en pacientes que habían recibido premedicación. Aunque nosotros no hemos evaluado el uso de suero fisiológico como premedicación, Gold et al.23 muestran que el uso de prehidratación sola o combinada con otros fármacos podría disminuir el riesgo de presentar una reacción aguda postinfusión de IFX en pacientes de alto riesgo. Sin duda, se requiere una validación de estos resultados antes que esta indicación pueda ser sugerida.
Es importante considerar que, como cualquier fármaco, el uso de corticosteroides y antihistamínicos también está asociado a eventos secundarios. Los primeros están relacionados con somnolencia, visión borrosa, dolor abdominal y disminución del estado de alerta, entre otros41. Además, el uso de corticoesteroides como premedicación no es óptimo si consideramos que los pacientes con EII están más expuestos a usar estos fármacos como estrategia terapéutica de su enfermedad de base, con las complicaciones que ello implica31. En relación a los antihistamínicos, estos fármacos pueden asociarse a somnolencia y disminución del estado de alerta, lo que puede prolongar el tiempo en el lugar de la infusión u obligar a que otra persona deba acudir como acompañante42. No deja de ser interesante que en un estudio prospectivo que incluyó 1.632 pacientes con patología reumatológica y EII, el uso de difenidramina se asoció a un aumento en la incidencia de reacciones postinfusión (OR 1,58; p: 0,0007)7.
Estudios prospectivos han confirmado la efectividad de los biosimilares en inducir y mantener la remisión en pacientes con EC y CU39. Aunque en Chile está disponible el biosimilar Remsima®, ningún paciente recibió este fármaco durante el desarrollo de este estudio. Existe evidencia que los biosimilares presentarían una baja inmunogenicidad y una frecuencia similar de reacciones agudas postinfusión que el fármaco original, siendo mayores en pacientes que han estado expuesto previamente a un anti-TNF y hayan desarrollado anticuerpos durante la fase de inducción43.
Nuestro estudio tiene ciertas fortalezas; al ser un estudio transversal y mostrar la experiencia de un centro terciario con un Programa de EII establecido, proporciona una visión de la práctica clínica diaria. A diferencia de otros estudios9,16,23, la premedicación ha sido estandarizada en todos los pacientes, el uso de corticosteroides, paracetamol y clorfenamina en este grupo permite sacar conclusiones reales sobre la efectividad de esta estrategia en la prevención del desarrollo de reacciones postinfusión. Por otra parte, sabemos que existen también limitaciones. El número de pacientes incluidos en este estudio es bajo en comparación a otros artículos. Sin embargo, el número de infusiones con o sin premedicación durante la fase de mantenimiento nos permite señalar que, en pacientes sin factores de riesgo de desarrollar eventos adversos, el usó de premedicación podría no ser efectiva en la prevención de reacciones agudas y tardías postinfusión de IFX. Segundo, al estar todos los pacientes en la fase de inducción premedicados, no podemos señalar su efectividad en este escenario y por lo tanto sugerir o no esta estrategia. Tercero, nosotros no pudimos definir con exactitud el tiempo transcurrido entre la administración de la premedicación, el inicio de la infusión de IFX y el momento en que se presentó la reacción postinfusión. La farmacocinética de los fármacos utilizados en la premedicación debe ser considerada al momento de definir el rol de ésta en el desarrollo de las reacciones postinfusión, sobre todo de las agudas. En el estudio de Gold et al., la mayoría de las reacciones agudas ocurrieron dentro de los 15 minutos de iniciada la infusión (datos no mostrados)23. Finalmente, en este estudio no fue posible evaluar la presencia de niveles y anticuerpos en todos los pacientes que presentaron reacciones agudas y tardías postinfusión de IFX.
En conclusión, nuestro estudio sugiere que las reacciones agudas y tardías postinfusión de IFX son infrecuentes, en su mayoría leve a moderadas y que pueden ser manejadas con éxito sin necesidad de suspender la terapia biológica. Aunque durante la fase de mantenimiento puede existir el escenario donde la premedicación pueda ser considerada, no lo sugerimos como uso rutinario. Estudios prospectivos aún deben definir el papel de esta estrategia en la fase de inducción.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.