INTRODUCCIÓN
El postoperatorio inmediato del trasplante hepático (TH) es un período de inestabilidad clínica en el que suelen surgir la mayoría de las complicaciones que pueden comprometer la vida del paciente. En estos primeros días o semanas el curso clínico del paciente puede verse alterado, entre otras razones, por infecciones, complicaciones quirúrgicas, insuficiencia renal, rechazo agudo y por los efectos secundarios de los fármacos inmunodepresores.
El objetivo fundamental de la inmunodepresión después del TH es la prevención del rechazo del injerto hepático. La inmunodepresión durante el postoperatorio inmediato del TH, en los primeros días (inmunodepresión de inducción), o semanas (inmunodepresión de mantenimiento), va dirigida a evitar el rechazo agudo, al mismo tiempo que debería evitar al máximo las infecciones y tener la mínima toxicidad posible. Los excelentes resultados obtenidos, y la cada vez menor incidencia de rechazo agudo y crónico en el TH1, permiten actualmente la utilización de regímenes de inmunodepresión menos tóxicos y más eficaces. Además, un nuevo objetivo que se plantea en los últimos años es disponer de pautas de inmunodepresión tolerogénicas, que sean capaces de inducir tolerancia del injerto, sin inmunodepresión, o con mínimas dosis de manteniminto con fármacos inmunodepresores2.
La introducción de la ciclosporina (Sandimmun®) fue uno de los acontecimientos más importantes en el desarrollo de los trasplantes3 y, con la introducción posterior del tacrolimus (Prograf®)4, ambos fármacos forman la base de casi todos las pautas de inmunodepresión tras el TH y otros trasplantes de órganos5.
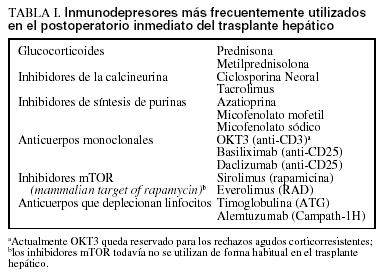
Aunque diversas combinaciones de fármacos inmunodepresores están mejorando los perfiles de toxicidad y disminuyen la incidencia de rechazo agudo, no existe actualmente ninguna pauta claramente superior a otra, lo que se refleja en las diversas combinaciones de inmunodepresión utilizadas por los distintos grupos de trasplante y en la gran cantidad de ensayos clínicos publicados cada año en la bibliografía médica que comparan o estudian nuevas pautas inmunodepresoras6. Los fármacos inmunodepresores habitualmente utilizados tras el TH pueden clasificarse, según el mecanismo de acción, en 6 grupos (tabla I): esteroides, inhibidores de la síntesis de purinas, inhibidores de la calcineurina (ICN), anticuerpos policlonales y monoclonales, inhibidores mTOR (mammalian target of rapamycin, RAPA) y anticuerpos que deplecionan linfocitos. Las pautas de inmunodepresión habitualmente utilizadas en el posoperatorio inmediato del TH se definen en la tabla II.
La presente revisión pretende analizar las distintas pautas de inmunodepresión después del TH en los pacientes con función renal normal, sus ventajas e inconvenientes, la posible aplicabilidad en algunos grupos de pacientes y, por último, definir las tendencias futuras que se van definiendo desde los primeros estudios, tanto en el ámbito clínico como en el experimental. Pretendemos plantear las preguntas que más frecuentemente nos hacemos los médicos que tratamos a los pacientes con TH.
ESTEROIDES: ¿ES POSIBLE EVITARLOS?
Los glucocorticoides son fármacos con una acción antiinflamatoria e inmunodepresora. Su efecto inmunodepresor incluye varios mecanismos: linfopenia, inhibición de la activación de células T (interleucinas 2, 3, 4 y 6, interferón gamma), supresión de la proliferación y función de las células T cooperadoras y supresoras, y supresión de linfocitos T citotóxicos7.
Los corticoides se han utilizado en el pasado de diversa forma: a dosis altas postraplante, con descenso progresivo hasta alcanzar dosis mínimas de mantenimiento, retirada a partir del tercer mes postrasplante, o bien no se han usado desde el primer momento postrasplante8.
Las pautas de inmunodepresión sin esteroides se enmarcan en el contexto clínico de conseguir un equilibrio entre una mínima toxicidad y un máximo rendimiento en términos de una menor incidencia de rechazo. Tras demostrarse que es posible retirar los esteroides algunos meses después del TH, en adultos9 y niños10, diversos estudios se han dirigido a comprobar su utilidad en el postraplante hepático inmediato. De los 13 estudios publicados hasta finales del año 2003 en los que se evitaban los esteroides en el postraplante inmediato, 9 fueron controlados, prospectivos y aleatorizados11. En dichos estudios, con un seguimiento entre 1,5 y 41 meses, la incidencia de rechazo agudo fue entre el 5 y el 66%. El rechazo crónico apareció entre un 0 y un 6%. La supervivencia del injerto y del paciente superó el 80% al año y la necesidad de reintroducir los esteroides se cifró en alrededor del 30% en la mayoría de los estudios.
Estos estudios tienen, sin embargo, dificultades en su interpretación, en primer lugar, por el escaso número de pacientes incluidos en los estudios; en segundo lugar, por la diversidad de protocolos estudiados, y por último, porque el escaso seguimiento en la mayoría de ellos no permite extraer conclusiones claras respecto a los posibles beneficios derivados de evitar el uso de esteroides tanto por lo que se refiere a los efectos secundarios como a la probable influencia sobre la evolución del virus C. No obstante, en la mayoría de los estudios se demostró una menor incidencia de hipertensión arterial, diabetes, alteraciones osteomusculares y, en algún caso, menor frecuencia en la recidiva del virus C12.
En un estudio retrospectivo realizado por el grupo de Pittsburgh13 en 499 pacientes, de entre los que se retiraron los esteroides al 97% de forma tardía, se observó que en el 24% fue necesaria su reintroducción. De los pacientes que precisaron reintroducir los esteroides, en el 36% se debió a rechazo tardío, en el 22% a recurrencia de la enfermedad primaria (cirrosis biliar primaria, colangitis esclerosante primaria, hepatitis autoinmunitaria), en el 18% a insuficiencia renal, para disminuir los ICN, y en el 12% por enfermedades de índole autoinmunitaria como la enfermedad de Crohn o la colitis ulcerosa. Es de destacar que el 70% de los pacientes con cirrosis biliar primaria, el 86% de los pacientes con colangitis esclerosante primaria y el 70% de los que tenían hepatitis autoinmunitaria pudieron continuar sin esteroides. Las conclusiones de este estudio quizá nos enseñen que debemos ser cautos en pacientes con enfermedades hepáticas autoinmunitarias, o con procesos patológicos como la enfermedad de Crohn o colitis ulcerosa, a la hora de evitar los esteroides, aunque en la mayoría de estos casos podemos prescindir de ellos.
Podemos concluir que es posible evitar los esteroides desde el postoperatorio inmediato del TH, y que esta pauta de inmunodepresión puede disminuir los efectos secundarios derivados del uso de esteroides. No obstante, es necesaria la realización de estudios con mayor número de pacientes, multicéntricos y, si es posible, a doble ciego que comparen pautas sin esteroides con placebo para asegurar una correcta inmunodepresión en el postoperatorio inmediato con ICN y micofenolato mofetil, dado que la monoterapia con ICN en este período comporta una alta incidencia de rechazo.
MICOFENOLATO MOFETIL (MMF): PAPEL EN LA INMUNODEPRESION ACTUAL DESPUÉS DEL TRASPLANTE HEPÁTICO
El ácido micofenólico (MPA), aislado por primera vez en 1898 a partir del moho Penicillin glaucun, inhibe de forma no competitiva y reversible la enzima inosina monofosfatodeshidrogenasa (IMPDH), una enzima fundamental en la ruta de novo de la biosíntesis de las purinas14. Especialmente actúa sobre los linfocitos B y T activados al suprimir la IMPDH tipo II presente en los linfocitos activados y, en menor medida, la IMPDH tipo I presente en células no replicativas, por lo que tiene una menor capacidad mielotóxica y hepatotóxica que la azatioprina15. La inhibición de la IMPDH tipo II mediada por MPA causa un fallo en la transición de la fase G1 a la fase S, con la inhibición subsiguiente de la proliferación de linfocitos T y B ante la exposición al antígeno15. El diferente mecanismo de acción del MPA con respecto a la ciclosporina y el tacrolimus, junto a un perfil de toxicidad distinto, con ausencia de nefrotoxicidad y neurotoxicidad16, confiere al MPA un efecto sinérgico y aditivo con los ICN para establecer una inmunodepresión más completa. Por tanto, el papel que puede tener el MPA sería como aditivo a la inmunodepresión estándar con ICN y esteroides, como fármaco capaz de reducir las necesidades de ambos y para aliviar o prevenir ciertas complicaciones de los ICN como la nefrotoxicidad.
Actualmente el MPA se encuentra disponible como profármaco en el caso del MMF (Cellcept®, Roche Pharmaceutical). Recientemente se ha comercializado en Suiza el micofenolato sódico con cubierta entérica (Myfortic®, Novartis Pharma) con la finalidad de mejorar la eficacia terapéutica del MPA al aumentar la tolerancia relativa a la exposición sistémica, dado que no se absorbe en el estómago como el MMF y se absorbe en el intestino delgado17. No obstante, en una reciente revisión de estudios en los que se comparaban el MMF y el micofenolato sódico con cubierta entérica18, se demostró una eficacia y seguridad similares de ambos principios en el trasplante renal. Los efectos secundarios más frecuentes del MPA son las molestias gastrointestinales, entre las que predominan la diarrea, la leucopenia y, en menor grado, la trombopenia y anemia. Es posible que la monitorización en sangre del MPA pueda limitar los efectos secundarios del fármaco, aunque este hecho está por demostrar en estudios más amplios19.
El MMF disminuye de forma significativa la incidencia de rechazo agudo tras el trasplante renal con respecto a la azatioprina16,20. En el TH se han realizado diversos estudios que pueden dividirse de la siguiente forma: adición de MMF a regímenes completos de inmunodepresión, adición de MMF para disminuir el uso de esteroides, tacrolimus o ciclosporina y rescate de rechazo agudo corticorresistente.
Adición de MMF a regímenes completos de inmunodepresión
Jain et al21 compararon 175 pacientes tratados con tacrolimus y esteroides con 175 pacientes tratados con tacrolimus, esteroides y MMF. Tras un seguimiento de 4 años, la incidencia global de rechazo fue menor durante los primeros 3 meses en el grupo con MMF (el 28 frente al 39%; p = 0,03), pero similar de forma global (un 39% en el grupo con MMF frente al 15,2% en el grupo sin MMF; p = 0,23). La supervivencia del injerto y del paciente fue similar, pero en un 59% de los pacientes del grupo con MMF se interrumpió éste por efectos secundarios. Los autores concluyen que la introducción de MMF en el TH no es de utilidad de forma habitual y debe restringirse a casos especiales como rechazo corticorresistente, nefrotoxicidad o neurotoxicidad, o bien para disminuir o eliminar los esteroides. En contraste con el estudio anterior, Wiesner et al22 demostraron, en un amplio estudio con 565 pacientes, una menor incidencia de rechazo con MMF que con azatioprina (el 39 frente al 48%; p < 0,002) en un régimen con ciclosporina y esteroides. De igual modo, Fischer et al23 observaron una menor incidencia de rechazo con MMF respecto a la azatioprina en un estudio con tratamiento cuádruple (timoglobulina, esteroides, ciclosporina Neoral y azatioprina o MMF). En todos los anteriores estudios la supervivencia del injerto y paciente fue similar al año.
En 2 estudios que comparaban la ciclosporina y el tacrolimus con el MMF24,25 se observó una menor incidencia de rechazo con tacrolimus que con ciclosporina debido a mayores concentraciones de MPA cuando se utilizaba con tacrolimus, lo que permitiría una reducción de los valores de tacrolimus.
Adición de MMF para disminuir el uso de esteroides, tacrolimus o ciclosporina
Como ya se ha comentado anteriormente, el MMF puede ayudar a reducir o eliminar los esteroides para disminuir así sus efectos secundarios.
El MMF puede permitir disminuir las dosis de ICN en el postrasplante inmediato, como demostraron Eckoff et al26 en un estudio retrospectivo en el que se compararon el tacrolimus a dosis de 0,1 mg/kg/día, los corticoides y el MMF con un grupo histórico en el que se utilizaron tacrolimus a dosis de 0,15 mg/kg/día y corticoides. En este estudio se comprobó la menor necesidad de tacrolimus cuando se asociaba a MMF, con una menor incidencia de rechazo agudo, y ello comportaba una menor nefrotoxicidad que con una pauta clásica de tacrolimus y esteroides.
Podemos concluir que MMF es útil para disminuir las dosis de ICN y para evitar el uso de esteroides, y es dudosa su indicación como fármaco añadido a regímenes estándar de inmunodepresión. No obstante, estas posibilidades, algunas de ellas extraídas de estudios retrospectivos, necesitan explorarse de forma prospectiva, en estudios multicéntricos con un amplio número de pacientes.
Se ha señalado que el MMF podría ser de utilidad en pacientes con hepatitis C por su capacidad antivírica27, pero los resultados publicados son contradictorios y poco concluyentes para tenerlos en cuenta de forma definitiva28.
Rescate con MMF del rechazo agudo corticorresistente
Diversos estudios han demostrado la utilidad del MMF para resolver los rechazos agudos corticorresistentes, en el marco del trasplante renal y cardíaco16,20,29. En el caso del TH, Pfitzman et al30 consiguieron resolver el rechazo agudo corticorresistente en 38 de 47 pacientes (80,9%), y se obtuvo una mejoría importante de la función hepática en 5 de 8 pacientes con rechazo crónico. El resultado de este estudio, junto a otros anteriores31, demuestra que el MMF influye de forma favorable en el curso del rechazo agudo corticorresistente y crónico, posiblemente por su acción supresora de la respuesta humoral y por la inhibición de la proliferación de las células musculares lisas32.
¿CICLOSPORINA, TACROLIMUS O AMBOS?
En 1977 Borel et al33 demostraron que el péptido cíclico ciclosporina, componente extraído del hongo Tolypocladium inflatum, tenía propiedades inmunodepresoras. Después de la experiencia inicial de Calne et al3 en el trasplante renal y hepático, la ciclosporina fue utilizada por primera vez de forma amplia en el TH por Starzl et al34 y, debido a los importantes resultados entre 1981 y 1982, se celebró la histórica Conferencia de Consenso de los National Institutes of Health de 198335, a partir de la cual se desarrolló de forma exponencial el TH en todo el mundo. Posteriormente, en 1989, la Universidad de Pittsburgh introdujo en la práctica clínica el tacrolimus4, otro ICN, extraído del hongo Streptomyces tsukubaensis36. Estos 2 ICN, la ciclosporina y tacrolimus, junto con los corticoides, siguen siendo hoy día la base de la inmunodepresión en el TH y en el trasplante de todos los demás órganos. A pesar de las ventajas y desventajas de cada uno de estos 2 ICN, ambos tienen un mecanismo de acción similar y un perfil de efectos secundarios parecido. Ambos fármacos inhiben la calcineurina intracelular impidiendo la formación de interleucina 2 y su efecto secundario más importante es la nefrotoxicidad5,36. A pesar de ello, se han realizado múltiples estudios que han intentado compararlos. Inicialmente se comparó la ciclosporina de base oleosa (Sandimmune®) con el tacrolimus. Posteriormente, debido a la gran variabilidad del perfil farmacocinético y de la biodisponibilidad de la ciclosporina, junto a su dependencia de la bilis para absorberse, se desarrolló la ciclosporina en microemulsión (Sandimmune Neoral®) y se realizaron estudios comparativos con la ciclosporina original y con el tacrolimus. Diversos estudios posteriores demostraron el mejor control del rechazo monitorizando la concentración a las 2 h de tomar Neoral (C2) que midiendo la concentración valle (C0). Actualmente se está desarrollando un estudio, aún pendiente de publicar, en el que se compara el tacrolimus con Neoral bajo control de la C2 (estudio LIST2). A continuación se resumen los distintos estudios mencionados, en los que se compararon la ciclosporina y el tacrolimus.
Comparación entre la ciclosporina clásica y el tacrolimus
En el año 1994 se publicaron 2 grandes estudios multicéntricos, en Europa y Estados Unidos, que comparaban la ciclosporina y el tacrolimus37,38. En ninguno de los 2 estudios, donde se incluyó a 529 pacientes, se observaron diferencias en la supervivencia del paciente o del injerto al año, aunque muchos pacientes con ciclosporina tuvieron que cambiar a tacrolimus por rechazo que no respondía, con lo que se consiguió el rescate de estos injertos. Sin embargo, con el tacrolimus la incidencia de rechazo agudo, rechazo corticorresistente, rechazo refractario y rechazo crónico fue significativamente menor. No obstante, estos resultados pueden ser cuestionables, dado que no afectaron a la supervivencia del paciente o del injerto ni a la frecuencia de retrasplante. Seguimientos más prolongados, de 5 y 10 años39,40, indican una tendencia a una mayor supervivencia del paciente con tacrolimus, especialmente en los pacientes con hepatitis C, y una menor frecuencia de rechazo crónico en los pacientes tratados con dicho fármaco.
En estos estudios se apreció que los pacientes tratados con ciclosporina tenían más hirsutismo e hipertensión, mientras que los pacientes con tacrolimus desarrollaron más nefrotoxicidad, neurotoxicidad y diabetes mellitus.
Comparacion entre la ciclosporina en microemulsión y la ciclosporina de base oleosa
Actualmente no se utiliza la ciclosporina de base oleosa y sólo se dispone de la ciclosporina en microemulsión, como consecuencia de los estudios favorables en la farmacocinética y eficacia de esta última. Por este motivo la Food and Drug Administration aprobó la ciclosporina en microemulsión (Neoral) en 19955.
Tras demostrarse un perfil farmacocinético más previsible y apenas dependiente de la presencia de bilis con la ciclosporina en microemulsión, los pacientes apenas necesitaban de la utilización de ciclosporina por vía intravenosa y, además, la exposición sistémica al fármaco era más consistente41. Por este motivo se realizaron diversos estudios clínicos con el fin de documentar si existía una mayor eficacia clínica con Neoral. En un metaanálisis de 10 estudios comparativos entre ciclosporina y Neoral42, se demostró una menor incidencia de rechazo con este último (0,43 episodios de rechazo por paciente en grupo de Neoral frente a 0,59 en el grupo de ciclosporina; p < 0,05), similar a lo que ocurría en pacientes con trasplante renal, con una incidencia de rechazo en los 4 estudios más significativos entre el 13 y el 25% con Neoral frente al 56 y el 65% en el grupo de ciclosporina (p entre 0,05 y 0,001). En este mismo metaanálisis se pudo comprobar una reducción de los efectos adversos con Neoral (7,1 acontecimientos adversos por paciente en el grupo de Neoral frente a 14,2 en el grupo de ciclosporina; p < 0,00001). El estudio comparativo más significativo fue el llamado MILTON (Multicenter International study in Liver Transplantation of Neoral)43. Este estudio, aleatorizado, doble ciego y prospectivo, se realizó con 390 pacientes en 28 centros de 9 países americanos y europeos, entre los que había 5 centros españoles. La incidencia de rechazo al año fue menor con Neoral de forma global (el 52,5% con Neoral y el 46,8% con ciclosporina; p = 0,42) y en los pacientes que eran portadores de un tubo de Kehr (un 30,2% para Neoral y un 44,9% para la ciclosporina; p = 0,007). La incidencia de rechazo corticorresistente también fue menor con Neoral (el 13,6 frente al 17% para la ciclosporina). Los efectos adversos fueron similares y el tiempo para alcanzar concentraciones terapéuticas fue menor con Neoral (4 frente a 7 días para la ciclosporina; p = 0,001).
En resumen, la ciclosporina en microemulsión es más eficaz que la ciclosporina clásica, debido a su mejor perfil farmacocinético, al alcanzar más rápidamente concentraciones terapéuticas, al existir una menor variabilidad intrapaciente en los valores sanguíneos de ciclosporina y al conseguirse concentraciones máximas más altas. En estos estudios y en otros con un análisis más farmacocinético se demostró que Neoral podía administrarse desde el postoperatorio inmediato por sonda nasoduodenal evitando la administración de ciclosporina intravenosa.
Comparación entre la ciclosporina en microemulsión (Neoral) y el tacrolimus
Hasta el momento se han realizado diversos estudios comparativos entre Neoral y tacrolimus, en los que se monitorizó a los pacientes con Neoral mediante la determinación de C0 de ciclosporinemia44. De estos estudios, 4 destacan por su trascendencia45-48 (tabla III). En todos ellos la incidencia de rechazo agudo, rechazo corticorresistente y rechazo crónico fue similar. Asimismo, la supervivencia del paciente y del injerto fue similar, salvo en el estudio de O'Grady et al45, donde fue menor en el grupo de ciclosporina. Sin embargo, en este estudio la mayor mortalidad y la menor supervivencia del injerto en el grupo de Neoral no estuvieron relacionadas con la inmunodepresión y sí con una miscelánea de procesos no relacionados. En el estudio canadiense48 se demostró que era posible la retirada de los esteroides a partir del cuarto mes en igual proporción en los pacientes que tomaban tacrolimus y Neoral. Por último, el perfil de seguridad de ambos fármacos fue similar, pero con una mayor incidencia de diabetes45 y diarrea46 en el grupo con tacrolimus y mayor incidencia de hipertensión e hiperuricemia en el grupo de Neoral en uno de los estudios46.
En resumen, la eficacia y el perfil de seguridad del tacrolimus y la ciclosporina Neoral son similares. No obstante, los estudios anteriores se realizaron con un seguimiento de un año y es preciso un seguimieno mayor y estratificado, analizando a los pacientes con infección por el virus C, para poder sacar conclusiones más fiables.
Comparación entre la ciclosporina en microemulsión (Neoral) con monitorización de las concentraciones valle y el tacrolimus
Una adecuada y consistente absorción de la ciclosporina Neoral es de gran importancia para la evolución del injerto49. La mayor variabilidad en la absorción de ciclosporina ocurre en las primeras 4 h tras la administración de Neoral (área bajo la curva, en siglas inglesas, AUC0-4), y el máximo efecto inmunodepresor también se produce durante este período. Sin embargo, AUC0-4 es poco útil en la práctica clínica. La C0 de ciclosporina no se correlaciona con el AUC0-4 (r2 < 0,50), mientras que existe una buena correlación entre el AUC0-4 y la C2 de ciclosporinemia, con un coeficiente de correlación r2 > 0,80. Estas características farmacocinéticas de la ciclosporina Neoral tienen una gran trascendencia clínica, dado que, en diversos ensayos clínicos, en el trasplante renal se ha demostrado que la C2 de Neoral más alta se correlacionaba con una menor incidencia de rechazo y, además, dicha concentración tenía una capacidad de predicción de la incidencia de rechazo agudo50.
El ensayo clínico INT-0651 fue el primer estudio prospectivo diseñado para comparar la dosificación individualizada de Neoral basada en la medición de la C2 con C0 en pacientes con TH de novo. En dicho estudio participaron 29 centros americanos y europeos, entre ellos 6 españoles, con un total de 307 pacientes que se dividieron en 2 grupos: monitorización con C0 entre 250 y 400 ng/ml y con C2 entre 850 y 1.400 ng/ml, durante las primeras 12 semanas. Con Neoral y monitorización de la C2 se pudo reducir la incidencia y gravedad del rechazo agudo durante el primer año postrasplante (incidencia de rechazo: el 26,6% para C2 frente al 33,5% para C0, diferencia no significativa; incidencia de rechazo moderado y grave: 47% para C2 frente al 70% para C0, p = 0,02). La incidencia de rechazo en los pacientes sin infección por el virus C fue menor en los monitorizados con C2 (21,2%) que en los monitorizados con C0 (33%), con un valor de p < 0,05. El perfil de seguridad fue similar en ambos grupos. Los autores conjeturan que estas diferencias a favor de monitorizar la C2 podrían deberse a que la C0 puede sobrestimar las concentraciones de ciclosporina, al medir también más metabolitos inactivos que la C2, ya que en este último caso apenas hay metabolitos en sangre.
Como consecuencia de todos los estudios realizados con Neoral monitorizando la C2 en el trasplante renal y hepático, se celebró una conferencia de consenso sobre Neoral: la llamada Conferencia CONCERT (The Consensus on Neoral C2: Expert Review in Transplantation)52. La C2 recomendada en el TH es de 1.000 ng/ml entre el día 0 y el tercer mes, de 800 ng/ml entre los meses 4 y 6, y de 600 ng/ml a partir del mes 6. Para calcular las dosis de Neoral se aplicará la siguiente fórmula: nueva dosis de Neoral = vieja dosis de Neoral x C2 deseada/C2 actual.
Como consecuencia de los mejores resultados con Neoral monitorizando la C2, se inició un estudio comparativo, multicéntrico e internacional entre Neoral-C2 y tacrolimus, el llamado estudio LIS2T (Liver International Study of C2 vs Tacrolimus), cuyos resultados se publicarán próximamente (comunicación personal). En un estudio preliminar de uno de los centros53, se indica que la incidencia de rechazo agudo a los 6 meses fue menor con Neoral (11%) que con tacrolimus (36%) (p < 0,005), al igual que la incidencia de diabetes de novo (el 14% para Neoral frente al 36% para tacrolimus; p < 0,05). Estos resultados, en lo que respecta a la incidencia de rechazo, parece que se igualan en el estudio internacional (comunicación personal).
En resumen, la eficacia del tacrolimus y la ciclosporina Neoral con control de la C2 es similar, por lo que ambos fármacos forman la base actual de la inmunodepresión en el TH. Los perfiles de seguridad son similares, si bien el tacrolimus es algo más diabetógeno y posiblemente la ciclosporina produzca más hipertensión e hiperlipemia. La incidencia de nefrotoxicidad y neurotoxicidad es similar.
NUEVAS PAUTAS DE INMUNODEPRESION INDUCTORAS DE TOLERANCIA
Calne54 afirma que la tolerancia en el trasplante de órganos, «desde un punto de vista clínico, es la función del injerto a largo plazo sin la necesidad de inmunodepresión de mantenimiento». Pero la tolerancia no es cuestión de «todo o nada»55, sino que existen diversos grados de tolerancia. A pesar de que un porcentaje seleccionado de pacientes con TH puede tener una función del injerto normal sin inmunodepresión tras algunos años con ésta56,57, hoy día es necesaria la inmunodepresión durante al menos los primeros meses postrasplante. En los últimos años se han desarrollado nuevas estrategias de inmunodepresión, patrocinadas por las 2 grandes figuras del TH (Calne y Starzl), en las que se está demostrando que los pacientes pueden mantenerse tras unos meses postrasplante con mínimas cantidades de un solo inmunodepresor, incluso una o 2 veces por semana. Para ello se han utilizado 2 tipos de anticuerpos antilinfocitarios: la globulina antitimocícica (timoglobulina)58 y el alemtuzumab (Campath-1), un anticuerpo monoclonal humano de inmunoglobulina G1 con dominios variables anti-CD52 de roedor59. Estos 2 anticuerpos producen depleción de linfocitos T. Esta estrategia se basa en la premisa de que la eliminación transitoria pero drástica de los linfocitos T del receptor en el momento del trasplante ayuda a crear un ambiente favorable para que, cuando se recupere el sistema inmunitario, se haga tolerante al injerto2. La experiencia con timoglobulina se ha circunscrito más al ámbito del trasplante renal58,60, mientras que con Campath-1 se están realizando diversos estudios en el ámbito del TH.
La primera experiencia con Campath-1 fue publicada por Calne et al59,61, en 31 pacientes con trasplante renal. Los pacientes recibieron 20 mg de Campath-1 antes o inmediatamente después de la cirugía, y una segunda dosis 24 h más tarde. La ciclosporina en monoterapia se administró 48 h después, para mantener valores bajos de ciclosporinemia entre 75 y 125 ng/ml, siguiendo la hipótesis llamada WOFIE (window of opportunity for immunological engaggement). Esta hipótesis establece que se debe dejar un tiempo para que el sistema inmunitario se acople con el antígeno extraño a fin de que, independientemente de que se produzca rechazo, con posterioridad se facilite la tolerancia. Con esta estrategia sólo 6 pacientes (19%) tuvieron rechazo y la supervivencia a los 5 años fue del 84% para el paciente y del 71% para el injerto62. Parece, por tanto, que con esta pauta se podrían mantener los injertos con bajas dosis de inmunodepresión, con pocos efectos secundarios y a un coste bajo. La experiencia en el TH ha sido publicada recientemente por Tzakis et al63 y Marcos et al64. Los primeros administraron 4 dosis de Campath-1 y tacrolimus para mantener valores de 5 a 10 ng/ml a 40 pacientes con TH, que no tuvieran hepatitis C, y los compararon con 50 pacientes tratados con tacrolimus y esteroides de forma no aleatorizada. La incidencia de rechazo (el 40 frente al 55%), la necesidad de esteroides y el tiempo transcurrido hasta la aparición del rechazo (2,76 frente a 0,34 meses; p = 0,0007) fueron menores con Campath-1, al igual que la incidencia de nefrotoxicidad. Se concluye, por tanto, que en el TH la eficacia de un régimen con Campath-1 y dosis bajas de tacrolimus es similar al régimen estándar con tacrolimus a mayor dosis y esteroides, con menor nefrotoxicidad y con menos necesidad de esteroides. Recientemente el grupo de Pittsburgh64 ha publicado, en forma de resumen, su experiencia con Campath-1 en 78 pacientes con TH, de los que el 40% tenían hepatitis C. De los 69 pacientes que sobrevivieron las primeras semanas, 4 (5,7%) tuvieron rechazo. A partir del tercer mes se disminuyeron progresivamente las dosis de tacrolimus y 49 pacientes recibieron dosis entre una vez al día y una vez a la semana. Los pacientes con hepatitis C que recidivaron respondieron de forma importante tras recibir tratamiento antiviral y reducir las dosis de tacrolimus. Esta estrategia está cambiando totalmente la pauta de actuación en inmunodepresión en el grupo de Pittsburgh, uno de los más importantes en TH del mundo.
NUEVOS FARMACOS INMUNODEPRESORES
Actualmente existe un importante número de fármacos inmunodepresores en fase de desarrollo preclínico y en ensayos clínicos iniciales1. Las dianas de estos nuevos inmunodepresores son las moléculas de superficie celular implicadas en la interacción inmunitaria celular (especialmente las vías coestimuladoras), las señales de activación de células T y la proliferación, tráfico y reclutamiento de células inmunitarias implicadas en el rechazo. Un grupo de fármacos prometedores incluye anticuerpos humanizados anti- CD11a (anti-LFA1), anti-B7.1/B7.2, anti-CD45RB y CTLA4Ig (LEA29Y) de segunda generación. Los inhibidores de la activación de células T y señalización están todavía en fase de desarrollo preclínico. Los inhibidores de la proliferación de células T incluyen los inhibidores de la tirosincinasa, de la proteína Janus, JAK 3 y FK778, un análogo de leflunomida. En los ensayos iniciales, FTY720, una molécula sintética que secuestra el tráfico de linfocitos, parece muy prometedora, aunque sus efectos adversos sobre el corazón han mitigado el entusiasmo inicial. Diversos antagonistas de las quimocinas CCR1, CXCR3 y CCR5 han demostrado su eficacia en el trasplante experimental y se consideran posibles fármacos inmunodepresores en el ámbito clínico. Por último existe un grupo de fármacos, llamados inhibidores de mTOR, que impiden la proliferación de las células T entre las fases G1 y S (vía a través de la señal 3). Entre estos fármacos se encuentran la rapamicina y su derivado everolimus (RAD). Actualmente la experiencia con la rapamicina es escasa en el TH y no existen conclusiones claras. Con everolimus se están realizando estudios en fase clínica II.
CONCLUSIONES
Un régimen óptimo de inmunodepresión sería aquel que incluyera la menor cantidad de fármacos inmunodepresores, a la menor dosis posible, para reducir la toxicidad y los costes, y al mismo tiempo pudiera prevenir el rechazo y la recurrencia de la enfermedad de base y proporcionar la mayor supervivencia posible del paciente y del injerto. Actualmente existe una gran cantidad de fármacos inmunodepresores, y otro gran número de fármacos en estudio avanzado. Sin embargo, los avances en la selección de los pacientes y la excelente técnica quirúrgica de los cirujanos del TH permiten actualmente poder utilizar pocos fármacos inmunodepresores. La base actual del tratamiento inmunodepresor sigue siendo la utilización de tacrolimus o ciclosporina en microemulsión, con resultados similares, pudiéndose prescindir de forma temprana o absoluta de los esteroides. El MPA tiene un papel importante para disminuir los efectos nefrotóxicos de los ICN y en los regímenes sin esteroides. Por último, los grandes avances en el conocimiento de los fenómenos de tolerancia permiten depositar muchas esperanzas en las nuevas estrategias con anticuerpos monoclonales capaces de deplecionar linfocitos, a fin de disminuir al máximo el mantenimiento con dosis mínimas de inmunodepresión. Todavía es pronto para saber cuál será el papel de los nuevos fármacos inmunodepresores en estudio. Quizá el futuro de la inmunodepresión en el trasplante de órganos sea la «no inmunodepresión», cuando se conozcan mejor y de forma completa los fenómenos de tolerancia en el ser humano.