INTRODUCCIÓN
El reflujo gastroesofágico es el paso del contenido gástrico o duodenal al esófago. Este fenómeno tiene lugar fisiológicamente en todas las personas varias veces al día sin que, en la mayoría de las ocasiones, tenga consecuencias clínicas. La presencia de síntomas con o sin lesiones anatomopatológicas evidentes en la mucosa esofágica se enmarca dentro de la expresión genérica de enfermedad por reflujo gastroesofágico. El término de esofagitis por reflujo queda relegado a los casos en que se evidencia lesión en la mucosa esofágica, consecuencia del paso del contenido gástrico.
La enfermedad por reflujo gastroesofágico (ERGE) es hoy una de las enfermedades gastrointestinales más importantes, no sólo por su frecuencia sino también por su asociación con el esófago de Barrett y el adenocarcinoma de esófago. La ERGE es una afección compleja debido a su etiología multifactorial, cuyo primer evento desencadenante es la presencia de contenido gastroduodenal, habitualmente a un pH ácido, en el interior de la luz esofágica. La lesión esofágica se desarrolla cuando la exposición al material refluido supera de alguna manera los mecanismos de defensa del esófago. En otras palabras, cuando se produce un desequilibrio entre factores agresivos y factores defensivos.
Actualmente, el pilar fundamental del tratamiento médico de la ERGE se sustenta en la neutralización de los factores radicales, con fármacos que reducen profundamente la secreción ácida gástrica, como los antagonistas de receptores H2, o, más recientemente, los inhibidores de la bomba de protones. Los buenos resultados obtenidos con estos agentes, su buena tolerancia y la satisfacción de los pacientes en tratamiento con estos fármacos son consecuencia de la efectividad de esta línea terapéutica. Sin embargo, el hecho de que las enfermedades del esófago por reflujo gastroesofágico estén aumentando de forma notable en el mundo occidental, de que pacientes con similar grado de lesión y tratamiento evolucionen a formas graves de lesión mientras que otros pacientes responden favorablemente, hace pensar que la capacidad defensiva del esófago puede ser clave para determinar la presencia/ausencia y el grado final de lesión en la mucosa esofágica.
A la vista de la magnitud de inhibición ácida obtenida con los inhibidores de la bomba de protones (IBP), parece francamente difícil obtener mejores resultados en lo que se refiere a esta aproximación terapéutica. Así pues, el futuro del tratamiento médico de la ERGE pasa por el desarrollo de fármacos con dianas terapéuticas diferentes. Los avances obtenidos en los últimos años en el conocimiento de diferentes áreas de la fisiología y la fisiopatología del esófago, y en concreto en lo referente a los sistemas de defensa esofágicos frente a la agresión ácido-péptica, sugieren que el tratamiento actual de la ERGE podría complementarse en el futuro con nuevos fármacos destinados a reforzar la defensa de la mucosa esofágica.
FISIOPATOLOGÍA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO
Mecanismos de defensa frente al reflujo gastroesofágico
El sistema de defensa del esófago frente al reflujo engloba 3 niveles: en un primer nivel, la barrera antirreflujo, que protege limitando la frecuencia (y volumen) del reflujo; en un segundo nivel, los mecanismos de aclaramiento esofágico, que reducen el tiempo que dura la exposición de la mucosa al material refluido. Aunque estos mecanismos no tienen nada que ver con la mucosa esofágica propiamente dicha, su importancia en la defensa esofágica está fuera de toda duda. El tercer y último nivel está constituido por los mecanismos de defensa propios de la mucosa esofágica, que se incluyen en el concepto global de resistencia tisular.
Primera línea de defensa: barrera antirreflujo
En circunstancias normales, el reflujo gastroesofágico es impedido por una barrera antirreflujo localizada en la unión gastroesofágica. Se trata de una zona anatómica compleja cuya integridad funcional depende de diversas estructuras: esfínter esofágico inferior (EEI), diafragma, ligamento frenoesofágico, el ángulo de Hiss y la roseta mucosa.
De todos ellos, el elemento principal es el EEI. Se trata de un área especializada de músculo liso circular en la parte inferior del esófago, que en situación de reposo está en contracción creando una zona de alta presión (10-25 mmHg), impidiendo el paso de material gástrico a la luz esofágica. Sin embargo, incluso en individuos sanos esta barrera es imperfecta, de forma que de manera fisiológica se producen relajaciones del EEI, probablemente debido a la necesidad de eliminar gas del estómago. Este fenómeno ha sido denominado relajación transitoria del EEI1. Se trata de relajaciones espontáneas no asociadas con la deglución, producidas por un reflejo vagal, que van acompañadas de relajación del diafragma crural.
Las relajaciones transitorias del EEI, a diferencia de las relajaciones del EEI relacionadas con la deglución, promueven episodios de reflujo, debido a que son más prolongadas (más de 10 s frente a 5-7 s) y no se acompañan de peristaltismo esofágico. Las relajaciones transitorias del EEI son responsables de la mayor parte de los episodios de reflujo gastroesofágico en sujetos sanos y en la mayoría (55 a 80%) de los pacientes con ERGE2. Los estudios realizados hasta el momento sugieren que su contribución varía en dependencia de la gravedad de la ERGE, y que es el mecanismo principal en situaciones de ERGE leve-moderada, mientras que en la ERGE grave los mecanismos predominantes son la hipotonía del EEI o la hernia de hiato. Sin embargo, el hecho de que las relajaciones transitorias sean causantes en términos globales de hasta un 80% de los episodios de reflujo en la ERGE ha motivado en los últimos años la realización de diversos estudios con fármacos destinados a disminuir la frecuencia de relajaciones transitorias del EEI, que más adelante revisaremos.
Segunda línea de defensa: aclaramiento esofágico
Son varios los factores que intervienen: a) la gravedad; b) el peristaltismo esofágico secundario a la presencia de contenido en la luz esofágica, y c) la secreción de bicarbonato por las glándulas salivales y esofágicas1. Los pacientes con ERGE presentan tiempos de aclaramiento ácido (tiempo que la mucosa esofágica está a pH < 4) más largos de lo normal. Esta alteración del aclaramiento esofágico podría estar relacionada con alteraciones del peristaltismo esofágico, ya que se ha visto correlación entre el grado de disfunción peristáltica y la gravedad de la esofagitis en pacientes con ERGE3.
Tercera línea de defensa: resistencia tisular
El término «resistencia tisular» engloba un conjunto de estructuras y funciones de la mucosa esofágica que interaccionan para minimizar la lesión del epitelio durante el contacto con los elementos nocivos presentes en el reflujo. De acuerdo con Orlando4, estos mecanismos de defensa de la mucosa podrían estructurarse en 3 niveles: factores preepiteliales, factores epiteliales y factores postepiteliales (tabla I).
Mecanismos de defensa preepitelial. Está formada por aquellos mecanismos y estructuras que evitan que los hidrogeniones entren en íntimo contacto con la superficie celular del epitelio. Esencialmente consta de 2 componentes: por un lado, el complejo formado por la capa de moco-capa fija de agua, y, por otro, los iones bicarbonato superficiales. El mecanismo de defensa consiste en crear un gradiente de pH entre la luz esofágica y la superficie del epitelio de la mucosa que impida la retrodifusión de H+. La glándulas submucosas del esófago son capaces de secretar bicarbonato, agua, moco, así como otras sutancias como factor de crecimiento endotelial (EGF) o prostaglandina E25. Sin embargo, los factores de defensa preepiteliales en el esófago no son tan eficaces como en el estómago o el duodeno. Este hecho quedó reflejado en el estudio de Quigley y Turnberg6, al comprobar que el gradiente de pH entre la luz y la superficie epitelial en el estómago puede ir de 5 a 7 unidades cuando el pH endoluminal es de 2, mientras que en el esófago, con estas mismas cifras de pH en la luz, se observó un pH de 2 a 3 en la superficie epitelial. La limitada capacidad del esófago para crear este gradiente de pH, y por tanto evitar que el medio ácido de la luz alcance la superficie epitelial, indica que la defensa de la mucosa esofágica depende fundamentalmente del propio epitelio.
Mecanismos de defensa epitelial. La defensa epitelial en el esófago depende de componentes tanto estructurales como funcionales. El componente estructural incluye las membranas celulares y las uniones intercelulares.
El principal mecanismo defensivo que posee el epitelio frente al ácido es su propia estructura estratificada. Las células están unidas por uniones estrechas que junto con la bicapa lipídica de la membrana celular constituyen una importante barrera frente a la libre penetración de iones y otras moléculas dentro de la mucosa, lo cual se manifiesta por una importante resistencia eléctrica (1.000-2.500 ohm/cm2). La capacidad de la membrana apical para resistir la penetración del ácido se ha estudiado en el epitelio del esófago de conejo por medio de microelectrodos7. Se observó que hasta un pH luminal de 2 el pH intracelular se mantenía, y sólo bajo estas cifras el pH intracelular descendía. Esto demuestra la importante impermeabilidad de la membrana celular apical frente a los iones hidrógeno, a diferencia de lo que ocurre con la porción basolateral de la membrana, que es muy permeable a los hidrogeniones.
Un segundo mecanismo que se opone a la libre difusión de los iones hidrógeno son las estructuras intercelulares de unión. El grupo de Orlando8, por técnicas de criofractura, microscopia electrónica y estudios fisiológicos, comprobó que las barreras paracelulares están formadas por uniones estrechas (localizadas fundamentalmente en las capas superiores del estrato espinoso) y material intercelular lipídico o glucoconjugados según la especie animal (ratón o conejo, respectivamente). Ambas estructuras ofrecen una importante resistencia a la circulación de iones desde la luz, pero no desde la vertiente adventicial.
Pese a todo lo anteriormente expuesto, la difusión de los hidrogeniones depende finalmente de su concentración. Cuando ésta alcanza unos valores determinados, los iones hidrógeno terminan por difundir al espacio intracelular y extracelular. Extracelularmente son los iones bicarbonato los encargados de realizar la neutralización. Aunque no se conoce con exactitud la concentración de bicarbonato a este nivel, se cree que están en equilibrio con la sangre, por lo que estaría en torno a 25 mM. Este bicarbonato procede en su mayor parte del aporte sanguíneo mucoso que llega desde la vertiente adventicial.
Cuando los hidrogeniones difunden al interior celular son tamponados por proteínas, fosfatos y bicarbonato1, este último derivado de la acción de la anhidrasa carbónica9. Si la capacidad tamponadora es superada en el ámbito intracelular, hay todavía 2 mecanismos de membrana que posibilitan la extrusión de iones hidrógeno. Se han estudiado fundamentalmente en el conejo, pero recientemente se ha comprobado que existen también en las células epiteliales del esófago humano con actividad muy similar. El primero de ellos es una bomba Na+/H+ amilorida sensible10 que responde a la acidificación intracelular con el intercambio de iones hidrógeno intracelulares por iones sodio extracelulares. Todo ello depende de la existencia de un gradiente favorable de sodio que es mantenido por una Na+/K+ATPasa. El segundo mecanismo es un transportador de membrana Cl/HCO3 también dependiente del sodio, que intercambia cloro intracelular por bicarbonato extracelular11. Si la exposición al ácido es prolongada o intensa, finalmente se produce la necrosis celular, y entonces son los fenómenos reparativos celulares los encargados de cubrir el defecto producido. En perros, la perfusión de ácido a concentraciones inferiores a las que producen lesiones de esofagitis producía un aumento de la proliferación celular objetivada por la captación de timidina tritiada12. El aumento de la síntesis de ADN se verificó a las 16 h de la aplicación del ácido con un pico de mitosis a las 20 h del mismo. La adición de pepsina no implica aumento de la actividad replicativa indicando que el estímulo depende del ácido.
En estudios in vivo en esófagos de conejo se ha comunicado que por debajo de las 12 h después de la agresión ácido-péptica no se verificaban cambios reparativos, sugiriéndose que la pérdida de epitelio en el esófago es reparada por medio de replicación celular y no por migración, como ocurre en otros tramos del tubo digestivo. Sin embargo, en estudios in vitro realizados por nuestro grupo en cultivos de células epiteliales esofágicas de conejo, se ha observado que el proceso de reparación mucosa se realiza tanto por mecanismos de migración como de proliferación celular, y que en las primeras 24 h el proceso reparativo es principalmente dependiente de la migración celular13. Asimismo, hemos observado que los mecanismos implicados en la reparación de la mucosa son claramente afectados por cambios del pH extracelular y el tiempo de exposición, objetivando un aumento de la replicación con cambios mínimos de pH y reducción importante en migración y proliferación con reducciones mayores por debajo de un pH de 5.
Mecanismos de defensa postepitelial. Dependen fundamentalmente del aporte sanguíneo a la mucosa que aporta oxígeno, iones bicarbonato, nutrientes, y retira los productos de desecho del metabolismo celular. Experimentalmente, se ha visto que en reposo el flujo sanguíneo es más intenso en las regiones esfinterianas que en el cuerpo gástrico. La presencia de ácido intraluminal aumenta de forma importante el flujo sanguíneo en ambos esfínteres y en el tercio inferior del cuerpo esofágico. La hiperemia depende de las capas musculares, mientras que en el ámbito mucoso-submucoso aumenta exclusivamente en la región del esfínter esofágico inferior. Por otro lado, Bass et al14 estudiaron las variaciones del flujo mucoso del esófago frente a la agresión por ácido en conejos. Observaron que cuando la barrera mucosa se rompía por sales biliares o tripsina a pH de 7, el flujo mucoso aumentaba de forma importante, y no se objetivó retrodifusión de hidrogeniones; sin embargo, cuando la lesión se producía por sales biliares, pepsina o ácido a un pH de 2, no se producía aumento del flujo mucoso y sí retrodifusión de ácido. El aumento del flujo sanguíneo es independiente de la inervación colinérgica y depende de un arco reflejo compuesto por fibras no adrenérgicas no colinérgicas que tendrían como neurotransmisor el óxido nítrico.
Mecanismos de lesión celular en la mucosa esofágica
Los mecanismos por los que los sistemas de defensa de la mucosa esofágica son superados y conducen a la lesión del epitelio son complejos. Sin embargo, estudios realizados tanto en modelos experimentales de esofagitis como en pacientes con ERGE han arrojado datos importantes al respecto15. Éstos han demostrado que el ácido presente en la luz esofágica ataca en primer lugar las estructuras intercelulares de unión, ya que el primer evento relacionado con la lesión por ácido es el aumento de la permeabilidad en el ámbito paracelular. La manifestación de esta alteración funcional estructural es la dilatación de los espacios intercelulares del epitelio esofágico, que se ha demostrado por microscopia electrónica en biopsias de esófago humano de pacientes con esofagitis.
La acidificación de los espacios intercelulares permite el acceso de los iones H+ a la membrana basolateral de las células epiteliales, que es mucho más permeable que la membrana apical. Como consecuencia, los hidrogeniones pueden ser transportados al interior celular a través de un intercambiador de membrana Cl/HCO3, comenzando así el proceso de lesión celular. La acidificación del pH intracelular está asociada a edema celular que se relaciona con el cotransportador NaK2Cl bumetanida-sensible, que a pH ácido actúa transportando iones y agua al interior de la célula. Esta situación se agrava aún más por el hecho de que a pH ácido los mecanismos celulares de extrusión de iones se inhiben. El resultado de todo ello es la pérdida de la osmorregulación celular, con edema y necrosis celular. Se ha visto también que la exposición esofágica a sustancias hipertónicas (p. ej., sodas/sustancias gaseosas) favorece el posterior daño inducido por ácido. El alcohol en concentraciones similares a las utilizadas por el ser humano altera la barrera mucosa y los mecanismos de transporte iónico celular.
En los últimos años, una serie de estudios han demostrado que otros mecanismos, presumiblemente de mayor importancia que el efecto que el pH ejerce sobre la propia viabilidad del epitelio esofágico, están también involucrados en la lesión mucosa inducida por el ácido y la pepsina. Estos estudios han demostrado que el daño mucoso esofágico inducido por el ácido es fundamentalmente mediado por radicales libres y que su eliminación previene la aparición de esofagitis.
La producción de radicales libres oxigenados se enmarca dentro del conjunto de mecanismos celulares inespecíficos activados para defender al organismo de cualquier agresión. Diversos elementos celulares (macrófagos, polimorfonucleares, etc.) se activan liberando productos inflamatorios (p. ej., citocinas) y productos intermediarios del metabolismo del oxígeno que destruyen microorganismos, células tumorales, etc., pero que pueden atacar también a células normales del propio organismo. En este contexto, los radicales oxidantes ejercen una doble acción, protectora y lesiva, sobre las estructuras celulares.
Su acción deletérea es contrarrestada por los diferentes sistemas antioxidantes de que dispone el organismo humano, tanto de tipo enzimático como no enzimático. Cuando estos mecanismos se desbordan, aparecen los efectos tóxicos como consecuencia de su gran capacidad reactiva, que permite que se fijen a componentes estructurales básicos de las células, modificándolos y perpetuando así la lesión. Una vez producidos, los radicales libres afectan a las membranas plasmáticas, la respiración aerobia, la producción de ATP a nivel mitocondrial, la síntesis proteica y la dotación genética celular.
En el ámbito intracelular y extracelular existen enzimas o sistemas que catalizan reacciones químicas destinadas a neutralizar radicales libres y que generan agua u otros menos tóxicos. Entre estos sistemas destacan la superóxido dismutasa (SOD), que cataliza el paso de anión superóxido a peróxido de hidrógeno, la catalasa, que cataliza la descomposición de H2O2 producido como resultado de la acción de la SOD o de otras reacciones, o el sistema glutatión, que incluye la enzima glutatión-peroxidasa, que acelera la oxidación de glutatión reducido; la glutatión-reductasa, y la que interioriza los 3 componentes del glutatión dentro de la célula, la gammaglutamiltranspeptidasa. En su forma reducida, el glutatión (GSH) se considera en sí mismo «barredor» específico del anión superóxido.
Existen otros muchos antioxidantes con funciones variadas, como el alopurinol, que ciñen su efecto a inhibir una enzima (p. ej., xantina-oxidasa). Su acción puede ser combinada y potenciar el papel defensivo ante un agente inductor de daño.
Los datos disponibles sobre el esófago son de reciente aparición, y en nuestra opinión dan pie a la posibilidad de un cambio radical en la aproximación a la patología mucosa esofágica originada por el ácido. Los primeros datos fueron publicados en 1995 por Wetscher et al16,17 en un modelo experimental de esofagitis en rata inducida por ligadura duodeno-yeyunal por un período de 24 h. Los estudios señalaron que, en ese modelo, la génesis de radicales libres, especialmente el anión superóxido, están implicados en la lesión de la mucosa esofágica tanto por reflujo ácido como mixto (ácido y biliar). Estudios posteriores han corroborado estos hallazgos. Así, en un modelo de esofagitis aguda en el conejo18 se demostró que la inducción de lesión por ácido y pepsina era también dependiente de la génesis de anión superóxido. Mediante citometría de flujo se demostró que la producción de anión superóxido dependía de células inflamatorias CD11b positivas. Otros estudios, sin embargo, sugieren que tanto las células inflamatorias como las propias células del epitelio esofágico participan en la producción de radicales en la mucosa esofágica, ya que la adición de un inhibidor de mieloperoxidasa a suspensiones de mucosa procedente de esofagitis disminuye la producción de radicales libres sólo un 30%19.
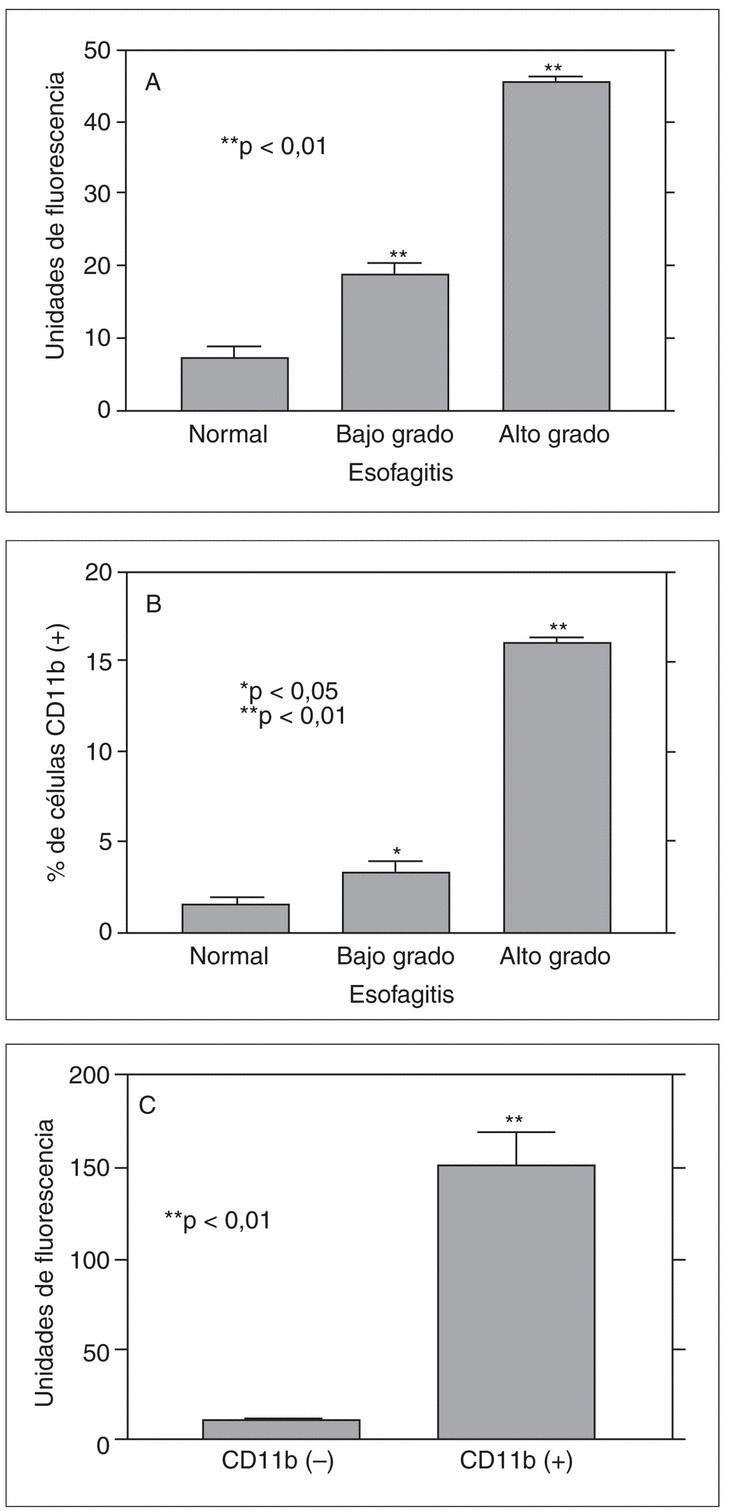
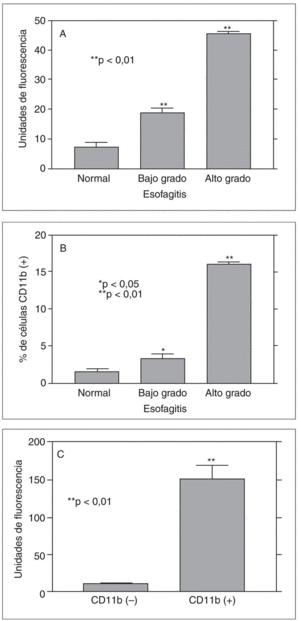
En un modelo propio de esofagitis crónica en conejos hemos podido comprobar que la génesis de anión superóxido está presente en situaciones de lesión crónica moderada-grave, aunque su papel en la esofagitis de bajo grado es cuanto menos limitado20,21 (fig. 1). En este modelo de esofagitis pudimos también observar por primera vez que, en situaciones de agresión grave, la mucosa esofágica genera radicales peroxinitrito, fruto de la interacción entre óxido nítrico y anión superóxido, pero no en situaciones de lesión esofágica leve.
Fig. 1. A) Producción de anión superóxido (medido por citometría de flujo) en células epiteliales esofágicas de conejo aisladas de esófago normal, con esofagitis de bajo grado y con esofagitis de alto grado. B) Porcentaje de células CD11b positivas en las mismas muestras. C) La mayor parte de la producción de anión superóxido depende de células CD11b positivas. *p < 0,05; **p < 0,01.
En un modelo experimental de adenocarcinoma de esófago en rata mediante anastomosis esofagoyeyunal hemos puesto de manifiesto que la progresión de la mucosa esofágica normal a adenocarcinoma se asocia con un aumento paralelo de los valores de anión superóxido en la mucosa esofágica. El anión superóxido permanece elevado hasta el octavo mes de seguimiento y alcanza sus valores máximos en presencia de esófago de Barrett, lo que sugiere un papel patogénico para el anión superóxido en la génesis del esófago de Barrett y adenocarcinoma22.
Nuestros resultados concuerdan con el estudio de Chen et al23 en un modelo similar de adenocarcinoma de esófago en rata (anastomosis esofagoduodenal), que evaluaron el daño oxidativo en el esófago distal 11 y 30 semanas después de realizar la anastomosis. El daño oxidativo en lípidos, ADN y proteínas eran significativamente más alto que las ratas no operadas, sugiriendo que existía correlación entre daño oxidativo y adenocarcinogénesis esofágica.
Los resultados obtenidos en modelos animales se han confirmado en el ser humano. Diversos estudios realizados en biopsias endoscópicas de mucosa esofágica procedentes de pacientes con ERGE han puesto de manifiesto que los pacientes con esofagitis y esófago de Barrett presentan niveles aumentados de radicales libres en esófago distal cuando se comparan con sujetos sin lesión esofágica, y además los valores de especies reactivas de oxígeno se correlacionan con el grado de esofagitis. Este aumento de radicales en la mucosa esofágica se acompaña de aumento de los niveles de lipoperoxidación, indicador de daño oxidativo19,24,25. También se ha visto que el daño oxidativo en el ADN tiene lugar precozmente en la secuencia ERGE-esofagitis-metaplasia-displasia-adenocarcinoma26.
DEFENSA DE LA MUCOSA ESOFÁGICA EN LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO: PERSPECTIVAS TERAPÉUTICAS
Tratamiento farmacológico de las relajaciones transitorias del esfínter esofágico inferior
El control de las relajaciones transitorias, para restablecer la barrera antirreflujo, constituye un nuevo enfoque en el tratamiento médico de la ERGE. En los últimos años se han identificado diversos agentes capaces de disminuir este fenómeno, incluidos los antagonistas de la colecistocinina A, agentes anticolinérgicos, morfina o los inhibidores de la sintasa del óxido nítrico. Sin embargo, el hecho de que todos se acompañen de efectos adversos ha hecho inviable su aplicación en la clínica humana. Más recientemente, los agonistas del receptor B del ácido *-aminobutírico se han perfilado como candidatos potenciales para el tratamiento de las relajaciones transitorias del EEI27.
El baclofeno, un agonista GABAB utilizado para el tratamiento de la espasticidad, es capaz de reducir las relajaciones transitorias en animales28,29. En sujetos sanos, la administración de una única dosis de 40 mg por vía oral de baclofeno reduce el número de episodios de reflujo en más de un 60%30, lo que ha llevado a la realización de diversos estudios para valorar su eficacia en pacientes con ERGE.
Zhang et al31 evaluaron el efecto de baclofeno frente a placebo en 20 pacientes con diversos grados de esofagitis, mediante pHmetría y manometría durante las 3 h posteriores a la ingesta de comida. La administración de baclofeno 40 mg por vía oral redujo en un 40% las relajaciones transitorias, con una reducción similar de los episodios de reflujo, y produjo además un aumento significativo de la presión basal del EEI. Sin embargo, la disminución del número de episodios de reflujo no se acompañó de una disminución significativa del tiempo de exposición ácida del esófago.
Otros estudios en pacientes con ERGE coinciden en la capacidad de baclofeno para disminuir la frecuencia de episodios de reflujo y de relajaciones transitorias del EEI, aunque en el estudio de Cange et al32 también observan disminución del tiempo de exposición ácida, mientras que en otro estudio el baclofeno no afectó a la presión del EEI33. Recientemente se ha visto que la administración de baclofeno también es efectiva en pacientes refractarios al tratamiento con IBP. En este estudio se incluyó a 16 pacientes que presentaban síntomas de reflujo durante al menos 3 meses a pesar del tratamiento con IBP. El tratamiento con baclofeno disminuyó significativamente el número de episodios de reflujo biliar, así como el número de episodios de reflujo de larga duración (> 5 min), y mejoró significativamente los síntomas de reflujo34. La administración crónica de baclofeno (40 mg/día durante 4 semanas) también se ha visto que reduce los episodios de reflujo y mejora significativamente los síntomas en pacientes con ERGE35.
Los resultados obtenidos hasta el momento indican que los agonistas GABAB pueden ser una alternativa viable en el tratamiento de la ERGE. Sin embargo, hay que tener en cuenta que en determinadas condiciones experimentales se ha visto que el baclofeno aumenta la secreción ácida gástrica. Si esta respuesta tuviera lugar en pacientes con ERGE, podría contrarrestar el efecto beneficioso obtenido en la función motora del esófago. Por otra parte, la mayoría de los estudios han utilizado una única dosis de 40 mg, pero su administración de forma crónica puede acompañarse de toxicidad neurológica o gastrointestinal.
Así pues, es preciso realizar ensayos clínicos más prolongados y que incluyan un mayor número de pacientes. De confirmarse su eficacia, el baclofeno podría estar indicado en el tratamiento de pacientes con ERGE y endoscopia negativa o esofagitis de bajo grado (en los que la principal causa de reflujo son las relajaciones transitorias del EEI), en pacientes con síntomas refractarios al tratamiento con IBP, así como en pacientes con reflujo enterogastroesofágico (biliar), con o sin evidencia de esófago de Barrett.
Defensa de la mucosa esofágica frente al daño oxidativo: antioxidantes
El conocimiento en los últimos años de la importancia de los radicales libres en la patogénesis de la ERGE ha abierto nuevas vías de investigación, y los sistemas antioxidantes han cobrado especial relevancia en el entramado defensivo de la mucosa esofágica. Aunque hasta el momento todos los estudios realizados se han llevado a cabo en modelos experimentales, éstos han demostrado que diversos barredores de radicales libres son capaces de disminuir la lesión de la mucosa esofágica inducida por reflujo.
Westcher et al16 demostraron que la administración de superóxido dismutasa prevenía la aparición de esofagitis inducida por reflujo duodenogástrico o ácido en ratas. En este estudio, la administración de SOD por vía intravenosa redujo en un 82% el área de lesiones macroscópicas en las ratas con reflujo mixto y en un 68% en el grupo de reflujo ácido. En otro estudio, estos mismos autores17 examinaron el efecto de diversos barredores de radicales en la esofagitis por reflujo inducida mediante la ligadura del yeyuno proximal durante 24 h: SOD, catalasa, dimetiltiourea, alopurinol, y la combinación de SOD + catalasa, o SOD + catalasa + dimetiltiourea + alopurinol. Macroscópicamente, la esofagitis fue inhibida sólo por la SOD, sola o en combinación con otros agentes. La peroxidación lipídica en la mucosa esofágica disminuyó también con la administración de SOD, cuyo efecto fue significativamente superior al de la catalasa. Sin embargo, no se observó ningún efecto con dimetiltiourea o alopurinol. La combinación de SOD y catalasa no mostró ninguna mejoría significativa respecto a la administración de SOD. La combinación de SOD + catalasa + dimetiltiourea + alopurinol redujo los valores de peroxidación lipídica a los de los controles. El efecto observado con la SOD dependía específicamente de su capacidad enzimática para inactivar radicales libres, ya que la administración de SOD previamente inactivada no ejerció efecto alguno.
El alto poder preventivo de la superóxido dismutasa en la lesión esofágica mediada por ácido ha sido posteriormente corroborado en un modelo de esofagitis inducida mediante perfusión de ácido y pepsina en el conejo. En este estudio18, la administración intravenosa de SOD 10 min antes y durante el tiempo que duraba la perfusión de pepsina acidificada disminuyó significativamente la lesión macroscópica de la mucosa. La SOD mejoró también la función de la barrera mucosa que se objetivó por la disminución del flujo positivo de K+ y de la retrodifusión de H+. En este estudio, la administración de catalasa (barredor de peróxido de hidrógeno) ejerció un efecto inferior a la SOD, mientras que DMSO no tuvo ningún efecto.
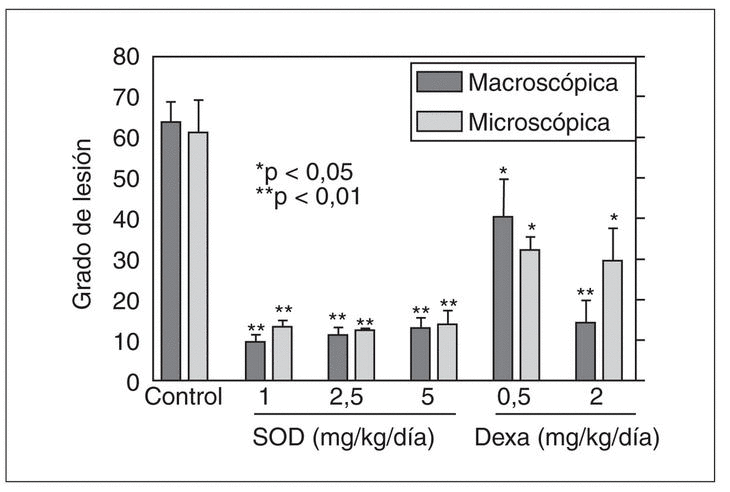
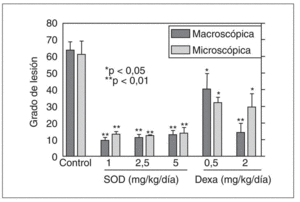
En un modelo propio de esofagitis crónica en conejos pudimos comprobar que la administración exógena de SOD no induce cambio alguno en la lesión inducida en el modelo de esofagitis de bajo grado20. Sin embargo, en el modelo de esofagitis de alto grado disminuye significativamente el grado de lesión a todas las dosis administradas (0,5-2,5 mg/kg/12 h)21 (fig. 2). Recientemente, Lee et al36-38 han evaluado el papel de un nuevo antioxidante (DA-9601) obtenido de una planta asiática, Artemisia asiatica, tanto en un modelo de esofagitis por reflujo aguda como crónica. La administración de DA-9601 disminuyó significativamente el grado de esofagitis de manera dosis-dependiente en el modelo de esofagitis aguda en ratas. En el modelo de esofagitis crónica el DA-9601 disminuyó significativamente el índice de proliferación en el esófago y previno el desarrollo de esófago de Barrett. Además, el DA-9601 disminuyó los niveles de peroxidación lipídica en el esófago y atenuó la disminución de GSH inducida por el reflujo. Los resultados obtenidos indican que los antioxidantes pueden tener aplicación futura no sólo en el tratamiento de la esofagitis por reflujo, sino también para prevenir el desarrollo de esófago de Barrett.
Fig. 2. La administración de superóxido dismutasa disminuye significativamente el grado de lesión tanto en el ámbito macroscópico como microscópico en el modelo de esofagitis de alto grado en el conejo. En este modelo, la administración de dexametasona también disminuye, aunque menos, la lesión inducida por la perfusión de ácido y pepsina. *p < 0,05; **p < 0,01 frente al control. SOD: superóxido dismutasa.
Nuestro grupo ha demostrado recientemente que la administración de superóxido dismutasa es capaz de prevenir el desarrollo de adenocarcinoma en un modelo de esófago de Barrett inducido experimentalmente mediante esofagoyeyunostomía en rata21. En este estudio, la SOD redujo significativamente el riesgo de desarrollar metaplasia intestinal alejada de la anastomosis (odds ratio = 0,32; intervalo de confianza del 95%, 0.108-0,981) y adenocarcinoma esofágico (odds ratio = 0,24; intervalo de confianza del 95%, 0,073-0,804). Aunque éste es el primer estudio que demuestra la eficacia de los antioxidantes en la prevención del adenocarcinoma de esófago, en humanos un estudio caso-control ha demostrado recientemente que el consumo elevado de antioxidantes (vitamina C, beta-caroteno y alfa-tocoferol) disminuye el riesgo de adenocarcinoma en un 40%, y de carcinoma escamoso de esófago en un 50%39.
Óxido nítrico
El óxido nítrico parece desempeñar un papel importante en los mecanismos de defensa de la mucosa esofágica. En un modelo experimental de lesión esofágica aguda, en el que se demostró la existencia del fenómeno de adaptación de la mucosa esofágica a la agresión consecutiva de un irritante leve (salino a pH 2) seguido de uno más agresivo (pepsina acidificada), se evidenció que el bloqueo de la síntesis de óxido nítrico con L-NAME (inhibidor de la sintetasa de óxido nítrico) revertía esa capacidad de adaptación40. Dada la naturaleza rápida de ese fenómeno y la ausencia de estímulo de la proliferación, sugeríamos la posibilidad, no evaluada, de intervención del flujo mucoso dependiente del óxido nítrico. Esta hipótesis es avalada por otros estudios, en los que se ha evidenciado que el ácido induce un aumento de flujo sanguíneo, siendo éste atenuado por la administración de inhibidores del óxido nítrico41. En un trabajo del grupo de Sarosiek42 se estudió el papel del óxido nítrico en la regulación de la secreción de moco en el esófago del opposum. La agresión ácido péptica aumentó la secreción de moco con respecto al grupo control (al que se administraba suero salino). Cuando se añadía NW-Nitro-L-arginina (L-NNA) (un inhibidor de la sintasa del óxido nítrico [NOs]) disminuía la secreción de moco en ambos grupos. Estos resultados sugieren que la secreción de moco está regulada en parte por el óxido nítrico, que desempeñaría así un papel importante en el mantenimiento de la integridad de la mucosa esofágica.
El papel que el óxido nítrico desempeña en la prevención o desarrollo de la esofagitis experimental ha sido investigado por nuestro grupo en el conejo, donde hemos demostrado la existencia de actividad NOs en la mucosa esofágica. En el modelo de esofagitis crónica se ha visto que el óxido nítrico endógeno desempeña un papel primordial en la defensa de la mucosa esofágica ante la agresión ácido péptica20,21. En este modelo pudimos comprobar que la mucosa del esófago, incluido el epitelio, presenta actividad NOs, ya que el examen inmunohistoquímico con nicotinamida-adenina-dinucleótido-fosfato (ADPH)-diaforasa mostró intensa tinción del epitelio, endotelio y la capa muscular.
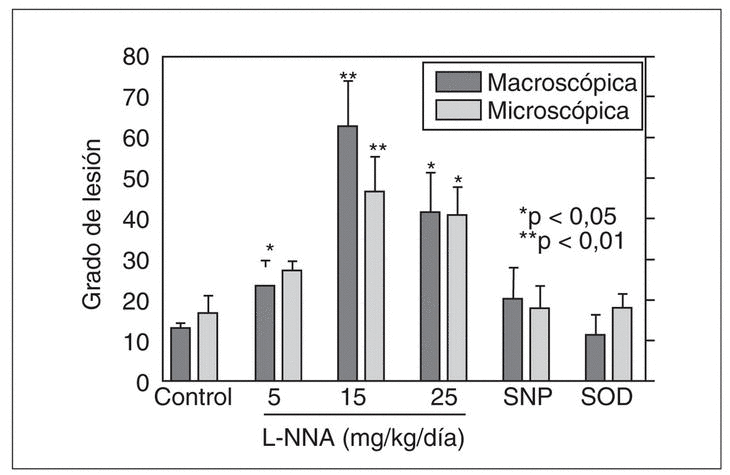
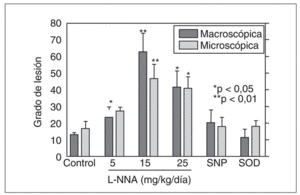
La agresión con ácido y pepsina produce un aumento de esta actividad NOs a expensas de ambas isoenzimas, inducible y constitutiva, pero mayoritariamente de la isoenzima constitutiva. Este aumento se observó en el modelo de esofagitis crónica de bajo grado, pero no en la lesión de alto grado, probablemente debido a la intensa pérdida epitelial. Que el óxido nítrico tiene un papel en la defensa de la mucosa se ha demostrado mediante la aplicación de bloqueadores de la síntesis de óxido nítrico como el L-NNA. Así, en la esofagitis de bajo grado, el L-NNA induce un empeoramiento de las lesiones respecto al grupo sin tratamiento (fig. 3). Sin embargo, el L-NNA no ejerció ningún efecto en el modelo de esofagitis de alto grado. Además en este modelo de esofagitis pudimos comprobar que la mucosa esofágica genera el radical tóxico peroxinitrito, resultado de la interacción del óxido nítrico con el anión superóxido, en situación de agresión grave, pero no en caso de esofagitis leve. Estos datos sugieren que el óxido nítrico ejerce un papel protector de la mucosa esofágica, pero cuando la agresión sobrepasa su capacidad defensiva, puede ejercer un papel negativo debido a capacidad para generar peroxinitritos, un radical extremadamente reactivo.
Fig. 3. La administración de L-NNA (un inhibidor de la sintasa del óxido nítrico) empeora significativamente la lesión inducida por la perfusión de ácido y pepsina en el esófago del conejo. En este modelo de esofagitis de bajo grado no se observa ningún efecto ni con la administración de un donador de óxido nítrico (nitroprusiato sódico) ni de SOD. *p < 0,05; **p < 0,01 frente al control.
Inhibidores de la ciclooxigenasa-2
A diferencia de lo que ocurre en el estómago, donde su papel protector está claramente establecido, el papel de las prostaglandinas en la mucosa esofágica es un tema objeto de controversia, ya que los estudios realizados tanto en experimentación animal como en humanos han arrojado resultados contradictorios. Diversos estudios han evaluado la producción de prostaglandina E2 tanto en biopsias de esófago de pacientes con esofagitis como en modelos experimentales de esofagitis en animales. Así, se ha visto que los pacientes con esofagitis presentan aumento de los niveles de PGE2 (así como de otros metabolitos de la vía de la lipooxigenasa) cuando se comparan con individuos sanos, y que los niveles de PGE2 se correlacionan con el grado de esofagitis. En la luz esofágica también se ha observado un aumento de secreción de PGE2 paralelo al grado de esofagitis43-45. El tratamiento con omeprazol, 20 mg/día durante 6 semanas, se sigue de una disminución de un 30% de los niveles de PGE2 y LTB446. Estos resultados sugieren que el aumento de PGE2 se correlaciona con el grado de inflamación en la esofagitis y retornan a valores normales cuando el proceso inflamatorio ha sido controlado con tratamiento antirreflujo efectivo.
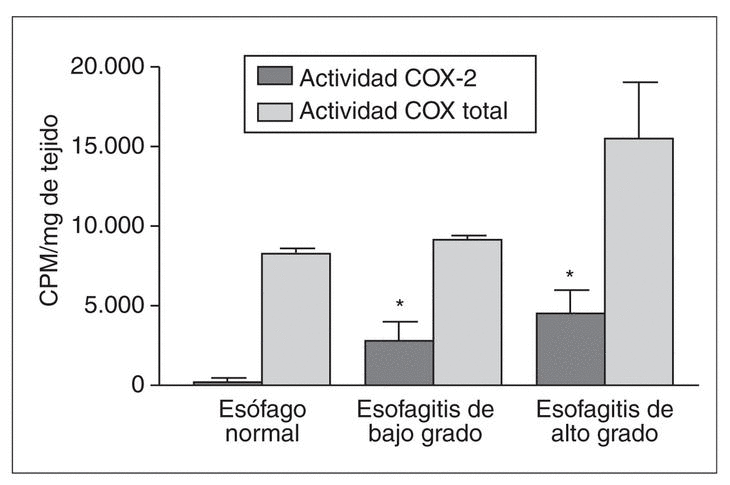
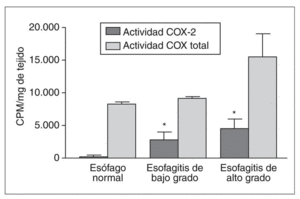
Los resultados obtenidos en modelos animales de esofagitis concuerdan con los observados en humanos. Recientemente, nuestro grupo ha demostrado que la actividad ciclooxigenasa (COX)-2 aumenta en un modelo de esofagitis crónica en el conejo47. En este estudio, la actividad COX-2 representaba menos de un 2% de la actividad total COX en el esófago normal. La inducción de esofagitis se asoció con un incremento de actividad COX-2, que aumentaba progresivamente con el grado de lesión, y se asociaba a un incremento en la concentración de PGE2 (fig. 4). Más aun, este estudio demostró que en condiciones normales la secreción de prostaglandina se realiza por la vía COX-1, que es constitutiva y parece desempeñar un papel defensivo en la integridad de la mucosa esofágica.
Fig. 4. Actividad de la ciclooxigenasa en la mucosa esofágica del conejo. La actividad COX-2 es muy baja en la mucosa normal, pero aumenta paralelamente al grado de lesión. *p < 0,05 frente al control.
Sin embargo, en los últimos años la mayoría de los estudios se han centrado en el papel de la COX-2 en la progresión de esófago de Barrett a adenocarcinoma y en el potencial uso de los inhibidores selectivos de la COX-2 en la quimioprofilaxis del adenocarcinoma esofágico, y es en este campo donde se han obtenido los resultados más prometedores. Diversos estudios han demostrado un progresivo aumento de la expresión de COX-2 en la secuencia metaplasia-displasia-adenocarcinoma en el esófago, aunque existen discrepancias sobre en qué momento tiene lugar esta sobreexpresión, ya que mientras algunos autores la sitúan ya en la etapa de metaplasia, otros sostienen que se produce en una etapa más tardía48.
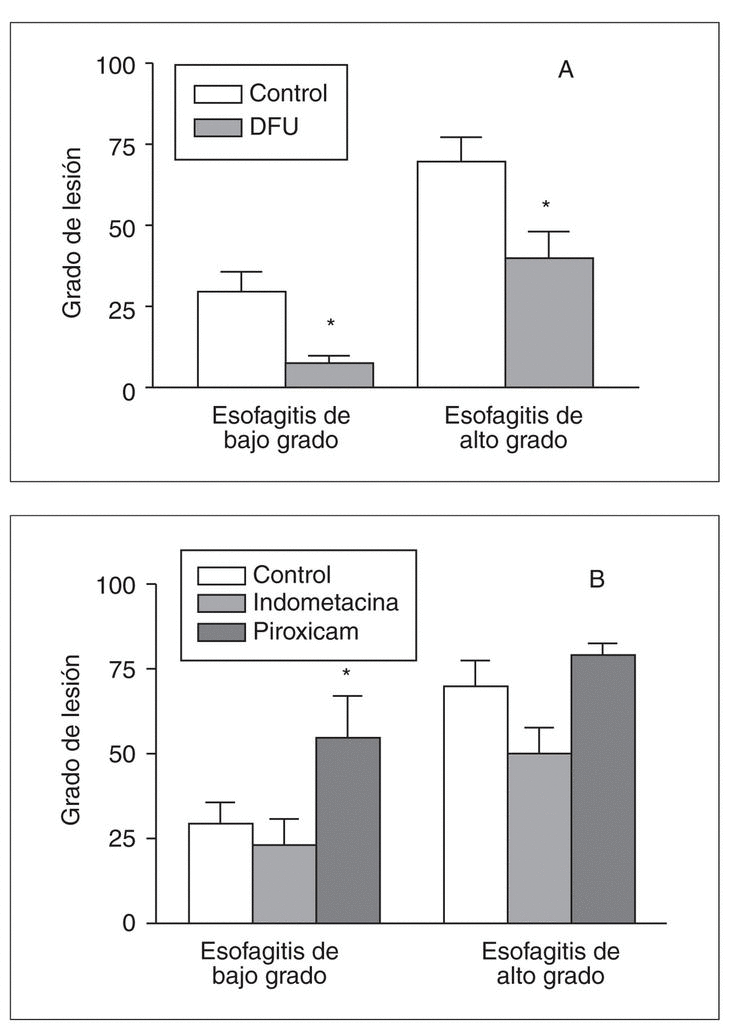
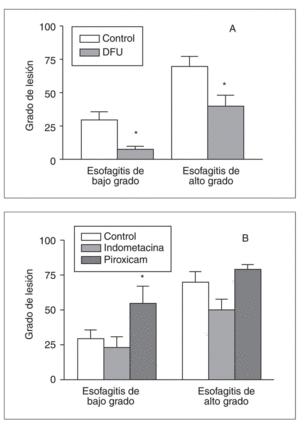
Experimentalmente, se ha visto que los antiinflamatorios no esteroideos (AINE) ejercen un efecto beneficioso en diversos modelos de esofagitis49,50. En el modelo de esofagitis crónica en el conejo, la administración oral de un inhibidor selectivo de la COX-2, DFU (3-[3-fluorofenil]-4-[4-metanesulfonil]-5,5-dimetil-5H-furan-2-one) a dosis de 30 mg/kg/día reduce significativamente la lesión mucosa inducida por la perfusión de ácido y pepsina tanto en el modelo de esofagitis de alto grado como en la esofagitis de bajo grado. Por otra parte, el tratamiento con indometacina, un inhibidor dual de COX-1 y COX-2, no induce ningún efecto estadísticamente significativo, mientras que el tratamiento con piroxicam, que inhibe preferentemente la COX-1, empeora el daño mucoso en el modelo de esofagitis de bajo grado47 (fig. 5).
Fig. 5. Efecto de diferentes inhibidores de la ciclooxigenasa en la esofagitis experimental inducida mediante perfusión de ácido y pepsina en el conejo. A) La administración de DFU (un inhibidor selectivo de la COX-2) reduce significativamente el grado de lesión mucosa tanto en el modelo de lesión de bajo grado como en el de alto grado. B) El tratamiento con indometacina o piroxicam no induce ningún cambio significativo en el modelo de esofagitis de alto grado. Sin embargo, en el modelo de esofagitis de bajo grado, el tratamiento con piroxicam aumenta significativamente el grado de lesión en la mucosa esofágica. *p < 0,05 frente al control.
En otro estudio, sin embargo, la administración de celecoxib retrasó la cicatrización de úlceras esofágicas inducidas experimentalmente mediante la aplicación de ácido acético en la serosa del esófago en ratas51. No obstante, desde nuestro punto de vista, el modelo utilizado dista mucho de reproducir lo que ocurre en la esofagitis grave en el humano. En este modelo, el tratamiento con celecoxib disminuyó la proliferación de las células epiteliales en los márgenes de la úlcera, así que probablemente sean diferentes los mecanismos responsables de los efectos observados en ambos estudios. En este último, el efecto deletéreo sobre la cicatrización mediante la inhibición de la proliferación, y por tanto del número de células disponibles para cerrar la úlcera, explicaría el efecto negativo observado, mientras que en nuestro modelo de esofagitis crónica en el conejo, la respuesta inflamatoria sería la principal diana del inhibidor selectivo.
Como ya hemos señalado antes, en la actualidad la mayoría de las investigaciones se centran en el potencial uso de los inhibidores de la COX-2 en la prevención de adenocarcinoma de esófago en pacientes con esófago de Barrett. En este sentido, Buttar et al han demostrado que la administración tanto de un inhibidor selectivo de COX-2 (MF-tricíclico) como de un inhibidor no selectivo (sulindaco) disminuye significativamente la aparición y el riesgo de cáncer en un 55 y un 79%, respectivamente, en un modelo de Barrett y adenocarcinoma de esófago en ratas mediante esofagoyeyunostomía52. El grado de inflamación también disminuyó significativamente tanto en el grupo tratado con MF-tricíclico como con sulindaco, aunque los autores no encontraron ninguna diferencia cuando compararon la prevalencia de metaplasia de Barrett entre los grupos. Éste es el primer estudio in vivo que demuestra que los inhibidores selectivos de la COX-2 son capaces de inhibir el desarrollo de adenocarcinoma esofágico inducido por reflujo crónico.
En líneas celulares humanas de cáncer de esófago se ha demostrado que el tratamiento con inhibidores selectivos de la COX-2 inhibe la síntesis de prostaglandina E2, así como la proliferación celular además de inducir la apoptosis53. En explantes de esófago de Barrett se ha demostrado que la síntesis de PGE2 está aumentada respecto al epitelio esofágico normal. Además, tanto el ácido como las sales biliares estimulan la liberación de PGE2, lo cual se traduce en un aumento de la proliferación celular, mientras que la adición de NS-398 (un inhibidor selectivo de la COX-2) reduce en más del 50% el grado de proliferación54,55.
Estas evidencias han motivado el planteamiento de estudios de mayor envergadura en humanos. Los primeros resultados en pacientes han sido recientemente publicados por el grupo de Triadafilopoulos56, que demuestran que la administración de rofecoxib, 25 mg/día, es capaz de disminuir la proliferación en un 62,5% en el esófago de Barrett, así como la expresión y actividad COX-2. A pesar de las limitaciones de este estudio en cuanto al número de pacientes incluidos12 y al tiempo de tratamiento (sólo 10 días), es el primer estudio realizado en humanos que ha demostrado que la inhibición de la COX-2 ejerce un efecto beneficioso en el esófago de Barrett y, por tanto, podría ser utilizado en combinación con los inhibidores de la bomba de protones en la quimioprevención de la displasia en estos pacientes.
En la actualidad, hay varios ensayos clínicos en marcha. Así, en estos momentos el National Institutes of Health (http://clinicaltrials.gov) está llevando a cabo un ensayo en fase II, aleatorizado, doble ciego, controlado con placebo y multicéntrico, encaminado a determinar el efecto de la inhibición de la COX-2 con celecoxib en la displasia de Barrett. Otro ensayo es un estudio piloto dirigido a evaluar la eficacia del celecoxib tras la ablación de metaplasia de Barrett, en el que se compara la regeneración del epitelio escamoso entre pacientes aleatorizados de acuerdo con el tratamiento con IBP solo o en combinación con celecoxib57. En el ámbito nacional, la AEG tiene en marcha un ensayo clínico en fase IV, multicéntrico, abierto y aleatorizado en el que se evaluará el efecto de rofecoxib en la progresión de esófago de Barrett a través de marcadores subclínicos: índices de proliferación y apoptosis, ciclina D1 y expresión de VEGF (vascular endothelial growth factor).
Factores de crecimiento
El papel potencial de los factores de crecimiento en el proceso de reparación de la mucosa esofágica ha sido explorado en los últimos años. Hasta el momento, son 4 los factores de crecimiento que se ha demostrado que desempeñan algún papel en el epitelio esofágico. El IGF-I aumenta el grosor de la mucosa y la proliferación celular y la síntesis de ADN tanto en explantes esofágicos de esofagitis inducidas in vivo, como en modelos de cicatrización in vitro con células de epitelio esofágico de conejo13,58, lo que sugiere que podría ser un factor de crecimiento clave en el esófago. Además, se han identificado 2 clases de receptores para IGF-I en células epiteliales esofágicas59. Otros factores de crecimiento importantes son el factor de crecimiento de los hepatocitos (HGF) y el factor de crecimiento epidérmico (EGF), ya que se han identificado receptores específicos para ambos en células epiteliales esofágicas. En células epiteliales de esófago de conejo, tanto el HGF como el EGF aceleran la restitución y la proliferación celular13.
En la mucosa esofágica se han encontrado valores disminuidos de EGF en presencia de inflamación60, lo que sugiere que este factor puede desempeñar un papel en el desarrollo o cicatrización de las esofagitis. Éste podría ser un factor decisivo en el mantenimiento de la actividad proliferativa y metabólica de la mucosa esofágica, ya que ésta tiene un importante potencial secretor de EGF. El factor de transformación del crecimiento beta (TGF-β1) desempeña un importante papel en la cicatrización y regeneración tisular, probablemente por vía de un efecto inductivo de la matriz extracelular. En el esófago se ha descrito la presencia de un receptor específico para TGF-β en la línea celular HET-1A. Los datos obtenidos por nuestro grupo muestran que el TGF-β1 inhibe tanto la restitución como la proliferación de células de epitelio esofágico13, indicando, una vez más, las profundas diferencias de respuesta de la mucosa esofágica a diferentes factores reguladores en comparación a otras áreas del tracto digestivo. La pérdida de este efecto inhibitorio podría ser importante en la adenocarcinogénesis esofágica, ya que la disminución de expresión del receptor de TGF-β se ha asociado con resistencia a la inhibición del crecimiento en células esofágicas transfectadas61.
RESUMEN
Los datos disponibles hasta el momento sugieren que los agonistas GABA podrían ser aplicados en el futuro en el control de las alteraciones de la motilidad y de las relajaciones transitorias del EEI. Los «barredores» de radicales libres, y en concreto la superóxido dismutasa, podrían ser utilizados tanto en la prevención como en el tratamiento de las esofagitis, en especial en las formas graves, solos o en combinación con otros agentes como los antisecretores. Finalmente, los inhibidores selectivos de la COX-2 podrían ser utilizados para disminuir la progresión de esófago de Barrett a adenocarcinoma. Entre los factores de crecimiento, la modulación de algunos de ellos (TGF-β, EGF, HGF, IGF) podría tener aplicación en el tratamiento de las esofagitis refractarias, úlceras esofágicas, así como en la progresión a esófago de Barrett o incluso adenocarcinoma. Sin embargo, queda todavía un largo camino que recorrer antes de que estos agentes puedan ser utilizados en el ser humano con indicaciones terapéuticas.
Este trabajo ha sido financiado por el Instituto de Salud Carlos III, según los expedientes C03/02 y 02/3037.