NTRODUCCIÓN
En 1996, el International Ascites Club definió la ascitis refractaria como la ascitis que no puede ser movilizada o cuya recurrencia temprana no puede ser prevenida por medio del tratamiento médico (restricción de sodio y tratamiento con fármacos diuréticos a dosis adecuadas)1.
Se definieron 2 tipos de ascitis refractaria: la resistente al tratamiento diurético, que no responde a una terapia diurética máxima con espironolactona (400 mg/día) + furosemida (160 mg/día), y la intratable, que no puede ser tratada con dosis adecuadas de diuréticos debido al desarrollo de complicaciones inducidas por los mismos medicamentos, mayoritariamente insuficiencia renal, hiponatremia dilucional y encefalopatía hepática.
Esta definición fue luego revisada en un Consenso del mismo International Ascites Club recientemente publicado2. La definición y los criterios diagnósticos de ascitis refractaria han quedado sustancialmente igual respecto a la definición precedente. Los criterios diagnósticos revisados se muestran en la tabla I.
TRATAMIENTO DE LA ASCITIS REFRACTARIA
En el curso de las últimas décadas del siglo xx se desarrollaron diferentes opciones terapéuticas con el objetivo de tratar a los pacientes cirróticos con ascitis refractaria. A continuación describiremos brevemente algunos de los tratamientos que se han utilizado, y posteriormente nos centraremos en el papel del TIPS (transjugular intrahepatic portosystemic shunt) en la ascitis refractaria.
Paracentesis terapéuticas
Las paracentesis evacuadoras repetidas constituyen actualmente la terapia de elección de la ascitis refractaria en los pacientes cirróticos. La paracentesis evacuadora fue reintroducida en la práctica clínica a mediados de la década de los ochenta, y su objetivo es la extracción de grandes volúmenes de líquido ascítico mediante una aguja introducida en la cavidad peritoneal. Numerosos estudios han demostrado que este tratamiento, si se realiza seguido de expansión del volumen plasmático, es efectivo y seguro en el tratamiento de estos pacientes, y que se asocia a una menor incidencia de complicaciones si se compara con la terapia diurética estándar3-10. La expansión del volumen plasmático es necesaria para prevenir el desarrollo de la «disfunción circulatoria post-paracentesis» (DCPP), una alteración caracterizada por una marcada activación de los sistemas vasoactivos endógenos y debida a un aumento de la vasodilatación arterial esplácnica y a la consiguiente reducción del volumen plasmático efectivo11-17. La DCPP puede causar empeoramiento de la función renal e hiponatremia11-17. Además, su aparición se asocia a una menor supervivencia17. La prevalencia de DCPP es aproximadamente del 70% en los pacientes tratados con paracentesis sin expansión del volumen plasmático, de aproximadamente el 35% en los tratados con expansores plasmáticos sintéticos (dextrano-70, poligelina) o con suero fisiológico, y del 20% (11-23%) en los pacientes tratados con albúmina17-22. Sin embargo, en caso de paracentesis de pequeño volumen (< 5 l), el uso de expansores plasmáticos sintéticos parece ser una alternativa tan eficaz como la albúmina.
Basándonos en los datos disponibles hoy en la bibliografía, la paracentesis terapéutica debe ser ejecutada junto con la expansión plasmática con albúmina (8 g/l de ascitis) si se extrae un volumen mayor de 5 l de líquido ascítico, o con otro expansor plasmático (dextrano-70, poligelina) si la paracentesis es de menor volumen (menos de 5 l de ascitis).
El «punto débil» de este tratamiento es que se trata de una terapia que, aunque efectiva, no actúa sobre los mecanismos fisiopatológicos que llevan a la formación de ascitis y que, por tanto, en caso de ascitis refractaria el líquido seguirá acumulándose en la cavidad peritoneal.
Shunts quirúrgicos
La reducción de la presión portal mediante la realización de shunts quirúrgicos portosistémicos produce supresión de los sistemas antinatriuréticos y aumento de la excreción renal de sodio, con eliminación de la ascitis. Sin embargo, los shunts quirúrgicos portosistémicos se asocian a una mortalidad intraoperatoria muy elevada y a una alta prevalencia de encefalopatía crónica a lo largo del seguimiento23-25. Debido a estas complicaciones, este tipo de shunt no ha llegado a ser un tratamiento estándar de la ascitis refractaria.
Shunt de LeVeen
El shunt de LeVeen es una anastomosis peritoneo-venosa diseñada, a mediados de los años setenta, para tratar la ascitis refractaria26. Se trata de una comunicación entre la cavidad peritoneal y la vena cava superior. El LeVeen produce una expansión del volumen circulante plasmático por medio del mismo líquido ascítico, lo que provoca una mejoría en los parámetros hemodinámicos (reducción de la activación de los sistemas vasoconstrictores endógenos) y en la función renal (aumento del flujo hemático renal y del filtrado glomerular, aumento en la excreción renal de sodio), y es una herramienta eficaz en el tratamiento de la ascitis refractaria27,28. El mayor inconveniente del LeVeen es la elevada incidencia de obstrucción de la prótesis (aproximadamente el 40% de los casos durante el primer año de seguimiento), complicación que requiere la reintervención quirúrgica para sacar y sustituir la prótesis29-31. Además, el uso de esta prótesis puede asociarse a otras complicaciones graves, como la trombosis de la vena cava superior y la peritonitis obstructiva intestinal, que no sólo necesitan ser tratadas quirúrgicamente, sino que también pueden llegar a contraindicar el trasplante hepático, hecho que deja al paciente sin una opción terapéutica fundamental26.
En los estudios en que se comparó el LeVeen con las paracentesis evacuadoras asociadas a expansión con albúmina se observó que ambos tipos de tratamiento eran eficaces para movilizar la ascitis. A lo largo del seguimiento el LeVeen demostró incluso ser aparentemente más eficaz en el control de la ascitis, con un menor número de reingresos hospitalarios por ascitis y un menor requerimiento de diuréticos30,31. Sin embargo, el tiempo total de hospitalización fue muy parecido y la probabilidad de supervivencia a medio-largo plazo fue similar en los 2 grupos30,31. Debido a la elevada incidencia de obstrucción de la prótesis, al posible desarrollo de complicaciones muy graves, a la falta de ventajas en términos de supervivencia y a la existencia de una opción terapéutica alternativa (paracentesis repetidas), el dispositivo de LeVeen no es actualmente un tratamiento recomendado.
Trasplante de hígado
En los pacientes con cirrosis, el desarrollo de ascitis refractaria es una complicación de los estadios avanzados de la enfermedad y, por tanto, estos pacientes deberían ser evaluados para recibir un trasplante de hígado. Con una supervivencia media del 70-80% a los 5 años, el trasplante hepático supera ampliamente el 20% de supervivencia de los pacientes cirróticos con ascitis no trasplantados32. Varios estudios en pacientes cirróticos han demostrado la presencia de unos parámetros, en gran parte relacionados con los trastornos circulatorios y hemodinámicos, asociados a mal pronóstico a medio-corto plazo33,34. Estos parámetros son:
1. Disminución de la excreción renal de agua (volumen urinario < 8 ml/min después de la sobrecarga hídrica con 20 ml/kg de solución glucosada al 5% por vía intravenosa).
2. Hiponatremia dilucional (sodio sérico < 130 mEq/l en ausencia de terapia diurética).
3. Hipotensión arterial (presión arterial media < 80 mmHg en ausencia de terapia diurética).
4. Filtrado glomerular disminuido.
5. Marcada retención renal de sodio (sodio urinario < 10 mEq/día en condiciones de dieta hiposódica con 60-90 mEq/día de sodio y en ausencia de terapia diurética).
Los pacientes con ascitis refractaria presentan a menudo una o más de las anteriores condiciones y se caracterizan por una probabilidad de supervivencia a medio-largo plazo muy baja. Por tanto, en ausencia de contraindicaciones, el trasplante hepático es el tratamiento de elección de estos pacientes.
TIPS: DESCRIPCIÓN E HISTORIA
La historia del TIPS empieza al final de la década de los sesenta, cuando Rösch introdujo en el ámbito médico la idea de una anastomosis intrahepática35. Sin embargo, el primer uso clínico del TIPS fue a principios de la década de los ochenta36,37, y su empleo en la práctica clínica se desarrolló en los noventa. Principalmente se ha utilizado en el tratamiento de pacientes cirróticos con sangrado debido a ruptura de varices esofágicas refractario al tratamiento médico y endoscópico38-42. Las mejorías técnicas y la búsqueda de nuevas opciones terapéuticas en el ámbito de la hipertensión portal llevaron sucesivamente a evaluar el TIPS para el tratamiento de las complicaciones relacionadas al trastorno de la función renal característico de estos pacientes, como la ascitis refractaria y el síndrome hepatorrenal.
Técnicamente, el TIPS se trata de una anastomosis porto-cava laterolateral que comunica, a través del parénquima hepático, la vena porta con las venas suprahepáticas, logrando de ese modo bajar la presión transhepática y, en consecuencia, la presión portal. La prótesis puede ser colocada por vía percutánea con anestesia local. Además su colocación no altera la anatomía portal, lo que constituye una gran ventaja en los pacientes candidatos a trasplante hepático43. Sin embargo, son muchas las complicaciones que pueden presentarse debido a la colocación del shunt.
Entre las complicaciones inmediatas, la más grave es el sangrado intraperitoneal debido a punción de la cápsula hepática. Afortunadamente, la mayoría de los episodios de sangrado intraabdominal son autolimitados y no ponen en peligro la vida de los pacientes44. Otras complicaciones son el desarrollo de insuficiencia cardíaca (debida al aumento del retorno venoso y característica de pacientes con función cardíaca comprometida), el desarrollo de sepsis y el empeoramiento de la función hepática, las últimas dos sobre todo en pacientes con enfermedad hepática avanzada (Child C)45.
Entre las complicaciones tardías, el desarrollo de encefalopatía hepática y la obstrucción/estenosis del shunt son las más importantes. La encefalopatía hepática, que se manifiesta en aproximadamente el 30% de los pacientes durante el seguimiento (incidencia que es más elevada en los pacientes con encefalopatía hepática pre-TIPS y con edad superior a los 60 años), representa uno de los mayores problemas para estos pacientes, y a menudo es difícilmente reversible por medio de los tratamientos estándar. La obstrucción/estenosis del shunt, con una incidencia del 60-70% al año, representa la complicación más frecuente en el seguimiento, y requiere la hospitalización de los pacientes y la revisión de la prótesis. Nuevos tipos de prótesis («shunts recubiertos») están en evaluación, con el propósito de reducir la tasa de obstrucción/estenosis del shunt y así mejorar la gestión clínica y la calidad de vida de estos pacientes2.
FISIOPATOLOGÍA Y PAPEL DEL TIPS
A lo largo de los últimos 50 años han sido numerosos los estudios que han intentado explicar la formación de la ascitis en los pacientes cirróticos y, más específicamente, de encontrar la relación fisiopatológica entre la formación de ascitis y los trastornos de la función renal, el aumento de actividad de los sistemas vasoactivos endógenos y la circulación hiperdinámica, hallazgos característicos de estos pacientes.
A finales de la década de los ochenta se desarrolló la teoría de la «vasodilatación arterial», que actualmente es la más aceptada para explicar la patogenia de la ascitis en la cirrosis46.
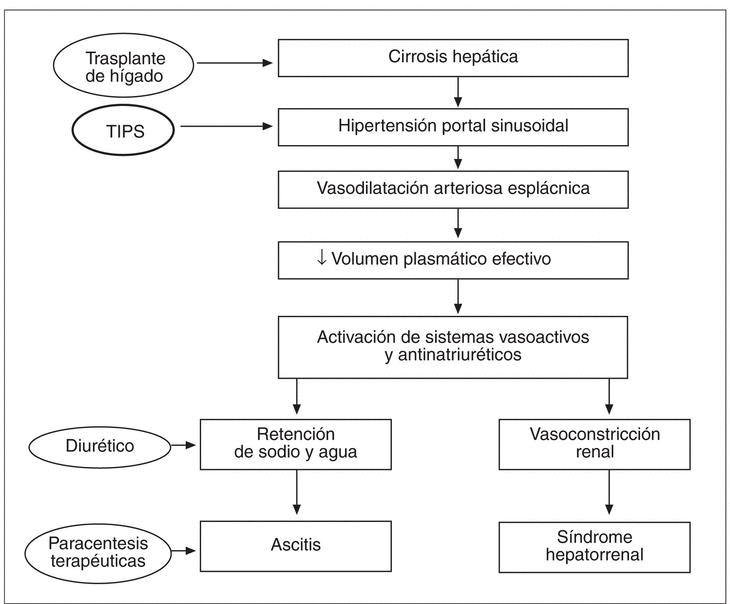
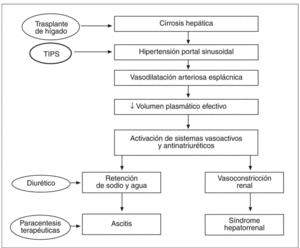
La base de esta teoría es que en los pacientes con cirrosis hepática e hipertensión portal sinusoidal se produce una marcada vasodilatación arteriolar esplácnica, posiblemente debida a la acción local de sustancias con poder vasodilatador, sustancias que se producirían secundariamente al desarrollo de hipertensión portal47. La desproporción entre el árbol vascular dilatado y el volumen plasmático, que en términos absolutos ha permanecido constante pero en términos funcionales ha disminuido, produce una activación del sistema nervioso simpático, del sistema renina-angiotensina-aldosterona y un aumento de la secreción de la hormona antidiurética, hechos que llevan a la retención de sodio y de agua en el túbulo proximal, en el asa de Henle y en el túbulo distal. La retención renal de sodio es la base de la formación de ascitis, mientras que la progresiva y constante activación de los sistemas vasoactivos endógenos causa vasoconstricción renal y el desarrollo del síndrome hepatorrenal46. Hay, entonces, una relación muy importante entre el grado de hipertensión portal sinusoidal, la intensidad de las alteraciones hemodinámicas y la gravedad de los trastornos de la función renal. En estos pacientes, el desarrollo de ascitis refractaria (y sucesivamente de síndrome hepatorrenal) representa la manifestación clínica de la grave alteración hemodinámica característica de los estadios extremos de la enfermedad.
En este contexto, el TIPS actúa sobre los mecanismos responsables del trastorno hemodinámico reduciendo la presión portal. El restablecimiento de un volumen plasmático eficaz produce la desactivación de los sistemas vasoactivos, hecho que causa un aumento de la perfusión renal, del filtrado glomerular y una mayor eliminación renal de sodio, lo que permite un control más fácil de la ascitis (fig. 1).
Fig. 1. Patogenia de la ascitis y del síndrome hepatorrenal.
Teóricamente el TIPS, que actúa sobre los mecanismos que causan la formación de la ascitis, es un tratamiento más definitivo que las paracentesis evacuadoras repetidas. Además, al reducir la presión portal, el TIPS actúa también previniendo las demás complicaciones de la hipertensión portal, como el sangrado por ruptura de varices gastroesofágicas48-54 y el síndrome hepatorrenal55.
A partir de los primeros estudios fisiopatológicos en pacientes cirróticos con ascitis tratados con TIPS se ha demostrado que después de la colocación de la prótesis se observa una ulterior disminución de las resistencias vasculares sistémicas junto a un aumento del volumen plasmático total y del gasto cardíaco. Además, la presión auricular, arterial pulmonar y capilar pulmonar resultan aumentadas56-63. En una primera evaluación el TIPS parece entonces empeorar la hemodinámica sistémica de estos pacientes. Pero no es así. Estos cambios son cambios fisiológicos a través de los cuales el sistema cardiocirculatorio se adapta a la nueva situación causada por la colocación del TIPS y no representan un empeoramiento en la hemodinámica sistémica. El aumento de las presiones cardiopulmonares y del gasto cardíaco es secundario al mayor retorno venoso inducido por el shunt, mientras que la disminución de las resistencias periféricas se debe al aumento del índice cardíaco26. Por tanto, si en valores absolutos la situación hemodinámica ha empeorado, no es así desde el punto de vista funcional. Numerosos estudios han demostrado que la colocación del TIPS se asocia a aumento del volumen plasmático eficaz y a la supresión de los sistemas vasoactivos y antinatriuréticos, con disminución de las concentraciones séricas de renina, aldosterona, norepinefrina y vasopresina. La perfusión renal resulta aumentada, así como el filtrado glomerular, con menor retención renal de sodio. Sin embargo, estos cambios favorables se producen lentamente, y requieren entre 1 semana y 3 meses después de la colocación de la prótesis56-63. El TIPS produce por tanto una mejoría del estado hemodinámico global del paciente y de su función renal, con mejor control de la ascitis.
TIPS Y ASCITIS REFRACTARIA
Al final de la década de los ochenta y a lo largo de la de los noventa, la búsqueda de nuevas estrategias terapéuticas para el tratamiento de las complicaciones de la hipertensión portal, junto con la evidencia de que en los pacientes con sangrado por varices esofágicas tratados con shunts portosistémicos la natriuresis inducida por diuréticos aumentaba y la ascitis se reducía o incluso desaparecía64, aumentó el interés de los hepatólogos por el TIPS. Numerosos autores empezaron a evaluar su uso en los pacientes cirróticos con ascitis refractaria. Aunque se publicaron muchos estudios con esta finalidad, la mayoría incluía series pequeñas y heterogéneas de pacientes y no contemplaba grupo de tratamiento de control56,57,60,65,66. Sin embargo, debido a su eficacia en el control de la ascitis, el TIPS llegó a ser en los noventa un tratamiento muy utilizado para en manejo de pacientes con ascitis refractaria, aunque no hubiera una sólida evidencia científica de ventajas respecto al tratamiento estándar (paracentesis evacuadoras más expansión del volumen plasmático).
Hoy la información sobre el papel del TIPS en el tratamiento de los pacientes cirróticos con ascitis refractaria se basa fundamentalmente en 4 estudios controlados y aleatorizados, que comparan TIPS y tratamiento con paracentesis terapéuticas (PT) repetidas más expansión plasmática con albúmina57,67-69.
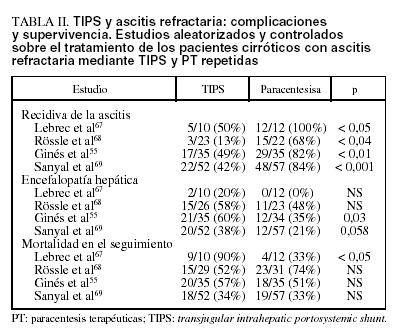
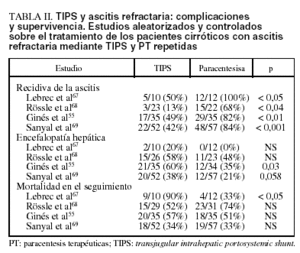
1. En el primer estudio, Lebrec et al67 aleatorizaron una serie de pacientes cirróticos con ascitis refractaria; 10 fueron tratados con TIPS y 12 con PT más albúmina. El TIPS fue más eficaz de las PT en el control de la ascitis, pero sólo en los pacientes con clase B de Child (no en los Child C). Además, a) el efecto favorable en el manejo de la ascitis en los pacientes Child B no se reflejó en una mejor supervivencia a medio-largo plazo, que, aunque sin alcanzar la significación estadística, fue superior en los pacientes tratados con PT, y b) así, en los pacientes en clase C de Child la mortalidad fue más alta en los pacientes tratados con TIPS, con una diferencia entre los 2 grupos estadísticamente significativa. Además, la incidencia de encefalopatía fue superior en los pacientes tratados con TIPS que en los tratados con PT (20% frente al 0%, respectivamente). El principal defecto de este estudio es el escaso número de pacientes tratados, sobre todo de pacientes con clase C de Child (3 en el «grupo TIPS» y 4 en el «grupo PT»), hecho que no permite sacar mayores conclusiones.
2. Sucesivamente, Rössle et al68 aleatorizaron a 60 pacientes con ascitis refractaria (33 pacientes) o recurrente (27 pacientes), tras definir ascitis recurrente como aquella ascitis a tensión que haya recurrido en al menos 3 ocasiones en los últimos 12 meses a pesar de un tratamiento adecuado. Veintinueve pacientes fueron tratados con TIPS y 31 con PT. El TIPS fue superior a las PT en el control de la ascitis. La supervivencia sin trasplante a los 2 años fue mayor en los pacientes tratados con TIPS (58%) que en los tratados con PT (32%); la diferencia, sin embargo, no fue estadísticamente significativa. A diferencia de la mayoría de los demás estudios, la incidencia de encefalopatía fue parecida en los dos grupos (aproximadamente el 50% de los pacientes). Este estudio presenta 3 defectos importantes. Primero, haber incluido no sólo a pacientes con ascitis refractaria, sino también a pacientes con ascitis de difícil manejo (recurrente), lo que implica una diferencia sustancial respecto a los otros estudios publicados. Segundo, la mayor parte de los pacientes tenía una función hepática relativamente preservada (Child B, 18 en el «grupo TIPS» y 24 en el «grupo PT»), cuando la mayoría de los pacientes cirróticos con ascitis refractaria presentan una función hepática muy comprometida (Child C). Tercero, en este estudio no todos los pacientes tratados con PT recibieron regularmente expansión con albúmina; por tanto, el desarrollo de DCPP podría haber afectado negativamente la supervivencia de estos pacientes.
3. Recientemente, Ginés et al55 aleatorizaron 70 a pacientes cirróticos con ascitis refractaria (35 en cada grupo de tratamiento). El TIPS demostró ser más eficaz que la PT en el control de la ascitis, con una menor recidiva y con una menor incidencia de desarrollo de síndrome hepatorrenal en el seguimiento. Sin embargo, la supervivencia sin trasplante a 1 y a 2 años no fue estadísticamente diferente entre los 2 grupos: respectivamente, del 41 y del 26% en los pacientes tratados con TIPS, frente al 35 y al 30% en los tratados con PT. Además, la incidencia de encefalopatía grave fue más alta en el «grupo TIPS» (60% frente al 35% en los pacientes tratados con PT).
4. Finalmente, en el último estudio publicado Sanyal et al69 incluyeron a 109 pacientes con cirrosis y ascitis refractaria (52 con TIPS y 57 con PT). El TIPS fue superior al tratamiento con PT en el control de la ascitis. Sin embargo, no hubo ninguna diferencia significativa ni en la supervivencia sin trasplante (66% frente al 67%) ni en tiempo total de hospitalización durante el seguimiento. Además, la incidencia de encefalopatía fue mayor en los pacientes tratados con TIPS (38%) que en los tratados con PT (21%) (p = 0,058).
La incidencia de obstrucción/estenosis del shunt fue elevada en todos los estudios, entre el 30 y el 45% de los pacientes tratados con TIPS55,67,68.
Además, el gasto médico del tratamiento con TIPS fue más elevado de lo que supone la terapia estándar con paracentesis terapéuticas más albúmina55, y el tratamiento con TIPS no parece asociarse a una mejor calidad de vida de los pacientes respecto a los tratados con PT69.
La tabla II muestra los principales resultados de los 4 estudios aleatorizados y controlados sobre el tratamiento de los pacientes cirróticos con ascitis refractaria mediante TIPS y PT repetidas.
CONCLUSIONES
1. El TIPS es más eficaz que el tratamiento con paracentesis evacuadoras repetidas en el manejo de los pacientes con ascitis refractaria, es decir, en la prevención de la recidiva de la ascitis. Además reduce el riesgo de desarrollo de síndrome hepatorrenal, una de las complicaciones de la cirrosis con peor pronóstico.
2. Se asocia a una elevada incidencia de obstrucción/estenosis del shunt, complicación que requiere frecuentes maniobras invasivas para mantener la prótesis funcionante.
3. Se asocia a una elevada incidencia de encefalopatía hepática.
4. Parece no mejorar la calidad de vida de los pacientes respecto a los tratados con terapia médica estándar.
5. Su gasto es considerablemente más elevado.
6. El tratamiento con TIPS no se asocia a una mejor supervivencia.
Por tanto, hoy parece razonable reservar esta opción terapéutica para los pacientes con función hepática relativamente preservada, estimada por un score de Child-Pugh < 12 (a causa del posible insulto hepático debido a la disminución de la perfusión sanguínea del hígado) y con una buena función cardíaca (con un corazón capaz de enfrentar el aumento de sobrecarga causada por el mayor retorno venoso debido al la acción del shunt)2.
Podemos concluir que las paracentesis evacuadoras repetidas asociadas a expansión con albúmina constituyen hoy el tratamiento de elección de la ascitis refractaria en los pacientes cirróticos. El tratamiento con TIPS debería ser considerado en el caso de pacientes que requieran paracentesis evacuadoras muy frecuentes (más de 3 veces/mes) o en caso de falta de eficacia de las paracentesis repetidas, como sucede en los pacientes con ascitis tabicada por adherencias peritoneales.