En los últimos años ha aumentado el número de pacientes anticoagulados y en consecuencia las complicaciones hemorrágicas derivadas de este tratamiento. Analizamos las hemorragias digestivas (HD) por ser las más frecuentes entre las hemorragias mayores y planteamos que estos sujetos deben presentar lesiones responsables de la HD independientemente de la intensidad de la anticoagulación, si bien aquellos excesivamente anticoagulados presentarán hemorragias más graves.
ObjetivosEstudiar las características de los pacientes anticoagulados con HD y la relación entre el grado de anticoagulación con el hallazgo de lesiones responsables y la gravedad de la hemorragia.
Pacientes y métodosEstudiamos prospectivamente 96 pacientes con HD, anticoagulados con acenocumarol, ingresados consecutivamente entre el 1 de enero de 2003 y el 30 de septiembre de 2005. Se excluyeron aquellos con hepatopatía severa y 9 por faltar datos.
ResultadosLa incidencia de HD fue de 19,6 casos/100.000 habitantes-año. El 90% de los pacientes presentaron lesiones responsables (85% de las HDA y 50% de las HDB) o potencialmente responsables del sangrado y el 30% requirió tratamiento endoscópico de dichas lesiones sin observarse diferencias en función del grado de anticoagulación. Tampoco se encontraron diferencias en el tipo de lesiones, si bien los pacientes excesivamente anticoagulados presentaron hemorragias más graves (un 23% de aquellos con un IRN ≥4 tuvieron hemorragias con compromiso vital frente a un 4% de los pacientes con un INR <4).
ConclusionesObservamos una incidencia 20 HD graves en anticoagulados/100.000 habitantes-año, sin diferencias ni en el tipo, ni en la frecuencia de lesiones responsables en función del grado de anticoagulación. Los pacientes excesivamente anticoagulados presentan HD más graves.
In the last few years, the number of anticoagulated patients has significantly increased and, as a consequence, so have hemorrhagic complications due to this therapy. We analyzed gastrointestinal (GI) bleeding because it is the most frequent type of major bleeding in these patients, and we hypothesized that they would have lesions responsible for GI bleeding regardless of the intensity of anticoagulation, although excessively anticoagulated patients would have more serious hemorrhages.
ObjectivesTo study the characteristics of anticoagulated patients with GI bleeding and the relationship between the degree of anticoagulation and a finding of causative lesions and bleeding severity.
Patients and methodsWe prospectively studied 96 patients, all anticoagulated with acenocoumarol and consecutively admitted to hospital between 01/01/2003 and 09/30/2005 because of acute GI bleeding. We excluded patients with severe liver disease, as well as nine patients with incomplete details.
ResultsThe incidence of GI bleeding requiring hospitalization was 19.6 cases/100,000 inhabitants-year. In 90% of patients, we found a causative (85% of upper GI bleeding and 50% of lower GI bleeding) or potentially causative lesion, and 30% of them required endoscopic treatment, without differences depending on the intensity of anticoagulation. No relationship was found between the type of lesions observed and the degree of anticoagulation in these patients. Patients who received more intense anticoagulation therapy had more severe hemorrhages (23% of patients with an INR ≥4 had a life-threatening bleed versus only 4% of patients with INR <4).
ConclusionsWe found an incidence of 20 severe GI bleeding episodes in anticoagulated patients per 100,000 inhabitants-year, with no difference in localization or in the frequency of causative lesions depending on the intensity of anticoagulation. Patients receiving more intense anticoagulation had more severe GI bleeding episodes.
Los anticoagulantes orales (ACO) son fármacos ampliamente utilizados en la prevención primaria y secundaria de la enfermedad tromboembólica arterial y venosa. El acenocumarol es el anticoagulante más utilizado en Europa continental y Latinoamérica. Aunque es muy eficaz, presenta enormes diferencias en la respuesta de cada individuo a la dosis administrada, que conllevan el riesgo de una respuesta anticoagulante exagerada, y por tanto, un aumento del riesgo hemorrágico. El envejecimiento de la población y las nuevas indicaciones para esta terapia han provocado, en los últimos años, un notable incremento del número de pacientes anticoagulados y, en consecuencia, de las complicaciones, fundamentalmente hemorrágicas, derivadas de la anticoagulación1. Dado que el tubo digestivo es la localización más frecuente de las hemorragias mayores o con compromiso vital que se producen entre los pacientes anticoagulados2, el porcentaje de estos pacientes, entre aquellos hospitalizados por episodios de hemorragia digestiva (HD) aguda, ha ido creciendo de forma estrechamente relacionada con el incremento en las indicaciones para la anticoagulación3, alcanzando tasas superiores al 13% de los ingresos por esta patología4. Este incremento es especialmente llamativo en el caso de las HD bajas, donde, en algunas series, hasta el 25% de los pacientes que precisan una endoscopia urgente por este motivo reciben tratamiento anticoagulante5.
Hasta que los estudios endoscópicos no se generalizaron era frecuente atribuir los episodios de HD de estos pacientes al tratamiento anticoagulante, especialmente si se trataba de pacientes excesivamente anticoagulados, sin embargo, en estudios más recientes se ha visto que si bien en ellos el número de lesiones encontradas en la endoscopia es menor, es peligroso realizar un tratamiento conservador atribuyendo el sangrado únicamente al excesivo alargamiento del international normalized ratio (INR)4,6,7. Al igual que ocurre en otras localizaciones, el riesgo de presentar una HD asociada al tratamiento con ACO está directamente relacionado con la intensidad de anticoagulación que está condicionada por interacciones fármaco-dietéticas, por las características individuales de cada paciente (edad y patología subyacente), por la duración y estabilidad del tratamiento y por factores genéticos8,9. Así, nuestro grupo comunicó que para valores de INR ≥4 el riesgo de HD se incrementa más de 25 veces y que la presencia de determinados polimorfismos genéticos o la toma de algunos fármacos también influyen de manera significativa10.
Por todo esto y a la vista de la creciente proporción de pacientes anticoagulados atendidos en nuestro servicio por presentar episodios hemorrágicos, nos propusimos analizar las características de las HD en estos sujetos. Para ello se planteó la hipótesis de que estos pacientes deberían presentar lesiones con potencial hemorrágico en el tracto gastrointestinal, independientemente de la intensidad de la anticoagulación, si bien aquellos más intensamente anticoagulados, debido al mayor compromiso de los mecanismos hemostáticos, presentarían hemorragias más graves. Así pues, se marcaron 3 objetivos: 1- estudiar las características de los pacientes anticoagulados que presentan HD; 2- valorar la relación entre el grado de anticoagulación y el hallazgo de lesiones responsables de la hemorragia en el tracto gastrointestinal, y 3- estudiar la relación entre el grado de anticoagulación y la gravedad de la hemorragia, independientemente de otros posibles factores «prohemorrágicos».
Pacientes y métodosSe escogió como ámbito de estudio el área de influencia del Hospital de Navarra (Pamplona) al que, tomando como referencia el padrón poblacional de 2005, le corresponde una población de 205.796 habitantes (177.714 si se excluyen los menores de 15 años, que no son atendidos en este centro).
Inicialmente se recogieron de forma prospectiva 96 pacientes de raza blanca, anticoagulados con acenocumarol, atendidos consecutivamente, en el periodo comprendido entre el 1 de enero de 2003 y el 30 de septiembre de 2005, por presentar un episodio de HD aguda (definida por la objetivación de sangrado en forma de hematemesis, melenas, rectorragia o hematoquecia). Se excluyeron del estudio los pacientes previamente diagnosticados de hepatopatía severa (grupoC de la clasificación de Child-Pugh) y 9 por pérdidas de seguimiento (por haber completado el estudio en otro centro o haber rechazado participar en el estudio). Finalmente se incluyeron 87 casos.
En todos los pacientes se anotaron los datos epidemiológicos referentes a la edad y sexo. Mediante anamnesis dirigida y revisando las historias clínicas se recogieron los antecedentes de hemorragia digestiva, los tratamientos concomitantes, el motivo y la duración del tratamiento anticoagulante, la dosis semanal media de acenocumarol (en miligramos) requerida durante el mes previo y nivel de INR en el momento de presentación de la hemorragia. Además se registraron los datos referentes a la presentación clínica del episodio de sangrado: tipo de exteriorización hemorrágica, parámetros hemodinámicos, cifras de hemoglobina y requerimientos transfusionales, complicaciones médicas atribuibles al sangrado y días de ingreso hospitalario. Para valorar la influencia del grado de anticoagulación en la gravedad de las hemorragias y en el tipo de lesiones responsables de las mismas, los pacientes fueron agrupados en 2 categorías en función de que presentasen un INR por debajo o por encima de 4 en el momento de su ingreso. Se escogió este valor porque como se ha señalado previamente, con un INR >4 el riesgo hemorrágico se incrementa de manera muy notable8,10 y porque el único estudio publicado que comparaba los hallazgos endoscópicos en pacientes anticoagulados con hemorragias en función del grado de anticoagulación (Rubin et al.)4 utiliza este mismo valor de corte y esto nos permitiría contrastar los hallazgos.
El estudio fue aprobado por el Comité Ético de Investigación Clínica de Navarra y todos los pacientes incluidos firmaron el correspondiente consentimiento informado.
Protocolo diagnósticoEn los casos en los que se sospechó clínicamente una hemorragia alta (HDA) se realizó una gastroscopia en las primeras 12 horas desde su llegada al hospital. Aquellos pacientes en cuyo estudio inicial no se encontraron lesiones que justificaran el sangrado, se sometieron a una segunda gastroscopia, o a un estudio mediante enteroscopia, colonoscopia o arteriografía cuando fue necesario. Si la sospecha inicial fue una hemorragia baja (HDB) se realizó una colonoscopia. En algunos pacientes, seleccionados en base a su comorbilidad y a la presentación clínica, se realizó como primera exploración una rectosigmoidoscopia y si esta exploración no aclaraba plenamente el origen del sangrado o se sospechaba que podían existir otras lesiones se completaba el estudio con una colonoscopia y cuando fue necesario con una gastroscopia y/o una enteroscopia. Los individuos con hemorragia activa, cuya lesión no se había detectado por endoscopia o cuya situación hemodinámica no permitía la demora para dicha exploración fueron estudiados mediante arteriografía. No se realizaron exploraciones con cápsula endoscópica por no disponer en nuestro centro de esta técnica en el periodo de inclusión de los pacientes.
Con la finalidad de valorar de una forma global el rendimiento de las exploraciones diagnósticas realizadas clasificamos los hallazgos del conjunto de procedimientos en 3 categorías: 1- no lesión, cuando no se halló ninguna anomalía que pudiera ser origen de una hemorragia; 2- lesión potencial, anomalía con riesgo reconocido de producir hemorragias, pero sin evidencia de estigmas de sangrado reciente que permitieran establecer con total seguridad la relación causal entre la lesión y la hemorragia, y 3- lesión responsable, cuando se detectó sangrado activo o estigmas de sangrado reciente.
Y con el propósito de valorar la gravedad de los episodios hemorrágicos, estos se clasificaron siguiendo los criterios de Fihn et al.11 en: 1- hemorragias graves, las HD que presentan exteriorización y las ocultas que requieren estudio endoscópico o radiológico; 2- hemorragias con compromiso vital, aquellas que conducen a una parada cardiorrespiratoria, precisan una intervención quirúrgica o angiográfica, condicionan secuelas irreversibles como un infarto de miocardio o un déficit neurológico, o que reúnen 2 de las siguientes situaciones: trasfusión de 3 o más unidades de hematíes, hipotensión sistólica (<90mmHg) y anemia crítica (hemoglobina ≤6g/dl), y 3- hemorragias fatales las que llevan directamente al fallecimiento del paciente.
Y de acuerdo con los criterios, más recientes, de la Subcomisión para el Control de la Anticoagulación de la Sociedad Internacional de Trombosis y Hemostasia (ISTH)8 en: 1- hemorragias mayores, aquellas que implican el fallecimiento y/o afectan de manera sintomática a un área u órgano críticos y/o implican la pérdida de ≥2g/dl de hemoglobina o precisan la trasfusión de 2 o más unidades de hematíes, y 2- hemorragias menores, el resto.
Análisis estadísticoLas distintas variables fueron registradas en una base de datos que se confeccionó utilizando el programa Microsoft Office Access 2003 (Seattle, EE. UU.). Los análisis estadísticos se realizaron mediante el software IBM SPSS Statistics 18 (Chicago, EE. UU.). Se realizaron comparaciones bilaterales considerando estadísticamente significativa una p <0,05. Si las variables eran continuas y seguían una distribución normal se utilizó el test de la t de Student, si no seguían una distribución normal empleamos el test de la U de Mann-Whitney; en el caso de las variables categóricas utilizamos la Chi cuadrado o el test exacto de Fisher si el número de pacientes incluidos en alguna categoría era demasiado pequeño.
ResultadosLa incidencia de pacientes anticoagulados con hemorragias digestivas que requirieron hospitalización en nuestro medio fue de 19,6 casos por 100.000 habitantes y año.
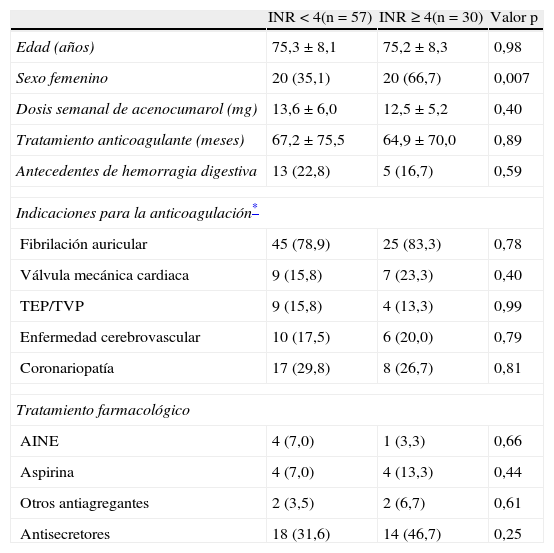
Características de los pacientesEn la tabla 1 se muestran las principales características de los pacientes en función del grado de anticoagulación en el momento de presentación de la HD. Como puede verse no se encontraron diferencias en ninguna de las variables analizadas, salvo en el sexo observándose un mayor riesgo de anticoagulación excesiva en las mujeres, con una odds ratio (OR) de 3,7 (IC 95% 1,4-9,4).
Características de los pacientes según el grado de anticoagulación
| INR <4(n=57) | INR ≥4(n=30) | Valor p | |
| Edad (años) | 75,3±8,1 | 75,2±8,3 | 0,98 |
| Sexo femenino | 20 (35,1) | 20 (66,7) | 0,007 |
| Dosis semanal de acenocumarol (mg) | 13,6±6,0 | 12,5±5,2 | 0,40 |
| Tratamiento anticoagulante (meses) | 67,2±75,5 | 64,9±70,0 | 0,89 |
| Antecedentes de hemorragia digestiva | 13 (22,8) | 5 (16,7) | 0,59 |
| Indicaciones para la anticoagulación* | |||
| Fibrilación auricular | 45 (78,9) | 25 (83,3) | 0,78 |
| Válvula mecánica cardiaca | 9 (15,8) | 7 (23,3) | 0,40 |
| TEP/TVP | 9 (15,8) | 4 (13,3) | 0,99 |
| Enfermedad cerebrovascular | 10 (17,5) | 6 (20,0) | 0,79 |
| Coronariopatía | 17 (29,8) | 8 (26,7) | 0,81 |
| Tratamiento farmacológico | |||
| AINE | 4 (7,0) | 1 (3,3) | 0,66 |
| Aspirina | 4 (7,0) | 4 (13,3) | 0,44 |
| Otros antiagregantes | 2 (3,5) | 2 (6,7) | 0,61 |
| Antisecretores | 18 (31,6) | 14 (46,7) | 0,25 |
Los valores en la tabla se expresan como media±desviación estándar o como valor absoluto (porcentaje).
AINE: antinflamatorios no esteroideos; INR: international normalized ratio; TEP/TVP: tromboembolismo pulmonar/trombosis venosa profunda.
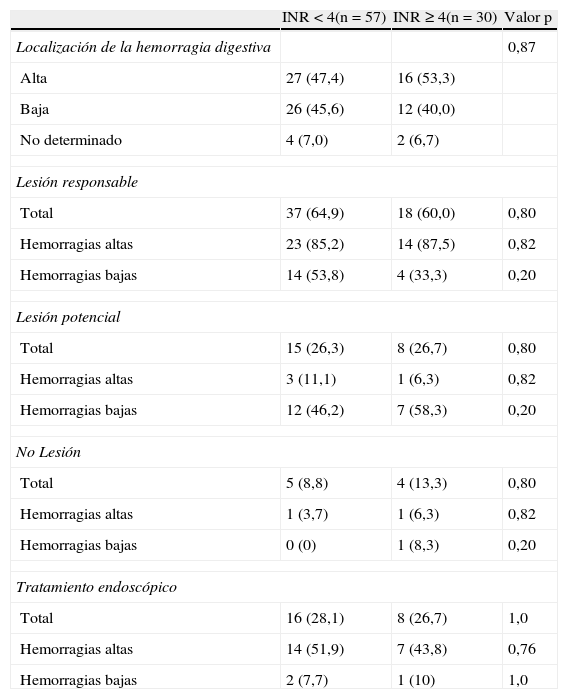
Todos los pacientes fueron estudiados mediante, al menos, una técnica endoscópica, salvo 2, con HDB, que fueron diagnosticados por arteriografía y no la precisaron. Aunque el grupo de pacientes con INR ≥4 precisó un mayor número de exploraciones endoscópicas para alcanzar el diagnóstico (el 46% precisó 2 o más endoscopias y el 22% un estudio endoscópico alto y bajo frente al 35% y el 10% respectivamente de los pacientes con INR <4), las diferencias no fueron estadísticamente significativas. Tampoco hubo diferencias en el tiempo transcurrido hasta la realización de la primera exploración endoscópica en función del grado de anticoagulación.
La localización de las HD fue alta en 43 casos (49%) y baja en 38 (44%). En 6 (7%) pacientes no se pudo determinar el lugar del sangrado. En más del 60% de los casos se determinó con seguridad la lesión responsable de la HD y aproximadamente un 30% requirió tratamiento endoscópico para el control de la HD, sin observarse diferencias en función del grado de anticoagulación (tabla 2).
Influencia del INR en la localización de la hemorragia y en los hallazgos diagnósticos
| INR <4(n=57) | INR ≥4(n=30) | Valor p | |
| Localización de la hemorragia digestiva | 0,87 | ||
| Alta | 27 (47,4) | 16 (53,3) | |
| Baja | 26 (45,6) | 12 (40,0) | |
| No determinado | 4 (7,0) | 2 (6,7) | |
| Lesión responsable | |||
| Total | 37 (64,9) | 18 (60,0) | 0,80 |
| Hemorragias altas | 23 (85,2) | 14 (87,5) | 0,82 |
| Hemorragias bajas | 14 (53,8) | 4 (33,3) | 0,20 |
| Lesión potencial | |||
| Total | 15 (26,3) | 8 (26,7) | 0,80 |
| Hemorragias altas | 3 (11,1) | 1 (6,3) | 0,82 |
| Hemorragias bajas | 12 (46,2) | 7 (58,3) | 0,20 |
| No Lesión | |||
| Total | 5 (8,8) | 4 (13,3) | 0,80 |
| Hemorragias altas | 1 (3,7) | 1 (6,3) | 0,82 |
| Hemorragias bajas | 0 (0) | 1 (8,3) | 0,20 |
| Tratamiento endoscópico | |||
| Total | 16 (28,1) | 8 (26,7) | 1,0 |
| Hemorragias altas | 14 (51,9) | 7 (43,8) | 0,76 |
| Hemorragias bajas | 2 (7,7) | 1 (10) | 1,0 |
Los valores en la tabla se expresan como valor absoluto (porcentaje).
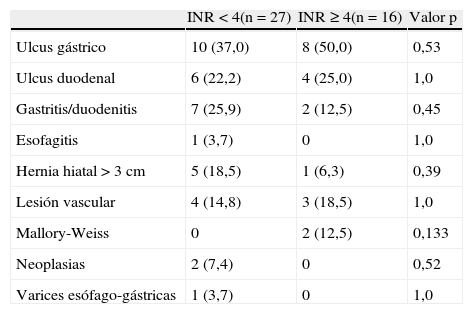
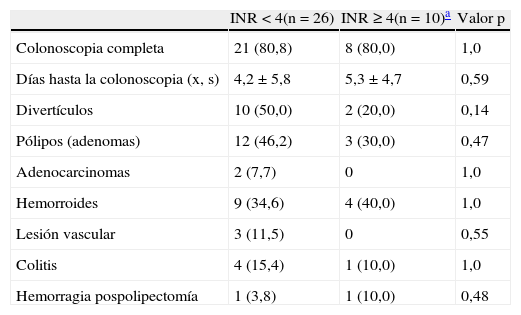
Cuando analizamos por separado los hallazgos endoscópicos y la necesidad de tratamiento endoscópico en función de la localización alta o baja de las HD tampoco encontramos diferencias en función del grado de anticoagulación. En las HDA se identificó la lesión responsable en más del 85% de los casos, siendo las úlceras los hallazgos más frecuentes y prácticamente la mitad de los pacientes precisaron tratamiento endoscópico para controlar el sangrado (tablas 2 y 3). Sin embargo, solo en el 50% de las HDB se halló la lesión responsable, siendo los pólipos, los divertículos y las hemorroides las lesiones más frecuentemente diagnosticadas y menos del 10% de los pacientes precisaron tratamiento durante la endoscopia (tablas 2 y 4).
Hallazgos endoscópicos* en las HDA en función del INR
| INR <4(n=27) | INR ≥4(n=16) | Valor p | |
| Ulcus gástrico | 10 (37,0) | 8 (50,0) | 0,53 |
| Ulcus duodenal | 6 (22,2) | 4 (25,0) | 1,0 |
| Gastritis/duodenitis | 7 (25,9) | 2 (12,5) | 0,45 |
| Esofagitis | 1 (3,7) | 0 | 1,0 |
| Hernia hiatal >3 cm | 5 (18,5) | 1 (6,3) | 0,39 |
| Lesión vascular | 4 (14,8) | 3 (18,5) | 1,0 |
| Mallory-Weiss | 0 | 2 (12,5) | 0,133 |
| Neoplasias | 2 (7,4) | 0 | 0,52 |
| Varices esófago-gástricas | 1 (3,7) | 0 | 1,0 |
Los valores en la tabla se expresan como valor absoluto (porcentaje).
Hallazgos endoscópicos* en las HDB en función del INR
| INR <4(n=26) | INR ≥4(n=10)a | Valor p | |
| Colonoscopia completa | 21 (80,8) | 8 (80,0) | 1,0 |
| Días hasta la colonoscopia (x, s) | 4,2±5,8 | 5,3±4,7 | 0,59 |
| Divertículos | 10 (50,0) | 2 (20,0) | 0,14 |
| Pólipos (adenomas) | 12 (46,2) | 3 (30,0) | 0,47 |
| Adenocarcinomas | 2 (7,7) | 0 | 1,0 |
| Hemorroides | 9 (34,6) | 4 (40,0) | 1,0 |
| Lesión vascular | 3 (11,5) | 0 | 0,55 |
| Colitis | 4 (15,4) | 1 (10,0) | 1,0 |
| Hemorragia pospolipectomía | 1 (3,8) | 1 (10,0) | 0,48 |
Los valores en la tabla se expresan como valor absoluto (porcentaje).
Siguiendo los criterios de Fihn et al.11, todos los pacientes incluidos en el estudio presentaron hemorragias graves, 11 (12,6%) una hemorragia con compromiso vital y 2 (2,3%) una hemorragia fatal.
De acuerdo con los criterios, más recientes, de la subcomisión para el control de la anticoagulación de la ISTH8, 56 pacientes (64,3%) presentaron hemorragias mayores por implicar el fallecimiento o precisar la trasfusión de 2 o más unidades de hematíes.
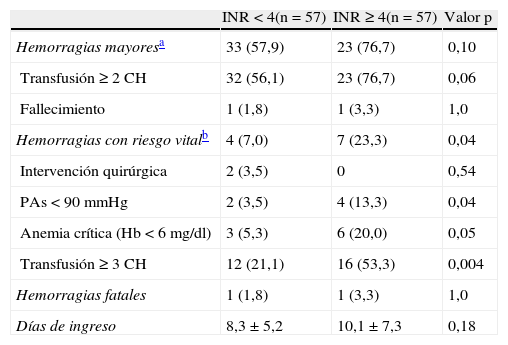
Tras analizar los parámetros hemodinámicos en el momento de presentación de la hemorragia, los requerimientos transfusionales y las complicaciones derivadas del episodio de sangrado encontramos que los pacientes con un mayor grado de anticoagulación presentaron hemorragias más graves (tabla 5). Se observó un porcentaje superior de hemorragias mayores, aunque la diferencia no alcanzó significación estadística y una diferencia estadísticamente significativa en el número de hemorragias con riesgo vital, más elevado entre los pacientes más intensamente anticoagulados. Sin embargo, no se observaron diferencias en la duración del ingreso hospitalario.
Influencia del INR en la gravedad de los episodios
| INR <4(n=57) | INR ≥4(n=57) | Valor p | |
| Hemorragias mayoresa | 33 (57,9) | 23 (76,7) | 0,10 |
| Transfusión ≥2 CH | 32 (56,1) | 23 (76,7) | 0,06 |
| Fallecimiento | 1 (1,8) | 1 (3,3) | 1,0 |
| Hemorragias con riesgo vitalb | 4 (7,0) | 7 (23,3) | 0,04 |
| Intervención quirúrgica | 2 (3,5) | 0 | 0,54 |
| PAs <90mmHg | 2 (3,5) | 4 (13,3) | 0,04 |
| Anemia crítica (Hb <6mg/dl) | 3 (5,3) | 6 (20,0) | 0,05 |
| Transfusión ≥3 CH | 12 (21,1) | 16 (53,3) | 0,004 |
| Hemorragias fatales | 1 (1,8) | 1 (3,3) | 1,0 |
| Días de ingreso | 8,3±5,2 | 10,1±7,3 | 0,18 |
Los valores en la tabla se expresan como valor absoluto (porcentaje).
CH: concentrado de hematíes; Hb: hemoglobina; PAs: presión arterial sistólica.
En la última década se ha producido un cambio progresivo en el panorama general de las HD, con una tendencia claramente decreciente en la incidencia de HDA y un aumento significativo de las HDB que ha hecho que sus tasas de incidencia tiendan a converger12,13. El envejecimiento de la población, con la consiguiente comorbilidad asociada, junto con un incremento en el consumo de antiinflamatorios, antiagregantes y anticoagulantes, son los factores que, sin duda, han contribuido a mantener elevadas las cifras de incidencia y mortalidad en relación a las HD.
En los pacientes anticoagulados las hemorragias constituyen la principal complicación del tratamiento y el territorio en el que con más frecuencia se producen hemorragias graves es el tracto gastrointestinal2,11. En nuestro estudio encontramos una incidencia de HD graves, en pacientes anticoagulados, de 20 casos por 100.000 habitantes y año, de las que prácticamente la mitad fueron HDA y la otra mitad HDB. Estos datos, teniendo en cuenta la incidencia de HD en nuestro medio, durante el periodo de estudio, publicadas por Lanas et al.13, permiten estimar que en torno a un 20% de los casos de HDA y un 30% de las HDB se producen en pacientes anticoagulados. Así pues, dado que la anticoagulación está presente en una proporción muy importante de los pacientes que presentan HD, consideramos que queda plenamente justificado un estudio que analice las características de las hemorragias en estos pacientes.
Hasta el momento diversos trabajos han valorado las lesiones gastrointestinales que presentan los pacientes anticoagulados con HD. Sin embargo, la mayoría de estos trabajos corresponden a estudios retrospectivos, se realizaron en grupos seleccionados de pacientes y/o en periodos de tiempo en los que los estudios endoscópicos o no estaban generalizados o no se realizaban a los pacientes excesivamente anticoagulados5,6,14. Aun así y pese a que los estudios diagnósticos en los pacientes sobreanticoagulados se consideraban menos rentables, ya en la década de los 90 había autores que encontraban peligroso adoptar una actitud conservadora y atribuir la HD al exceso de anticoagulación7. Los resultados de publicaciones más recientes apoyan esta idea de que los pacientes anticoagulados con HD deben presentar lesiones responsables en el tracto gastrointestinal, si bien únicamente en el trabajo de Rubin et al.4 se analiza la frecuencia de lesiones diagnosticadas en función de la intensidad de la anticoagulación4,15.
Nosotros analizamos las características de las HD en función del grado de anticoagulación en el momento de su presentación sin encontrar diferencias en la localización de las mismas (27 altas vs. 26 bajas si el INR era menor de 4 y 16 altas vs. 12 bajas si el INR era mayor o igual a 4). Independientemente del grado de anticoagulación, en más del 60% de nuestros pacientes se encontró la lesión responsable de la hemorragia después de un estudio endoscópico adecuado, y este porcentaje se elevaba hasta el 90% si se incluían las lesiones potencialmente responsables del sangrado. En 6 pacientes no pudo determinarse la localización del sangrado, y en otros 3, pese a que los datos permitían establecer el origen alto o bajo de la HD no se encontró ninguna lesión con potencial hemorrágico. Esto supone un porcentaje (10%) prácticamente igual al descrito en las HD de la población general, que sitúa a la hemorragia de origen oscuro entre el 5-8% del total16. No obstante, debemos señalar que si hubiésemos podido realizar a estos pacientes un estudio con cápsula endoscópica para la valoración del intestino delgado, lugar de localización del 75% de las hemorragias de origen oscuro, muy probablemente esta cifra habría sido menor. Sin embargo, esta técnica no estaba disponible en nuestro centro en el período de inclusión de los pacientes.
No se encontraron diferencias significativas ni en el tipo de lesiones, ni en la necesidad de tratamiento endoscópico entre los pacientes con INR < o ≥ de 4. Estos hallazgos, en la línea de los comunicados por Rubin et al.4, confirman nuestra hipótesis, que planteaba que deben existir lesiones con potencial hemorrágico en el tracto gastrointestinal de los pacientes anticoagulados con HD, independientemente del grado de anticoagulación. La importancia del estudio endoscópico en estos pacientes no radica exclusivamente en el hecho de realizar un diagnóstico etiológico de la HD, ya que un porcentaje importante de estos pacientes, en nuestro estudio casi un 30%, se beneficia en la misma exploración de un >tratamiento endoscópico de la lesión responsable. Así, es importante señalar que en el caso de las HDA la lesión responsable se identificó en más del 85% de los casos y a prácticamente la mitad de estos pacientes se les pudo realizar un tratamiento endoscópico. En el caso de las HDB, solo se halló la lesión responsable en la mitad de los pacientes, precisando menos del 10% de ellos tratamiento durante la endoscopia. Sin duda la mayor demora que existió en la realización de las colonoscopias respecto a las gastroscopias y el hecho de que las HDB sean en muchas ocasiones autolimitadas explica en parte esta diferencia. Estos datos apoyan la necesidad de realizar un estudio endoscópico temprano en los pacientes anticoagulados con HD independientemente del tipo de presentación de la misma y que, al igual que se recomienda en las HDA17, probablemente también en el caso de las HDB la corrección de los trastornos de la coagulación, al menos en las hemorragias graves, no debe retrasar la endoscopia de urgencia18. Conocer el estado de la lesión que ha ocasionado la hemorragia y una resolución rápida del episodio hemorrágico, nos va a permitir reinstaurar el tratamiento anticoagulante en el plazo más breve posible, evitando de esta forma el riesgo de complicaciones tromboembólicas al que se ven sometidos los pacientes que precisan una suspensión temporal del tratamiento19–21.
Al analizar la gravedad de los episodios, en primer lugar, debemos señalar que todas las HD tuvieron una gran relevancia clínica por implicar ingresos hospitalarios y/o la realización de exploraciones complementarias costosas. Además 11 (12,6%) pacientes presentaron una hemorragia con compromiso vital y 2 (2,3%) fallecieron como consecuencia de la misma o sus complicaciones. Como ya se ha señalado la intensidad de la anticoagulación es determinante a la hora de establecer el riesgo de HD de los pacientes anticoagulados10, pero ninguno de los trabajos publicados hasta el momento había analizado la influencia del grado de anticoagulación en la gravedad de las hemorragias. Tan solo en el estudio de Rubin et al.4 se analizaba la evolución clínica de los pacientes en función del INR sin hallar diferencias significativas. En nuestro estudio se constata, como se había postulado teniendo en cuenta el mayor compromiso de los mecanismos hemostáticos en los pacientes más intensamente anticoagulados, que aquellos individuos con un INR mayor de 4 presentaban hemorragias más graves que los pacientes con valores de INR menores de 4. No se encontraron diferencias en la mortalidad entre ambos grupos, sin embargo al ser esta una complicación poco frecuente (solo hubo 2 fallecidos) el tamaño muestral no permite extraer conclusiones al respecto. Tampoco hubo diferencias en la estancia hospitalaria, que si bien fue prolongada, no difería de la estancia media de los pacientes no anticoagulados con HD en ese periodo de tiempo.
Actualmente asistimos a la introducción de nuevos ACO (los inhibidores del factor Xa [rivaroxaban y apixaban] y el inhibidor directo de la trombina [dabigatran etexilato]) en la prevención de la enfermedad tromboembólica. Con estos nuevos fármacos se pretenden evitar los inconvenientes de los ACO clásicos, antagonistas de la vitamina K (warfarina, acenocumarol, phemprocumon) como son las interacciones farmacológicas, la farmacocinética variable y especialmente la necesidad de una monitorización frecuente. Los estudios publicados hasta el momento muestran una disminución de los episodios de hemorragias mayores e intracraneales en los pacientes tratados con estos nuevos anticoagulantes frente a los tratados con warfarina, sin embargo no encuentran diferencias significativas en la incidencia de hemorragias digestivas, que incluso en un reciente metaanálisis parecen más frecuentes con estos fármacos22,23. Además es importante señalar que los estudios utilizan la warfarina como fármaco de referencia con el que contrastar los nuevos ACO y sería interesante poder compararlos frente al acenocumarol que es el ACO utilizado mayoritariamente en nuestro medio (por el momento no hay estudios que comparen estos fármacos).
Actualmente el acenocumarol sigue siendo el anticoagulante utilizado de manera más generalizada en nuestro entorno y aunque progresivamente son más los pacientes tratados con los nuevos ACO, será necesario un tiempo hasta que su utilización esté más extendida para poder evaluar sus implicaciones en las HD en la práctica clínica habitual. No debemos olvidar que las principales desventajas de estos nuevos fármacos radican en la dificultad para su monitorización (las pruebas rutinarias de coagulación no reflejan los niveles circulantes) y para la reversión de su efecto en caso necesidad, como es el caso de las hemorragias. Hasta entonces creemos que los estudios relativos al acenocumarol siguen estando plenamente vigentes.
Como se ha expuesto previamente 2 limitaciones de este estudio son por un lado el intervalo de tiempo transcurrido hasta la realización de algunas de las colonoscopias que pudo condicionar el rendimiento diagnóstico de estas exploraciones y por otro lado la imposibilidad de realizar estudios con cápsula endoscópica a los pacientes (exploración que por otro lado solo se recomienda en pacientes sin comorbilidad grave en los que las medidas diagnósticas y de tratamiento adicionales puedan tener un impacto significativo en la supervivencia)18. Solamente un 10% de los pacientes quedó sin diagnóstico de al menos una lesión potencial tras el estudio endoscópico realizado y por ello consideramos que los datos obtenidos de un estudio endoscópico temprano y más completo no harían sino apoyar nuestras conclusiones, ya que con probabilidad hubieran permitido identificar lesiones responsables en un mayor número de pacientes.
Conclusiones- •
En nuestro medio se observa una incidencia de HD graves, en pacientes anticoagulados, de 20 casos por 100.000 habitantes y año.
- •
No se encontraron diferencias significativas ni en el tipo, ni en la frecuencia de lesiones responsables de la HD en función del grado de anticoagulación.
- •
El 90% de los pacientes presentaron lesiones responsables o potencialmente responsables del sangrado y un 30% requirió tratamiento endoscópico de dichas lesiones.
- •
Se confirma que los pacientes más intensamente anticoagulados presentan HD más graves.
- •
A la vista de nuestros resultados, consideramos que todo paciente anticoagulado con HD debe ser sometido a un estudio endoscópico en el plazo más breve posible, con independencia del valor de INR en el momento de presentación de la HD.
Los autores declaran no tener ningún conflicto de intereses.