La infección por el virus de la hepatitis C (VHC) es frecuente, con una incidencia del 2-3% en nuestro medio, con una prevalencia estimada en nuestro país de 390.000 infectados1. Puede manifestarse como una hepatitis aguda o más frecuentemente como una hepatitis crónica clínicamente asintomática, pudiendo evolucionar con el transcurso de los años a una cirrosis hepática e incluso un hepatocarcinoma. Durante más de una década el tratamiento de la hepatitis crónica C se ha basado en el uso combinado de interferón pegilado alfa 2a o 2b y ribavirina, obteniéndose una respuesta virológica sostenida en torno al 40-50% en los pacientes infectados por el genotipo 1. En el año 2011 fueron aprobados 2 nuevos antivirales de acción directa (telaprevir y boceprevir), que han logrado una tasa de curación de los enfermos infectados por este genotipo por encima del 70%2. Telaprevir (Incivo®) es un inhibidor de la proteasa NS3/4, una de cuyas principales limitaciones es su toxicidad cutánea. Presentamos una serie de casos de afectación cutánea con el uso de telaprevir y su manejo terapéutico.
Recopilamos un total de 5 casos, 2 mujeres de 58 años y 46 años de edad y 3 hombres de 51, 55 y 48 años respectivamente. Todos los casos fueron diagnosticados de infección crónica por VHC, genotipo 1, sin otros antecedentes personales de interés. Habían realizado previamente tratamiento con interferón pegilado y ribavirina presentando una respuesta virológica al final del tratamiento con recaída posterior, sin reacciones adversas cutáneas. Se decidió comenzar triple terapia añadiendo a los fármacos anteriores telaprevir, alcanzándose una carga viral indetectable en las 4 primeras semanas de tratamiento en todos ellos.
Los pacientes acudieron a la consulta de dermatología entre la semana 3 y 4 de tratamiento por la aparición de lesiones cutáneas pruriginosas, de escasos días de evolución, no evanescentes, sin sintomatología general asociada.
Caso 1En la exploración física la paciente presentaba un exantema urticariforme y de morfología anular que afectaba en torno al 30% de la superficie corporal, localizándose en tercio proximal de las extremidades inferiores (fig. 1). Las lesiones desaparecían a la vitropresión y no tenía afectación de mucosas.
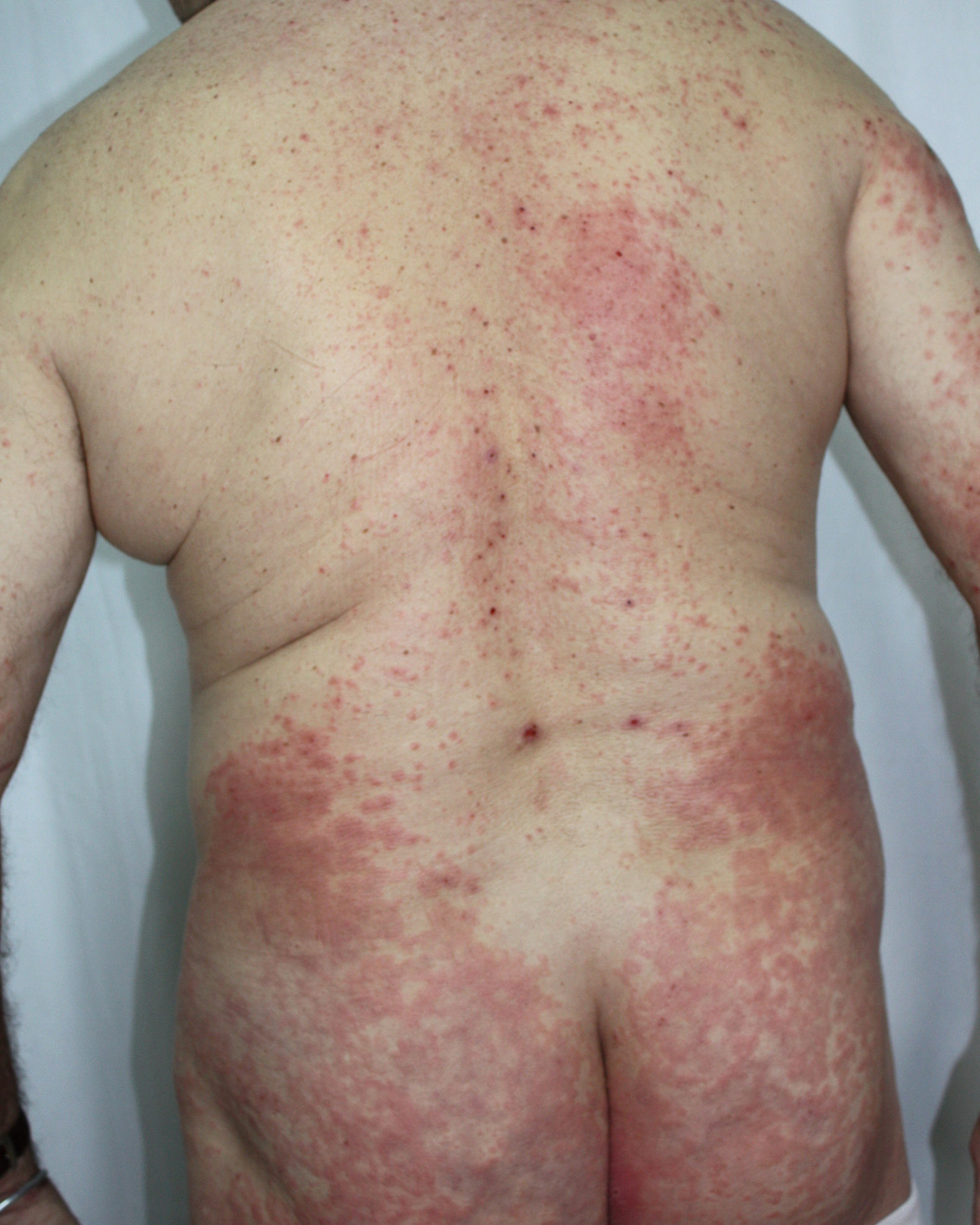
Caso 2El paciente presentaba un exantema maculoso, de límites netos y superficie eritemato-violácea, con maniobra de diascopia negativa. Las lesiones se extendían centrífugamente en la espalda y la zona glútea con signos de rascado evidentes (fig. 2).
Caso 3Se observaba un exantema máculo-papuloso, mal delimitado que afectaba únicamente a la región centrotorácica, con erosiones superficiales, cubiertas por una costra melicérica, signo de sobreinfección (fig. 3).
Caso 4Presentaba lesiones eritematosas, de características similares al caso 1. Se trataba de un exantema maculoso mal delimitado, de predominio en el tronco y confluente en algunas zonas formando placas, de 4 días de evolución, no evanescente y con aclaramiento central a la vitropresión. La afectación no sobrepasaba el 50% de la superficie corporal y tampoco existía afectación de mucosas (fig. 4).
En estos pacientes, dada la clínica, extensión de las lesiones y su evolución, se pautó en todos los casos tratamiento tópico con betametasona 17-valerato, añadiendo ácido fusídico tópico en el caso 3, sin retirada de telaprevir. Se realizaron controles periódicos semanales hasta la finalización del tratamiento. Durante la evolución las lesiones no progresaron y remitieron variablemente en los 4 pacientes entre las semanas 2-4 tras la finalización de telaprevir.
Caso 5Nuestro último caso es el de una paciente mujer de 46 años, que acudió a consulta en la semana 6 de tratamiento por la aparición de lesiones eritemato-edematosas, muy pruriginosas de predominio en el tronco (fig. 5A); sin embargo, a pesar del tratamiento tópico las lesiones progresaron con aparición de un exantema máculo-papuloso generalizado que afectaba prácticamente a toda la superficie corporal, con lesiones en los miembros inferiores anulares y de morfología dianiforme, con signos importantes de excoriación y sobreinfección (fig. 5B). Debido a ello telaprevir se suspendió en la semana 7 de tratamiento, con mejoría progresiva de las lesiones en las semanas sucesivas.
Telaprevir es un inhibidor de la NS3/4A proteasa, aprobado por la Food and Drug Administration (FDA) y la Agencia Europea del Medicamento (EMEA) para el tratamiento de pacientes con hepatitis crónica C infectados por el genotipo 1 en el año 2011. Con este fármaco se ha conseguido alcanzar una tasa de respuesta virológica sostenida en torno al 75% en pacientes naïve3, del 85-90% en pacientes recaedores, del 55-65% en respondedores parciales y del 25-35% en respondedores nulos4–7. La pauta recomendada de tratamiento incluye 12 semanas con triple terapia (telaprevir, interferón pegilado y ribavirina) seguidas de 12 a 36 semanas más de interferón y ribavirina en función del tipo de paciente.
Los efectos secundarios que se producen con mayor frecuencia en pacientes en triple terapia con telaprevir frente a la doble terapia incluyen prurito, exantema, anemia y trastornos gastrointestinales (síntomas anorrectales, náuseas y diarrea)8. Las reacciones cutáneas asociadas con el empleo de telaprevir suponen una de las limitaciones más importantes de este tratamiento. En los estudios fase ii y iii, controlados con placebo, la incidencia de reacciones cutáneas durante el periodo de tratamiento de 12 semanas con telaprevir fue del 56%, en comparación con el 34% observado en los pacientes tratados con placebo y peginterferón alfa/ribavirina9, produciéndose en estos pacientes reacciones locales en el sitio de inyección y exantemas máculo-papulosos pruriginosos localizados en el tronco y las extremidades, en general bien tolerados y con escasa probabilidad de progresión a cuadros más graves3. En una serie de 52 pacientes tratados en nuestro centro el 71% presentó reacciones cutáneas, que en el 20% de los casos afectaban a más del 50% de la superficie cutánea. El tratamiento hubo de ser suspendido en el 3,8% de los enfermos por este motivo10.
El manejo y tratamiento de los efectos secundarios cutáneos por telaprevir se establece teniendo en cuenta la severidad de las lesiones, la presencia de síntomas sistémicos y anomalías analíticas11. El grado i o leve se define como una erupción cutánea localizada o limitada, sin signos sistémicos ni afectación mucosa. El grado ii, o moderado, es aquel que afecta como máximo al 50% de la superficie corporal, sin despegamiento epidérmico. Puede haber inflamación de las mucosas, sin úlceras y síntomas sistémicos como fiebre, artralgias o eosinofilia. El grado iii, o intenso, es aquel que presenta lesiones cutáneas que afectan a más del 50% de la superficie corporal, o en menor porcentaje si presenta alguna de las siguientes características: presencia de vesículas o ampollas, úlceras en mucosas, desprendimiento epidérmico, lesiones en escarapela, púrpura palpable o eritema que no blanquea a la vitropresión. Por último, el grado iv o potencialmente mortal se produce si la clínica es de pustulosis exantemática aguda generalizada, síndrome de hipersensibilidad retardada a fármacos (DRESS), necrólisis epidérmica tóxica o síndrome de Stevens-Johnson3,12.
En la mayoría de los estudios el 80-90% de estas reacciones fueron grado i o ii, caracterizadas por lesiones de tipo eccematoso, pruriginosas, que afectaban a menos del 30% de la superficie corporal, ocurriendo la mayoría de ellas durante las primeras 4 semanas del tratamiento. Solo en un pequeño porcentaje de los pacientes tratados con telaprevir se produjeron reacciones cutáneas graves, grado iii o iv12. No es necesaria la interrupción del fármaco por reacciones grado i-ii, pero sí su control periódico hasta la resolución completa del cuadro, por la posible progresión a reacción cutánea grave9.
Solo en caso de reacciones grado iii-iv se debe suspender telaprevir, interrumpiendo secuencialmente ribavirina e interferón en el caso de no mejoría en los siguientes 7 días. En ningún caso debe reintroducirse posteriormente telaprevir por la posibilidad de recurrencia (y probablemente con mayor severidad13) de la reacción cutánea y por el elevado riesgo de aparición de resistencias al fármaco. Tampoco se recomienda el empleo de boceprevir en aquellos pacientes que ya han sido tratados con telaprevir por la existencia de resistencias cruzadas.
Las lesiones cutáneas se deben intentar tratar con corticoides tópicos, ya que el empleo de corticoides sistémicos puede producir pérdida de eficacia de telaprevir y modificar sus niveles séricos por la interactuación de ambos a través de la vía CYP3A4 y glucoproteína-P20, motivo por el cual otros fármacos como astemizol y terfenadina están contraindicados con telaprevir14. Probablemente la excreción fecal tras su metabolización hepática es la causante de síntomas anorrectales como prurito.
En definitiva, la aparición de reacciones cutáneas es muy frecuente en los pacientes tratados con triple terapia con telaprevir, siendo imprescindible la existencia de una buena comunicación entre los servicios de gastroenterología y/o hepatología y dermatología que permita la detección y tratamiento precoz de los efectos cutáneos potencialmente graves y evite la suspensión del tratamiento en aquellos enfermos con reacciones más leves.