INTRODUCCIÓN
La utilización de modelos animales de hipertensión portal es de enorme utilidad en el estudio de la fisiopatología de la hipertensión portal. Estos modelos permiten, por una parte, el estudio detallado de cuestiones surgidas de la práctica clínica habitual, y a las que es difícil dar respuesta mediante estudios en humanos. Por ejemplo, el concepto de que la hipertensión portal no sólo es consecuencia de un aumento de resistencia al flujo portal, sino que también existe un hiperaflujo portal que contribuye a mantener y agravar la hipertensión portal no pudo ser demostrado definitivamente hasta que se desarrolló la metodología adecuada para realizar estudios hemodinámicos detallados en animales de experimentación1,2. Por otra parte, los modelos animales permiten estudiar en detalle los mecanismos moleculares implicados en las alteraciones de la circulación esplácnica y sistémica asociadas a este síndrome3. Esto permite el desarrollo y la validación de dianas terapéuticas que, posteriormente, pueden ser ensayadas en pacientes con hipertensión portal. Este trabajo pretende resumir los modelos disponibles para el estudio de la hipertensión portal y su utilidad relativa para el abordaje desde diferentes enfoques.
A la hora de elegir un modelo animal para el estudio de la hipertensión portal se deben tener en cuenta diferentes factores. Unos son de índole general, aplicables a cualquier modelo animal, y se resumen en la tabla I4. Otros dependerán del trastorno específico de la fisiopatología de la hipertensión portal que se quiera estudiar, ya que no todos los modelos de hipertensión portal expresan, de forma completa, todas las
alteraciones características del síndrome de hipertensión portal. El primer paso es la elección de la especie animal. Las especies más utilizadas han sido la rata y el conejo. Más recientemente, y a pesar de las dificultades para la instrumentación que entraña su pequeño tamaño, la metodología utilizada en los estudios hemodinámicos en rata y conejo ha podido ser adaptada al ratón5-7. Esto ha aumentado enormemente las posibilidades de investigación en este campo por la disponibilidad de ratones knock out y transgénicos. El uso de animales de gran tamaño, como el perro o el cerdo, ofrece la ventaja del mayor tamaño y, por lo tanto, mayor facilidad para la instrumentación y para la disección de estructuras vasculares. Aunque existen estudios antiguos en los que se han utilizado estas especies8, en la práctica su uso se ha abandonado principalmente por su alto coste. La presente revisión se centrará en los modelos de hipertensión portal más utilizados en la actualidad.
MODELOS DE HIPERTENSIÓN PORTAL
Como en cualquier sistema hidrodinámico, la presión portal se determina por la interrelación entre el flujo sanguíneo portal y la resistencia que se opone a éste. De acuerdo con la ley de Ohm, el gradiente de presión entre 2 puntos (P1-P2) en un vaso sanguíneo queda definido por la ecuación:
(P1 P2) = Q ¥ R
en la que, aplicada al sistema portal, P1 P2 sería el gradiente de perfusión hepática o gradiente de presión portal (la diferencia entre la presión portal y la presión de la vena cava inferior), Q el flujo sanguíneo portal y R la resistencia vascular del sistema venoso portal. De esto se desprende que los 2 mecanismos básicos por los que puede aumentar la presión portal son el aumento del flujo sanguíneo y el aumento de las resistencias vasculares hepáticas9.
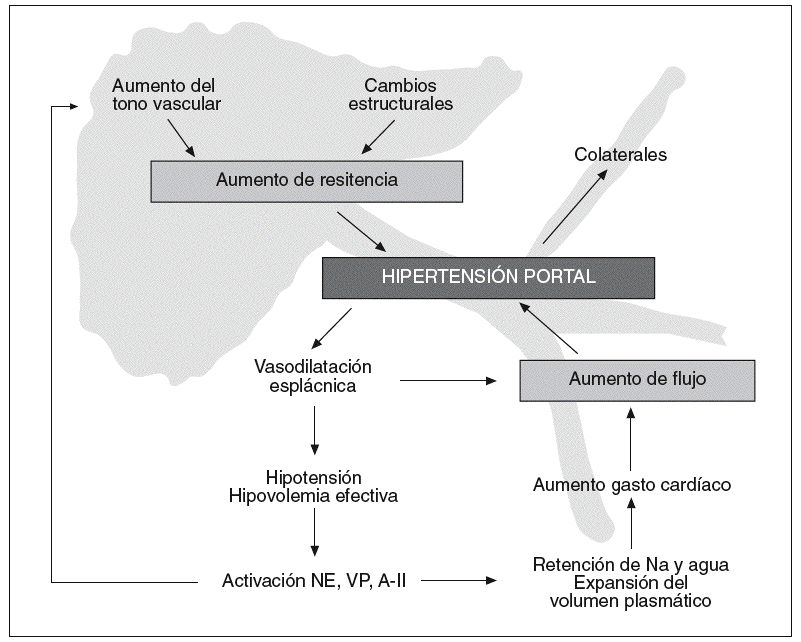
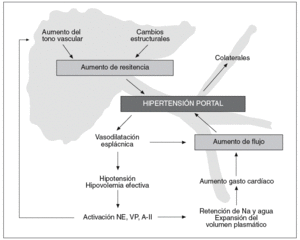
El factor inicial necesario para que aumente la presión portal es un aumento en la resistencia al flujo portal10-12. Este aumento puede estar localizado en el ámbito prehepático (como en la trombosis portal), intrahepático (cirrosis hepática) o posthepático (síndrome de Budd-Chiari). Independientemente de la causa de hipertensión portal, ésta se asocia a una serie de alteraciones en la hemodinámica esplácnica y sistémica, caracterizadas por vasodilatación, hipotensión, activación de los sistemas vasoactivos, expansión del volumen plasmático y aumento del gasto cardíaco13. Es lo que se conoce como el síndrome de circulación hiperdinámica, y conduce a un aumento del flujo sanguíneo portal que contribuye a mantener y agravar la hipertensión portal a pesar del desarrollo de colaterales portosistémicas que descomprimen el sistema (fig. 1). Esto quiere decir que para el estudio de la circulación hiperdinámica tanto los modelos de hipertensión portal prehepática, como intrahepática, serían útiles, con la particularidad de que los modelos de hipertensión portal prehepática no desarrollan ascitis. Para el estudio de las alteraciones de la circulación intrahepática se requieren modelos específicos de cada enfermedad.
Fig. 1. Resumen de la fisiopatología de la hipertensión portal. Véase texto para detalles.
Modelos de hipertensión portal prehepática
Ligadura parcial de la vena porta
Este modelo, conocido en la literatura médica anglosajona como PVL (portal vein ligation), ha sido ampliamente utilizado en el estudio de la fisiopatología de la hipertensión portal. Se ha caracterizado en ratas1,14,15, ratones6,7 y conejos16. La técnica consiste en aislar la vena porta del tejido graso que la rodea, colocándose una ligadura rodeando a la vena porta y una aguja de punta roma entre la ligadura y la vena. La ligadura se cierra con fuerza y se retira la aguja. El resultado es una estenosis calibrada de la vena porta, cuyo diámetro es el de la aguja sobre la que se ha realizado la ligadura. En el modelo convencional de PVL en ratas se utiliza una aguja de calibre 20 G (0,889 mm)1,14,15. Utilizando agujas de mayor calibre se obtienen estenosis menos severas y menor grado de hipertensión portal17,18. En ratones, el calibre de aguja convencionalmente utilizado es el 27 G6,7, y en conejos, el 18 G18. La cirugía debe realizarse en condiciones asépticas. Existen numerosas páginas web de universidades e instituciones que proporcionan información acerca de la técnica quirúrgica y el cuidado preoperatio y postoperatorio de los animales, y donde se pueden encontrar pautas de anestesia, analgesia y profilaxis antibiótica adecuada (p. ej., http://info.med.yale.edu/yarc/vcs/). Para la ligadura de la vena porta no es necesario el uso de profilaxis antibiótica.
El modelo PVL ha sido extensamente utilizado por su facilidad, su reproducibilidad, su bajo precio y por la rapidez de instauración del síndrome de la hipertensión portal. Después de una semana la ligadura de la vena porta las ratas desarrollar de forma completa, el síndrome de hipertensión portal con síndrome de circulación hiperdinámica y shunting portosistémico. El shunting portosistémico comienza a ser detectable al segundo día y es cercano al 100% a partir del séptimo día11. La vasodilatación mesentérica y el aumento de gasto cardíaco son evidentes a partir del 4.o día11,14. El principal inconveniente del modelo es que la hipertensión portal se induce de forma aguda, y que al contrario que la mayoría de las situaciones halladas en la clínica, el grado de hipertensión portal es máximo a las 24 h, y va disminuyendo a lo largo de los días debido al desarrollo de colaterales portosistémicas11.
Modelos de hipertensión portal intrahepática
La hipertensión portal intrahepática se puede clasificar a su vez en presinusoidal, sinusoidal o postsinusoidal. Los modelos que reproducen la cirrosis, la causa más frecuente de hipertensión portal intrahepática en el mundo occidental, tienen un doble componente presinosoidal y sinusoidal, pero, por motivos prácticos, serán incluidos dentro de los modelos de hipertensión portal sinusoidal.
Hipertensión portal intrahepática presinusoidal
Esquistosomiasis. La infección experimental por Schistosoma mansoni se ha estudiado en ratones y hámsters. Este modelo se consigue inyectando cercarias del parásito en la pared abdominal. A las 5-7 semanas los animales desarrollan hipertensión portal de manera progresiva19,20. El modelo de hámster no desarrolla shunting portosistémico ni circulación hiperdinámica por causas que se desconocen21. Por el contrario, el modelo en ratones desarrolla shunting portosistémico, que comienza a ser detectable a la semana 9, y alcanza un 15% de media a la semana 1119,20. Su utilización es muy escasa, y en la última década no se han publicado estudios con este modelo. Tiene la ventaja de que el desarrollo de hipertensión portal, al contrario que en el modelo PVL y más parecido a lo que sucede en las hepatopatías crónicas, es lentamente progresivo.
Hipertensión portal intrahepática sinusoidal
Existen numerosos modelos animales de cirrosis. En esta revisión se describen los más utilizados en el estudio concreto de la hipertensión portal.
Cirrosis por ligadura del colédoco (CBDL). El modelo de ligadura de colédoco (CBDL) es un modelo de cirrosis biliar secundaria que se ha ensayado principalmente en ratas22. Esta especie tiene la especial ventaja de no tener vesícula biliar, lo que la hace especialmente apropiada. También se ha ensayado en conejo23 y ratón24. Los ratones tienen el inconveniente de que desarrollan una dilatación marcada de la vesícula biliar, que en muchas ocasiones conduce a perforación y coleperitoneo. La intervención consiste en disecar el colédoco de la grasa subyacente, craneal a la salida de los conductos pancreáticos, tras lo cual se realiza una doble ligadura y resección de una porción de colédoco entre las 2 ligaduras para evitar su repermeabilización. El uso de tratamiento antibiótico profiláctico (ampicilina 100 mg/kg por vía subcutánea u otros de espectro similar antes de iniciar la cirugía) y la administración semanal de vitamina K (50 µg por vía subcutánea)25 mejoran considerablemente la supervivencia de las ratas CBDL. Uno de los inconvenientes de este modelo es la formación de un gran quiste biliar a tensión, más voluminoso cuanto más caudal sea la ligadura. La formación de este quiste puede resultar en compresión de la vena porta em en el ámbito hiliar, causando hipertensión portal prehepática incluso en la primera semana tras la cirugía. Se han propuesto diferentes métodos para evitar la formación de este quiste. En nuestra unidad hemos utilizado una variación del modelo, propuesta por Colombato et al14 en la que, mediante un catéter P10 se inyecta lentamente formol (10%, 120 µl/100 g) en la vía biliar antes de la ligadura15,26. Esto evita de forma eficaz la formación de quiste biliar. Otros autores han obtenido los mismos resultados con la inyeccción de Ethibloc®27, sustancia utilizada para embolización en radiología vascular intervencionista. Un grupo español ha solucionado este problema realizando la ligadura y sección individual del conducto hepático de cada lóbulo28,29.
El modelo CBDL desarrolla fibrosis-cirrosis biliar entre las 4 y 6 semanas. Histológicamente, presenta marcada proliferación colangiolar y fibrosis portal expansiva, pero es muy infrecuente hallar las alteraciones arquitecturales características de cirrosis como la observada en humanos o el modelo experimental de cirrosis por tetracloruro de carbono30. A las 2 semanas el modelo presenta hipertensión portal leve31. A las 4 semanas presenta hipertensión portal marcada, manifestaciones típicas de la circulación hiperdinámica y un shunting portosistémico de un 30-50%22,32,33. Aproximadamente un 60% presenta ascitis. A partir de la quinta semana la mortalidad es alta (20%). La hipertensión portal en este modelo tiene un importante componente presinusoidal34.
Cirrosis por tetracloruro de carbono (CCl4). La administración aguda de tetracloruro de carbono produce una hepatitis aguda. Su administración continuada produce una lesión hepática crónica que conduce al desarrollo de cirrosis35. La cirrosis por tetracloruro se ha descrito en ratas34,36, ratones37 y conejos23. Se puede administrar por vía oral38,39, intraperitoneal40 o inhalatoria36,41,42. La vía subcutánea se desaconseja por su bajo rendimiento. El uso de diferentes esquemas de tratamiento, incluso utilizando la misma vía de administración, podría explicar la variabilidad de rendimiento en la obtención de cirrosis entre los diferentes laboratorios. Para acelerar el modelo se administra fenobarbital en el agua de bebida (0,3 g/l) desde una semana antes de iniciar la exposición al CCl4. Los estudios hemodinámicos se realizan generalmente una semana después de interrumpir la administración de CCl4 y fenobarbital.
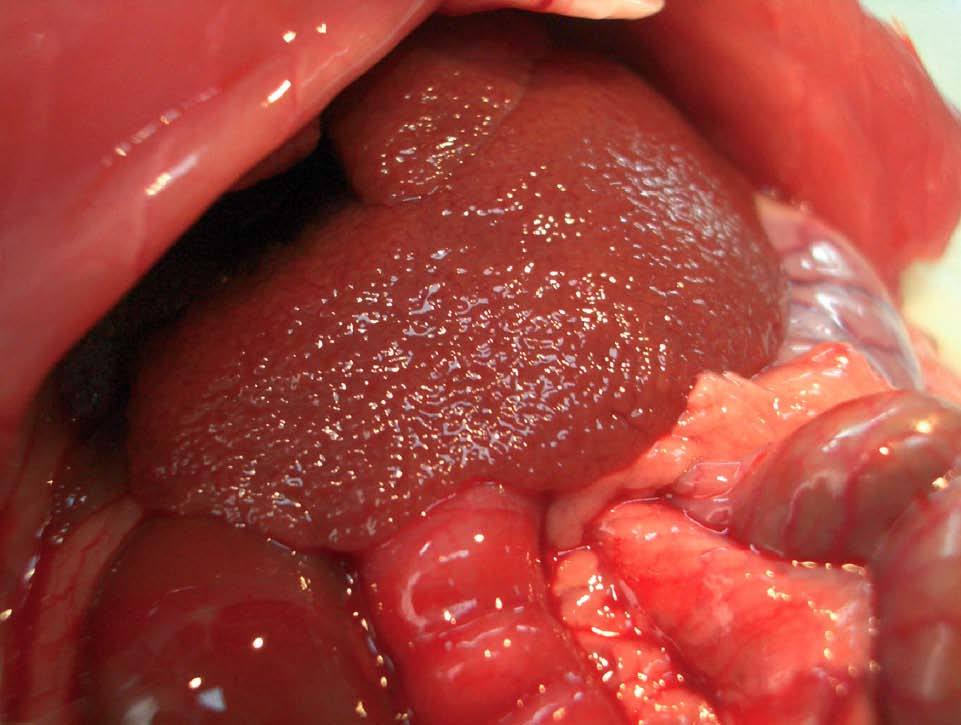
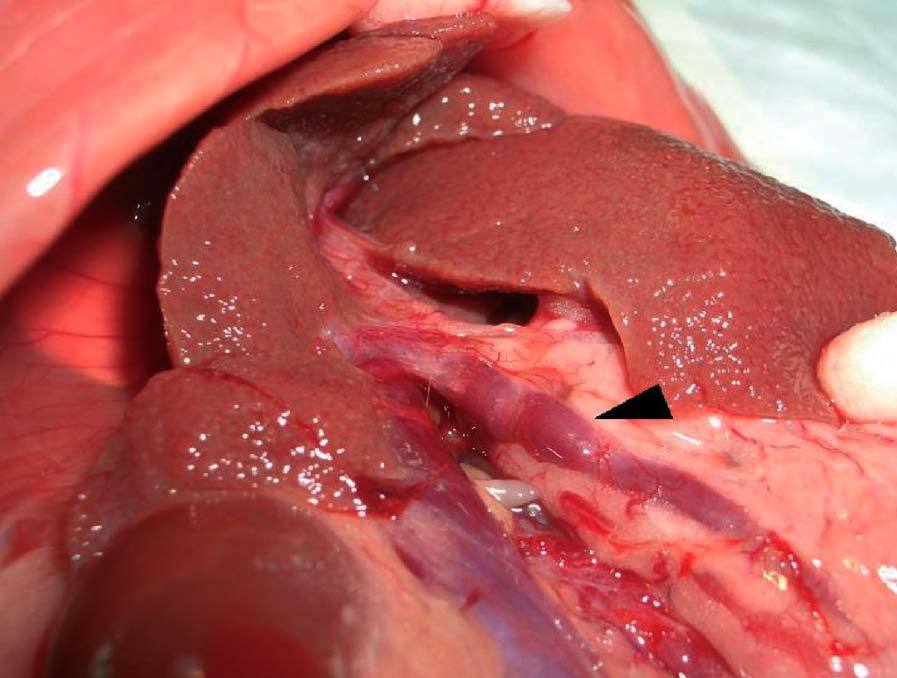
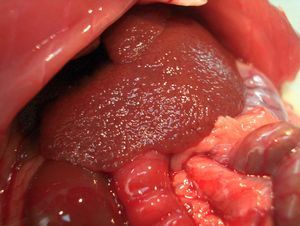
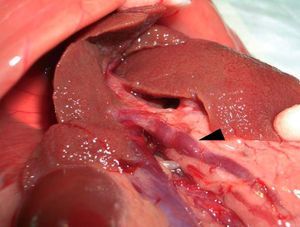
Tras aproximadamente 12-15 semanas, las ratas desarrollan cirrosis micronodular (fig. 2), hipertensión portal, shunting portosistémico (de entre un 30-60%) y síndrome de circulación hiperdinámica2. Si se mantiene durante más tiempo el tratamiento con CCl4 (14-20 semanas), la mayoría de las ratas acaba desarrollando ascitis. El mayor problema del modelo es la diferente sensibilidad de los animales al tetracloruro de carbono, lo que hace difícil obtener un grupo con un grado homogéneo de cirrosis. Proctor et al38 han propuesto una solución consistente en individualizar la dosis de cada animal de acuerdo con el efecto de la dosis anterior, midiendo la ganancia/pérdida de peso diaria del animal38. Probablemente este esquema se podría simplificar evaluando el peso del animal cada semana.
Fig. 2. Modelo de cirrosis por tetracloruro de carbono. A) La superficie hepática muestra un aspecto micronodular. B) Exposición de la vena porta previa a su canulación. Se observa una vena porta ingurgitada (flecha) y fina circulación colateral.
Cirrosis por tioacetamida (TAA). Éste es otro modelo ampliamente utilizado de cirrosis tóxica. Se ha descrito en ratas43 y ratones44. Tiene la ventaja de que puede ser diluido en el agua de bebida y es estable por lo menos durante una semana43. También se ha administrado como inyección i.p.45.
En este modelo se desarrolla cirrosis micromacronodular en aproximadamente 12 semanas. Presenta el mismo problema que la cirrosis por CCl4, es decir, la diferente sensibilidad de las ratas y la heterogeneidad del grado de cirrosis. Li et al43 han propuesto un esquema de administración, en el que la dosis administrada se matiza cada semana de acuerdo con la pérdida/ganancia de peso del animal. Esta modificación evita, de forma completa, la mortalidad durante la inducción de cirrosis y obtiene un rendimiento del 90% a las 12 semanas. Las ratas desarrollan hipertensión portal, signos de circulación hiperdinámica y un 40% desarrolla ascitis.
Cirrosis inducida por dimetilnitrosamina (DMNA). La DMNA es otro tóxico que causa necrosis hepatocitaria y que tras su administración continuada causa fibrosis a partir de la cuarta semana. A las 5 semanas, las ratas muestran hipertensión portal y shunting portosistémico. Sin embargo, la cirrosis franca con ascitis no se desarrolla hasta las 13 semanas46,47. En diversos estudios se ha utilizado este modelo 5 semanas tras el inicio de la administración de DMNA. En ese momento los animales no presentan cirrosis ni circulación hiperdinámica48. La administración del tóxico es generalmente intraperitoneal. Es un modelo muy poco estudiado desde el punto de vista hemodinámico, principalmente debido a las importantes limitaciones para el uso de DMNA por su alta carcinogenia.
Cirrosis inducida por dieta. La administración a ratas y ratones de una dieta deficiente en colina y metionina, o de una dieta baja en proteínas y colina y ricas en grasa, origina esteatosis hepática asociada a un marcado aumento del estrés oxidativo que origina inflamación y fibrosis46,49. Con estos modelos se obtiene cirrosis de forma muy variable entre las semanas 12 y 24. No han sido bien caracterizados desde el punto de vista hemodinámico y no se han utilizado en el estudio de la hipertensión portal.
Hipertensión portal postsinusoidal
Recientemente, se ha descrito un modelo en rata que reproduce las características histológicas y clínicas de la enfermedad venooclusiva, una de las causas de hipertensión portal postsinusoidal observadas en la clínica50. Este modelo se induce mediante la administración por gavaje de monocrotalina. Las ratas desarrollan hiperbilirrubinemia, hepatomegalia y ascitis a los 4-5 días. Este modelo es útil para el estudio específico de la enfermedad venooclusiva. Sin embargo, no ha sido caracterizado desde el punto de vista hemodinámico, por lo que su utilidad potencial para el estudio de la hipertensión portal es desconocida.
Hipertensión portal posthepática
Estos modelos tratan de reproducir la fisiopatología del síndrome de Budd-Chiari, es decir, la lesión hepática por obstrucción del drenaje vascular del hígado. Para evitar la mortalidad derivada de una obstrucción aguda completa se han utilizado unos dispositivos denominados ameroides. Éstos se colocan alrededor del vaso que se quiere ocluir y se expanden en contacto con la humedad dentro de un soporte rígido de acero inoxidable, con lo que tras su implantación el vaso se ocluye de forma progresiva. Este modelo se ha ensayado con éxito en perros51. En ratas es prácticamente imposible disecar las venas suprahepáticas, con lo que, en el modelo que se ha descrito, la obstrucción del drenaje hepático se consigue ocluyendo la vena cava inferior en su porción suprahepática52, lo que no es un modelo puro de síndrome de Budd-Chiari. Estos modelos han sido escasamente estudiados, por lo que su utilidad no está bien establecida.
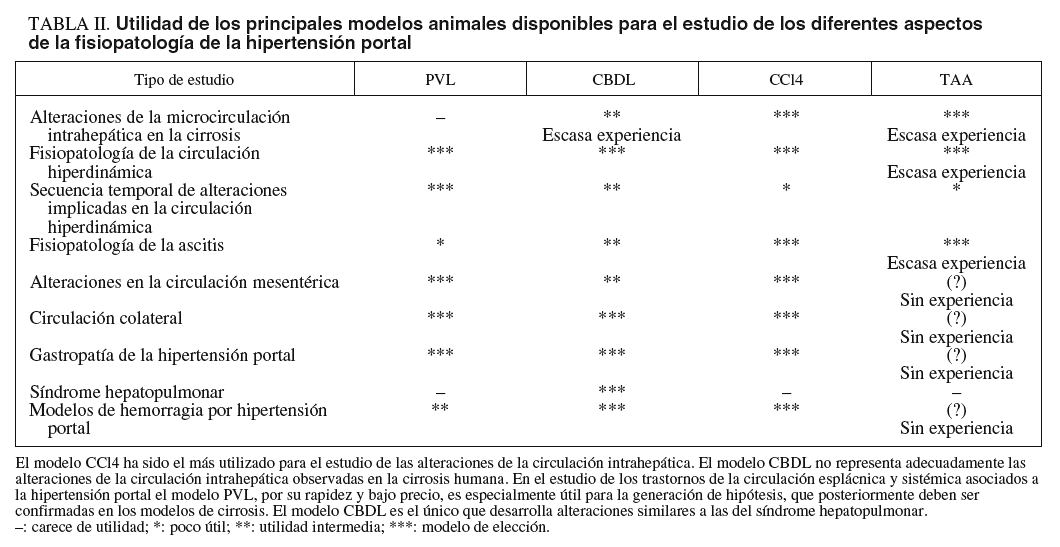
FISIOPATOLOGÍA DE LA HIPERTENSIÓN PORTAL Y SUS COMPLICACIONES: MODELOS PARA SU ESTUDIO (tabla II)
Alteraciones en la microcirculación intrahepática en la cirrosis
La causa más frecuente de hipertensión portal en nuestro medio es la cirrosis, en la que el primer fenómeno fisiopatológico es un aumento de la resistencia hepática al flujo portal. Este aumento de resistencia no sólo es consecuencia de una alteración de la arquitectura hepática, sino que también se debe a un aumento del tono vascular hepático. Este concepto ha sido demostrado mediante estudios realizados en hígado aislado y perfundido de rata53. Estos estudios permiten evaluar el tono vascular hepático y su respuesta a vasoconstrictores y vasodilatadores. Esto no lo permiten los estudios in vivo, ya que no es posible disociar el efecto de las sustancias vasoactivas sobre la presión portal que dependen de cambios en la circulación sistémica, mesentérica y colateral de los efectos derivados de cambios en la resistencia intrahepática. Otra forma de evaluación de la microcirculación hepática es mediante estudios de microscopia intravital54.
El modelo más estudiado en perfusión aislada de hígado es el modelo de cirrosis por CCl4. En este modelo se ha demostrado que el hígado cirrótico muestra un aumento del tono vascular hepático, hiperrespuesta a los vasoconstrictores e hiporrespuesta a los vasodilatadores36,55,56. El principal mecanismo que media estas alteraciones es una disfunción endotelial caracterizada por una insuficiente producción de óxido nítrico y una producción aumentada de prostanoides vasoconstrictores55,57. La respuesta de la circulación intrahepática a sustancias vasoactivas en el modelo de perfusión aislada de hígado se ha evaluado también en otros modelos de cirrosis, como CBDL58,59 y cirrosis por TAA60, pero los datos disponibles son escasos. Al evaluar los datos en estos modelos se debe recordar que las ratas con CBDL tienen un importante componente presinusoidal en el aumento de resistencia intrahepática35.
Alteraciones en la circulación sistémica, mesentérica y colateral asociadas a la hipertensión portal
Estos estudios comprenden la realización de estudios hemodinámicos in vivo y la perfusión ex vivo del lecho vascular mesentérico y de las colaterales portosistémicas.
Los estudios in vivo permiten estudiar la fisiopatología de la circulación hiperdinámica asociada a la hipertensión portal. La circulación hiperdinámica se ha descrito en el modelo PVL1,14 y en los modelos de cirrosis por CCl42, CBDL22 y TAA61. Excepto en este último, en el que los estudios son escasos, en los demás existen multitud de trabajos que han estudiado los mecanismos moleculares que activan la cascada de episodios que conducen al desarrollo de la circulación hiperdinámica.
Los estudios in vivo, por otra parte, evalúan de forma global los efectos de un determinado fármaco en la presión portal, integrando los efectos en el influjo portal, la resistencia colateral y la resistencia hepática.
Cualquiera de los modelos de hipertensión portal es, en teoría, válido para el estudio de la circulación mesentérica. Ésta se ha evaluado mediante la perfusión aislada del lecho vascular mesentérico (preparación de McGregor62), mediante el estudio de vasos mesentéricos aislados63 o mediante la perfusión de la microvasculatura intestinal64. En los modelos PVL y cirrosis por CCl4 se ha demostrado la característica hiporrespuesta vascular a vasoconstrictores de la vasculatura mesentérica63-66.
La circulación colateral se ha estudiado con diferentes metodologías. La más frecuente ha sido el cálculo del shunting portosistémico mediante la inyección de microesferas radiactivas, de colores o fluorescentes67,68. El uso de microesferas marcadas con diferentes isótopos, colores o marcadores fluorescentes permite evaluar en un mismo animal los cambios del shunting portosistémico en respuesta a diferentes intervenciones10. Otra forma de estudiar las colaterales ha sido la medición mediante técnicas basadas en ultrasonidos del flujo en el shunt esplenorrenal espontáneo, colateral de gran tamaño que desarrollan diferentes modelos de ratas con hipertensión portal (PVL, cirrosis por CBDL y CCl4)48. Por último, Mosca et al69 desarrollaron un sistema para la perfusión ex vivo de colaterales, que permite evaluar la respuesta del lecho colateral a diferentes vasodilatadores y vasoconstrictores. A la hora de realizar estos estudios se debe tener en cuenta que las ratas con PVL tienen un shunting prácticamente total (del 100%), mientras que en las ratas con cirrosis avanzada éste es de entre un 30 y un 60%.
La disponibilidad del modelo PVL supone una enorme ventaja para la realización de estos 3 tipos de estudios, ya que es un modelo muy rápido y enormemente barato en comparación, sobre todo con los modelos de cirrosis tóxica. A lo largo de los últimos 20 años, la mayoría de los investigadores ha seguido la estrategia de generar hipótesis en el modelo PVL para luego corroborarlas en los más laboriosos y costosos modelos de cirrosis.
Ascitis y trastornos de la función renal en la cirrosis
La gran mayoría de los estudios en este campo se ha realizado en el modelo de cirrosis por CCl470-72. La administración de CCl4 se mantiene hasta que se detecta ascitis en la exploración. El modelo de PVL, al igual que ocurre en los pacientes con hipertensión portal prehepática, no desarrolla ascitis. Aún así, por ser ideal para estudios secuenciales, el modelo ha resultado fundamental en la descripción de la fisiopatología de la circulación hiperdinámica14, y en la validación de la teoría de la vasodilatación arterial periférica como iniciadora de la retención de sodio y agua que conduce al desarrollo de ascitis en la cirrosis14,73-75. Los modelos de cirrosis por CBDL y por CCl4 también se han utilizado para estudios longitudinales dirigidos a demostrar la secuencia vasodilatación-retención de sodio-ascitis76-78, pero su evolución temporal, especialmente en el caso de cirrosis por CCl4, carece de la homogeneidad del modelo PVL y, por lo tanto, la interpretación de estos estudios es más difícil.
Gastropatía de la hipertensión portal
Diversos estudios han demostrado que las ratas con PVL y con cirrosis presentan alteraciones de la microcirculación gástrica comparables con la gastropatía de la hipertensión portal observada en pacientes. Este modelo ha sido útil para evaluar intervenciones terapéuticas que posteriormente han demostrado cierta eficacia en la práctica clínica70,71.
Síndrome hepatopulmonar
Las ratas CBDL desarrollan alteraciones comparables a las del síndrome hepatopulmonar observado en humanos, consistentes en shunting intrapulmonar y aumento del gradiente alveoloarterial de oxígeno81. Estas alteraciones son obvias ya a partir de la segunda semana tras la ligadura del colédoco45. Por razones no bien aclaradas, las ratas con hipertensión portal de otra causa (PVL, cirrosis por TAA) no desarrollan síndrome hepatopulmonar45,81.
Hemorragia por hipertensión portal
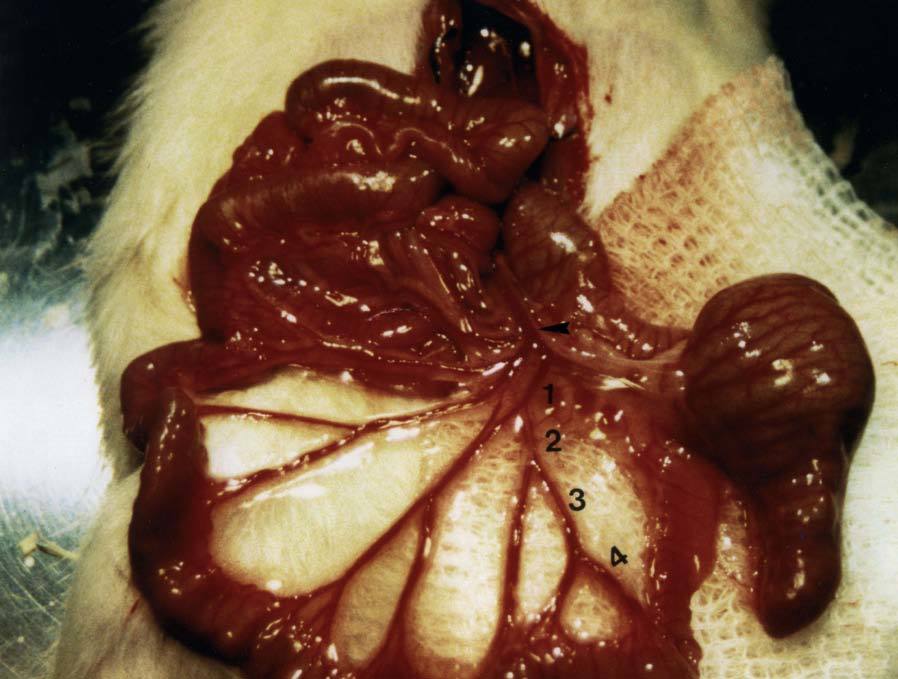
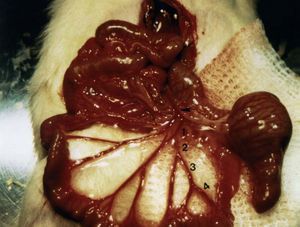
Recientemente se ha descrito un modelo de hemorragia por hipertensión portal que ha demostrado ser útil para valorar intervenciones terapéuticas en la hemorragia aguda por complicaciones de la hipertensión portal, como la transfusión de volumen o el tratamiento con fármacos vasoactivos15,26,82. El modelo consiste en la sección de una rama de la vena ileocólica. La severidad de la hemorragia depende del grado de hipertensión portal y del calibre de la rama seccionada15 (fig. 3). Este modelo de hemorragia ha sido ensayado en ratas PVL y CBDL15,26,82. Una sección de una rama de primer orden de la vena ileocólica induce una mortalidad del 50% en ratas CBDL, mientras que ésta es nula en ratas PVL. En estas últimas se ha ensayado un modelo con 2 secciones sucesivas de una rama de primer orden de la vena ileocólica. Por una parte, esto aumenta la mortalidad del modelo hasta el 50%. Por otra, permite ensayar tratamientos farmacológicos en presencia de hipovolemia, reproduciendo más fielmente el contexto clínico en que se aplican estas terapias82.
Fig. 3. Modelo de hemorragia por hipertensión portal. El modelo consiste en la sección de una rama de la vena ileocólica de primer (1), segundo (2), t deprimer orden82. orden. Para el ensayo de tratamientos farmacológicos se emplea la sección de una rama