INTRODUCCIÓN
La azatioprina (AZA) y su metabolito la 6-mercaptopurina (6-MP) son análogos de las purinas con actividad inmunodepresora que se utilizan para el tratamiento de diversas enfermedades, entre las que se encuentra la enfermedad inflamatoria intestinal (EII)1,2. En la enfermedad de Crohn y en la colitis ulcerosa los esteroides y los 5-aminosalicilatos suelen considerarse como los tratamientos de primera elección, mientras que la AZA y la 6-MP se emplean fundamentalmente en los pacientes que no responden al tratamiento con esteroides (corticorresistencia), en los que no es posible su reducción o eliminación (corticodependencia) o en los casos con enfermedad de Crohn fistulizante refractaria al tratamiento antibiótico1,2.
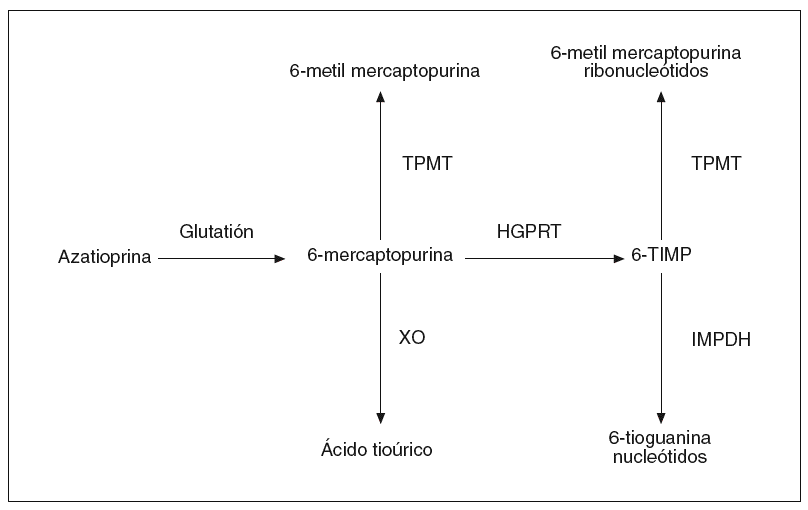
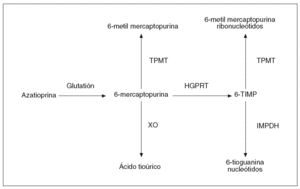
La AZA sufre inicialmente una conversión no enzimática a 6-MP, la cual puede seguir diversas rutas metabólicas: puede ser metilada a través de la tiopurina metiltransferasa (TPMT), oxidada a ácido tioúrico gracias a la xantina oxidasa, o catabolizada hacia los nucleótidos de la 6-tioguanina (6-TGN) a través de la hipoxantina-guanina fosforribosil transferasa (fig. 1)3. En suma, el efecto de la AZA y de la 6-MP es consecuencia fundamentalmente de su conversión intracelular en sus metabolitos activos, los 6-TGN3. Por el contrario, la enzima TPMT es responsable de la conversión de la AZA en sus metabolitos inactivos, la 6-metilmercaptopurina (6-MMP) y los ribonucleótidos de la 6-metilmercaptopurina (6-MMPR).
Fig. 1. Vía metabólica de la azatioprina. TPMT: tiopurina metiltransferasa; XO: xantina oxidasa; HGPRT: hipoxantina guanina fosforibosil transferasa; 6-TIMP: 6-tioinosina 5-monofosfato; IMPDH: inosina monofosfato deshidrogenasa.
La dosis de AZA y 6-MP se ajusta habitualmente en función del peso del paciente. Así, diversos ensayos clínicos controlados han demostrado que en la enfermedad de Crohn la dosis efectiva de AZA es de 2-3 mg/kg/día, mientras que la posología correspondiente para la 6-MP sería de 1,5 mg/kg/día1,2. Con esta dosificación se pretende alcanzar la mayor eficacia terapéutica y, al mismo tiempo, reducir la incidencia de efectos adversos, aunque esto obviamente no siempre se consigue. No obstante, se han sugerido diversas estrategias para monitorizar de forma individualizada y de modo más fiable la dosis de AZA/6-MP con la intención, por una parte, de identificar a los pacientes con riesgo de toxicidad por estos fármacos y, por otro, a los pacientes con dosis subterapéuticas e inmunodepresión inadecuada3-14. Entre estas estrategias se encuentra la determinación de los cambios en el volumen corpuscular medio, la confirmación de la inducción de una determinada leucopenia, la monitorización de la actividad de la TPMT y la cuantificación de los valores de 6-TGN; estas dos últimas opciones son las más prometedoras3-14.
La actividad de la enzima TPMT parece ser uno de los factores más relevantes en la regulación de las concentraciones de los 6-TGN. Así, en los pacientes con baja actividad de la TPMT se observan elevadas concentraciones de estos metabolitos, mientras que en los pacientes con alta actividad enzimática las concentraciones de los 6-TGN son bajas3-14. Por su parte, como se revisará más adelante, se ha observado que las concentraciones intracelulares de 6-TGN parecen estar relacionadas con la toxicidad y con el efecto terapéutico de la AZA/6-MP.
Hace unos pocos años se llevó a cabo una revisión sobre las diversas estrategias que podrían permitir monitorizar de forma individualizada la dosis de AZA/6-MP, haciendo especial hincapié en el papel de la determinación de la TPMT3. Desde entonces, se ha acumulado una notable experiencia relacionada con esta cuantificación, y se han publicado además diversos estudios que evalúan la utilidad de determinar las concentraciones de los metabolitos tiopurínicos (6-TGN, 6-MMP y 6-MMPR) con la intención de predecir tanto el efecto terapéutico de la AZA/6-MP como su posible toxicidad. En este artículo se revisará críticamente el papel que las mencionadas estrategias determinación de TPMT y de metabolitos tiopurínicos podrían tener en la optimización del tratamiento y el seguimiento de los pacientes con EII que precisan recibir AZA o 6-MP.
Para llevar a cabo esta revisión se realizó una búsqueda bibliográfica en internet hasta enero de 2006, empleando el motor de búsqueda en PubMed. Se utilizaron en todos los campos de búsqueda los siguientes descriptores o palabras clave: thiopurine methyltransferase o TPMT o nu cleotides o 6-thioguanine o tioguanine o thioguanine o 6-methylmercaptopurine o 6-TGN, y azathioprine o mercaptopurine, y ulcerative colitis o Crohn's disease o inflammatory bowel disease. Asimismo, se revisaron las referencias bibliográficas incluidas en las revisiones identificadas sobre el tema, así como la bibliografía utilizada en los artículos incluidos. Se tuvieron en consideración los artículos publicados en cualquier idioma, menos en japonés.
MONITORIZACIÓN DE LA ACTIVIDAD DE LA TPMT
Distribución de la actividad de la TPMT en la población
La farmacocinética de la AZA está sujeta a una importante variabilidad interindividual que se debe, en gran parte, a un significativo polimorfismo genético de la TPMT. Se han descrito 2 alelos que codifican 2 variantes enzimáticas, una de alta y otra de baja actividad15. De este modo, desde el punto de vista genotípico, hace ya más de dos décadas que Weinshilboum y Sladek16 estudiaron una muestra aleatoria de población de aproximadamente 300 individuos y establecieron el siguiente modelo de distribución trimodal: el 88,6% eran homocigotos para el alelo de alta actividad (TPMTHH), el 11,1% eran heterocigotos (TPMTHL) y tan sólo el 0,3% eran homocigotos para el alelo de baja actividad (TPMTLL).
Posteriormente, otros autores han cuantificado la actividad de esta enzima en función del genotipo del paciente17,18 y han encontrado los siguientes valores: sujetos homocigotos para el alelo de alta actividad (valores altos, > 13,8 U/ml hematíes), sujetos heterocigotos (valores intermedios, 5-13,7 U/ml) y sujetos homocigotos para el alelo de baja actividad (valores bajos, < 5 U/ml). En nuestro medio, un estudio inicial llevado a cabo sobre 135 pacientes con EII no logró identificar ningún paciente con baja actividad de la TPMT (< 5 U/ml)19. Más recientemente, otro estudio multicéntrico español con un grupo muy numeroso (7,046 pacientes con EII) permitió establecer la siguiente distribución de la actividad de la TPMT: valores bajos (< 5 U/ml) en el 0,5% de los casos, valores intermedios en el 11,1% y valores altos en el 88,4% de los casos20. Estos hallazgos son superponibles a los descritos en un estudio21, también realizado en nuestro país, sobre 14.545 pacientes con diversas enfermedades (EII y otras) susceptibles de recibir tratamiento con AZA o 6-MP, al demostrar que tan sólo el 0,5% de los pacientes tenían una actividad de la TPMT clasificada como baja.
Genotipo y actividad de la TPMT
Hay 2 estrategias para identificar a los pacientes con deficiencia de TPMT: la medición de la actividad de esta enzima en los eritrocitos (es decir, el fenotipo) y la determinación de las diversas mutaciones presentes en el ADN celular (esto es, el genotipo). Diversos autores han detectado la presencia de mutaciones de la TPMT mediante la técnica de reacción en cadena de la polimerasa (PCR) y digestión con enzimas de restricción22-36. Múltiples estudios han demostrado una elevada concordancia entre la clasificación genotípica y fenotípica de la actividad de la TPMT, que ha sido tan alta como del 97-98%23,37, o incluso del 100%27 en algunos casos, aunque otros autores han comprobado que estos favorables resultados sólo se observan en los pacientes homocigotos para el alelo de baja actividad de la TPMT, pero no en los heterocigotos18.
Ventajas e inconvenientes de la determinación del fenotipo y del genotipo de la TPMT
Una ventaja teórica de la determinación del fenotipo es que éste podría indicar con más fidelidad la actividad real de la enzima, pues la manifestación fenotípica de un determinado genotipo no es siempre la misma, sino que puede depender de diferentes variables, como la edad, el sexo, la dieta, la presencia de insuficiencia renal o el tratamiento con algunos fármacos38-46. Así, por ejemplo, diversos tratamientos farmacológicos, algunos de ellos de uso frecuente en la EII, podrían modificar teóricamente la actividad de la TPMT47-52. Además, la determinación del genotipo permite únicamente clasificar a los pacientes, como hemos visto, en tres grandes grupos (homocigotos TPMTHH, heterocigotos TPMTHL y homocigotos TPMTLL), mientras que la cuantificación de la actividad enzimática podría permitir, en teoría, la individualización de la dosis de AZA/6-MP en cada paciente, incluso en los que presentan un genotipo «normal» (homocigotos de alta actividad)53; en este último grupo hay una notable variabilidad interindividual en la actividad de la TPMT, y es posible que ello implique la necesidad de administrar dosis distintas de fármacos inmunodepresores. Por último, aunque la determinación del genotipo de la TPMT permite detectar la gran mayoría de los pacientes con actividad enzimática reducida, hay la posibilidad de que alguna variante alélica pueda quedar sin identificar13. Por su parte, la determinación del genotipo de la TPMT tiene una serie de ventajas, como su sencillez (la automatización progresiva del diagnóstico molecular es ya una realidad), su rapidez (los resultados se obtienen en unas pocas horas) y el precio relativamente bajo de la técnica22,30,54. Además, puesto que el genotipo no varía en un determinado paciente, sólo necesita ser determinado una única vez. Finalmente, la medición de la actividad eritrocitaria de la TPMP (el fenotipo) puede modificarse si se ha recibido una transfusión de hematíes en las últimas semanas55,56 o en presencia de insuficiencia renal57, mientras que la clasificación genotípica no se verá influenciada por estas circunstancias.
Actividad de la TPMT y riesgo de mielotoxicidad debida a AZA/6-MP
La leucopenia es el efecto adverso más frecuentemente producido por la AZA y la 6-MP, alteración analítica que acontece entre el 5 y el 25% de los pacientes que reciben este tratamiento58-61. Más raramente, la mielotoxicidad aparece como una forma más aguda y grave, generalmente de leucopenia o pancitopenia58,62,63. Diversos estudios han evidenciado una correlación entre el fenotipo o el genotipo de la TPMT y el riesgo de mielotoxicidad13,17,18,24-27,39,40,54,58,64-74. De este modo, los pacientes homocigotos para el alelo de baja actividad de la TPMT tienen un riesgo aumentado de sufrir mielotoxicidad grave debido al exceso de acumulación de 6-TGN, como consecuencia de que una cantidad mayor de 6-MP se metaboliza por la ruta enzimática de la hipoxantina-guanina fosforibosil transferasa17,38. Algunos autores han descrito incidencias de mielotoxicidad de hasta el 100% en los sujetos homocigotos para el alelo de baja actividad, pero de tan sólo el 7% en los individuos con una actividad enzimática normal27.
No obstante, no todos los estudios coinciden en demostrar una estrecha correlación entre la actividad de TPMT y el riesgo de mielotoxicidad71,75-79. Recientemente, se ha evaluado en nuestro medio si aparece dicha correlación en los pacientes con EII tratados con AZA/6-MP19 y, como se ha mencionado previamente, no se detectó ningún paciente con valores enzimáticos bajos (< 5 U/ml). Por tanto, ninguno de los pacientes con efectos adversos hematológicos tuvo una actividad de la TPMP anormalmente baja, pero ni siquiera intermedia (entre 5 y 13,7 U/ml). En un estudio posterior, también español, se evaluó prospectivamente si la elección de la dosis de AZA/6-MP basada en la actividad de la TPMT era capaz de prevenir la aparición de mielotoxicidad en 131 pacientes con EII80. En coincidencia con la experiencia previa, entre los 4 pacientes que presentaron afectos adversos hematológicos, uno tenía una actividad de TPMT intermedia, mientras que 3 tenían, incluso, valores de actividad elevada80. En resumen, si bien parece evidente que los pacientes homocigotos para el alelo de baja actividad de la TPMT tienen un riesgo aumentado de sufrir mielotoxicidad grave por AZA/6-MP, la verdadera utilidad de determinar de forma sistemática la actividad de la TPMT con la intención de identificar a los pacientes con EII y riesgo de mielotoxicidad no está definitivamente establecida.
El grado de déficit de actividad de la TPMT parece guardar relación con el período transcurrido entre la administración del tratamiento con AZA/6-MP y la aparición de los efectos adversos hematológicos. Así, se ha descrito que este período de latencia es corto (de aproximadamente unas semanas o unos pocos meses) en los pacientes homocigotos para el alelo de baja actividad, mientras que sería algo más prolongado en los heterocigotos, y más aún en los homocigotos, para el alelo de alta actividad39,58. De estos datos se deduce que la neutropenia que aparece precozmente tras haber comenzado el tratamiento, considerada hasta ahora como un efecto adverso de tipo idiosincrásico, se debe en muchos casos al déficit fundamentalmente absoluto de actividad de la TPMP. Por otra parte, la toxicidad medular tardía que ocasionalmente se identifica en los pacientes tratados con AZA/6-MP estaría relacionada, posiblemente, con otros factores distintos de la deficiencia de TPMT.
Actividad de la TPMT y efectos secundarios distintos de la mielotoxicidad
Aunque la hepatotoxicidad asociada al tratamiento con AZA o 6-MP está bien documentada, sus mecanismos patogénicos son aún desconocidos. Se ha comprobado que una actividad elevada de la TPMT tiene como consecuencia la acumulación de 6-MMP y 6-MMPR, metabolitos que, aunque son inactivos, parecen incrementar, como se revisará más adelante, el riesgo de hepatotoxicidad26,27,81-83. No obstante, otros autores no han podido demostrar ninguna relación entre la deficiencia de la TPMT y la toxicidad hepática18,25,27, por lo que el verdadero papel que esta enzima desempeña en la predicción de los efectos adversos hepáticos es aún controvertido.
La posible relación entre la actividad de la TPMT y la incidencia de efectos adversos no hematológicos ni hepáticos, como la intolerancia digestiva o las diversas reacciones de tipo idiosincrásico, no está en absoluto establecida73,75,78,84. Algunos autores han sugerido que la incidencia de efectos adversos gastrointestinales podría estar también relacionada con un déficit de actividad de la TPMT26,74,85,86, aunque estos resultados deberán ser confirmados en el futuro.
En resumen, se precisan más estudios para poder esclarecer definitivamente si la actividad de la TPMT está relacionada con la aparición de otros efectos adversos diferentes de la mielotoxicidad, como la hepatotoxicidad, la intolerancia digestiva o las reacciones de tipo idiosincrásico (p. ej., pancreatitis)9,13.
Actividad de la TPMT y eficacia clínica de la AZA/6-MP
Mediante la determinación de la actividad enzimática de la TPMT no sólo podría estimarse el riesgo de sufrir efectos adversos hematológicos, sino también la probabilidad de que la dosis administrada de AZA/6-MP esté produciendo la inmunodepresión adecuada y el consiguiente efecto terapéutico. Así, se ha sugerido que los pacientes homocigotos para el alelo de alta actividad de la TPMT, y especialmente los que presentan una actividad muy elevada de esta enzima, estarían indebidamente inmunosuprimidos con la posología convencional de AZA/6-MP y podrían beneficiarse de dosis más elevadas de este fármaco17,40,74,79,87-89. Esto se debería a la creación de un shunt o cortocircuito preferencial desde la AZA hacia la vía de los metabolitos inactivos (6-MMP y 6-MMPR), perfil que definiría a los pacientes «resistentes» a la AZA/6-MP6,11,81,82,90,91. No obstante, una vez más, se han publicado artículos con resultados discordantes, donde no ha podido demostrarse una correlación entre la ac tividad de la TPMT y la respuesta al tratamiento con AZA/6-MP77,92.
¿Cómo se puede ajustar la dosis de AZA/6-MP en función de la actividad de la TPMT?
Se ha sugerido que, según la actividad de la TPMT, se podría actuar básicamente de 3 formas. Los pacientes con un genotipo homocigoto de alta actividad (o con actividad elevada de la TPMT) deberían recibir dosis de inmunosupresores que hayan demostrado ser claramente eficaces; por ejemplo, en el caso de la EII, entre 2 y 3 mg/kg/día de AZA, y aproximadamente 1,5 mg/kg/día de 6-MP93. En estos pacientes, además, podrían administrarse dosis «de carga» de estos fármacos en determinadas circunstancias clínicas que precisen una actividad terapéutica inmediata94. En los pacientes con genotipo heterocigoto o con actividad intermedia de la TPMT se ha sugerido que la dosis inicial de AZA/6-MP debería reducirse empíricamente hasta cerca del 50%5,6,9,11,13,93, puesto que algún estudio ha demostrado una mayor incidencia de efectos adversos de la AZA también en ellos74. No obstante, otros autores no han podido confirmar una mayor frecuencia de mielotoxicidad en los pacientes heterocigotos92, y se ha propuesto que la mencionada recomendación de reducir a la mitad la dosis de AZA/6-MP en los pacientes con actividad intermedia no parece estar basada en evidencias científicas sólidas, por lo que otra opción igualmente válida es utilizar dosis plenas de AZA/6-MP también en estos casos. Finalmente, ante un paciente con un genotipo o fenotipo homocigoto de baja actividad de la TPMT, se debería contraindicar el empleo de AZA/6-MP o, en todo caso, sería obligada la prescripción de dosis muy reducidas de estos fármacos (p. ej., un 10-15% de la dosis estándar)18,27,38,93,95,96. En este sentido, algunos autores han demostrado que a pesar de que haya una deficiencia completa de TPMT es posible administrar finalmente tratamiento con AZA/6-MP, aunque en mínimas dosis y bajo un estricto control clínico y analítico18,87,97.
Interacción entre diversos fármacos y la actividad de la TPMT
Se ha sugerido que el propio tratamiento con AZA podría incrementar la actividad de la TPMT. No obstante, los investigadores que han descrito la mencionada interacción lo han hecho fundamentalmente en pacientes con trasplante renal40,47,57 o leucemia42,43, situaciones en que se administra tratamiento concomitante con otros fármacos que podrían ser realmente los responsables de la inducción de la TPMT. Además, recientemente se ha demostrado que la uremia en los pacientes sometidos a trasplante renal incrementa la actividad de la TPMT57. Hasta el momento, sólo en un estudio se ha evaluado la inducción de la actividad de la TPMT en controles sanos tras la administración de 6-MP, sin poder demostrar ningún efecto98, lo que coincide con lo observado en pacientes con EII19,20 u otras enfermedades21.
Diversos estudios farmacológicos realizados tanto in vitro como in vivo han evidenciado una inhibición de la TPMT o un incremento en los 6-TGN debidos al tratamiento con sulfasalazina o 5-aminosalicilatos48-50,92,99-102. Sin embargo, muchos otros estudios llegan a la conclusión de que estos fármacos no parecen modificar de forma clínicamente relevante la actividad enzimática de la TPMT o los valores de 6-TGN, al inducir únicamente cambios mínimos, tanto in vitro103 como in vivo19,20,26,50,77,79,82,84,101,102,104-107. Por tanto, el posible sinergismo entre la AZA/6-MP y los 5-aminosalicilatos no está establecido, pero, en todo caso, éste no estaría mediado por una inhibición de la TPMT.
Por último, el tratamiento concomitante con alopurinol parece incrementar el riesgo de mielotoxicidad debida a la AZA/6-MP38,108-110. Por una parte, no hay evidencia de que este fármaco interaccione con la TPMP. Por otra, como es sabido, la enzima xantina oxidasa metaboliza tanto la 6-MP como los 6-TGN hasta ácido tioúrico (un metabolito inactivo), y el alopurinol actúa como un inhibidor competitivo de dicha enzima. De este modo, con la intención de favorecer la producción de 6-TGN, se ha llegado a administrar este fármaco en pacientes que no responden al tratamiento con AZA/6-MP y que tienen un exceso de síntesis de 6-MMP110. Aunque el objetivo de elevar las concentraciones de 6-TGN se cumplió en el mencionado estudio, no se evaluó con precisión si ello se acompañaba o no de una mejoría en la actividad de la EII110, por lo que la relevancia clínica de este hallazgo está aún por confirmar. En cualquier caso, parece prudente extremar los controles hematológicos en los pacientes tratados con AZA/6-MP que reciben concomitantemente alopurinol.
¿Está indicado hacer un seguimiento de la actividad de la TPMT en todos los pacientes que vayan a recibir tratamiento con AZA o 6-MP? ¿Cuál es su relación coste-beneficio?
Como se ha mencionado previamente, los resultados «negativos» obtenidos por algunos estudios, en los que la determinación de la actividad de la TPMT no muestra una utilidad clínica para identificar a los pacientes con EII y riesgo de mielotoxicidad, plantean dudas sobre si realmente está indicada la monitorización sistemática de la actividad de esta enzima en todos los pacientes que vayan a recibir tratamiento con AZA o 6-MP. Sin embargo, los resultados más alentadores de otros estudios ya comentados, que demuestran que el conocimiento de la actividad de la TPMP permite predecir con notable fiabilidad la aparición de efectos adversos hematológicos graves argumentan a favor de la determinación sistemática del genotipo o fenotipo de esta enzima en los pacientes que van a recibir tratamiento tiopurínico17,27,30,93,111. Es posible que la decisión final dependa en gran medida de la proporción de pacientes no sólo homocigotos para el alelo de baja actividad sino, y más importante, de la proporción de sujetos heterocigotos (ya que este subgrupo constituye aproximadamente un 10%, una cifra ya mucho más relevante)16. De todos modos, la prevalencia del genotipo o fenotipo homocigoto de baja actividad de la TPMT, aunque relativamente baja, es suficientemente elevada (1 entre 300) y las complicaciones de la potencial mielosupresión suficientemente graves como para que diversos autores hayan recomendado la determinación sistemática de dicho parámetro antes de comenzar el tratamiento con AZA/6-MP.
Es evidente que se precisan más estudios, no sólo clínicos sino también de coste-beneficio, para aclarar definitivamente esta cuestión. Así, es posible que el estudio de la actividad de la TPMT en todos los pacientes sea coste-efectiva si tenemos en cuenta lo costoso del tratamiento de los pacientes con mielotoxicidad grave inducida por AZA/6-MP25,54. En este sentido, Tavadia et al54 han calculado el coste de la determinación sistemática de la actividad de la TPMT basándose en los resultados de un caso real de toxicidad medular ocurrido en su propio centro. Los autores llegan a la conclusión de que esta actitud sería «neutra» desde el punto de vista económico si se asume que la mielotoxicidad aparece únicamente en los pacientes homocigotos para el alelo de baja actividad de la TPMT, pero sería coste-efectiva si, como algunos investigadores han sugerido que ocurre realmente, los efectos adversos aparecen también en los pacientes heterocigotos54.
Otros autores han llevado a cabo una evaluación farmacoeconómica de la determinación sistemática de la actividad de la TPMT, para lo cual han desarrollado modelos de análisis de decisión, y han concluido que esta estrategia es coste-efectiva112,113. En el primero de estos análisis se tuvo en cuenta tanto el coste de la determinación de la TPMT como el derivado de la leucopenia y las infecciones asociadas112. En el segundo modelo de análisis de decisión se consideró también el impacto de la determinación de la TPMT sobre la eficacia terapéutica de la AZA/6-MP113. Estos alentadores resultados coinciden con los descritos en otras enfermedades, como la artritis reumatoide o el lupus eritematoso sistémico, donde la determinación del genotipo de la TPMT ha demostrado tener también una favorable relación coste-beneficio114,115.
No obstante, no debemos olvidar que los modelos de análisis de decisión se basan en diversas hipótesis respecto a los costes y los beneficios, y las probabilidades de los distintos desenlaces se basan en datos obtenidos de la literatura médica, por lo que sus resultados pueden no ser aplicables en todos los medios. De ello se deduce que un modelo de análisis de decisión no debe reemplazar a un buen diseño prospectivo. Precisamente, un reciente estudio aleatorizado ha comparado la estrategia «clásica» (comenzar con una dosis baja de AZA e ir incrementando ésta progresivamente) frente a la «personalizada» (en la que tras la determinación de la actividad de la TPMP se administraba AZA en dosis de 2,5 mg/kg)76. Aunque únicamente se incluyó a 29 pacientes y el seguimiento fue relativamente corto, los autores demuestran que la estrategia basada en la determinación de la TPMP no permite predecir la aparición de efectos adversos y, además, se asocia con un incremento de los costes76. Por tanto, es evidente que los aspectos económicos relacionados con la monitorización de la TPMT precisan un mayor y mejor estudio. De todos modos, como en cualquier decisión médica, es preciso tener presente no sólo los condicionantes económicos, sino también, y fundamentalmente, los éticos. De esta forma, si es posible llevar a cabo una determinación analítica que permita evaluar los riesgos de la AZA, o incluso utilizar una dosis completa más precozmente, parecería apropiado ofrecérsela al paciente, siempre que sus costes sean asumibles.
El seguimiento de la actividad de la TPMT, ¿evita la necesidad de realizar controles analíticos sistemáticos?
Para responder a esta pregunta es necesario plantearse, en primer lugar, si el déficit de TPMT es responsable de todos los casos de mielotoxicidad o, por el contrario, hay otros factores que pueden desencadenar esta complicación. Diversos estudios han demostrado que el fenotipo o el genotipo asociado con el déficit de TPMP explica un porcentaje variable de casos de mielotoxicidad, pero que en ningún caso llega a ser del 100%3-14. Por tanto, se concluye que diversos factores algunos conocidos, ambientales o farmacológicos, y otros aún no identificados no relacionados con la actividad de la TPMP pueden ser responsables de la mielotoxicidad producida por la AZA/6-MP, por lo que los controles analíticos periódicos deben seguir realizándose en estos pacientes a pesar de que la función deRÍNICOS
Correlación entre actividad de la TPMT y valores de 6-TGN
Los metabolitos tiopurínicos están representados fundamentalmente por los 6-TGN, la 6-MMP y los 6-MMPR. Los 6-TGN pueden determinarse en el interior de los eritrocitos mediante técnicas de cromatografía de alta resolución, y se ha demostrado que la concentración intraeritrocitaria refleja la que presentan los tejidos116. En general, se ha considerado que los pacientes con baja actividad de la TPMT se asocian con unos valores elevados de 6-TGN26,64,72,87,90,92,104,106,117-125, lo que, como se ha revisado previamente, parece implicar un mayor riesgo de mielotoxicidad. Sin embargo, diversos autores han puesto de manifiesto que el conocimiento de la actividad de la TPMT en un determinado paciente no nos indica con precisión si en él predomina la vía metabólica de los 6-TGN o la de los 6-MMPR y, por tanto, han descrito una escasa o incluso nula correlación entre la actividad enzimática de la TPMT y las concentraciones intracelulares de 6-TGN26,74,77,90,92,106,126-129.
Concentraciones de metabolitos tiopurínicos y riesgo de mielotoxicidad debida a AZA/6-MP
Se ha sugerido que las concentraciones intracelulares de 6-TGN estarían relacionadas con la toxicidad medular de la AZA. Así, diversos autores han descrito una correlación entre los valores de estos metabolitos y la incidencia de leucopenia25,26,43,50,51,64,84,122,128,130-132. Sin embargo, en otros estudios no se ha podido comprobar la relación entre el recuento leucocitario de los pacientes tratados con AZA o 6-MP y las concentraciones séricas de 6-TGN26,91,92,104,107,120,126,133, lo que cuestiona seriamente la idea de que estos metabolitos sean los principales responsables de la mielosupresión asociada al tratamiento tiopurínico. Por otra parte, la administración directa de tioguanina no parece incrementar el riesgo de mielotoxicidad, a pesar de que va seguida de un incremento notable de las concentraciones de 6-TGN, mucho más elevadas que las descritas habitualmente en los pacientes tratados con AZA/6-MP14,134-136. Más aun, en estos últimos estudios el tratamiento con tioguanina y los consiguientes valores elevados de 6-TGN no se correlacionaron, paradójicamente, con la incidencia de efectos adversos hematológicos134,135,137,138. En resumen, si bien es cierto que algunos estudios han descrito una relación evidente entre las concentraciones elevadas de 6-TGN y la mielotoxicidad, otros no han podido demostrar dicha asociación, lo que obliga a continuar investigando en esta línea.
Concentraciones de metabolitos tiopurínicos y riesgo de hepatotoxicidad debida a AZA/6-MP
Como se ha mencionado previamente, los pacientes con baja actividad de la TPMT tienen, con frecuencia, valores altos de 6-TGN; en sentido contrario, una actividad elevada de la TPMT va seguida de una producción excesiva de 6-MMP/6-MMPR, lo que podría comportar un riesgo aumentado de hepatotoxicidad. De este modo, diversos estudios han confirmado que la acumulación de 6-MMP/6-MMPR (en concentraciones mayores de 5.700 pmol/8 108 hematíes) incrementa el riesgo de sufrir efectos adversos hepáticos6,26,81-83,104, aunque no todos los autores coinciden en ello62. No obstante, es preciso recalcar que la excesiva actividad de la TPMT no es la única causa que condiciona el metabolismo preferencial de la AZA por la vía de la 6-MMP/6-MMPR, pues se ha demostrado una desproporcionada acumulación de estos metabolitos en algunos pacientes con actividad normal de la TPMT82. Puesto que la hepatotoxicidad puede tardar en aparecer varias semanas tras haberse detectado unos valores excesivos de 6-MMP/6-MMPR, algún autor ha recomendado la reducción de la dosis de AZA/6-MP precozmente, para así «adelantarnos» a la aparición de estos efectos adversos82.
Concentraciones de metabolitos tiopurínicos y eficacia clínica de la AZA/6-MP
Dado que los 6-TGN son los metabolitos tiopurínicos activos, sería lógico pensar que sus concentraciones séricas podrían ser útiles para ajustar la dosis de AZA/6-MP. Así, algunos autores han demostrado que los pacientes con EII tratados con AZA/6-MP que responden favorablemente y alcanzan la remisión clínica tienen unos valores me-dios de 6-TGN superiores a los de los pacientes en que ha fracasado el tratamiento inmunomodulador26,87,89,90,104,106,107,120,127,139,140. Estudios recientes han confirmado que los pacientes tratados con dosis bajas de AZA/6-MP tienen unas concentraciones subterapéuticas de 6-TGN, y que al incrementar progresivamente la dosis de los fármacos tiopurínicos se logra alcanzan valores más elevados de estos metabolitos y se consigue así una mejor respuesta clínica84,120, si bien otro estudio demuestra que este objetivo únicamente se consigue en una minoría de los pacientes82.
En sentido contrario, en otros estudios no se ha podido comprobar ninguna relación entre la actividad de la EII de los pacientes tratados con AZA/6-MP y las concentraciones séricas de 6-TGN y, de hecho, se han descrito numerosos pacientes que han logrado la remisión clínica con estos inmunomoduladores a pesar de no alcanzar unos valores de 6-TGN considerados «suficientes»77,91,92,126,128,133,141. Más aun, tras la administración directa de tioguanina se obtuvieron, en 2 estudios muy recientes, unas concentraciones impredecibles de 6-TGN, y además estas últimas no se correlacionaron claramente con la eficacia terapéutica134,135.
Finalmente, cabe destacar que incluso en los estudios en que se evidencia una diferencia en los valores de 6-TGN entre los pacientes con y sin respuesta clínica, no se ha podido identificar un punto de corte nítido que pueda discriminar de forma certera entre ambos grupos. De este modo, la notable amplitud de los rangos observados en pacientes en remisión o en actividad, y la superposición entre los valores de 6-TGN, hace casi imposible elaborar una aproximación diagnóstica común razonable.
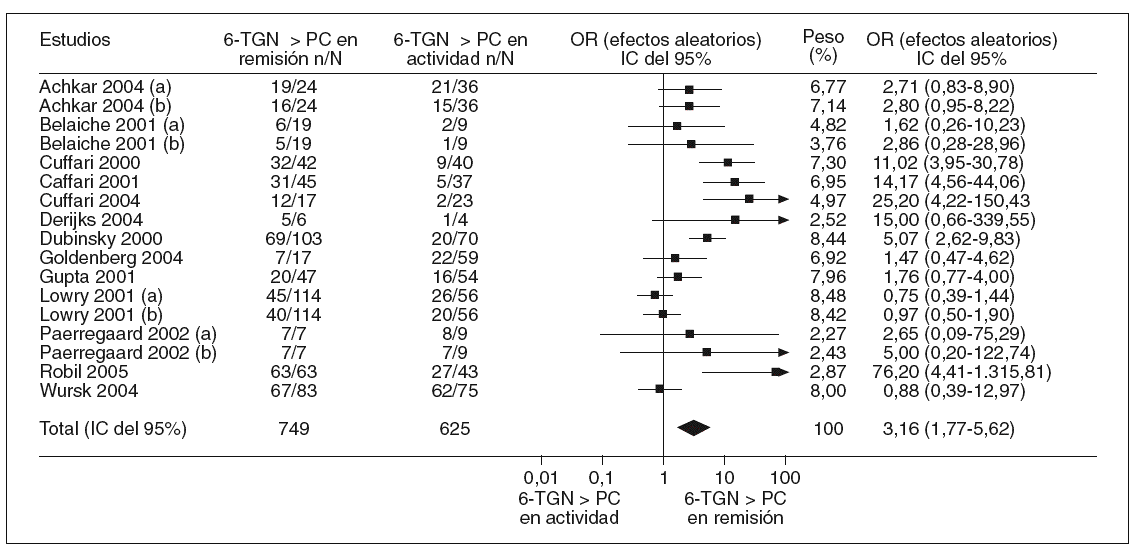
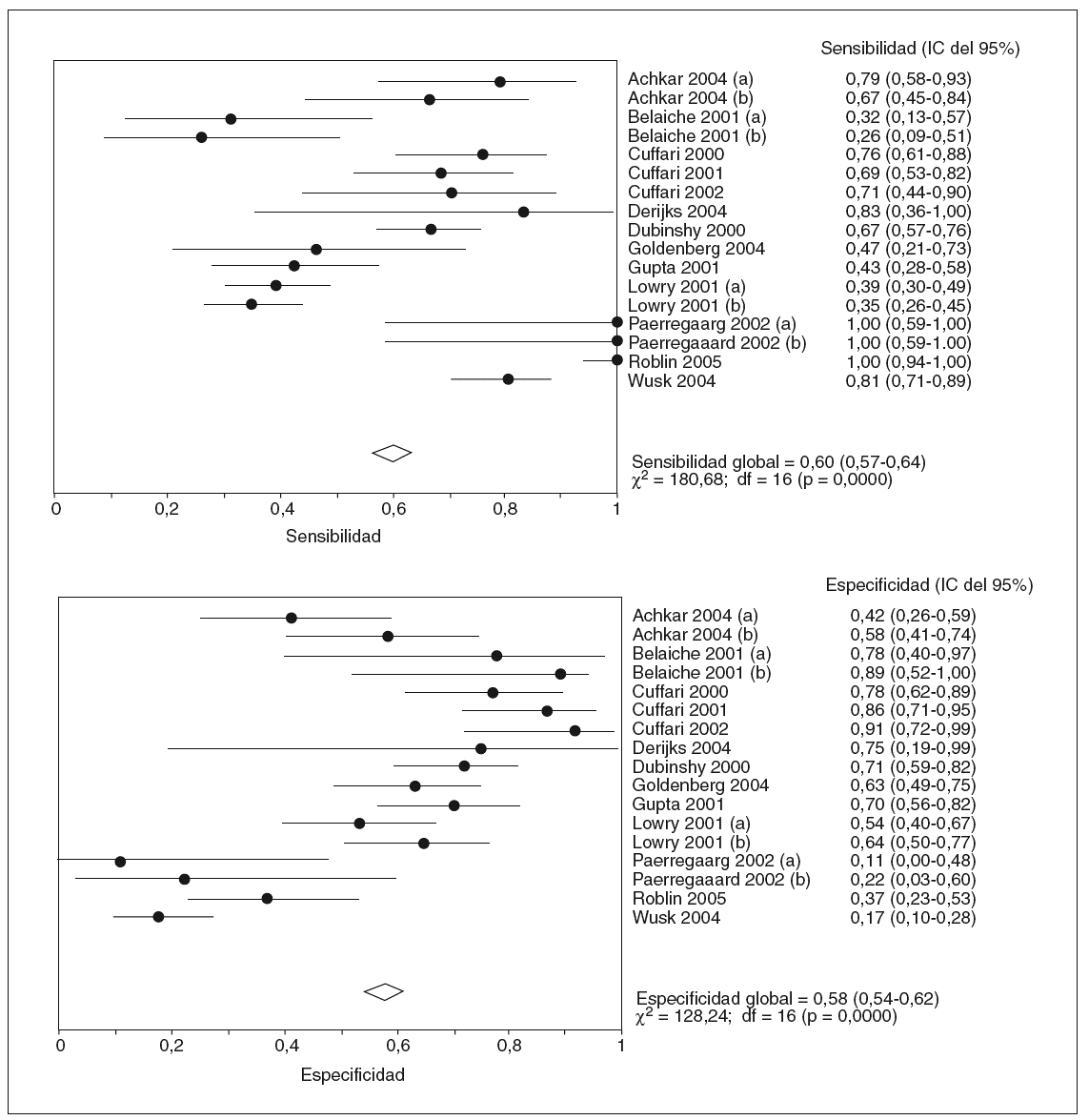
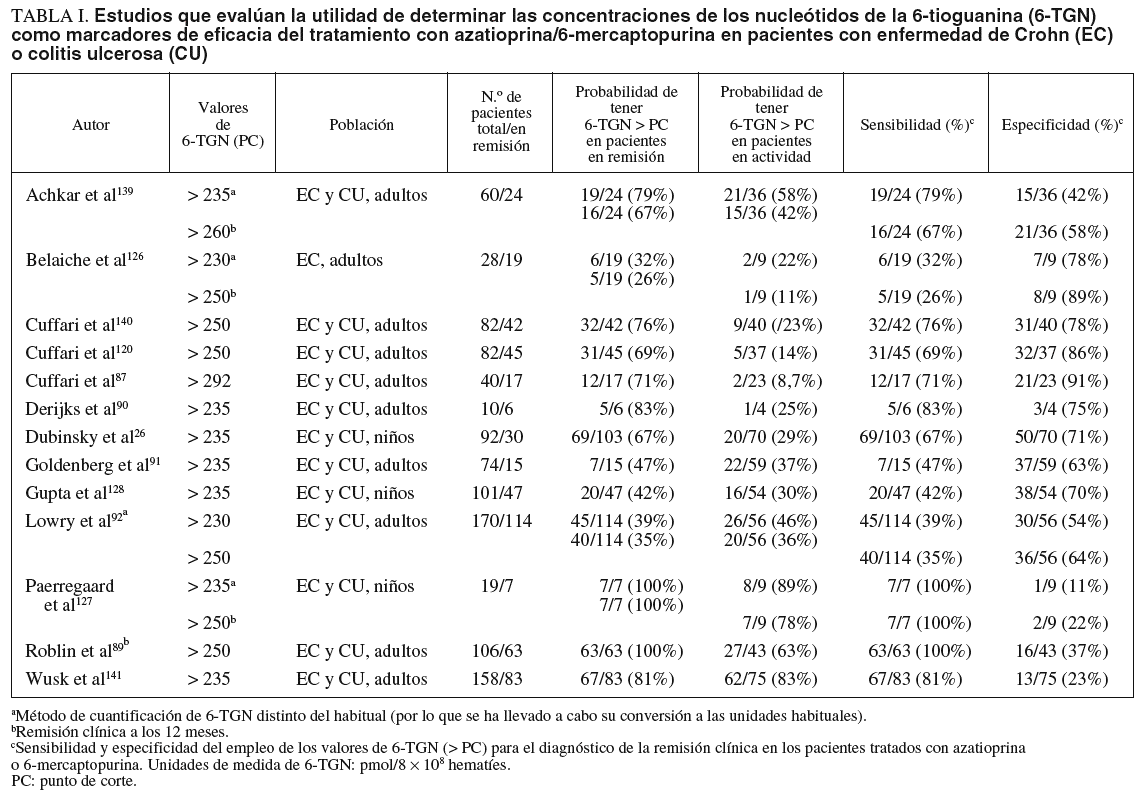
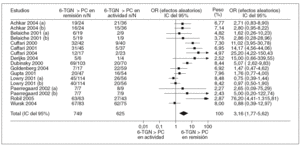
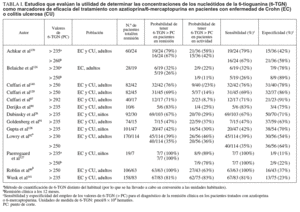
En la tabla I se resumen los estudios que han evaluado la utilidad de determinar los valores de 6-TGN como marcadores de eficacia del tratamiento con AZA/6-MP, y a partir de los que se puede calcular la exactitud diagnóstica de dicha cuantificación26,87,89-92,120,126,128,139-141. Otros autores han determinado también estos metabolitos tiopurínicos, pero la presentación de los resultados no ha permitido la valoración de un punto de corte concreto77,106,107,133. A partir de los estudios incluidos en la tabla I se puede comparar la probabilidad de detectar unas concentraciones de 6-TGN superiores a un determinado punto de corte en los pacientes en remisión y en actividad. Así, como se representa gráficamente en la figura 2, la odds ratio para esta asociación es de 3,16 (intervalo de confianza [IC] del 95%, 1,8-5,6), lo que indica que, efectivamente, la probabilidad de encontrar unos valores de 6-TGN por encima de un determinado punto de corte es, aproximadamente, 3 veces mayor en los pacientes en remisión que en los que presentan actividad clínica. Sin embargo, la traducción práctica de esta asociación es escasa, pues la detección de unas concentraciones de 6-TGN superiores a un cierto valor tiene una sensibilidad y una especificidad para el diagnóstico de la remisión clínica en los pacientes con EII tratados con AZA/6-MP de tan sólo el 60 y el 58%%, respectivamente (fig. 3).
Fig. 2. Asociación entre las concentraciones de los nucleótidos de la 6-tioguanina (6-TGN) y la remisión clínica en los pacientes con enfermedad inflamatoria intestinal tratados con azatioprina o 6-mercaptopurina. (a) y (b) indican diferentes puntos de corte para las concentraciones de los nucleótidos de la 6-tioguanina (véase tabla I para más detalles). IC: intervalo de confianza; OR: odds ratio; PC: punto de corte.
Fig. 3. Exactitud diagnóstica de la determinación de los valores de los nucleótidos de la 6-tioguanina como marcadores de eficacia del tratamiento con azatioprina o 6-mercaptopurina en pacientes con enfermedad inflamatoria intestinal. (a) y (b) indican diferentes puntos de corte para las concentraciones de los nucleótidos de la 6-tioguanina (véase tabla I para más detalles). IC: intervalo de confianza.
Además, como también puede observarse en la figura 3, los resultados son notablemente heterogéneos, lo que obliga a interpretar con cautela los hallazgos derivados de la combinación de los estudios. Los resultados contradictorios obtenidos por diversos autores podrían explicarse, al menos en parte, por diversas diferencias en: a) la población de estudio (adultos o niños); b) el diseño del protocolo (estudios retrospectivos, transversales o prospectivos); c) el número de pacientes incluido (muy reducido en algunos casos, con la consiguiente limitación de su potencia estadística); d) el índice utilizado para evaluar la respuesta clínica (índices de actividad clásicos o de calidad de vida); e) el tiempo de seguimiento desde que se inició el tratamiento con AZA/6-MP (pues es bien sabido que la latencia para constatar el efecto beneficioso de estos fármacos varía considerablemente); f) los criterios de exclusión (en algún estudio se excluyen precisamente los pacientes que no han respondido a la AZA/6-MP o que han presentado efectos adversos); g) los métodos de cuantificación de las concentraciones de 6-TGN (lo que puede impedir la comparación directa entre diversos estudios, en especial en lo que se refiere al punto de corte más adecuado)142, y h) la notable variabilidad en las concentraciones de 6-TGN en el mismo paciente con el tiempo, a pesar de recibir una dosis constante de AZA/6-MP, podría justificar algunos resultados discordantes, lo que supone una limitación adicional de la determinación aislada puntual de estos metabolitos tiopurínicos107.
Valores de referencia de los metabolitos tiopurínicos y puntos de corte recomendados
La selección precisa del punto de corte para establecer si las cifras de 6-TGN son o no normales es motivo de controversia. Como se ha expuesto previamente, hay una notable superposición entre los valores considerados en los diversos estudios pero, en general, se acepta que las cifras «normales» de 6-TGN, las que se asocian teóricamente con una mayor probabilidad de respuesta terapética a la AZA/6-MP y un escaso riesgo de efectos adversos, se situarían entre 230 y 450 pmol/8 108 hematíes (tabla I). Por tanto, habitualmente se consideran valores bajos, con probabilidad de inmunosupresión insuficiente, los inferiores a aproximadamente 230 pmol/8 108 hematíes. No obstante, otros autores han recomendado el empleo de puntos de corte más elevados, en torno a 250 pmol/8 108 hematíes (tabla I). En sentido opuesto, habitualmente se han considerado como valores altos y, por tanto, con riesgo de mielotoxicidad, los que se encuentran por encima de 450 pmol/8 108 hematíes. Por su parte, se han definido como normales las concentraciones de 6-MMP menores de 5.700 pmol/8 108 hematíes, y los valores superiores se asociarían con un mayor riesgo de hepatotoxicidad11.
Por último, se ha sugerido que la determinación del cociente entre 6-MMP y 6-TGN, al considerar conjuntamente ambos parámetros, sería más fiable para predecir la respuesta de los pacientes al tratamiento con AZA/6-MP6,82,90. Así, se ha propuesto que un cociente elevado entre 6-MMP y 6-TGN (30-100:1) se asociaría con una actividad elevada de la TPMT6. Dicho de otro modo, los pacientes con un cociente 6-MMPR/6-TGN bajo (p. ej., < 11) responderían mejor al tratamiento6,82,90. No obstante, como ocurre con los metabolitos tiopurínicos, tanto la verdadera utilidad como el punto de corte adecuado del mencionado cociente deberá ser validado en futuros estudios.
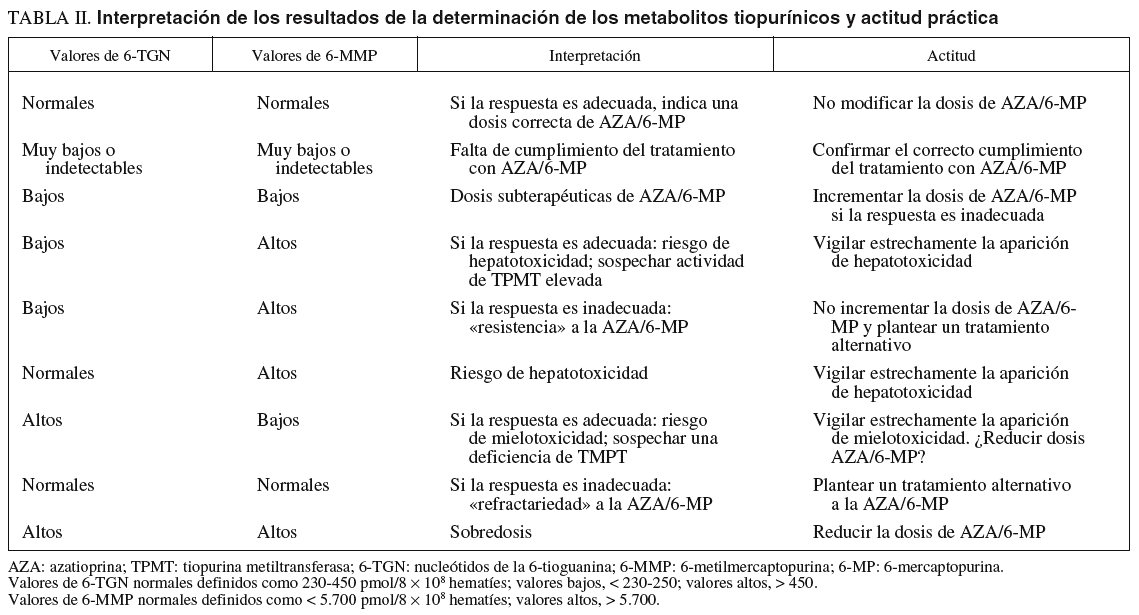
Interpretación de las concentraciones de los metabolitos tiopurínicos y su utilidad en la práctica clínica
En la tabla II se resume la interpretación de las posibles combinaciones de resultados de los metabolitos tiopurínicos y la recomendación que se ha sugerido para cada situación. En primer lugar, unos valores normales tanto de 6-TGN (230-450 pmol/8 108 hematíes) como de 6-MMP (< 5.700 pmol/8 108 hematíes) indicaría que, si la respuesta clínica es adecuada, se ha administrado la dosis correcta de AZA/6-MP. El hallazgo de concentraciones muy bajas o indetectables de ambos metabolitos haría sospechar una falta de cumplimento terapéutico. Si los valores de 6-TGN y 6-MMP son bajos, pero no tanto como en el supuesto previo, cabría deducir que se han administrado dosis subterapéuticas de AZA/6-MP y, en ausencia de respuesta clínica, el incremento de su dosis sería la actitud recomendable. En cualquier caso, debe tenerse presente que el objetivo fundamental es conseguir la remisión clínica (y evitar la toxicidad), y no alcanzar unas adecuadas concentraciones de metabolitos séricos per se. Por tanto, si las concentraciones de 6-TGN son bajas pero la respuesta clínica a la AZA/6-MP es adecuada, no será preciso incrementar la dosis de estos fármacos. En el extremo contrario, unas concentraciones elevadas de ambos metabolitos en un paciente con respuesta al tratamiento indicarían una sobredosis y quizá harían aconsejable reducir la posología. Los pacientes denominados «resistentes» a la AZA/6-MP tendrían unos valores bajos de 6-TGN y altos de 6-MMP, lo que indicaría una preferencia de la vía de síntesis de metabolitos inactivos, con el consiguiente riesgo de hepatotoxicidad; en estos casos, el incremento de la dosis de AZA no conseguirá alcanzar unas adecuadas concentraciones de 6-TGN, sino que elevará aún más los valores de 6-MMP, por lo que debería plantearse un tratamiento alternativo (con otros inmunomoduladores o cirugía). Por último, los pacientes auténticamente «refractarios» presentarían un perfil de metabolitos tiopurínicos similar al de los respondedores, pero sin respuesta al tratamiento a la AZA/6-MP. Estos pacientes deberían ser también candidatos a tratamiento coadyuvante o alternativo, en lugar de empecinarse en incrementar la dosis de AZA/6-MP, lo que probablemente será inútil. Otras situaciones intermedias quedan también recogidas en la tabla II.
Coste-eficacia del seguimiento de los metabolitos tiopurínicos
Como en el caso de la TPMT, algunos autores han llevado a cabo una evaluación farmacoeconómica de la determinación sistemática de la actividad de los 6-TGN en los pacientes que van a recibir tratamiento con AZA/6-MP empleando modelos de análisis de decisión, y han concluido que la evaluación de la actividad TPMT es más útil para estimar inicialmente la respuesta al tratamiento (al permitir administrar desde el comienzo dosis plenas de AZA/6-MP), mientras que la cuantificación de los 6-TGN sería más coste-efectiva para la evaluación de la respuesta sostenida a lo largo del seguimiento (al detectar valores subterapéuticos de estos metabolitos y permitir, por tanto, la corrección la dosis de AZA/6-MP más precozmente)113.
Indicaciones para el seguimiento de los metabolitos tiopurínicos en la práctica clínica
Como se deduce de lo hasta aquí expuesto, actualmente no está establecida la utilidad de la determinación sistemática, en la práctica clínica, de las concentraciones de 6-TGN y 6-MMP en los pacientes tratados con AZA/ 6-MP. Así, se ha sugerido que probablemente su cuantificación sólo estaría indicada en las siguientes situaciones6,10,11,84,93,143: a) cuando se sospecha que el paciente no está cumpliendo correctamente el tratamiento con AZA/6-MP (para así confirmar la sospecha clínica); b) cuando se administre tratamiento concomitante con alopurinol (por el incremento en la síntesis de 6-TGN que puede inducir); c) cuando la actividad de la TPMT es baja, y quizá también intermedia (con el objetivo de ajustar con precisión las dosis, más bajas, de AZA/6-MP); d) cuando se detecta un efecto adverso (especialmente si es de tipo hematológico o hepático), y e) finalmente, y sobre todo, cuando no hay respuesta clínica o se produce una recidiva de la enfermedad a pesar de administrar una dosis estándar de AZA o 6-MP. En este último caso, como se ha revisado previamente, el hallazgo de unas concentraciones adecuadas de 6-TGN confirmaría la refractariedad a los fármacos tiopurínicos y nos obligaría a optar sin más demora por otras alternativas terapéuticas; por el contrario, unos valores de 6-TGN bajos nos llevarían a incrementar la dosis de AZA/6-MP. No obstante, la verdadera utilidad de las indicaciones expuestas, en particular de la última estrategia, deberá demostrarse en estudios prospectivos diseñados a tal efecto.
Interacciones farmacológicas con la AZA/6-MP: papel de los metabolitos tiopurínicos
Algunos estudios han sugerido que la administración de AZA/6-MP asociada al tratamiento con infliximab mejora su eficacia y, sobre todo, su seguridad; de hecho, se recomienda el tratamiento combinado144. Aunque esta mejor respuesta se atribuye generalmente a la prevención de la formación de anticuerpos antiinfliximab, también se ha postulado la existencia de una interacción farmacológica sinérgica entre infliximab y AZA, que potenciaría la eficacia de esta última. Así, un reciente estudio ha cuantificado los valores de 6-TGN en pacientes con EII que estaban recibiendo previamente AZA y requerían posteriormente infliximab, y se ha demostrado un incremento de estas concentraciones entre 1 y 3 semanas después de administrar la infusión de infliximab, aunque las cifras de 6-TGN se normalizaron posteriormente145. Además, la constatación de un incremento en los valores de 6-TGN por encima de 400 pmol/8 108 hematíes en este mismo estudio se correlacionó estrechamente con una buena tolerancia y una respuesta favorable al infliximab145.
CONCLUSIONES
A pesar del elevado número de pacientes con EII que reciben tratamiento con AZA/6-MP, no conocemos actualmente cuál es la dosis más adecuada para cada uno de ellos. Se han sugerido diversas estrategias para evaluar de forma individualizada y de modo más fiable la dosis de AZA/6-MP con la intención, por una parte, de identificar a los pacientes con riesgo de toxicidad por estos fármacos y, por otro, a los pacientes con dosis subterapéuticas e inmunodepresión inadecuada. Entre estas estrategias destacan como las más prometedoras la determinación de la actividad de la TPMT y el seguimiento de los metabolitos tiopurínicos. La actividad de la enzima TPMT parece ser el factor más importante en la regulación de las concentraciones de los 6-TGN. La actividad de la TPMT en la población general sigue una distribución trimodal, en la que aproximadamente el 0,3% de los individuos es homocigoto para el alelo de baja actividad. La identificación de los pacientes con deficiencia de TPMT se puede llevar a cabo mediante la determinación de la actividad enzimática (fenotipo) o de las diversas mutaciones presentes en el ADN celular (genotipo). Hay una elevada concordancia entre ambas estrategias y cada una tiene sus ventajas e inconvenientes. Se ha demostrado una notable correlación entre el fenotipo o el genotipo de baja actividad de la TPMT y el riesgo de mielotoxicidad. Sin embargo, el papel que puede desempeñar este parámetro en la predicción de otros efectos adversos no hematológicos es aún controvertido. Aunque se ha sugerido que mediante la determinación de la actividad enzimática de la TPMT podría estimarse la probabilidad de que la dosis administrada de AZA esté produciendo la inmunodepresión adecuada y el consiguiente efecto terapéutico, este punto precisa aún ser confirmado. Los pacientes con un genotipo o fenotipo homocigoto de alta actividad de la TPMT deberían recibir dosis de inmunosupresores que hayan demostrado ser claramente eficaces. Por el contrario, en los pacientes con genotipo o fenotipo homocigoto de baja actividad de la TPMT se debería contraindicar el empleo de AZA/6-MP o, en todo caso, sería obligado administrar dosis muy reducidas de estos fármacos. Aunque algunos estudios farmacológicos han evidenciado una inhibición de la TPMT o un incremento en los 6-TGN debidos al tratamiento con sulfasalazina o 5-aminosalicilatos, otros no han podido confirmar que esta interacción sea clínicamente relevante. En resumen, la determinación de la actividad de la TPMT es una atractiva opción para individualizar el empleo de AZA/6-MP y prevenir el riesgo de efectos adversos, aunque está por demostrar si esta estrategia es coste-efectiva y si debe, definitivamente, aplicarse sistemáticamente en todos los pacientes. En cualquier caso, es importante recalcar que el déficit de TPMP explica sólo un porcentaje de los casos de mielotoxicidad, por lo que los controles analíticos periódicos deben seguir realizándose en los pacientes que reciben AZA/6-MP, aunque la función de esta enzima sea normal.
A pesar de los múltiples estudios que han evaluado el papel de los metabolitos tiopurínicos en el seguimiento del tratamiento con AZA/6-MP, aún no se conoce con seguridad si hay una correlación y cuán estrecha es entre la actividad de la TPMT y las concentraciones intracelulares de 6-TGN y 6-MMP. Del mismo modo, se desconoce si la relación que se ha descrito por algunos autores entre dichas concentraciones y la eficacia y los efectos adversos de la AZA/6-MP es suficientemente precisa como para que su determinación sea útil en la práctica clínica. Los resultados contradictorios descritos en la literatura médica podrían deberse a diferencias metodológicas o de diseño del estudio. La elección del punto de corte adecuado para las concentraciones de 6-TGN es también motivo de controversia. Aunque, en teoría, la cuantificación de los metabolitos tiopurínicos podría ser útil tanto para los pacientes con riesgo de toxicidad (en los que debería llevarse a cabo un seguimiento más estrecho) como para los que presentan una respuesta inadecuada (en los que la comprobación de unos valores bajos de 6-TGN llevaría a incrementar la dosis de AZA/6-MP), actualmente no está establecida la utilidad de su determinación sitemática en los pacientes tratados con fármacos tiopurínicos, cuya cuantificación está limitada, en todo caso, a algunas circunstancias problemáticas, como la ausencia de respuesta al tratamiento tiopurínico o la aparición de efectos adversos. Se precisan estudios prospectivos amplios, con un diseño adecuado (aleatorizado), que comparen la estrategia habitual de dosificación de la AZA/6-MP (basada únicamente en el peso del paciente) frente al seguimiento individualizado (basado en la cuantificación de la actividad de la TPMT y/o de los metabolitos tiopurínicos) para poder concluir definitivamente cuál es la alternativa más adecuada desde el punto de vista de la eficacia, de la seguridad y de la relación coste-beneficio.