La neoplasia sólida seudopapilar del páncreas es una entidad rara, que típicamente se presenta en mujeres jóvenes y que tiene un pronóstico relativamente favorable. La evaluación histológica usualmente revela áreas papilares y áreas sólidas, de bajo potencial maligno, como el nombre lo indica. Se realiza un estudio retrospectivo de 5 casos diagnosticados y tratados en nuestra institución, con descripción de las características clínicas e histopatológicas. Todas las pacientes fueron del sexo femenino, de entre 13 y 27 años y consultaron por dolor abdominal. En todas se detectó un tumor pancreático mayor de 4cm distribuido en todos los segmentos del páncreas. El diagnóstico anatomopatológico fue el de neoplasia sólida-seudopapilar del páncreas, con un recuento mitótico bajo y en solo 2 casos se reportó angioinvasión e invasión neural.
Solid pseudopapillary pancreatic neoplasms (SPPN) are rare entities mainly diagnosed in young women. Prognosis is generally relatively favorable. Histological evaluation usually reveals papillary as well as solid areas of low malignant potential, as the name implies. A retrospective review of five cases, diagnosed and treated in our institution, is presented with the corresponding clinical and pathological data and follow-up. All SPPN occurred in women, with an average age of 19years (13 to 27years), who consulted for abdominal pain. In all patients, the tumors were > 4cm, distributed in several pancreatic segments. The histopathologic report confirmed papillary as well solid areas and low mitotic count. In two patients, neural and angioinvasion were found.
La neoplasia sólida-seudopapilar del páncreas es una entidad rara, observada por primera vez en 1927 en una mujer de 19 años y descrita por Frantz en 19591. A través del tiempo, este tumor ha sido llamado por distintos nombres, como: tumor de Frantz; tumor sólido y papilar; tumor quístico papilar; tumor sólido-quístico; neoplasia epitelial sólida, quística y papilar; tumor papilar de páncreas benigno o maligno; etc., hasta que la OMS propone el término de «neoplasia sólida-seudopapilar», nombre que se debe a sus 2 características histológicas más importantes: áreas sólidas y áreas seudopapilares2.
Estos tumores representan entre el 1 y el 2% de los tumores originados en el páncreas exocrino y es más frecuente en mujeres, con una relación 9:13. La edad promedio de presentación es de 30 a 35 años, sin embargo, se han reportado casos entre 8 y 67 años.
La etiología del tumor es desconocida, sin embargo, su distribución por edad y sexo orientan a factores genéticos y hormonales. No tiene asociación conocida con el uso de anticonceptivos orales (ACO).
Los síntomas de presentación no son específicos y un porcentaje de ellos corresponde a hallazgos incidentales en exámenes realizados por otros motivos, posterior a traumatismos abdominales o durante exámenes obstétricos o ginecológicos. Otro porcentaje de pacientes se presentan con malestar o dolor abdominal, y es muy poco frecuente la ictericia, incluso en los tumores ubicados en la cabeza del páncreas. No hay alteraciones endocrinas pancreáticas y los marcadores tumorales son normales.
El estudio de imágenes abdominales revela lesiones bien delimitadas sólidas quísticas en proporción variable, sin septos internos. Angiográficamente son hipovasculares o levemente hipervasculares.
Pacientes y métodoSe buscaron en la base de datos de biopsias del Servicio de Anatomía Patológica del Hospital Clínico de la Universidad de Chile, todos los casos biopsia y citologías pancreáticas desde 1992 hasta mayo de 2009.
Se obtuvieron 5 casos con el diagnóstico de neoplasia sólida seudopapilar y se rescataron los antecedentes clínicos de la ficha clínica. A todas las pacientes se les realizó una resección quirúrgica y los diagnósticos fueron hechos en la pieza quirúrgica. Se obtuvo seguimiento de 4 de los casos.
ResultadosSe obtuvieron 333 informes de biopsias de páncreas y 18 citologías. De los estudios histopatológicos, 80 casos correspondieron a enfermedad inflamatoria y 228 a enfermedades neoplásicas, de las cuales 177 fueron neoplasias malignas (77,6%). Cinco casos correspondían a neoplasia sólida seudopapilar del páncreas (2,2%).
Con respecto a este último grupo, los 5 casos correspondían a mujeres cuyas edades fluctuaron entre los 13 y los 27 años, con un promedio de 19 años. Todas las pacientes eran sanas y 3 de ellas usuarias de ACO. Todas consultaron por dolor abdominal de meses de evolución. Los principales hallazgos de laboratorio y de imágenes se resumen en la tabla 1. En 4 de las pacientes se realizó una pancreatectomía parcial distal, una de ellas con esplenectomía y en un caso se realizó una pancreatoduodenectomía.
Características clínicas de las lesiones y de imagen de los tumores
| Caso | Sexo | Años | Síntoma principal | Alteraciones bioquímicas | Hallazgos por técnicas de imagen |
| TC de abdomen | |||||
| 1 | F | 27 | Dolor epigástrico, irradiado al dorso | - | Tumor sólido, de bordes bien definidos, nodular, hipodenso |
| 2 | F | 15 | Dolor abdominal difuso | - | Tumor encapsulado de contenido heterogéneo |
| 3 | F | 18 | Dolor epigástrico e hipocondrio izquierdo | PCR 34,9 mg/dl | Lesión sólido-quística aparentemente encapsulada |
| Htco: 32,5% | |||||
| Hb: 10,5 g/dl | |||||
| 4 | F | 13 | Dolor epigástrico e hipocondrio izquierdo | PCR 60 mg/dl | Masa bien delimitadaa |
| Ldh 876 U/l | |||||
| VHS 83 mm/h | |||||
| Ca 19-9: 40 U/ml | |||||
| 5 | F | 23 | Dolor hipocondrio derecho | LDH 550 U/l | Lesión expansiva de predominio quístico |
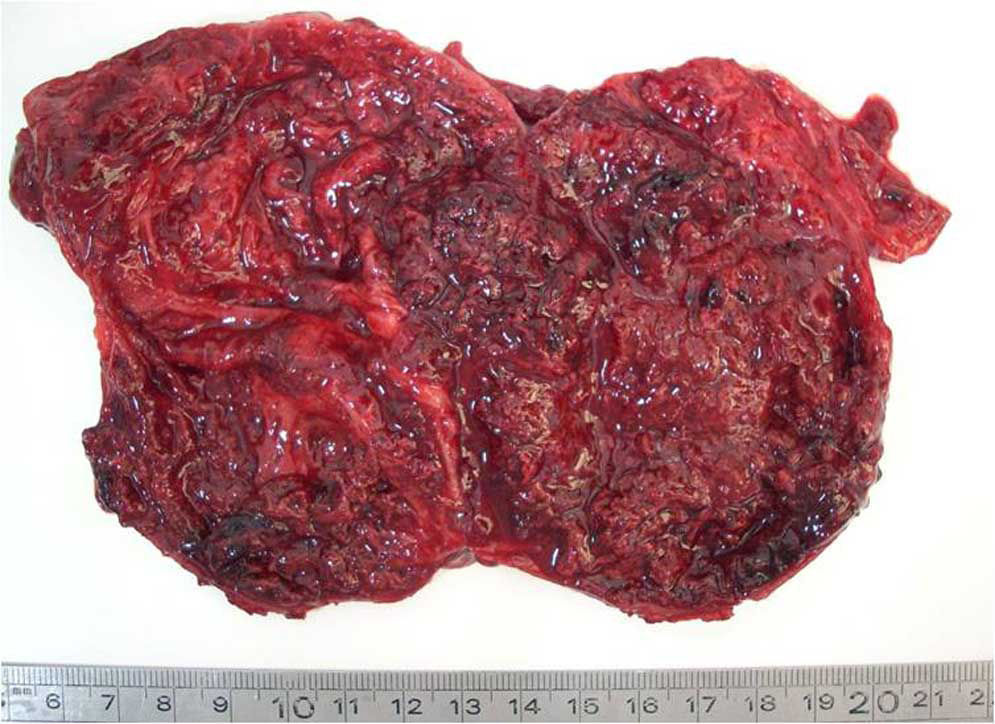
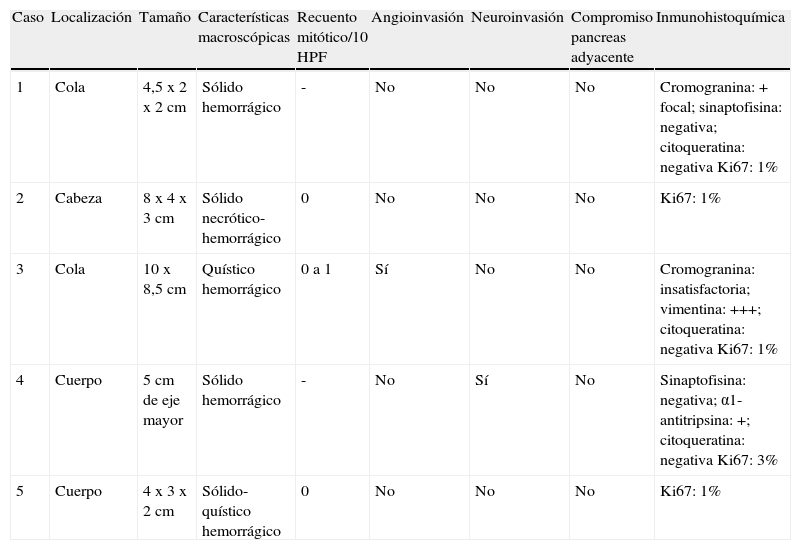
Macroscópicamente, los tumores eran masas grandes (entre 4 y 10cm), redondeadas y solitarias, bien delimitadas con respecto al páncreas adyacente, sólidas o sólido-quísticas con áreas de hemorragia (fig. 1).
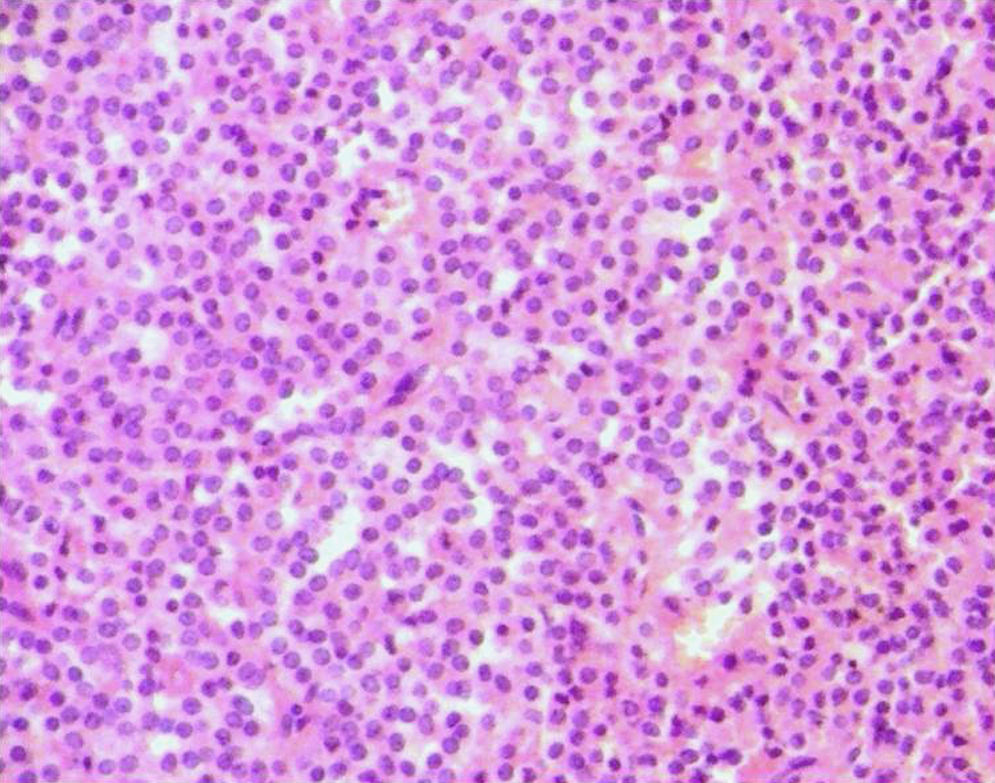
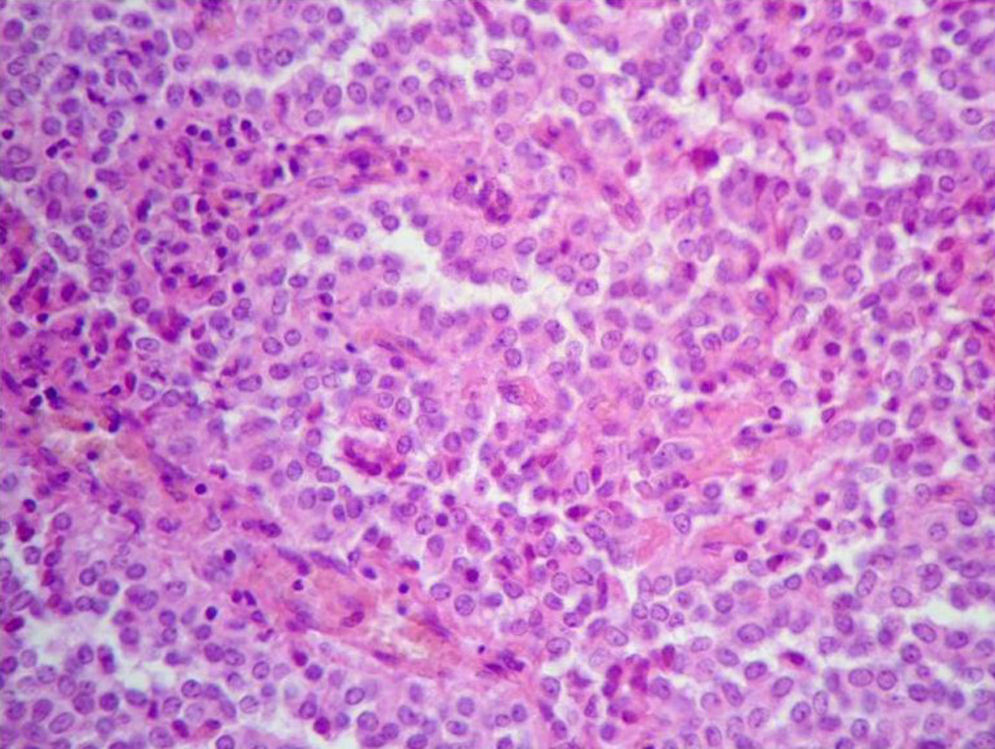
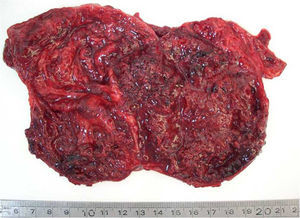
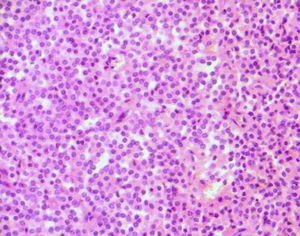
Microscópicamente en las áreas sólidas se observa una proliferación celular monomorfa de células poligonales, uniformes, con núcleos hendidos, de arquitectura con patrón seudopapilar hacia el centro, (figs. 2 y 3). Los principales hallazgos histopatológicos se resumen en la tabla 2. En 3 tumores se realizó pancitoqueratina que resultó negativa; uno de ellos fue positivo para vimentina, y uno para α1-antitripsina. La cromogranina fue positiva focal en uno de los tumores. Se realizó Ki67 en los 5 casos, siendo en 4 de ellos cercanos al 1%, y en uno de ellos, el que presentaba permeaciones perineurales, de un 3%. Se pudo obtener información del seguimiento en 4 de los 5 casos reportados, y hasta la fecha, las 4 pacientes se encuentran en buen estado general, y sin recidivas, con un período de seguimiento entre 2,4 y 10 años.
Características histopatológicas de los tumores reportados
| Caso | Localización | Tamaño | Características macroscópicas | Recuento mitótico/10 HPF | Angioinvasión | Neuroinvasión | Compromiso pancreas adyacente | Inmunohistoquímica |
| 1 | Cola | 4,5 x 2 x 2 cm | Sólido hemorrágico | - | No | No | No | Cromogranina: + focal; sinaptofisina: negativa; citoqueratina: negativa Ki67: 1% |
| 2 | Cabeza | 8 x 4 x 3 cm | Sólido necrótico-hemorrágico | 0 | No | No | No | Ki67: 1% |
| 3 | Cola | 10 x 8,5 cm | Quístico hemorrágico | 0 a 1 | Sí | No | No | Cromogranina: insatisfactoria; vimentina: +++; citoqueratina: negativa Ki67: 1% |
| 4 | Cuerpo | 5cm de eje mayor | Sólido hemorrágico | - | No | Sí | No | Sinaptofisina: negativa; α1-antitripsina: +; citoqueratina: negativa Ki67: 3% |
| 5 | Cuerpo | 4 x 3 x 2 cm | Sólido-quístico hemorrágico | 0 | No | No | No | Ki67: 1% |
HPF: hi power field, campos de aumento mayor.
La neoplasia sólida seudopapilar del páncreas es una neoplasia que se presenta predominantemente en mujeres jóvenes, aunque también se han descrito casos en hombres y en niños. En nuestra serie, todos los casos correspondieron a mujeres con una media de edad de 19 años, tal como se ha descrito ampliamente en la literatura médica y se ha reportado en otras series4. En todos los casos el cuadro clínico fue similar al descrito en la literatura científica y consultaron por dolor abdominal recurrente, si bien se han reportado casos con presentaciones poco comunes como hematemesis5.
La TC es el examen de elección para la detección y caracterización de estos tumores, mientras que la RNM puede ser más precisa en diferenciar el componente sólido-quístico del interior del tumor6. Las imágenes de esta lesión se caracterizan por una masa bien circunscrita, la cual está rodeada por una cápsula peritumoral, con cambios quísticos y hemorrágicos, lo que resulta en el componente heterogéneo quístico central y sólido en la periferia7, como se describe en las imágenes de los casos reportados. La ultrasonografía endoscópica puede ser útil en la evaluación inicial de neoplasias pancreáticas, sobre todo en lesiones quísticas8 y es especialmente útil para realizar una punción guiada de aguja fina que puede llevar a un diagnóstico preoperatorio de certeza en un 75% de los casos9.
El diagnóstico diferencial incluye tumores endocrinos, carcinoma acinar, pancreatoblastoma, adenocarcinoma ductal y tumores quísticos.
Estos tumores se distribuyen uniformemente en todos los segmentos pancreáticos y se presentan como masas solitarias, redondeadas, bien delimitadas con respecto al páncreas adyacente, con tamaños que varían desde unos pocos centímetros hasta masas mayores de 20cm. La macroscopia de estos tumores revela áreas sólidas pardo blanquecinas con focos de necrosis y hemorragia, y otras zonas quísticas que contienen fragmentos necróticos. En la medida que aumentan de tamaño, las áreas de degeneración quística- hemorrágica van creciendo hasta que llegan a simular un seudoquiste. En la histología hay áreas sólidas compuestas de células epitelioides poligonales distribuidas en un patrón seudopapilar con células tumorales de apariencia blanda, de mediano tamaño, citoplasmas basófilos, y núcleos redondeados u ovoides aumentados de tamaño con membrana nuclear reforzada y cromatina en grumos finos. En numerosas células se observa la presencia de hendiduras nucleares y ocasional evidencia de cambios degenerativos. Recientemente se ha reportado una variedad de células predominantemente fusadas10. Pueden encontrarse histiocitos espumosos, cristales de colesterol, fibrosis y calcificaciones11. En los casos predominantemente quísticos, sólo se encontrará tumor en las áreas subcapsulares del quiste. Mitosis muy escasas y no se observa glucógeno o mucina. Las células tumorales son PAS y azul Alcián negativas. Con respecto a la inmunohistoquímica: α1-antitripsina y α1-antiquimotripsina son intensamente positivas, pero en un pequeño grupo de células. La enolasa neuronal específica y vimentina, CD-10 y β-catenina nuclear son positivas en forma constante, pero no específica. Comunicaciones recientes han sugerido que la marcación con Ki67 se puede correlacionar con el potencial maligno y el peor pronóstico de estas neoplasias, por lo que se sugiere que todos estos tumores deben ser estudiados con esta tinción a fin de predecir mejor su potencial maligno, tal como se observó en uno de nuestro casos en que el Ki67 que fue mayor se presentó en el caso que presentaba permeaciones perineurales, siendo este un método simple de realizar, que puede darnos importante información sobre la naturaleza biológica de estas lesiones12,13.
Si bien la neoplasia sólida seudopapilar del páncreas es considerada un lesión indolente con un bajo potencial maligno y un pronóstico favorable después de la resección quirúrgica, se han reportado metástasis entre un 10 y un 15% de los casos, con mayor frecuencia hacia peritoneo, omento mayor e hígado (más frecuentemente como tumor solitario) y menos a menudo hacia linfonodos regionales y tejido celular subcutáneo. Recurrencias locales se presentan con muy baja frecuencia y en un período entre 3 y 10 años. Las características histológicas que orientan hacia un comportamiento más agresivo son angioinvasión, invasión perineural y afectación del páncreas adyacente, agregándose en algunos reportes el grado de atipia nuclear, recuento mitótico elevado y muchas figuras apoptóticas. En caso de presentarse estos criterios, algunos autores sugieren llamarlos «carcinomas sólidos seudopapilares», y si no están presentes considerarlos de malignidad borderline, ya que aún en estos casos puede originar metástasis aunque con baja frecuencia. Según un reciente reporte, la supervivencia estimada a 1,3 y 5 años es de 99,4, 97,5 y 96,9%, respectivamente12.
El hecho de que en 2 de los 5 casos se haya observado angioinvasión e invasión neural, respectivamente, orienta a un probable comportamiento maligno de estas neoplasias. Sin embargo, el pronóstico es favorable, aun en presencia de metástasis o recurrencia local (que no son contraindicaciones de la cirugía)14,15 y la resección quirúrgica generalmente es curativa.
En conclusión, estos casos demuestran la necesidad de un seguimiento estricto y regular de todos los pacientes a fin de diagnosticar una posible recurrencia local o metástasis a distancia y así elegir la adecuada alternativa terapéutica, con particular atención a tumores mayores de 5cm de diámetro y/o con histología indicativa de una probable conducta maligna, así como aquellos que presentan un índice de proliferación mayor con técnicas de inmunohistoquímica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses