Los inhibidores de la bomba de protones (IBP) constituyen uno de los grupos farmacológicos más usados y su potencial toxicidad se revisa periódicamente haciendo hincapié en aspectos que en un primer momento se habían considerado secundarios. En la presente revisión se analizan las bases fisio-farmacológicas y la limitada evidencia clínica de una potencial relación entre la administración continuada de IBP y la aparición de osteoporosis y fracturas óseas. Ambas patologías están claramente relacionadas con la homeostasis del calcio, y son de gran importancia en pacientes de edad avanzada por su mal pronóstico general y las consecuencias invalidantes que conllevan.
Proton pump inhibitors (PPI) are one of the most widely used groups of drugs and their potential toxicity is periodically reviewed, emphasizing aspects originally considered secondary. The present review analyzes the physiological and pharmacological bases and the scarce clinical evidence for a potential association between the continued administration of PPI and the development of osteoporosis and bone fractures. Both disorders are clearly related to calcium homeostasis and are highly important in elderly patients due to their poor general prognosis and disabling consequences.
Los inhibidores de la bomba de protones (IBP) constituyen uno de los grupos farmacológicos más usados1 y su potencial toxicidad se revisa periódicamente haciendo hincapié en aspectos que en un primer momento se habían considerado secundarios2–5. Aunque poseen un mecanismo de acción muy específico y son muy seguros, se considera que la incidencia de sus potenciales efectos adversos podría reducirse aún más restringiendo su prescripción, puesto que hay evidencias de que hasta un 60% del uso de los IBP se realiza en indicaciones médicas donde su eficacia es cuestionable6.
En la presente revisión se analizan las bases fisiofarmacológicas y la evidencia clínica de una relación potencial entre la administración continuada de IBP y la aparición de osteoporosis y fracturas óseas. Ambas están claramente relacionadas con la homeostasis del calcio y son de gran importancia en pacientes de edad avanzada por su mal pronóstico general y las consecuencias invalidantes que conllevan7,8.
Influencia de los inhibidores de la bomba de protones en la homeostasis del calcioHay 2 posibles mecanismos por los cuales la administración crónica de inhibidores de la secreción ácido-gástrica, principalmente inhibidores de la bomba de protones (IBP) y antagonistas de los receptores H2 (anti-H2), podrían hipotéticamente interaccionar con la homeostasis del calcio:
- 1.
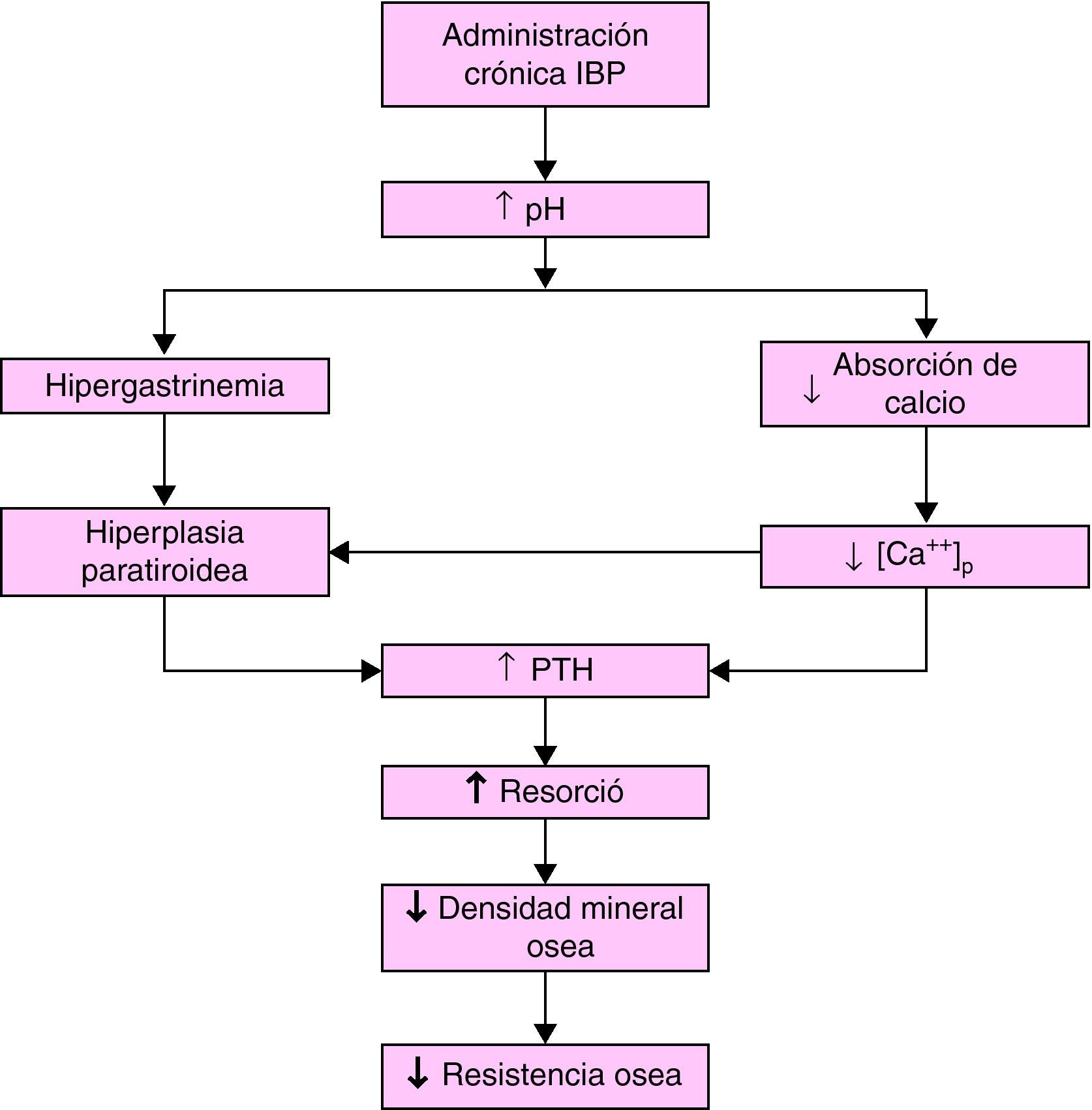
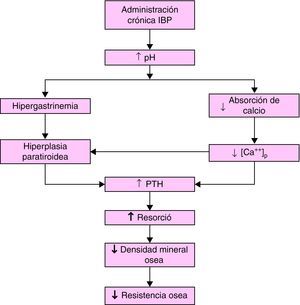
La solubilidad de las sales de calcio es dependiente del pH y el ambiente ácido en la luz gástrica facilita la liberación del ión calcio desde sales relativamente insolubles9–11. El incremento del pH puede reducir la absorción de calcio (al igual que la de otros minerales, nutrientes o fármacos) y generar un déficit del mismo. Al disminuir la calcemia se incrementa la concentración plasmática de parathormona (PTH) (también se aumenta directamente por la hipergastrinemia) que estimularía la actividad de los osteoclastos y aceleraría la pérdida de mineral óseo con un eventual desarrollo de osteoporosis y la subsiguiente posibilidad de fracturas óseas.
Este mecanismo (fig. 1) es el más frecuentemente utilizado para explicar una relación causal entre el incremento del riesgo de fracturas óseas y, en particular, la administración crónica de IBP12, asumiendo que al ser su potencia antisecretora muy superior es lógico que esta problemática se manifieste fundamentalmente con este grupo farmacológico.
Figura 1.Hipótesis del efecto de la administración crónica de IBP sobre la homeostasis del calcio. (Modificada de Yang et al5.).
(0.11MB).Estudios experimentales iniciales observaron que la administración de omeprazol, o una gastrectomía, genera una malabsorción de fosfato cálcico y el deterioro de la densidad mineral ósea, efectos que son revertidos en parte por la acidificación de la luz digestiva13,14. En el mismo sentido, la gastrectomía y la anemia perniciosa se asociaron en el ser humano con un aumento de osteopenia y riesgo de fractura15, y la administración de IBP con un menor incremento de la concentración plasmática de calcio tras la administración de sales de este mineral. Ambos hechos fueron atribuidos a que se había reducido la absorción16–18 o que existía una menor eficiencia en la absorción de dicho ión19. Estos estudios han sido cuestionados20 porque la absorción del calcio era determinada de forma indirecta y utilizando métodos invasivos; por no considerar enfermedades concomitantes que afectan a la homeostasis de este mineral, como la insuficiencia renal o la aclorhidria; o porque valoraban la absorción en ayunas de una sal como el carbonato cálcico, que es menos efectiva en dicha situación.
Además, trabajos más recientes determinando la absorción intestinal de calcio mediante el método del doble isótopo estable, una técnica más precisa para evaluar de forma directa este proceso21, han demostrado que esta no parece verse afectada por la administración de IBP durante periodos cortos. En estos estudios se ha observado que la administración durante un mes de omeprazol a mujeres posmenopáusicas, con una dieta controlada en cuanto a la carga de calcio y controlando que el pH está elevado, no conlleva una reducción en la fracción de absorción de este ión con respecto al inicio del tratamiento manteniendo estables los niveles de vitamina D22. De igual manera, cuando se comparaba la administración aguda de esomeprazol frente a placebo en adultos jóvenes, se observó que aun habiendo un aumento sustancial y sostenido del pH gástrico en el grupo tratado con el IBP, no existían diferencias entre ambos grupos en cuanto a la absorción de calcio ni en el calcio urinario como medida indirecta del metabolismo general de este ión23.
- 2.
Los IBP actúan selectivamente sobre el eslabón final del proceso de secreción de H+ por la célula parietal gástrica, la H+/K+-ATPasa o bomba de protones24. Existen formas similares de esta enzima en colon, riñón y, en particular, en el osteoclasto donde tiene un importante papel dentro del proceso de remodelación ósea. La H+/K+-ATPasa del osteoclasto, denominada vacuolar, permite la resorción ósea al posibilitar la acidificación del nicho o unidad de resorción, imprescindible para la solubilización de los cristales de apatita25, a través de la subunidad Atp6v0d2 de la que depende su capacidad para secretar ácido26. Se ha observado que una alcalinización del medio inhibe la formación y función de los osteoclastos, mientras que la acidificación estimula su actividad27. En principio esta enzima no es una diana de los IBP, por las diferencias estructurales con la existente en la célula parietal y porque el pH que genera no es tan ácido como el de la luz canalicular, imprescindible para que el IBP sufra una óptima protonización, forme el derivado sulfonamido y la inactive. Sin embargo, se ha observado que el omeprazol y el pantoprazol son capaces de reducir la actividad osteoclástica e inhibir la resorción ósea, aunque con una eficacia menor a la de fármacos más selectivos sobre este sistema como la bafilomicina A128. Una actuación en este sentido no parece involucrada en la aparición de fracturas, ya que condicionaría un aumento de la mineralización y la densidad ósea, al menos inicialmente, siendo potencialmente útil frente a la osteoporosis25, y para modular, a corto plazo, la actividad osteoclástica en cirugía reconstructiva donde se emplean implantes de biomateriales de fosfato cálcico, frente a los cuales se activan los osteoclastos poniendo en riesgo su eficacia29,30.
Las evidencias que evalúan el posible riesgo de fracturas óseas en pacientes que toman antisecretores de forma crónica son escasas12,31–35. Los resultados no son concluyentes y no han permitido establecer una relación causal clara. El análisis de los motivos de esta falta de causalidad considera que no se ha tenido en cuenta el impacto de situaciones clínicas concomitantes capaces de modificar dicho riesgo y que existe una falta de relación dosis-respuesta o, cuando se ha observado, se trata de una asociación de baja magnitud36.
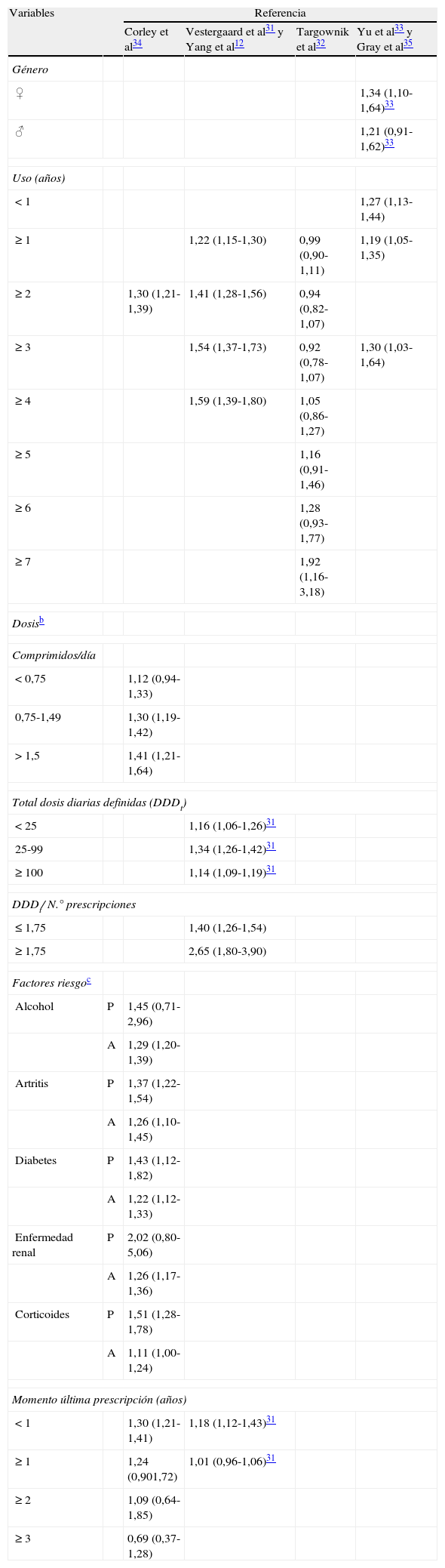
De forma concreta, estos estudios son epidemiológicos, observacionales, del tipo caso-controles, evaluando la posible modificación del riesgo de sufrir fracturas por la exposición previa a inhibidores de secreción ácido-gástrica, en comparación con grupos control no expuestos a dicha medicación, expresándola como odds ratio (OR) o riesgo relativo (RR). La tabla 1 resume los valores más representativos de este parámetro en los principales estudios. En general, estos resultados se ajustan con respecto a factores de confusión que pueden incidir en el riesgo de fracturas incluyendo: a) tanto enfermedades coadyuvantes (epilepsia, diabetes, isquemia miocárdica, hipertensión, artritis reumatoide, EPOC, trasplante de órganos, abuso de estupefacientes, depresión o esquizofrenia); b) la situación socioeconómica, o c) otras medicaciones que pudieran afectar al metabolismo óseo o aumentar el riesgo de caídas (antiandrógenos, antiestrógenos, bisfosfonatos, vasodilatadores, antianginosos, antihipertensivos, anticoagulantes, antidepresivos, benzodiacepinas, barbitúricos, antipsicóticos, antiepilépticos y AINE). Como veremos, en ocasiones se han obtenido resultados contradictorios que dificultan la interpretación global de esta posible asociación. En todos los estudios se cuantifican pacientes diagnosticados en un periodo determinado de fracturas en general, y sobre todo de aquellas que se relacionan más directamente con osteoporosis, como son las de cadera o las vertebrales y, menos, las de antebrazo o muñeca. En muchos casos como un primer diagnóstico de una potencial alteración del metabolismo del calcio se analiza la densitometría ósea.
Riesgo de fractura ósea asociado a la administración de inhibidores de la bomba de protones (IBP) teniendo en cuenta diferentes variables mostrado en las publicaciones citadasa
| Variables | Referencia | ||||
| Corley et al34 | Vestergaard et al31 y Yang et al12 | Targownik et al32 | Yu et al33 y Gray et al35 | ||
| Género | |||||
| ♀ | 1,34 (1,10-1,64)33 | ||||
| ♂ | 1,21 (0,91-1,62)33 | ||||
| Uso (años) | |||||
| < 1 | 1,27 (1,13-1,44) | ||||
| ≥ 1 | 1,22 (1,15-1,30) | 0,99 (0,90-1,11) | 1,19 (1,05-1,35) | ||
| ≥ 2 | 1,30 (1,21-1,39) | 1,41 (1,28-1,56) | 0,94 (0,82-1,07) | ||
| ≥ 3 | 1,54 (1,37-1,73) | 0,92 (0,78-1,07) | 1,30 (1,03-1,64) | ||
| ≥ 4 | 1,59 (1,39-1,80) | 1,05 (0,86-1,27) | |||
| ≥ 5 | 1,16 (0,91-1,46) | ||||
| ≥ 6 | 1,28 (0,93-1,77) | ||||
| ≥ 7 | 1,92 (1,16-3,18) | ||||
| Dosisb | |||||
| Comprimidos/día | |||||
| < 0,75 | 1,12 (0,94-1,33) | ||||
| 0,75-1,49 | 1,30 (1,19-1,42) | ||||
| > 1,5 | 1,41 (1,21-1,64) | ||||
| Total dosis diarias definidas (DDDt) | |||||
| < 25 | 1,16 (1,06-1,26)31 | ||||
| 25-99 | 1,34 (1,26-1,42)31 | ||||
| ≥ 100 | 1,14 (1,09-1,19)31 | ||||
| DDDt/ N.° prescripciones | |||||
| ≤ 1,75 | 1,40 (1,26-1,54) | ||||
| ≥ 1,75 | 2,65 (1,80-3,90) | ||||
| Factores riesgoc | |||||
| Alcohol | P | 1,45 (0,71-2,96) | |||
| A | 1,29 (1,20-1,39) | ||||
| Artritis | P | 1,37 (1,22-1,54) | |||
| A | 1,26 (1,10-1,45) | ||||
| Diabetes | P | 1,43 (1,12-1,82) | |||
| A | 1,22 (1,12-1,33) | ||||
| Enfermedad renal | P | 2,02 (0,80-5,06) | |||
| A | 1,26 (1,17-1,36) | ||||
| Corticoides | P | 1,51 (1,28-1,78) | |||
| A | 1,11 (1,00-1,24) | ||||
| Momento última prescripción (años) | |||||
| < 1 | 1,30 (1,21-1,41) | 1,18 (1,12-1,43)31 | |||
| ≥ 1 | 1,24 (0,901,72) | 1,01 (0,96-1,06)31 | |||
| ≥ 2 | 1,09 (0,64-1,85) | ||||
| ≥ 3 | 0,69 (0,37-1,28) | ||||
Expresado como odds ratio (OR), salvo en las referencias 33 y 35 que se expresa el riesgo relativo (RR), junto con el IC 95%, ajustado a diferentes factores de confusión que pueden contribuir, por sí mismos, al riesgo de fractura.
Los primeros trabajos que evalúan explícitamente la posible relación entre administración crónica de IBP y riesgo de fracturas óseas datan del año 200612,31. Con anterioridad solo existe una publicación en la que de forma colateral se relacionan otros antisecretores con esta problemática37. En un primer estudio se evaluó dicha relación comparando el comportamiento de la administración crónica de IBP con anti-H2 y antiácidos31. Diferenciaba entre riesgo de distintos tipos de fractura según que el tratamiento se mantuviera dentro del año en que se produjo la lesión o se hubiera abandonado con anterioridad. Se observó que la utilización de IBP, dentro del año del incidente de fractura, se relacionaba con un leve incremento estadísticamente significativo en el riesgo global de fractura, y también específicamente en la de cadera y en la vertebral; los anti-H2 con una reducción en los mismos casos y los antiácidos no modificaban el riesgo global pero sí incrementaban el riesgo de fractura de cadera y vertebral. En todos los casos las variaciones en el factor de riesgo son limitadas y prácticamente desaparecían cuando había transcurrido un año desde la última exposición. Otros tratamientos, como la resección gástrica o la administración de AINE o anti-H1, y situaciones patológicas, como úlcera de duodeno y estómago, también incrementan el riesgo de fractura. El riesgo de fractura de antebrazo prácticamente no se modifica por ninguna de las situaciones comentadas excepto la administración de AINE, y sobre todo la resección gástrica, que lo incrementan. Hay que destacar en este estudio que la relación entre administración de IBP y riesgo de fractura no es dependiente de la dosis, lo cual limita la relación de causalidad, mientras los anti-H2 sí la presentan.
Un segundo estudio evaluó la relación entre administración crónica de IBP, durante más de un año, y el riesgo de fractura de cadera12 y generó resultados bastante coincidentes con los obtenidos en el primer análisis31. La elección de este periodo mínimo de tratamiento se basa en que aquellos grupos farmacológicos que han demostrado alterar el riesgo de fracturas, como son los bisfosfonatos, diuréticos tiacídicos y corticosteroides, empiezan a manifestar dicho comportamiento a partir de este periodo de exposición38,39. Se observó que los pacientes que habían recibido IBP durante más de un año mostraban una mayor incidencia de fracturas de cadera que la población que no había estado expuesta a este tratamiento, y que la diferencia era más notable cuanto más elevada era la dosis. El tratamiento con anti-H2 inducía una respuesta similar, pero de menor entidad que la generada con los IBP, lo que estaba en consonancia con un estudio previo donde se observó que la cimetidina podría tener relación con un incremento en el riesgo de la fractura de cadera37. En ambos casos el efecto es dependiente de la dosis, a mayor dosis acumulada el riesgo es mayor, y en el caso de los IBP el riesgo también se incrementa con la duración del tratamiento.
En la misma línea, un estudio posterior32 incidió en la posible relación entre administración de IBP y fracturas de cadera, muñeca y vertebrales; evaluando la prevalencia de fracturas de origen osteoporótico y los factores de riesgo para su desarrollo, asumiendo que si existe esta relación sería más por la exposición acumulada al fármaco que por su administración en el momento de producirse la fractura. Se observó que 7 años de administración continuada de IBP se puede relacionar con la aparición de cualquier tipo de fractura; mientras que cuando discrimina distintos tipos, la de cadera y la vertebral (con mayor significación en el primer caso) se asocian con los IBP a partir de los 5 años de administración. El incremento del riesgo es leve, pero significativo y similar al descrito para otros factores de riesgo de fracturas relacionadas con procesos osteoporóticos, como son el hábito de fumar, el bajo índice de masa corporal o la ingesta de alcohol40.
Otro aspecto importante, sobre todo en pacientes de edad avanzada, es dilucidar si el hipotético efecto deletéreo de la supresión ácida estaría relacionado con la aportación de calcio al organismo. Un análisis del tipo de fracturas mostró que la utilización de IBP aumenta levemente el riesgo de fractura no vertebral en mujeres y en hombres, pero en este último caso dicho incremento desaparece con la administración de suplementos de calcio33. Ello apoyaría la hipótesis inicial de que los efectos nocivos de la supresión de ácido serían más evidentes entre los pacientes con baja ingesta de calcio33.
Por el contrario, no se detectó ninguna relación cuando se evaluó si los IBP modifican la incidencia de fracturas de cadera en pacientes sin otros factores de riesgo, dado que en el protocolo se excluyeron los pacientes considerados de alto riesgo de este tipo de lesión41. Esta conclusión es similar a la descrita más recientemente observando que la utilización de anti-H2 e IBP se asocia a un incremento en el riesgo de fracturas en general, o específicamente a nivel de cadera, vertebral, de antebrazo o de muñeca, siempre que exista al menos otro factor de riesgo adicional, sobre todo osteoporosis, aunque sin excluir otros34,35. El riesgo se incrementa con la dosis pero, y al contrario que en estudios previos 12,32, no con la duración del tratamiento y se reduce con su suspensión, algo que también se había observado con anterioridad31.
Finalmente, un reciente metaanálisis concluye que no se puede establecer una relación causal entre utilización de IBP e incremento en el riesgo de fractura ósea. Considera que, en general, el incremento en tal riesgo es muy limitado, no existe un mecanismo probado que justifique esta relación, y no es posible descartar la influencia de factores residuales de confusión, incluso cuando se ha intentado ajustar el riesgo a otras enfermedades asociadas y/o a la utilización de otros grupos farmacológicos42.
Inhibición de la secreción ácido-gástrica y riesgo de osteoporosisLa polémica sobre la posibilidad de una relación entre el consumo de IBP y el riesgo de fracturas no se reproduce cuando hablamos de osteoporosis, ya que la evidencia actual no parece sustentar su relación causal. Los parámetros más utilizados para el diagnóstico de osteoporosis son la densidad mineral ósea total, determinada por densitometría ósea en puntos como el cuello de fémur o diversos segmentos vertebrales, y el porcentaje anualizado de cambio en la misma, que sirve de indicador de la velocidad de pérdida de hueso en el tiempo. Cuando se evalúa el efecto que la utilización crónica de IBP, o anti-H2, tiene sobre ambos parámetros, los resultados son coincidentes. Un primer estudio en el que se diferenciaba a los pacientes por sexo33 no observó ninguna relación entre utilización de IBP o anti-H2 y aceleración en la velocidad de pérdida de mineral óseo. Este trabajo sí observó que los hombres usuarios de IBP o anti-H2 presentaban inicialmente una leve reducción en la densidad mineral ósea del cuello del fémur, mientras que las mujeres mostraban un comportamiento similar con los IBP, pero paradójicamente un leve incremento entre las usuarias de anti-H2. En cualquier caso, ninguna de las diferencias era estadísticamente significativa. Al mismo tiempo se describió una mayor velocidad en la pérdida de hueso en todos los pacientes que han utilizado cualquiera de los 2 tipos de antisecretores, aunque tampoco estadísticamente significativa.
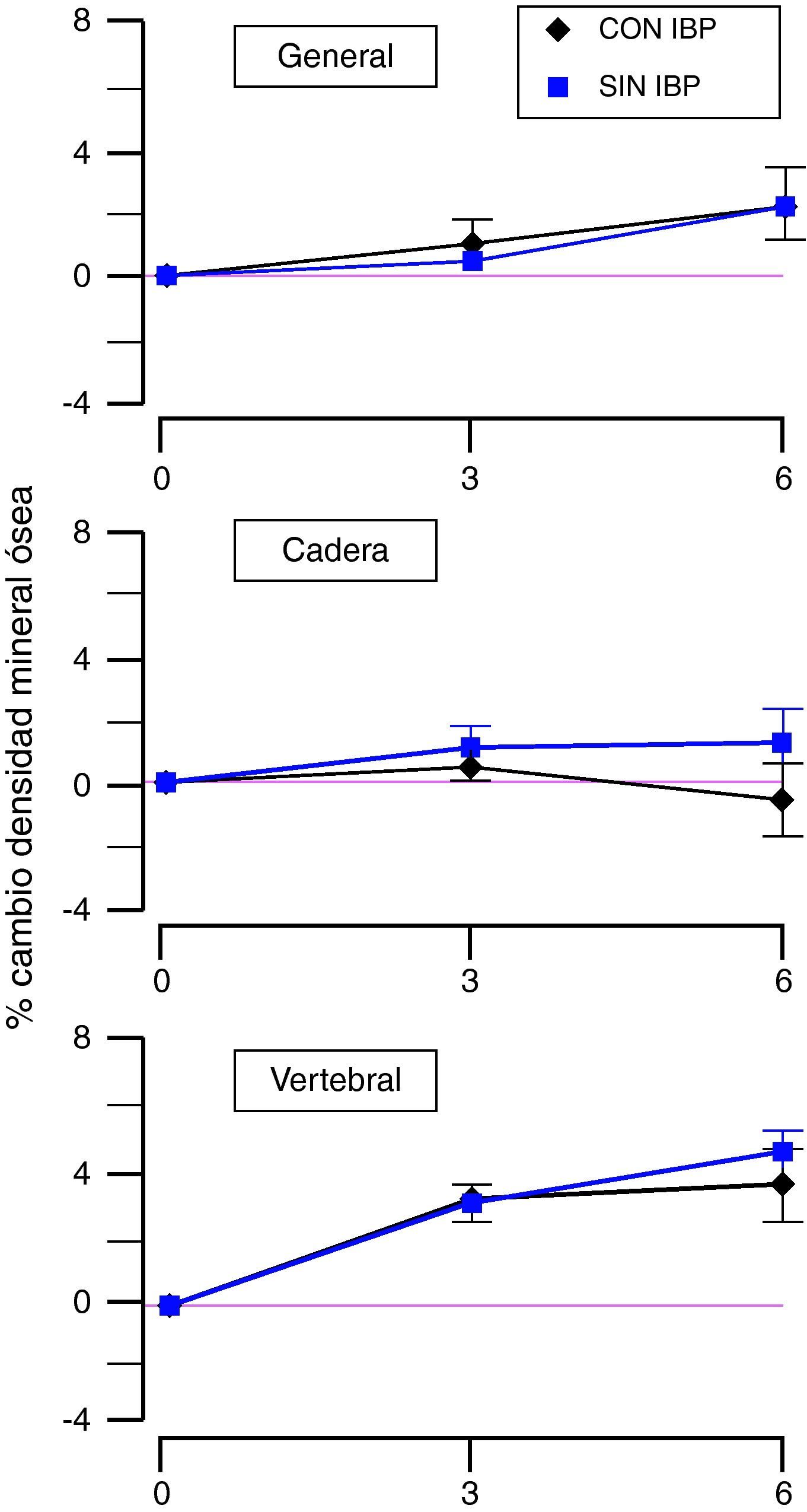
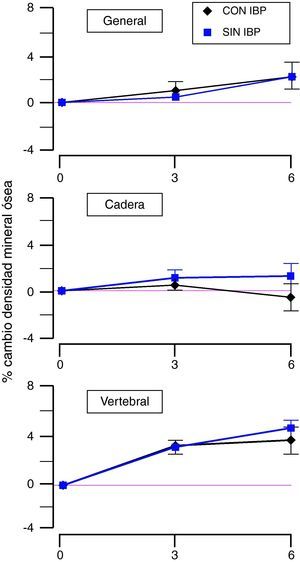
En el mismo sentido, otro estudio mostró recientemente que la densidad mineral ósea no varía, independientemente de si los grupos de población utilizan o no IBP o de la duración de su uso35. También se evaluó si los IBP interfieren en la acción de tratamientos favorecedores de la mineralización ósea (terapia hormonal, suplementos de calcio o vitamina D). Como podemos ver en la figura 2, estos fármacos inducen un incremento en la densidad mineral ósea en el periodo que va desde la determinación inicial a la realizada a los 3 años, para posteriormente enlentecer la velocidad de aumento en el periodo desde los 3 hasta los 6 años. Como se observa, el comportamiento de la densidad mineral ósea general no difiere entre las usuarias de IBP y las del grupo control. Sin embargo, desde un punto de vista más concreto, el tratamiento con IBP determina hasta los 3 años un menor crecimiento, no estadísticamente significativo en la cadera, y una evolución similar a las no tratadas a nivel vertebral. A los 6 años se observa que en la cadera el uso de IBP frena la mineralización ósea mientras que a nivel vertebral solo presenta una ligera reducción en la velocidad de mineralización, de nuevo no estadísticamente significativa.
Efecto de la administración crónica de IBP sobre el porcentaje de cambio en la densidad mineral ósea, por la acción de fármacos favorecedores de la mineralización, en distintas localizaciones. (Modificada de Gray et al35.).
Estos resultados han sido confirmados por una nueva publicación que consta de un estudio transversal, comparando pacientes con y sin osteoporosis y evaluando su relación con la administración continuada de IBP, y un estudio longitudinal evaluando cambios en el tiempo en la densidad mineral ósea en un grupo de usuarios de IBP frente a una población que no los utiliza43. La administración continua de IBP no se relaciona con osteoporosis en el primer caso, y tampoco en el segundo estudio afecta a la evolución en el tiempo de la densidad mineral ósea, que por el contrario sí aparece modificada por la exposición a fármacos con capacidad para modular el metabolismo del calcio; incrementándose con bisfosfonatos, estrógenos y moduladores del receptor estrogénico (descritos por su capacidad para aumentar la densidad mineral ósea), y disminuyendo con el uso de corticosteroides (ampliamente aceptada su capacidad para reducir la densidad mineral ósea)43. Por tanto, según este estudio, los IBP no están relacionados con la presencia de osteoporosis o pérdida acelerada de densidad mineral ósea. En principio esta conclusión podría entrar en contradicción con la descripción previa por el mismo grupo de una asociación entre administración de IBP y fractura de cadera32, por lo que concluyen que dicha asociación pudiera atribuirse a la presencia de factores de confusión no evaluados que estén relacionados tanto con la utilización de IBP como con otros factores específicos de riesgo de cadera independientes de la osteoporosis44. En este sentido hay que recordar que la reducción de la actividad osteoclástica, descrita anteriormente, si se mantiene en el tiempo comporta un bloqueo de la actividad osteoblástica (dado que fisiológicamente la función de ambas células está relacionada) con lo que la posibilidad de reparación de microfracturas y defectos en la microarquitectura ósea está inhibida y por tanto el riesgo de fractura está aumentado43. Sería un proceso similar al que ocurre en la osteopetrosis donde de forma congénita hay un fallo de esta H+/K+-ATPasa vacuolar45. De igual modo, tampoco hay una base científica clara que justifique el uso de bisfosfonatos para prevenir o revertir una posible osteoporosis que hubiera generado el uso crónico de IBP46.
ConclusionesLa evidencia que sustenta una potencial relación entre la administración crónica de IBP y un incremento en el riesgo de fracturas es contradictoria, y es aún más cuestionable cuando se relaciona con el riesgo de osteoporosis. Tampoco está claro que los IBP modifiquen de forma significativa la homeostasis general del calcio, y menos su absorción. Por ello, no hay motivo que justifique evitar su administración prolongada en aquellos pacientes que lo requieren. Sin embargo, dado que los IBP son frecuentemente utilizados en situaciones en las cuales no están recomendados, por precaución debiéramos restringir su uso crónico a aquellas circunstancias en las cuales está absolutamente indicado. Además, en pacientes de edad avanzada, que requieren tratamiento con IBP a largo plazo y con dosis elevadas, podría ser también prudente incrementar la cantidad total de calcio que recibe el organismo, preferentemente con la ingesta diaria o mediante suplementos a ser posible de sales solubles.
Conflicto de interesesEl Dr. Juan V. Esplugues declara haber dictado conferencias sufragadas por los laboratorios AstraZeneca y Merch Sharp and Dohme. El Dr. Miguel Martí-Cabrera y Miguel Martí-Masanet declaran no tener ningún conflicto de intereses.
Los autores agradecen a Dora Martí la preparación de las tablas y figuras.
Este trabajo ha sido financiado en parte por las ayudas PI081325 del Ministerio de Ciencia e Innovación (Instituto de Salud Carlos III) y PROMETEO/2010/060 de la Conselleria d’Educació de la Generalitat Valenciana.