La peritonitis bacteriana espontánea (PBE) es la infección del líquido ascítico (LA) en ausencia de foco infeccioso intraperitoneal en pacientes con enfermedad hepática e hipertensión portal. El objetivo del estudio fue la evaluación de la rentabilidad de los cultivos microbiológicos tras la optimización de la sistemática en su recogida en la práctica clínica habitual.
MétodosSe analizaron 2 series, la primera retrospectiva con datos de 156 episodios de PBE consecutivos de enero de 2003 a diciembre de 2005 (grupo R), y la segunda con un grupo prospectivo desde octubre de 2007 a octubre de 2008, constituido por 79 episodios, en los que se optimizó el protocolo diagnóstico de PBE (grupo P), con la recogida sistemática de 10ml de LA por bote de hemocultivo.
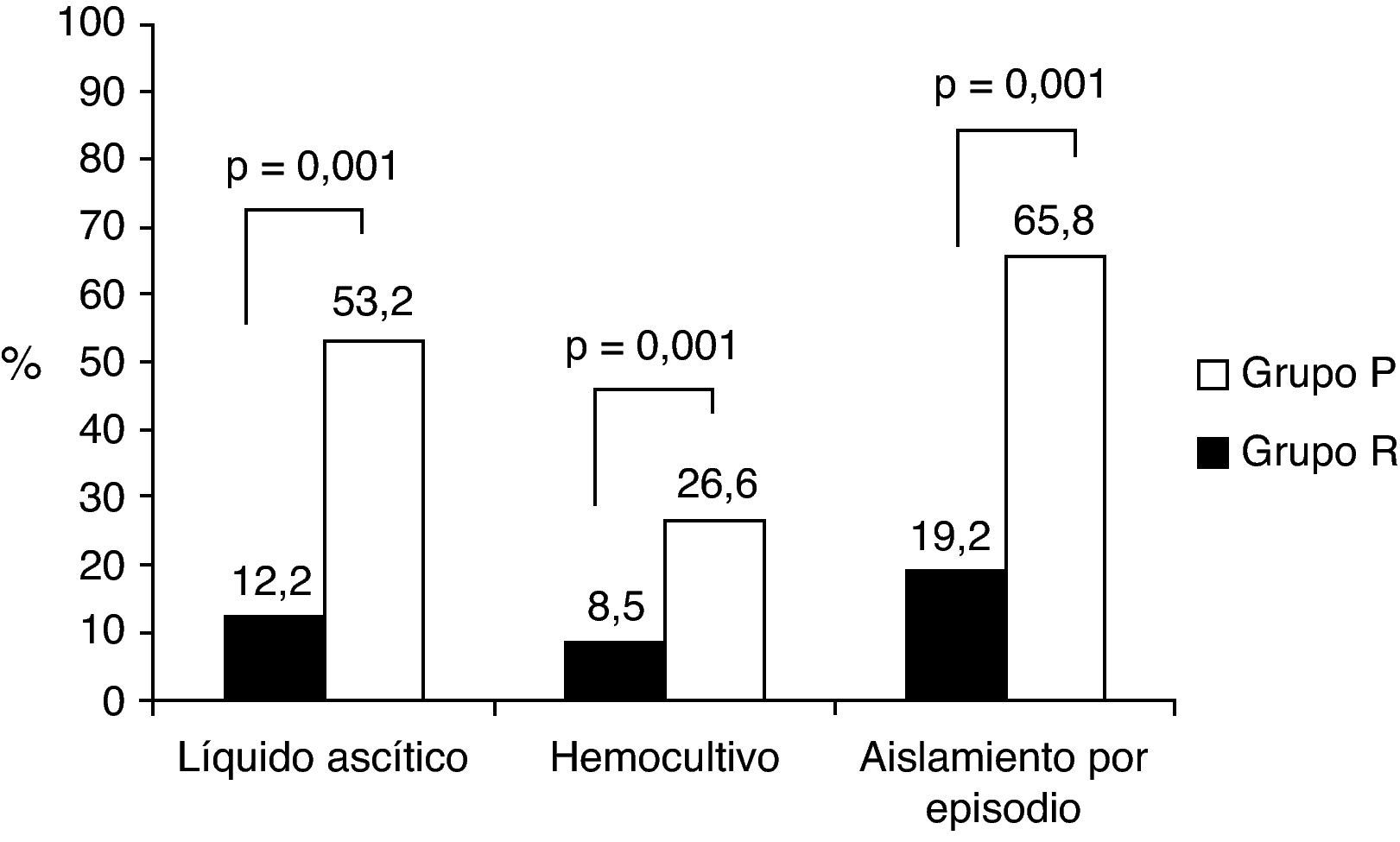
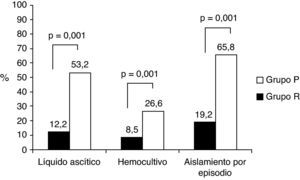
ResultadosLas características basales epidemiológicas y clínicas entre los episodios fueron similares, salvo mayor incidencia de insuficiencia renal, ascitis a tensión e íleo adinámico, y en la etiología de la hepatopatía, más frecuente de origen etílico, en el grupo P. Se consiguió aislamiento microbiológico en LA en el 12,2% de los episodios del grupo R, frente al 53,2% del grupo P (p=0,001) y en hemocultivos en el 8,5 y 26,6% (p=0,001), respectivamente. Se obtuvo aislamiento microbiológico en el 65,8% de los episodios del grupo P frente al 19,2% del grupo R (OR 8; IC 95%: 4,4-14,9; p=0,001). El microorganismo más frecuentemente aislado en la en el grupo P fue Escherichia coli (42,9%).
ConclusionesLa optimización en la realización de la sistemática diagnóstica en la práctica asistencial del paciente cirrótico con ascitis aumenta su rendimiento microbiológico diagnóstico.
Spontaneous bacterial peritonitis (SBP) is ascitic fluid (AF) infection in the absence of an intraperitoneal source of infection in patients with liver disease and portal hypertension. The aim of this study was to evaluate the yield of microbiological cultures to optimize their collection and systematic implementation in routine clinical practice.
MethodsWe analyzed two cohorts: the first consisted of retrospective data from the clinical records of 156 consecutive episodes of SBP from January 2003 to December 2005 (group R), and the second was composed of data collected prospectively from October 2007 to October 2008, consisting of 79 episodes (group P), with systematic inoculation of 10 cc of AF in each blood culture bottle.
ResultsNo significant differences were demonstrated in baseline epidemiological or clinical characteristics among episodes, except the more frequent presence of alcoholic liver disease and the incidence of tense ascites, paralytic ileus and kidney failure at diagnosis in group P. Microbiological isolation in AF was achieved in 12.2% of the episodes in group R compared with 53.2% in group P (p=0.001) and 8.5 and 26.6% (p=0.001) in blood culture, respectively. Microbiological isolation was achieved in 65.8% of episodes in group P versus 19.2% in group R (OR 8; 95% CI: 4.4-14.9; p=0.001). The most frequently isolated organism in AF in group P was Escherichia coli (42.9%).
ConclusionsOptimizing the diagnostic procedure in cirrhotic patients with ascites significantly increases diagnostic microbiologic performance.
Se denomina peritonitis bacteriana espontánea (PBE) a la infección del líquido ascítico (LA) en ausencia de foco infeccioso intraperitoneal, o de los tejidos adyacentes, que ocurre en presencia de cirrosis o fallo hepático fulminante. Su prevalencia se halla en torno a un 10-30% de los pacientes cirróticos con ascitis no seleccionados que ingresan en un hospital1,2.
En la década de 1980 se realizaron estudios que mejoraron la capacidad de diagnóstico de la PBE y del cultivo de LA, tras la instauración en la rutina clínica de la paracentesis diagnóstica3–9. Se ha fijado para el diagnóstico clínico de una PBE, como se recoge en consensos y guías clínicas recientes, un recuento de polimorfonucleares (PMN) en LA ≥ 250/μl, sea el cultivo de LA positivo o negativo1,2,10. Además, el cultivo de LA en bote de hemocultivo en el mismo momento de la paracentesis mejora de forma importante su rentabilidad y se ha establecido como el método de referencia6–11.
Si bien el diagnóstico y tratamiento no deja de ser rutinario en la práctica clínica, esto mismo puede conllevar una relajación en el proceder diagnóstico con una disminución de la rentabilidad diagnóstica de las pruebas utilizadas. Tras la realización de un estudio retrospectivo para valorar la supervivencia y factores pronósticos asociados, se detectó un porcentaje de aislamientos en LA extremadamente bajo12. Este hallazgo llevó a la revisión de la bibliografía y a establecer unas recomendaciones más estrictas que fueron aplicadas de forma prospectiva, cuyo resultado y comparación con el periodo previo son el objetivo del presente estudio.
Material y métodosSe realizó un estudio observacional y retrospectivo, sobre todas las altas hospitalarias con diagnóstico, principal o secundario, de PBE en el periodo comprendido entre enero de 2003 y diciembre de 2005, en el Servicio de Aparato Digestivo del Hospital General Universitario Gregorio Marañón, cuyo objetivo fundamental era valorar la supervivencia tras un episodio de PBE y sus factores pronósticos asociados12. El proceder diagnóstico y terapéutico durante este periodo fue la inclusión de pacientes cirróticos con diagnóstico primario o secundario de PBE en su codificación en el alta hospitalaria. El diagnóstico de cirrosis se basó en datos histológicos o en la conjunción de datos clínicos, endoscópicos, de laboratorio y ecográficos. En todos los pacientes ingresados por PBE se realizó de forma protocolizada un estudio clínico y terapéutico que constaba de: examen físico periódico, radiografía de tórax y abdomen, ecografía abdominal, control analítico cada 24-48 h, sedimento urinario y urocultivo, paracentesis diagnóstica al ingreso y a las 48 h (recuento celular y cultivo con inoculación de 5ml en cada frasco de hemocultivo en la cabecera del paciente), antibioticoterapia empírica por vía intravenosa con modificación posterior, si se precisaba, en función del antibiograma obtenido de los cultivos de LA o de los hemocultivos o no respuesta analítica o clínica, sobrecarga con albúmina si deterioro de función renal o hepática al diagnóstico (1,5 g/kg de peso en las primeras 24 h de la infección y 1 g/kg de peso el tercer día), y extracción de hemocultivos por 3 si la temperatura era igual o superior a 37,8°C o en el paciente afebril con afectación sistémica importante. Se prosiguió con controles ambulatorios, el primero a los 3 meses, y posteriormente cada 3-6 meses con pruebas analíticas y de imagen según fuera preciso, y la instauración de profilaxis antibiótica de nuevos episodios de PBE con norfloxacino por vía oral al alta hospitalaria.
Tras la valoración de los resultados de esta serie de pacientes (grupo R) se observó un porcentaje de aislamientos microbiológicos inferior al referenciado en la literatura médica1.
Este fue unos de los motivos por el que se realizó una recogida prospectiva de los casos desde octubre de 2007 a octubre de 2008, tras establecer una modificación del protocolo diagnóstico de PBE (grupo P) en pacientes con cirrosis hepática. Se realizaron sesiones dentro del servicio, para conseguir una sistemática más homogénea, en la práctica clínica, en la indicación y realización de paracentesis diagnóstica en el paciente con cirrosis y ascitis. Se recalcó la necesidad de extracción sistemática de LA para cultivo, con un incremento en el volumen de extracción de LA a 30ml, para asegurar la incubación de al menos 10ml de LA inoculados por bote de hemocultivo (aerobios y anaerobios) a la cabecera de la cama del paciente. A su vez se fijaron recomendaciones más estrictas en el protocolo de extracción de hemocultivos ante todo paciente con cirrosis y descompensación edemoascítica con temperatura igual o superior a 37,8°C o en el paciente afebril con deterioro de la función hepática y/o renal de origen no filiado junto con signos de inflamación o infección sistémica. La extracción de las muestras de sangre, 5ml por bote de hemocultivo, y en número de 3, fue realizada antes de la instauración del tratamiento antibiótico sistémico. Las muestras microbiológicas para su cultivo, tanto de sangre como de LA, fueron inoculadas en botes de hemocultivo BD BACTECTM Plus + Aerobic y Anaerobic (Becton, Dickinson and Company, Shannon, Ireland). Las muestras fueron procesadas tras su recogida, según práctica habitual, mediante sistemas automatizados de monitorización continua, y ante positividad se realizaba el antibiograma de forma manual. El protocolo del estudio fue revisado y aceptado por el comité ético de investigación clínica local.
Se incluyeron en el presente estudio todos los episodios con un recuento de polimorfonucleares (PMN) en LA ≥ 250/mm3 y la ausencia de datos analíticos, clínicos o radiológicos de peritonitis secundaria (presencia en líquido ascítico de 2 o más de los siguientes datos: glucosa < 50 mg/dl, proteínas > 10 g/l, concentración de LDH superior a la plasmática o la existencia de cultivo o Gram polimicrobianos).
En el grupo R se evaluaron un total de 158 episodios en 119 pacientes y en el grupo P se incluyeron de forma prospectiva todos los episodios diagnosticados durante un año, que sumaron un total de 90 episodios en 78 pacientes. Se excluyeron para el presente análisis los episodios de bacterioascitis, recuento de PMN < 250/mm3 con cultivo de LA positivo, tanto si asintomáticos (5 episodios en el grupo P, ninguno en el grupo R) como sintomáticos, episodios en los cuales se cursó con ingreso hospitalario en el contexto de deterioro clínico del paciente y signos de inflamación o infección sistémicos, sin otra infección activa detectada durante la estancia hospitalaria, y cuyo tratamiento fue igual al de un episodio de PBE. Se excluyeron, por este motivo, 6 episodios en el grupo P (PMN en LA entre 178 y 240/mm3) y 2 episodios en el grupo R, ambos con recuento de PMN ≥ 240/mm3. Por tanto, para el presente análisis, se incluyeron 156 episodios de PBE en el grupo R y 79 episodios en el grupo P.
El objetivo principal del presente estudio fue valorar si la implementación del protocolo diagnóstico de PBE en pacientes con cirrosis y ascitis en la práctica clínica habitual mejoraba la capacidad diagnóstica del aislamiento microbiológico. Como objetivos secundarios se establecieron la caracterización y comparación de las características clínicas de los episodios de PBE entre ambos grupos y la evaluación de las características microbiológicas de los episodios de PBE evaluados en el grupo P.
En el análisis estadístico las variables cuantitativas se expresan mediante la media y la desviación estándar, salvo cuando la distribución de la variable no se ajusta a la normal, que se expresan como mediana y rango, y las variables cualitativas como porcentajes. Se realizó la comparación de variables cualitativas mediante el test de X2 y de variables cuantitativas mediante la t de Student, o el test de la U de Mann-Whitney si las variables no presentaban una distribución normal. Se estableció la significación estadística cuando p < 0,05. Los datos fueron analizados utilizando el programa estadístico SPSS 15.0, para Windows (SPSS Inc., Chicago, IL, USA).
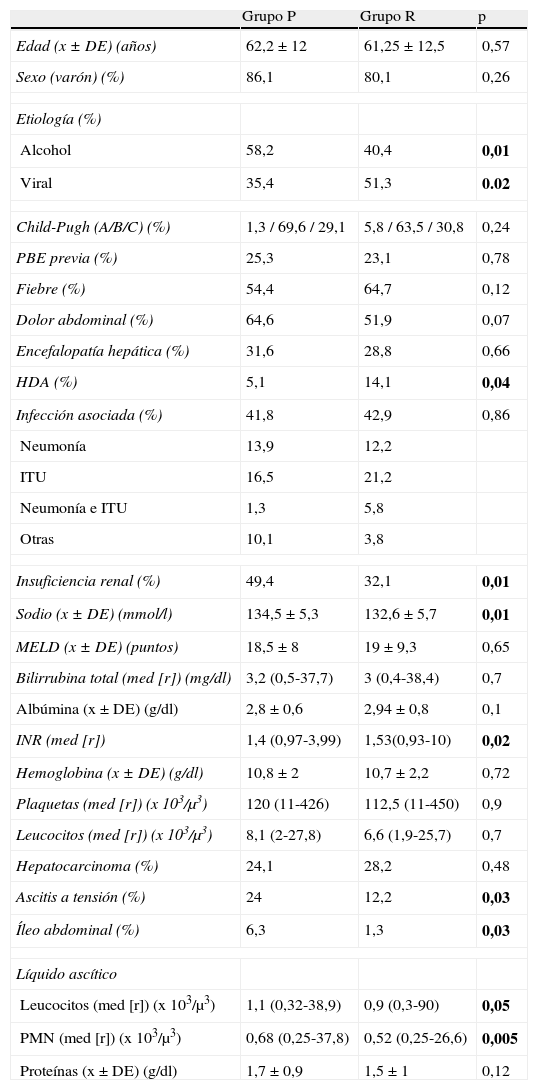
ResultadosCaracterísticas basalesEn la tabla 1 se describen las características epidemiológicas y de la enfermedad hepática en los episodios de PBE incluidos en ambos grupos. Los grupos presentaban características similares con diferencias estadísticas en la etiología de la cirrosis, con predominio en el grupo R de la causa vírica frente a la alcohólica en el grupo P; mayor relación con un episodio de hemorragia digestiva en el grupo R; la mayor incidencia de insuficiencia renal, ascitis a tensión e íleo adinámico en el grupo P; y una menor concentración de sodio sérico y mayor INR en el grupo R, estas 2 últimas no relevantes desde un punto de vista clínico. En cuanto a las características del líquido ascítico, se observó un significativo incremento en el recuento de leucocitos y PMN en los episodios de PBE del grupo P.
Características basales
| Grupo P | Grupo R | p | |
| Edad (x±DE) (años) | 62,2±12 | 61,25±12,5 | 0,57 |
| Sexo (varón) (%) | 86,1 | 80,1 | 0,26 |
| Etiología (%) | |||
| Alcohol | 58,2 | 40,4 | 0,01 |
| Viral | 35,4 | 51,3 | 0.02 |
| Child-Pugh (A/B/C) (%) | 1,3 / 69,6 / 29,1 | 5,8 / 63,5 / 30,8 | 0,24 |
| PBE previa (%) | 25,3 | 23,1 | 0,78 |
| Fiebre (%) | 54,4 | 64,7 | 0,12 |
| Dolor abdominal (%) | 64,6 | 51,9 | 0,07 |
| Encefalopatía hepática (%) | 31,6 | 28,8 | 0,66 |
| HDA (%) | 5,1 | 14,1 | 0,04 |
| Infección asociada (%) | 41,8 | 42,9 | 0,86 |
| Neumonía | 13,9 | 12,2 | |
| ITU | 16,5 | 21,2 | |
| Neumonía e ITU | 1,3 | 5,8 | |
| Otras | 10,1 | 3,8 | |
| Insuficiencia renal (%) | 49,4 | 32,1 | 0,01 |
| Sodio (x±DE) (mmol/l) | 134,5±5,3 | 132,6±5,7 | 0,01 |
| MELD (x±DE) (puntos) | 18,5±8 | 19±9,3 | 0,65 |
| Bilirrubina total (med [r]) (mg/dl) | 3,2 (0,5-37,7) | 3 (0,4-38,4) | 0,7 |
| Albúmina (x±DE) (g/dl) | 2,8±0,6 | 2,94±0,8 | 0,1 |
| INR (med [r]) | 1,4 (0,97-3,99) | 1,53(0,93-10) | 0,02 |
| Hemoglobina (x±DE) (g/dl) | 10,8±2 | 10,7±2,2 | 0,72 |
| Plaquetas (med [r]) (x 103/μ3) | 120 (11-426) | 112,5 (11-450) | 0,9 |
| Leucocitos (med [r]) (x 103/μ3) | 8,1 (2-27,8) | 6,6 (1,9-25,7) | 0,7 |
| Hepatocarcinoma (%) | 24,1 | 28,2 | 0,48 |
| Ascitis a tensión (%) | 24 | 12,2 | 0,03 |
| Íleo abdominal (%) | 6,3 | 1,3 | 0,03 |
| Líquido ascítico | |||
| Leucocitos (med [r]) (x 103/μ3) | 1,1 (0,32-38,9) | 0,9 (0,3-90) | 0,05 |
| PMN (med [r]) (x 103/μ3) | 0,68 (0,25-37,8) | 0,52 (0,25-26,6) | 0,005 |
| Proteínas (x±DE) (g/dl) | 1,7±0,9 | 1,5±1 | 0,12 |
Nota: Todos los parámetros son evaluados al diagnóstico del paciente, salvo la existencia de infección asociada que ha sido valorada en las primeras 48 h tras el ingreso una vez se disponía de todas las pruebas necesarias para su diagnóstico, y la presencia de hepatocarcinoma que incluye los que presentaban el diagnóstico al ingreso y los diagnosticados durante el ingreso. La insuficiencia renal se ha evaluado como la presencia de un creatinina sérica ≥ 1,5 mg/dl.
HDA: hemorragia digestiva alta; med (r): mediana (rango); MELD: Model for End-Stage Liver Disease; X±DE: media±desviación estándar.
Se observó un significativo aumento en los aislamientos microbiológicos en el grupo P frente al grupo R. El 53,2% de los cultivos de LA fueron positivos frente al 12,2% (p=0,001). También se observó un aumento en los aislamientos en los hemocultivos, siendo del 26,6% en el grupo P frente al 8,5% en el grupo R (p=0,001).
En global, se realizó un aislamiento microbiológico en el 65,8% de los episodios en el grupo P frente al 19,2% en el grupo R, lo que implica un aumento en el rendimiento de las técnicas microbiológicas muy significativo (OR: 8; IC 95%: 4,4-14,9; p=0,001) (fig. 1).
Análisis de los datos microbiológicos del grupo PSe detectaron hemocultivos positivos en 21 episodios de PBE (26,6%). Los microorganismos observados con mayor frecuencia fueron Staphylococcus aureus (S. aureus) (6 episodios, 28,6%) y Escherichia coli (E. coli) (5 episodios, 23,8%).
Se realizó aislamiento en LA en 42 episodios (53,2%). El microorganismo más frecuentemente aislado fue E. coli en 18 episodios (42,9%) seguido de S. aureus en 9 episodios (21,4%) (tabla 2). De los 18 aislamientos de E. coli en 4 se identificó como resistente a quinolonas (22,2%). Se detectaron 3 episodios causados por S. aureus resistente a meticilina (SAMR) y 2 episodios por E. coli resistente a cefalosporinas (BLEA).
Aislamientos microbiológicos y antibioterapia de rescate
| Aislamiento microbiológico | n (%) |
| Hemocultivo (n=21) | |
| Staphylococcus aureus | 6 (28,6) |
| Escherichia coli | 5 (23,8) |
| Staphylococcus epidermidis | 3 (14,3) |
| Enterococcus faecalis | 2 (9,5) |
| Pseudomonas aeruginosa | 2 (9,5) |
| Streptococcus viridans | 1 (4,75) |
| Salmonella grupo D | 1 (4,75) |
| Bacillus sp. | 1 (4,75) |
| Líquido ascítico (n=42)a | |
| Escherichia coli | 18 (42,9) |
| Staphylococcus aureus | 9 (21,4) |
| Enterococcus faecium/faecalis | 7 (16,7) |
| Streptococcus viridans | 3 (7,1) |
| Enterobacter spp. | 2 (4,75) |
| Pseudomonas aeruginosa | 2 (4,75) |
| Bacteroides spp. | 1 (2,4) |
| Cambio de antibiótico (n=38) | % |
| Mala evolución | 84,2 |
| Ausencia de sensibilidad | 10,5 |
| Reacciones adversas | 2,6 |
| Otros | 2,6 |
En 4 episodios existió un aislamiento múltiple, todos ellos reflejados en la tabla como aislamiento de Enterococcus faecium/faecalis: en un caso junto a Veillonella spp., otro con Staphylococcus aureus sensible a meticilina, otro junto a Clostridium fallax y el último junto a Enterococcus raffinosus.
El tratamiento antibiótico de inicio fue en un 65,8% de los episodios una cefalosporina de tercera generación y como segundo grupo de antibióticos más utilizado fue un carbapenem en el 21,5%. Se realizó un cambio en la pauta antibiótica en 38 episodios (48,1%). En 33 episodios la causa fue la evolución clínica no favorable según decisión del médico responsable del tratamiento del paciente, teniendo en cuenta que en 20 de estos episodios no hubo aislamiento microbiológico en LA. En 4 episodios se tomó la decisión al obtener el antibiograma y ser este compatible con resistencia al antibiótico pautado.
Si comparamos, desde un punto de vista descriptivo, los datos microbiológicos con el grupo R, se observa una menor predominancia de aislamiento de S. aureus en hemocultivos en el grupo P respecto al grupo R y en LA se mantienen similares los porcentajes de aislamientos microbiológicos. Se objetiva un incremento en la necesidad de cambio del tratamiento antibiótico empírico (28,2 y 48,1%, grupo R y grupo P, respectivamente). Estos resultados deben ser interpretados con precaución dada la diferente pauta diagnóstica en su recogida y el significativo incremento diagnóstico microbiológico derivado.
Se detectaron 20 episodios de PBE en pacientes con antecedentes de episodios previos y estando todos los pacientes en profilaxis antibiótica con 400 mg/día de norfloxacino. Se obtuvo aislamiento en sangre en 4 episodios y en LA en 9 (2 episodios con aislamiento en sangre y LA). En 2 de los 4 hemocultivos positivos se aisló E. coli, siendo en ambos resistente a quinolonas. En 4 de los 9 aislamientos en LA se detectó E. coli, siendo en todos ellos resistente a quinolonas. En todos los pacientes se mantuvo la profilaxis posteriormente con 400 mg/día de norfloxacino.
DiscusiónSe considera que el mecanismo de producción de la PBE se debe al paso de microorganismos entéricos a través de la barrera mucosa intestinal, alcanzando los nódulos linfáticos mesentéricos (fenómeno denominado translocación bacteriana) y diseminándose por vía hematógena a través del conducto torácico. La posterior colonización del LA es facilitada por la alteración del sistema inmune que presentan estos pacientes a nivel local (escasa capacidad de opsonización del LA) y sistémica (actividad reducida del sistema mononuclear fagocítico)13. Posteriormente se desencadenará una respuesta inflamatoria local, caracterizada por el aumento de los PMN en LA, y sistémica, causante de la alteración clínica y hemodinámica del paciente asociada a la infección del LA. Todo ello, a pesar de que el número de bacterias que alcanzan el LA es bajo1,2. Este hecho ha marcado una mayor dificultad en obtener aislamientos microbiológicos en los cultivos del LA, y se tuvo que modificar la realización de los cultivos, mediante la inoculación en bote de hemocultivo de una cantidad de al menos 10ml a la cabecera de la cama del paciente, para mejorar su rentabilidad3,6–8.
Tras la realización de un estudio retrospectivo sobre episodios de PBE12 se detectó un porcentaje de aislamientos en LA extremadamente bajo, motivo que llevó a una revisión de la práctica clínica habitual e implementación de una optimización en su realización para mejorar la rentabilidad diagnóstica microbiológica. El objetivo principal del estudio fue conseguido al optimizar la sistemática diagnóstica en un paciente cirrótico con ascitis e incrementar de forma significativa los aislamientos microbiológicos. De este modo, se obtuvo aislamiento en LA con criterios de PBE en más de la mitad de los pacientes y en aproximadamente 2 de cada 3 pacientes si tenemos en cuenta el rendimiento diagnóstico microbiológico conjunto con los hemocultivos. Los datos obtenidos en la serie prospectiva se enmarcan por tanto en lo esperable en esta situación clínica1, si bien en los estudios originales se alcanzaban cifras difícilmente reproducibles en la práctica clínica, mayores del 90%6,7. Lo destacable de estos resultados es por un lado su consecución en la práctica clínica y la actualización de la validez, en la actualidad, de una sistemática basada en estudios publicados hace más de 20 años3–9.
El presente estudio tiene varias limitaciones y puntos de discusión. La primera la comparación de una serie retrospectiva con una prospectiva. En ambas cohortes se han obtenido casos consecutivos, si bien en la serie retrospectiva pueden no haber sido detectados los casos mal codificados, no ha existido un criterio inducido por el investigador que pueda haber causado una diferente selección de los episodios entre ambas cohortes. El cambio realizado en el procedimiento asistencial, en su práctica clínica, ha causado un marcado e importante incremento en el rendimiento del procesamiento posterior habitual de las muestras en laboratorio. Por lo tanto, como se indicaba en el apartado de resultados, tendría un significado muy limitado la interpretación de la comparación de ambas cohortes en cuanto a sus características microbiológicas, dado el claro sesgo en la detección de los casos, motivo por el que no se han comparado desde un punto de vista analítico ambas series en el estudio. Claros ejemplos de este efecto son el incremento en el porcentaje de hemocultivos con aislamiento microbiológico, en gran parte con seguridad debido a una más estricta indicación y realización, y la detección de episodios de bacterioascitis. Estos casos están reconocidos como un primer paso hacia el establecimiento completo de una PBE, y en práctica clínica, en pacientes con afectación clínica significativa derivada de esta infección, bacterioascitis sintomática, no se puede esperar a repetir en unos días la paracentesis diagnóstica antes de establecer un tratamiento antibiótico, por lo que en las guías se reconoce la necesidad de asistir este proceso como un episodio de PBE1,2,4,10,11. Si bien en el presente estudio se excluyen del análisis, este dato aporta una información relevante, y no hace más que poner todavía más en evidencia la mejora de la rentabilidad de la técnica microbiológica cuando se toman las muestras de la forma más óptima posible. Incluso, podríamos decir, que se obtiene en algunos casos un diagnóstico, que en el pasado hubiera quedado como de deterioro funcional de un paciente cirrótico de causa no explicable. Por último, como en todo estudio en práctica clínica, no se puede evitar que a pesar de unas guías de actuación consensuadas, exista heterogeneidad en su aplicación individual, y que esto pueda haber influido en el resultado.
Desde un punto de vista pronóstico, se observan características en la cohorte prospectiva que se relacionan con una peor evolución clínica, como se ha evaluado y comunicado de forma preeliminar14. Estos resultados no están influidos por la optimización del protocolo asistencial, sino que, como se analizó y observó, en relación con hepatopatías más evolucionadas y con mayor deterioro circulatorio14. Hay que puntualizar que el estudio está realizado en un centro de tercer nivel con programa de trasplante hepático, y por tanto los datos puede que no sean trasladables a centros con menor especialización en este tipo de pacientes.
Los resultados microbiológicos obtenidos no difieren de lo esperable en pacientes con cirrosis atendidos en un medio hospitalario con unidades de cuidados intermedios especializadas en el cuidado de pacientes graves, y por tanto también desde un punto de vista microbiológico, con un incremento en los aislamientos de microorganismos grampositivos15,16. Otro punto importante, en este contexto clínico, es la modificación de la sensibilidad a los antibióticos de los microorganismos aislados en relación con el uso de profilaxis antibióticas15,17. Cabe destacar el incremento en el aislamiento de cepas de E. coli resistentes a quinolonas en pacientes en profilaxis con norfloxacino, si bien el control de la infección desde un punto de vista clínico es adecuado en relación con los tratamientos antibióticos habituales del episodio de PBE por vía intravenosa. También se ha observado la detección de cepas con resistencias clínicamente significativas (SAMR Y BLEA). Todo ello en relación con el cambio progresivo en la sensibilidad a los antibióticos habituales en el medio hospitalario como se ha comentado.
Se concluye en la necesidad de seguir las recomendaciones de las guías de práctica clínica como la revisión de su implementación en la rutina diaria para la obtención de los mejores resultados según la evidencia disponible. Este hecho se demuestra en el presente estudio en relación con los aislamientos microbiológicos en el contexto del paciente cirrótico con ascitis y la detección de una PBE, y que apoyan las recomendaciones, en el contexto clínico actual, basadas en los resultados de estudios clínicos publicados hace al menos 20 años.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.