El sarcoma fibromixoide de bajo grado (SFBG) es una variante de fibrosarcoma. Es un tumor infrecuente, que afecta a adultos jóvenes de ambos sexos. La histología e inmunohistoquímica son la clave del diagnóstico diferencial con otras entidades, dada su elevada especificidad. El tratamiento de elección es la resección quirúrgica.
En este caso clínico exponemos la dificultad de diagnosticar este tipo de tumor, dada la escasa literatura al respecto, debido a la rareza del tumor.
Varón de 57 años, con antecedentes de HTA, DM2 y dislipemia. Refiere cuadro de 2 meses de evolución de astenia, distensión abdominal, estreñimiento, no pérdida de peso. En la exploración física se palpa, masa periumbilical en hemiabdomen izquierdo, de bordes bien definidos no dolorosa, de unos 15cm.
La analítica general dentro de los parámetros normales, destacando únicamente elevación de PCR en sangre (103mg/dl). Se realiza ecografía abdominal observándose masa de características ecográficas heterogéneas, con zonas hipoecogénicas quísticas y otras más ecogénicas, no valorada en su totalidad por su dimensión. Se sospecha tumoración de origen digestivo realizándose gastroscopia y colonoscopia. No se visualizan lesiones intraluminales, objetivándose compresión extrínseca en colon izquierdo. El tránsito esófago-gastroduodenal, dilatación de la segunda y tercera porción duodenal, con pliegues engrosados, pareciendo que la dilatación se extendía a las asas de intestino delgado, sin lesiones endoluminales. Se realiza una tomografía axial computarizada (TAC) abdominal que muestra una masa de (10×19cm) en región abdominal anterior, que desplaza intestino delgado, sin plano de separación con las asas, siendo difícil precisar si el tumor se origina en las asas intestinales o estas están infiltradas. Escaso líquido libre peritoneal, adenopatías subcentimétricas mesentéricas y retroperitoneales. Tras punción-biopsia guiada por TAC, el diagnóstico histopatológico fue de tumor mesenquimal de bajo grado de malignidad.
Con dicho diagnóstico, se lleva a cabo la resección quirúrgica de la lesión. Citología intraoperatoria del líquido ascítico, negativa para células malignas.
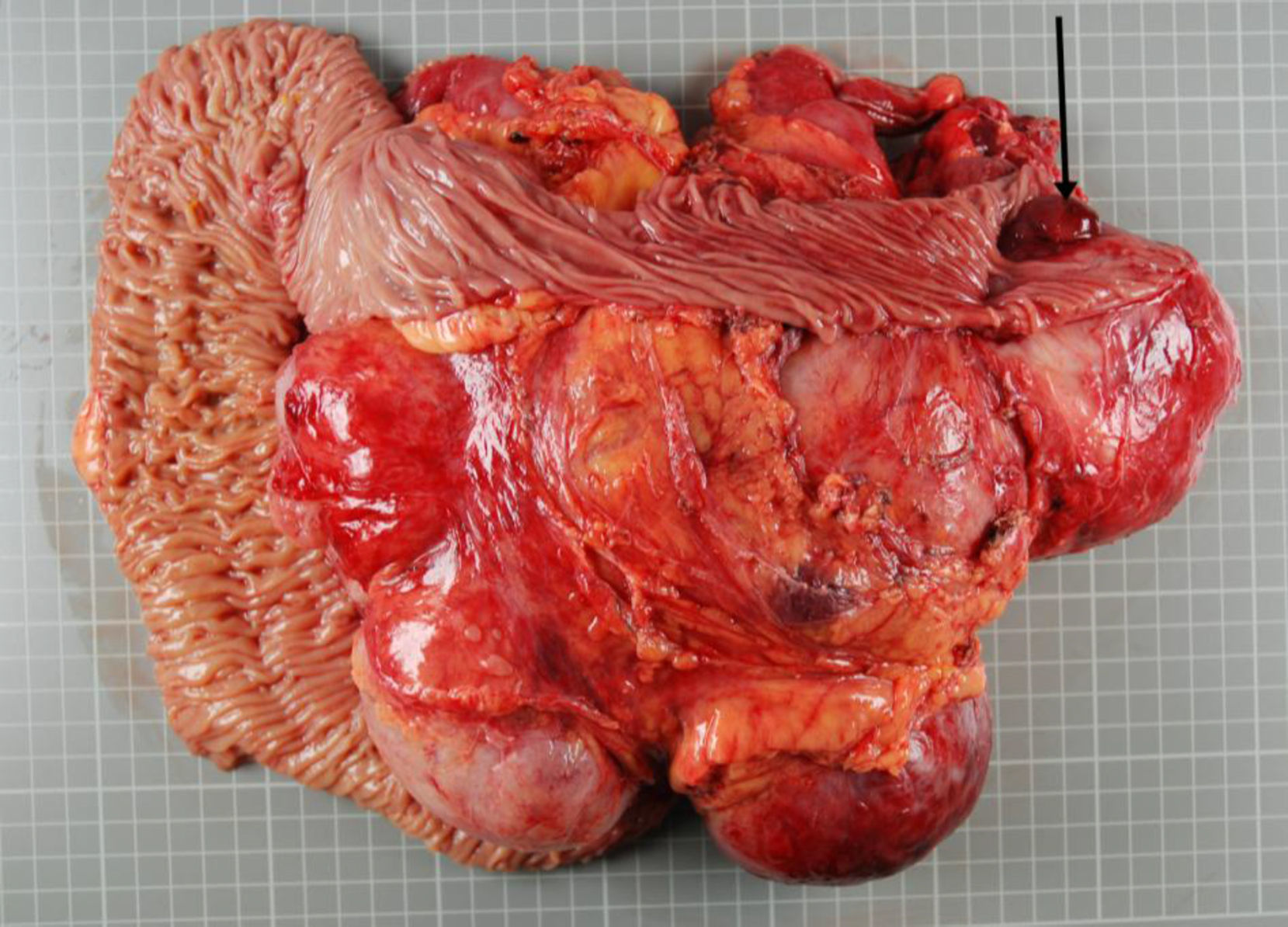
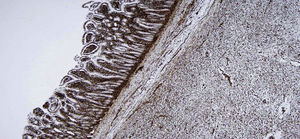
Macroscópicamente, formación tumoral de aproximadamente 24×21cm, en relación con asas de intestino delgado con adherencias profundas a las mismas. A la apertura de las asas de intestino delgado, se observa que la tumoración ulcera la mucosa, apareciendo en forma de mamelón en la luz intestinal (fig. 1).
Macroscópicamente masa de 3.145g que incluye tumoración de 24×21cm, tumoración sólida al corte, con zonas aparentemente quísticas, blanda, con zonas vascularizadas y amplias áreas mixoides, sin focos de necrosis ni calcificaciones, infiltración de la pared intestinal con ulceración de la mucosa sobresaliendo a la luz intestinal (flecha).
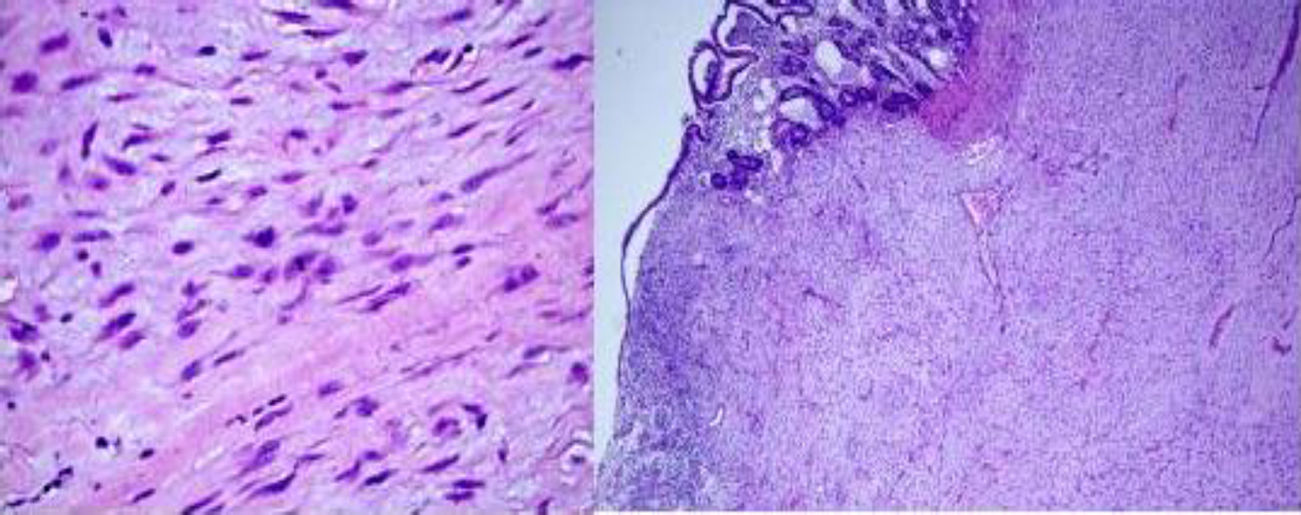
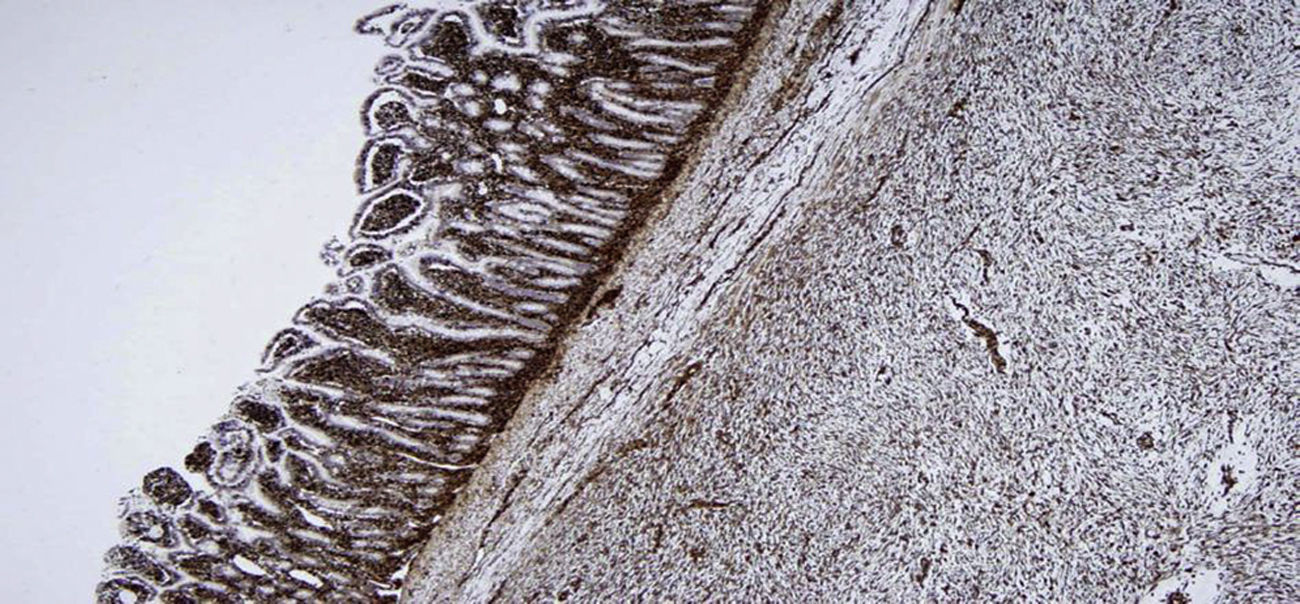
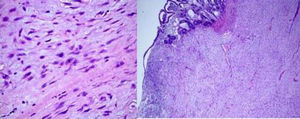
Al corte, estructura sólida, con zonas quísticas y amplias zonas de aspecto mixoide. Microscópicamente, proliferación de células fusiformes y estrelladas con citoplasma eosinófilo y con escasa actividad mitótica (5 mitosis no atípicas por 50 campos a alto aumento), en un estroma mixoide (fig. 2). Inmunohistoquímica tinción fuerte y difusa para vimentina y negativa para CD117, CD34, ALK, S100, EMA, CK AE1/AE3, CD31, BCL2 y desmina (fig. 3). La cuantificación de c-Ki-67 del 8%. El diagnóstico histológico e inmunohistoquímico final fue, sarcoma fibromixoide de mesenterio de bajo grado.
Tinción con hematoxilina-eosina: microscópicamente se observan proliferación de células fusifomes, con baja densidad celular, con núcleos ovales e hipercromáticos, con ligero pleomorfismo, cromatina finamente agrupada y uno o varios nucléolos pequeños, con escasa actividad mitótica (5 mitosis-50 CGA). Células depositadas en estroma mixoide, que varía en la tumoración, con transición entre ellas. En las zonas de mayor densidad infiltrado inflamatorio linfoplasmocitario. Depósitos de hemosiderina.
El paciente no presentó complicaciones posquirúrgicas y fue dado de alta. No se indicó terapia neoadyuvante. Tras 2 años de seguimiento, se encuentra asintomático.
El SFBG se presenta de manera habitual como una masa indolora en los tejidos blandos profundos, de tamaño variable, se suele originar en las extremidades inferiores, sobre todo muslo; seguido por orden decreciente de la pared torácica, axila, hombro, ingle, nalga y cuello. Desde su descripción en 1987 por Evans1 hasta la última revisión2, la afectación del mesenterio solo se recoge en 4 casos. Otras localizaciones infrecuentes son el retroperitoneo, el mediastino o la región paravertebral3.
El examen físico, pruebas de imagen como la resonancia magnética (RM) y la TAC orientan al diagnóstico de esta enfermedad. En la TAC se identifican áreas de atenuación hipodensa en el músculo y disminución de la intensidad, en la RM mejoría del realce tras la administración de contraste4.
Para el diagnóstico definitivo la toma de muestras mediante incisión, escisión o resección quirúrgica suelen ser necesarias5. Dadas las características citológicas, el diagnóstico mediante biopsia por aspiración con aguja fina (PAAF) no es específico, sin embargo, los hallazgos histológicos y la correlación clínica pueden reducir el abanico diagnóstico6.
En la inmunohistoquímica existe tinción intensa y definida para vimentina y negativa para desmina, queratina, S100, CD117, CD34, CD31. La actina es positiva en la pared de los vasos pequeños dentro del tumor y muy positiva en la capa fibrosa periférica.
La translocación balanceada t(7;16)(q34;p11) que conlleva el gen de fusión FUS/CREBL2 (en casos raros FUS/CREB3L1), parece ser específica para el diagnóstico de este tumor7. Se han descrito 2 casos de SFBG con una mutación no descrita previamente (EWSR1/CREB3L1), mostrando tinción positiva mediante inmunohistoquímica para MUC48.
La transcripción de fusión genética es una herramienta útil para confirmar el diagnóstico, en casos de escaso material extraído o cuando la histopatología típica no está presente7, sin tener ningún papel en la predicción de los resultados clínicos a medio plazo9.
El diagnóstico diferencial en el tracto gastrointestinal es bastante amplio y abarca una gran variedad de neoplasias fibroblásticas y/o mixoides que pueden ocurrir en el intestino, pero en particular debemos realizarlo con la fibromatosis, tumores del estroma gastrointestinal, perineuroma, pólipo fibroso inflamatorio, schwanoma intestinal, tumor miofibroblástico inflamatorio, mesenteritis esclerosante, liposarcoma retroperitoneal de bajo grado de diferenciación y el tumor miofibroblástico angiomixoide plexiforme10.
El tratamiento habitual es la resección quirúrgica, con márgenes libres, teniendo en cuenta el alto potencial metastásico y de recidiva local a pesar de ser tumores de bajo grado2. Se describen recidivas y metástasis pulmonares (54 y 6%, respectivamente) hasta 45 años después del diagnóstico, por lo que se recomienda seguimiento a largo plazo. No existe un consenso respecto a cada cuanto tiempo se deben realizar pruebas de imagen de control11.
La radioterapia no parece ser efectiva. Los tumores con translocación genética demostrada, la quimioterapia con trabectedina podría ser eficaz12.