La peritonitis bacteriana espontánea (PBE) es la infección más característica, y una de las más frecuentes, en los pacientes cirróticos1. Aunque las bacterias gramnegativas de origen entérico han sido consideradas tradicionalmente las responsables de la mayoría de las PBE, en el transcurso de los últimos años se han producido cambios sustanciales en la epidemiología y la etiología de este proceso. En primer lugar, la generalización del uso prolongado de quinolonas como profilaxis de la recidiva de la PBE se ha acompañado de un incremento de la proporción de casos debidos a bacterias grampositivas2,3. Por otra parte, se ha constatado la progresiva aparición de PBE causadas por gérmenes resistentes a los antibióticos usados habitualmente en su tratamiento, tanto quinolonas4-8 como cefalosporinas9. Paralelamente, las infecciones causadas por Staphylococcus aureus resistentes a meticilina (SARM) se han convertido en un fenómeno preocupante dada su potencial gravedad y su creciente incidencia10. Los pacientes cirróticos constituyen sin duda un grupo de riesgo para la colonización e infección por SARM, dado que no solamente se someten a frecuentes hospitalizaciones y maniobras invasivas sino que reciben con frecuencia tratamientos prolongados con quinolonas. Se presentan 2 casos de PBE por SARM que comparten algunas características epidemiológicas y de curso evolutivo.
OBSERVACIONES CLINICAS
Caso 1
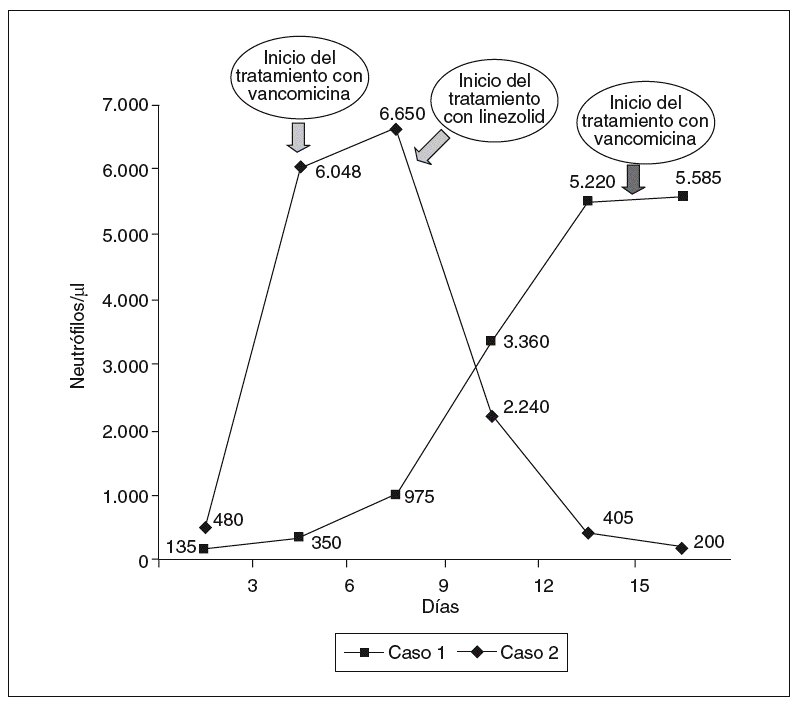
Varón de 71 años, ex fumador y consumidor habitual de dosis elevadas de alcohol. Presenta antecedentes patológicos de diabetes mellitus tipo 2 con nefropatía diabética, enfermedad pulmonar obstructiva crónica (EPOC) y cirrosis hepática de etiología alcohólica en estadio Child-Pugh B. Un mes antes de su ingreso fue diagnosticado en otro centro de hepatocarcinoma en estadio avanzado no subsidiario de tratamiento con intención curativa o paliativa. Ingresó en nuestro servicio procedente de urgencias por progresión de la semiología de ascitis y aparición de una ictericia significativa. En la exploración física destacaba la presencia de ictericia cutaneomucosa franca, hepatomegalia y semiología de ascitis significativa, aunque no a tensión, con edemas en ambas piernas. En la analítica al ingreso presentaba los siguientes parámetros: leucocitos 14.000/µl (95% polimorfonucleares); hematocrito 42%; hemoglobina 14,7 g/dl; VCM 95 fL; plaquetas 303.000/µl; AP 72%; glucosa 116 mg/dl; urea/creatinina 95/3,1 mg/dl; GOT/GPT: 135/75 U/l; bilirrubina total 30 mg/dl; albúmina 3 g/dl. Líquido ascítico al ingreso: proteínas 1,1 g/dl; leucocitos 300/µl. En la radiografía de tórax se apreció únicamente un derrame pleural izquierdo de pequeño tamaño. En la ecografía de abdomen se observó una masa hepática heterogénea de gran tamaño en el lóbulo hepático derecho con compresión de las vías biliares en el hilio hepático, que se acompañaba de dilatación intrahepática de éstas. Se abordó la vía biliar intrahepática por vía transparietohepática y se implantó un drenaje biliar percutáneo interno-externo, que se acompañó de un descenso significativo de las cifras de bilirrubina. Pocos días después del drenaje biliar el paciente presentó clínica de encefalopatía hepática y se detectó, en la búsqueda de una causa desencadenante, la presencia de criterios de PBE (500 leucocitos/µl, 70% polimorfonucleares). Se instauró tratamiento antibiótico empírico con cefotaxima, y posteriormente imipenem, sin que reuniera criterios de respuesta al tratamiento en los sucesivos controles de líquido ascítico. Se descartó la presencia de focos sépticos intraabdominales mediante tomografía computarizada (TC) de abdomen urgente. Tras aislarse SARM en uno de los cultivos de líquido ascítico, se inició tratamiento con vancomicina. A pesar de que en el antibiograma se confirmó que la cepa aislada era sensible a dicho antibiótico (concentración mínima inhibitoria [CMI] < 1 µg/ml), el recuento leucocitario en el líquido ascítico siguió aumentando progresivamente en los días sucesivos (fig. 1). En este contexto, el paciente desarrolló un cuadro de sepsis grave con fallo multiorgánico y progresión del cuadro de insuficiencia hepática y encefalopatía, que causó finalmente su fallecimiento.
Fig. 1. Evolución del líquido ascítico.
Caso 2
Mujer de 28 años de edad, con antecedentes de epilepsia temporooccipital en tratamiento con carbamacepina y hepatopatía avanzada, atribuida a fibrosis hepática congénita diagnosticada a los 10 años de edad mediante biopsia hepática. Había presentado 2 episodios previos de hemorragia digestiva por hipertensión portal, por lo que seguía profilaxis secundaria con bloqueadores beta y nitratos, así como 2 episodios de ascitis e hidrotórax leves con muy buena respuesta a dosis bajas de diuréticos, manteniendo una función renal normal. Unas semanas antes presentó un cuadro de gastroenteritis aguda, que requirió ingreso hospitalario y por el que recibió tratamiento antibiótico con levofloxacino. Ingresó en nuestro servicio por reaparición del cuadro de fiebre y diarrea desde 24 h antes. A su llegada al servicio de urgencias se encontraba febril, con signos de deshidratación, y refería un dolor abdominal difuso de características poco específicas. No se detectó ascitis en la ecografía abdominal. Tras su ingreso se practicó una TC de abdomen y se detectó un conglomerado adenopático en el tronco celíaco y la raíz del mesenterio, así como adenopatías retroperitoneales, todo ello altamente sugestivo de linfoma. Tras valoración por el servicio de hematología, se practicó una laparotomía exploradora, que transcurrió sin incidencias, para toma de biopsias de la masa, que fue informada como angiomatosis linfática reactiva sin datos de malignidad. En el postoperatorio la paciente presentó ascitis e hidrotórax, por lo que se diagnosticó una PBE (800 leucocitos/µl, 70% polimorfonucleares) y se inició tratamiento empírico con cefotaxima. Al día siguiente la paciente presentó una hemorragia por varices esofágicas, que requirió el ingreso en la unidad de cuidados intensivos (UCI). Durante su estancia en la UCI se constató el aumento del recuento de polimorfonucleares en líquido ascítico (900 leucocitos/µl, con un 90% de polimorfonucleares), por lo que se añade levofloxacino y clindamicina al tratamiento antibiótico. Asimismo, en el frotis nasal, realizado por protocolo en la UCI, se detecta colonización nasal por SARM. Una vez en la planta de hospitalización, se constató un empeoramiento de las características del líquido ascítico (7.000 leucocitos, con un 95% de polimorfonucleares) (fig. 1), por lo que se modificó la pauta antibiótica iniciando tratamiento con imipenem y, dada la presencia de colonización por SARM, con vancomicina. Una nueva TC de abdomen descartó la presencia de abscesos y colecciones intraabdominales. Posteriomente, se confirmó la positividad del cultivo del líquido ascítico y del exudado de la herida quirúrgica para SARM sensible in vitro a vancomicina (CMI < 1 µg/ml). A pesar de ello, la paciente no presenta buena evolución clínica al cambio de tratamiento y no se observan criterios de resolución de la PBE en un nuevo control de líquido ascítico (2.800 leucocitos/µl, un 80% polimorfonucleares), por lo que se inicia tratamiento con linezolid. Tras este último cambio de tratamiento se constata la resolución de la infección en 8 días. Sin embargo, a pesar de ello, la paciente presentó durante su ingreso un deterioro progresivo de la función hepática (bilirrubina 43 mg/dl, AP18% y encefalopatía hepática de grado IV), que condujo finalmente a su fallecimiento.
DISCUSION
La colonización por SARM en los pacientes hospitalizados es frecuente y se asocia con estancias prolongadas, tratamiento antibiótico previo, ingreso en unidades de críticos y práctica de maniobras invasivas. Además, a diferencia de lo que ocurre con la colonización por cepas de S. aureus meticilin-sensibles, conlleva un elevado riesgo de desarrollar una infección grave11. Aunque las infeccio nes más frecuentemente causadas por SARM son cutáneas, urinarias o respiratorias, se ha descrito en los últimos años la aparición de PBE por SARM9,12,13. Un 17-29% de los pacientes cirróticos hospitalizados se ha identificado como portadores nasales de SARM12-14. Al igual que en el resto de los casos, la colonización por SARM en los pacientes cirróticos se produce con frecuencia en el transcurso de la hospitalización y se asocia con la práctica de maniobras invasivas y la administración previa de antibióticos12,13. Además, es más frecuente en pacientes con una peor función hepática, evaluada tanto por el índice de Child-Pugh como por el sistema MELD12,14. La relevancia clínica de la colonización por SARM en los pacientes cirróticos se deriva de su asociación con una mayor probabilidad de desarrollar infecciones por dicha bacteria que conlleva, dada su potencial gravedad, un incremento significativo de la mortalidad intrahospitalaria. De hecho, la colonización y/o infección por SARM se ha identificado en varios estudios como un factor predictivo independiente de mortalidad en pacientes cirróticos12,13,15. Por otra parte, el estado de portador nasal de SARM en el pretrasplante se ha identificado también como un factor de riesgo para la aparición de infección postrasplante, con un incremento de la mortalidad en el mismo período14,16.
Los dos casos de PBE por SARM que aquí se discuten comparten algunas características. En ambos casos, además de estar ingresados en el momento de detectar la infección por SARM, se registraba un episodio previo y reciente de hospitalización. Es razonable suponer que en el transcurso de alguna de estas hospitalizaciones pudo establecerse la contaminación por SARM. Por otra parte, ambos pacientes fueron sometidos a prácticas invasivas (drenaje biliar transparietohepático y laparotomía exploradora, respectivamente), durante las cuales es factible que se produjera la contaminación del líquido ascítico a partir de una colonización cutánea. En este sentido, y dada la ausencia de un foco séptico intraabdominal, ambos episodios infecciosos pueden englobarse dentro de la categoría de peritonitis «espontáneas», aunque en su patogenia la translocación bacteriana intestinal, origen de las bacterias responsables de la mayoría de las PBE, no desempeñe probablemente ningún papel en estos 2 casos. Por otra parte, aunque ninguno de los 2 pacientes seguía profilaxis con quinolonas, al menos uno de ellos había recibido tratamiento con dichos antibióticos recientemente.
En la medida en que la práctica de maniobras invasivas y el uso de profilaxis antibiótica es cada vez más frecuente en los pacientes cirróticos, es previsible que la PBE, así como otras infecciones causadas por SARM, constituyan un problema emergente en este grupo de pacientes. Por ello, parece razonable plantearse la utilidad de adoptar medidas de control de la colonización por SARM en los pacientes cirróticos hospitalizados. En un sentido general, se ha recomendado el desarrollo de programas de detección de colonización nasal por SARM en pacientes de alto riesgo, a fin de instaurar precozmente medidas de aislamiento y disminuir la transmisión por contacto17. La eficacia de la erradicación de la colonización nasal mediante la administración de mupirocina tópica para disminuir la aparición de infecciones por SARM es, sin embargo, controvertida18,19. Son muy escasas las evidencias disponibles acerca de la eficacia de programas de vigilancia activa de colonización, y de erradicación de ésta, en la disminución de la incidencia de infecciones por SARM en los pacientes cirróticos hospitalizados. En el estudio más relevante al respecto, Dupeyron et al20 evaluaron prospectivamente la eficacia de un programa de erradicación de la contaminación nasal por SARM con mupirocina en 484 pacientes, de los cuales el 69% padecía una hepatopatía crónica. Aunque el tratamiento con mupirocina consiguió la erradicación en el 99% de los 86 pacientes colonizados y tratados, en un 26% de ellos se demostró la recolonización durante el mismo ingreso y, lo que es más importante, no se observó una disminución en la incidencia de infecciones por SARM con respecto al grupo de pacientes colonizados por SARM y no tratados con mupirocina. Así pues, no se dispone hasta el momento de argumentos que justifiquen el tratamiento con muporicina en todos los pacientes cirróticos colonizados por SARM que ingresen en un hospital. Se ha propuesto, como un abordaje más práctico del problema, añadir vancomicina al tratamiento antibiótico empírico de la PBE en situaciones de alto riesgo (p. ej., en las adquiridas en el hospital) y/o en pacientes sometidos a tratamientos prolongados con antibióticos, en especial quinolonas, o cuando el tratamiento estándar no es eficaz en las primeras 48 h13,15. Sin embargo, tampoco se dispone de datos que proporcionen argumentos sólidos para recomendar la adopción de esta actitud terapéutica en la práctica clínica.
Por otra parte, en los 2 casos que se discuten se observó resistencia in vivo al tratamiento con vancomicina, pese a haberse documentado sensibilidad in vitro a dicho antibiótico. Este fenómeno, frecuente en las infecciones por SARM, puede relacionarse con la presencia de cepas portadoras del polimorfismo II, con una peor respuesta clínica y mayor resistencia al tratamiento en diferentes estudios20-22. Por ello, debe destacarse el papel de los antibióticos de reciente aparición, fundamentalmente linezolid, quinupristin-dalfopristin y daptomicina, en el tratamiento de las infecciones por SARM. Quinupristin-dalfopristin ha demostrado su eficacia frente a infecciones por SARM, aunque con tasas de respuesta en torno al 71%. La daptomicina es un antibiótico bactericida, eficaz frente a SARM, aunque no parece presentar diferencias respecto a la vancomicina. Finalmente, linezolid, por su mejor biodisponibilidad y su eficacia contrastada en diversos ensayos clínicos, parece la mejor opción en casos de SARM no respondedores a vancomicina23.
En conclusión, el cambio epidemiológico producido durante los últimos años en la etiología de la PBE debe hacernos considerar los gérmenes grampositivos, y entre ellos a SARM, como los agentes más probablemente responsables de dicha infección en algunos pacientes cirróticos (hospitalizados, en tratamiento prolongado con antibióticos o sometidos a maniobras invasivas) y considerar la modificación de la pauta antibiótica empírica, añadiendo vancomicina, en caso de mala evolución de la PBE con el tratamiento antibiótico habitual. Sin embargo, por el momento no hay evidencias que apoyen la búsqueda y la erradicación sistemática de la colonización por SARM en los pacientes cirróticos hospitalizados. Finalmente, la emergencia de infecciones por SARM y otras bacterias multirresistentes en pacientes cirróticos, que está en clara relación con el uso prolongado de antibióticos, pone de manifiesto las limitaciones y los riesgos de la generalización de la descontaminación intestinal selectiva con quinolonas y subraya la necesidad de buscar alternativas al uso de antibióticos en la prevención primaria y secundaria de la PBE.