INTRODUCCION
En 1953, Shaw y Green1 publicaron el caso de un infarto mesentérico masivo tras ligar la arteria mesentérica inferior (AMI) en el curso de una resección de colon por carcinoma. Diez años después, Scott Boley et al2 comunicaron el primer caso de isquemia no oclusiva y reversible del colon. Ambas formas clínicas (oclusiva y no oclusiva) se englobaron bajo el nombre de colitis isquémica (CI) por Martson et al3 en 1966. Gran parte de nuestro conocimiento de esta enfermedad se sustenta en la experiencia publicada por el propio Scott Boley y Lawrence J. Brandt. En su manuscrito, «Colonic ischemia», que recoge la experiencia del Hospital Montefiori de Nueva York, se anuncia que «el número de casos de CI aumentará en las próximas décadas, en la medida que aumente la población de más de 65 años y también nuestra capacidad para sospechar y diagnosticar esta enfermedad»4. Estas previsiones han empezado a hacerse realidad en nuestro país, donde el 25% de la población alcanza ya una edad igual o superior a los 65 años. Datos recientes obtenidos en España5 indican que efectivamente la incidencia de CI se está incrementando. El presente artículo proporciona información acerca de las claves que permiten sospechar el cuadro, y los procedimientos disponibles para confirmar el diagnóstico, en función del patrón de presentación.
CONCEPTO Y EPIDEMIOLOGIA
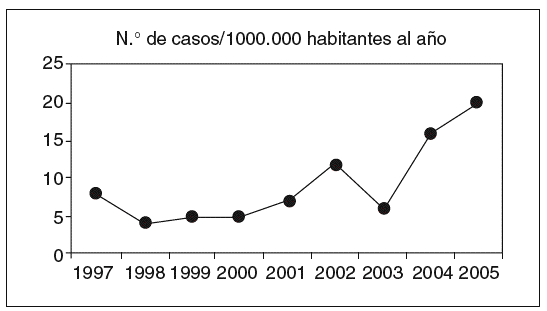
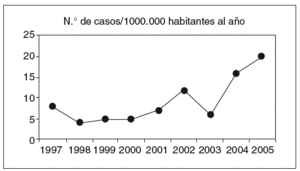
La CI representa la forma más frecuente de isquemia intestinal (el 60-70%) y surge cuando el colon se ve transitoriamente privado del flujo vascular debido a una alteración de la circulación sistémica o a un problema local de naturaleza anatómica o funcional. Su presentación oscila entre las formas leves y transitorias con afección de la mucosa y la submucosa, y las formas fulminantes que conducen a un estado de necrosis gangrenosa con perforación, peritonitis y muerte (tabla I). Datos comunicados por Brandt4 y corroborados en nuestro medio5 permiten estimar que la CI representa en el momento actual uno de cada 2.000 ingresos hospitalarios y el 0,9-1% de todas las colonoscopias en un hospital de referencia. La incidencia estimada en la población general oscila entre 4,5 y 44 casos por 105 habitantes al año, según se desprende de algunas revisiones sistemáticas6, y es superior entre las personas de más de 65 años, en los pacientes con enfermedad pulmonar obstructiva crónica y, probablemente, entre los pacientes con síndrome de intestino irritable (SII). En la figura 1 se muestra la incidencia de CI en nuestro medio, situada en el momento actual en 16-20 casos por 105 habitantes y año5. Todas estas cifras infravaloran la verdadera incidencia de la enfermedad, debido a que las formas más leves pasan a menudo desapercibidas. En algunos casos, el paciente no llega a consultar con el médico, en otros no llega a establecerse el diagnóstico, debido a que las exploraciones se realizan tarde. Finalmente, muchos casos se han interpretado de forma errónea como colitis de naturaleza infecciosa o inflamatoria (v. más adelante)7.
Fig. 1. Incidencia de colitis isquémica en el Hospital San Jorge (1997-2005).
ANATOMIA VASCULAR DEL COLON: AREAS DE RIESGO
El colon recibe la irrigación de dos sistemas vasculares principales. La arteria mesentérica superior (AMS) proporciona el flujo vascular al colon derecho y al colon transverso proximal, por medio de tres arterias (cólica media, cólica derecha e ileocólica). Estas tres arterias se hallan interconectadas entre sí por un sistema de arcadas que configuran la arteria marginal de Drummond. Desde esta arteria, el flujo vascular se conduce a través de los vasos rectos hasta el colon derecho. La arteria marginal de Drummond está pobremente desarrollada en el 50% de la población y, además, una o más de las tres ramas principales de la AMS puede estar ausente hasta en el 20% de la población. Ello explica que el colon derecho sea uno de los tres puntos más sensibles a los efectos de la hipoxia, especialmente en situaciones de bajo gasto. El colon izquierdo está irrigado por tres ramas de la AMI (cólica izquierda, sigmoidea y rectal superior). Éstas se hallan igualmente interconectadas entre sí por la arteria marginal de Drummond. Hay un sistema de colaterales, conocido como arco de Riolano, que une la AMS y la AMI mediante una conexión entre la arteria cólica media y la cólica izquierda. Este sistema garantiza el aporte de flujo en condiciones de isquemia al ángulo esplénico del colon. Sin embargo, hasta en un 30% de la población, el soporte vascular proporcionado por el arco de Riolano y la arteria marginal de Drummond es pobre o inexistente, haciendo del ángulo esplénico (punto de Griffith) un punto especialmente vulnerable a la isquemia. Hay un tercer punto de riesgo en la unión rectosigmoidea, en que las ramas de la arteria sigmoidea se unen con la arteria rectal superior (punto de Sudek). La circulación en esta zona también es pobre, haciéndola especialmente sensible a los efectos de la hipoxia. Aun cuando los 3 puntos descritos (colon derecho, flexura esplénica y flexura rectosigmoidea) son áreas de mayor riesgo, realmente cualquier área del colon, incluido el recto, puede verse afectada por una colitis isquémica8. En una serie de 250 casos, el colon izquierdo fue el más comúnmente afectado, y se apreciaba una afección del colon derecho en el 12% de los casos, del colon transverso y el ángulo esplénico en el 17%, de la flexura esplénica sola en el 11%, del colon descendente y el sigma en el 40%, y del recto en el 6%2. Estos datos han sido refrendados en nuestro país en una evaluación prospectiva que está siendo llevada a cabo por el grupo de trabajo para el estudio de la CI en España (GTECIE) (www.colitisisquemica.org). Finalmente, se ha comprobado que en los ancianos se aprecia una mayor tortuosidad en los vasos que irrigan el colon. Este factor anatómico incrementa el riesgo de accidentes vasculares al aumentar la resistencia vascular.
ETIOLOGIA: FACTORES PREDISPONENTES
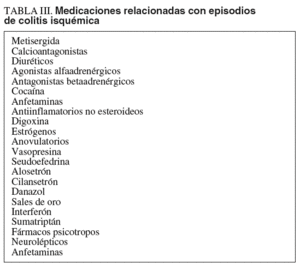
El conocimiento de los mecanismos que predisponen a la prersentación de una CI es esencial para establecer la sospecha diagnóstica (v. más adelante). Hay formas oclusivas y no oclusivas (tabla II). En el primer caso, la isquemia aparece como consecuencia de la obstrucción de una de las ramas vasculares que irrigan el colon (embolia, trombosis o traumatismo). El ejemplo más característico de CI secundaria a un trauma es la cirugía de reconstrucción aórtica9. En estos casos, la CI surge tras la ligadura de la AMI, en pacientes con pobre circulación colateral. Las oclusiones de pequeños vasos suelen obedecer a estados de hipercoagulabilidad o vasculitis10. Las formas no oclusivas pueden aparecer espontáneamente o como consecuencia del vasospasmo que surge en situaciones de bajo gasto secundario a insuficiencia cardíaca, hemorragia, sepsis o deshidratación11. En tal caso, el colon derecho suele ser el órgano más sensible. Los casos de isquemia no oclusiva que aparecen de forma espontánea (los más frecuentes) no suelen estar asociados a un factor precipitante claro. No obstante, es interesante conocer que el flujo sanguíneo del colon es inferior al de cualquier otro segmento intestinal, desciende con la actividad motora y se ve afectado, en gran medida, por la estimulación autónoma7. Estos factores, unidos al hecho de que los pequeños vasos afectados por la arteriosclerosis responden exageradamente a los estímulos vasoconstrictores, hacen que el colon de los pacientes mayores de 65 años, diabéticos, hipertensos o en diálisis sean más vulnerables a este tipo de accidentes12. Entre estos estímulos se incluyen algunos fármacos con propiedades vasoconstrictoras, frecuentemente empleados en los pacientes ancianos (digital, bloqueadores beta, antihistamínicos)12. Otros fármacos que se han implicado en el desarrollo de CI incluyen los antiinflamatorios no esteroideos (AINE), los fármacos psicotropos y los laxantes13 (tabla III). Entre los pacientes jóvenes, debe hacerse una búsqueda intencionada del uso de cocaína14,15, un potente vasoconstrictor, o la práctica de atletismo16 (corredores de largas distancias). Nuevamente, en estos casos, la importante vasodilatación asociada al ejercicio extenuante y la deshidratación pueden desviar la sangre del territorio esplácnico hacia los órganos vitales, provocando una isquemia en el colon. Otras causas de CI en los pacientes jóvenes incluyen los estados de hipercoagulabilidad17,18, el abuso de fármacos vasoconstrictores (anfetaminas) y algunas vasculitis, como la poliarteritis nodular y el lupus eritematoso. La CI puede igualmente complicar la evolución de los pacientes con oclusión del colon debido a neoplasias, diverticulitis, vólvulos o bridas19. En este mismo grupo debe incluirse la impactación fecal asociada a un estreñimiento grave. Ello ocurre porque la distensión que aparece en el segmento proximal provoca un incremento de la presión intramural que conduce a un estado de hipoxia relacionada con la estasis venosa20. Actualmente se discute la asociación entre CI, el SII y el uso de agentes serotoninérgicos utilizados para su tratamiento21. El alosetrón, un antagonista de los receptores HT3 tuvo que ser retirado del mercado transitoriamente, por haberse relacionado con la aparición de episodios de CI. Sin embargo, no hay claras evidencias que hayan implicado al tegaserod, un agonista de los receptores-HT4 utilizado para el tratamiento de la constipación. De hecho, el estreñimiento, per se, constituye un factor de riesgo para el desarrollo de CI, especialmente en pacientes ancianos20,22.
FISIOPATOLOGÍA
La isquemia cólica aparece como resultado de un flujo vascular inadecuado para responder a las demandas metabólicas del intestino2. Cuando este fenómeno surge como consecuencia de la oclusión o de la hipoperfusión de un vaso de grueso calibre, la afección suele ser transmural y conduce a un estado de necrosis gangrenosa. Por el contrario, cuando la isquemia es el resultado de la oclusión o baja perfusión de los vasos de pequeño calibre, la afección es intramural (no gangrenosa) y el pronóstico más favorable23. La respuesta intestinal a la isquemia se caracteriza inicialmente por un estado de hipermotilidad. Esta intensa respuesta motora explica el dolor intenso experimentado por el paciente en las fases inciales, así como la urgencia por la defecación, un fenómeno que aparece incluso en los casos en que la isquemia queda limitada a la mucosa. A medida que la isquemia progresa, la actividad motora cesa y la permeabilidad del intestino aumenta, apareciendo fenómenos de translocación bacteriana. En las formas graves, la extensión transmural de la isquemia permite el desarrollo de inflamación visceral y parietal, y aparecen signos de peritonitis y un síndrome de respuesta inflamatoria sistémica (SRIS)11 con fallo multiórgano.
DIAGNOSTICO
Índice de sospecha
El diagnóstico de CI requiere un elevado índice de sospecha clínica. Una evaluación retrospectiva de una serie de 62 casos, que analizó el grado de concordancia entre los diagnósticos emitidos al ingreso y al alta hospitalaria, mostró que sólo en el 8,1% de los casos considerados como definitivos o probables, de acuerdo con los criterios de Brandt (tabla IV), se había consignado esta posibilidad en el informe emitido en la sala de urgencias23. Estos datos han sido validados prospectivamente por el GTECIE, y se puede establecer que el índice de sospecha de CI en los servicios de urgencias (número de casos sospechados/número de casos confirmados + número de casos validados como probables) es sólo del 18%. Este bajo índice se explica por dos razones fundamentalmente: a) en la CI coexisten manifestaciones de tres grandes síndromes, el dolor abdominal agudo, la diarrea y la rectorragia. Todos estos síntomas constituyen la expresión de numerosas enfermedades que pueden afectar al colon, y b) el peso específico de cada uno de estos síntomas varía considerablemente de unos casos a otros. Mientras que en algunos pacientes se inicia el proceso patológico con un cuadro de dolor abdominal agudo de extrema gravedad, otros únicamente presentan un cuadro de diarrea aguda indolora y de curso autolimitado (con o sin sangre en las heces). Esta heterogeneidad en el patrón de presentación comporta una especial dificultad para establecer la sospecha clínica. Por otra parte, algunas de las exploraciones que podrían certificar el diagnóstico (p. ej., colonoscopia), a menudo no se realizan, o se llevan a cabo en un momento en el que ya se ha producido la restitutio ad íntegrum de las lesiones. Datos preliminares del estudio Colitis Isquémica en España (CIE) permiten estimar que, en nuestro país, el tiempo transcurrido desde el ingreso hasta la realización de la endoscopia es inferior a 48 h en el 38,2% de los casos, entre 2 y 5 días en el 29,4%, y superior a 5 días en el 32,2% (datos no publicados). Adecuar el índice de sospecha clínica a la verdadera prevalencia de la enfermedad obliga, por consiguiente, a tener un profundo conocimiento de sus diferentes patrones de presentación clínica, considerar siempre el contexto en el que se desarrollan los síntomas y realizar los procedimientos diagnósticos con la precocidad necesaria. A continuación, se exponen las formas de presentación típica y atípica de la CI, las pruebas complementarias que pueden ayudar a confirmar el diagnóstico y el orden en que éstas deben ser indicadas en función de la forma clínica predominante.
Presentación clínica
La forma de presentación de la CI es heterogénea y varía en función de la causa y la extensión de la oclusión vascular, el tiempo que el colon permanece privado del flujo vascular, el grado de circulación colateral y las comorbilidades asociadas. Se distinguen las siguientes formas clínicas8,23,24:
Formas leves (no gangrenosas)
En su forma más típica, el paciente presenta un cuadro de dolor abdominal en el cuadrante inferior izquierdo del abdomen, de intensidad leve o moderada, seguido de urgencia por la defecación y por la emisión de heces mezcladas con sangre de color rojo brillante u oscura en las 24 h siguientes7,8. El examen físico suele mostrar una leve hipersensibilidad sobre el área abdominal afectada. El carácter cólico del dolor es fruto de la intensa respuesta motora del intestino a la isquemia en sus fases iniciales, y representa el síntoma inicial en el 60-70% de los casos. En nuestra experiencia, así como en la de otros autores7,8,23, la tríada formada por dolor abdominal cólico, urgencia defecatoria y rectorragia se halla presente en más del 70% de los casos y es una de las claves para orientar el diagnóstico23. Un rasgo clínico interesante es la intensidad leve-moderada de la rectorragia. De hecho, sólo un 18% de los pacientes presenta anemia con valores de hemoglobina inferiores a 12 g/dl al tercer día del ingreso23. Una hemorragia de gran magnitud que requiere hemotransfusión debería sugerir otro diagnóstico7,23-25. Un 38% de los casos muestra una diarrea asociada o no a la presencia de sangre en las heces. En algunos de estos pacientes (un 12%), la diarrea es el rasgo clínico predominante y pueden ser ingresados en servicios de medicina interna con la sospecha clínica de una infección bacteriana gastrointestinal. El clínico debe estar atento, cuando este cuadro incide en un paciente con cualquiera de los factores de riesgo mencionados, especialmente si los exámenes bacteriológicos de las heces son negativos, dado que bajo la apariencia de una diarrea aguda de probable etiología infecciosa subyacen no pocas CI (con independencia de la edad de los pacientes). Un paciente de 17 años ingresó en nuestra unidad de gastroenterología por presentar una colitis hemorrágica de curso autolimitado. El enfermo había ingerido 24 h antes una hamburguesa poco cocinada (un caldo de cultivo excelente para el serotipo 0157:H7 de Escherichia coli enterohemorrágico). La endoscopia mostró una colitis ulcerativa segmentaria en el sigma y colon descendente. Ante la negatividad de los cultivos de las heces y la ausencia de otros factores de riesgo se indicó un estudio de trombofilia que permitió descubrir heterocigosidad para la mutación G20210A de la protrombina y un incremento de la lipoproteína (a) > 80 mg/dl. La investigación de los familiares permitió documentar otras mutaciones en el contexto de un síndrome hereditario de hipercoagulabilidad. Este ejemplo permite subrayar la importancia de un alto índice de sospecha para esta enfermedad (incluso en personas jóvenes) debido al impacto que ello representa para el futuro de estos pacientes y/o sus familiares.
Este patrón de presentación (forma no gangrenosa) afecta al 70-80% de los pacientes. De ellos, dos tercios, aproximadamente, cursan con restitutio ad íntegrum de las lesiones, incluidas las formas de colopatía reversible y/o de colitis transitoria. El tercio restante incluye un subgrupo de pacientes que siguen refiriendo diarrea persistente con sangre en la deposición y colopatía con pérdida de proteínas e hipoalbuminemia. Es importante identificar este subgrupo, dado que la persistencia de estos síntomas durante más de 2 semanas comporta un riesgo de perforación. Algunos pacientes (el 25-30%) desarrollarán una colitis segmentaria de curso crónico (v. más adelante).
Formas gangrenosas
Alrededor de un 15% de los pacientes muestran signos de peritonitis en el momento de la presentación. Se trata de los casos de afección transmural que conducen al infarto y necrosis gangrenosa del colon. En tales casos, el paciente suele presentar anorexia, náuseas, vómitos y distensión abdominal como expresión de íleo. Otros síntomas de alarma incluyen fiebre > 38 ºC, obnubilación e hipotensión, además de los signos de irritación peritoneal. Su evolución natural es hacia la perforación con peritonitis, sepsis y fracaso multiorgánico. La mortalidad de estos casos es superior al 50%5,8,12,26,27.
Pancolitis fulminante (colitis fulminante universal)
Este término se aplica a un subgrupo (< 5%) caracterizado por síntomas de curso rápidamente progresivo similares a los observados en una colitis ulcerosa grave con diarrea profusa y signos de toxicidad: fiebre, taquicardia, hipotensión, obnubilación, deshidratación, alteraciones hidroelectrolíticas, anemia, leucocitosis (> 20.000 leucocitos/µl) e hipoalbuminemia. Su evolución natural es también hacia la perforación con peritonitis. Este subtipo puede ser igualmente interpretado como una colitis de naturaleza infecciosa o incluso como el inicio de una enfermedad inflamatoria intestinal (EII), con el riesgo sobreañadido que comporta el empleo de corticoides en estos casos. Únicamente una endoscopia precoz permite asegurar el diagnóstico con precocidad y conceder una oportunidad al tratamiento (colectomía total).
Colitis ulcerativa crónica
Este subgrupo de pacientes (el 25-30%) se caracteriza por la aparición de un patrón ulcerativo crónico que afecta a una extensión variable del colon. Es importante conocer este patrón evolutivo, dado que no es excepcional que los síntomas del episodio inicial hayan pasado desapercibidos28,29 y el paciente consulte por primera vez por cualquiera de las siguientes manifestaciones:
Diarrea frecuentemente acompañada de sangre y pus, que imita el curso habitual de una EII. A menudo va acompañada de una colopatía con pérdida de proteínas.
Episodios recidivantes de fiebre alta acompañada de leucocitosis. Estos casos se explican por la presencia de un corto segmento ulcerado desde donde se producen fenómenos de translocación bacteriana (únicamente la exéresis quirúrgica resuelve este problema).
Síntomas de oclusión intestinal debidos a la aparición de una estenosis cicatricial.
Pruebas complementarias
Datos de laboratorio
Desafortunadamente, no hay un marcador sérico que pueda establecer de una forma precoz y fiable el diagnóstico de CI. Una leucocitosis moderada (> 12.000/ml) se observa en el 35% de los casos5,7,23. Como ya se ha mencionado, menos del 20% de los pacientes presentan anemia con valores de hemoglobina < 12 g/dl. Igualmente, puede apreciarse una elevación de la urea y alteraciones en los electrólitos séricos en los pacientes que muestran deshidratación. La elevación de la creatinfosfocinasa, la fosfatasa alcalina y la lactato deshidrogenasa, sugiere la presencia de una necrosis gangrenosa. En estos casos suele haber una acidosis metabólica, un marcador de mal pronóstico. Algunos estudios recientes indican que los valores plasmáticos de D-lactato, un producto del metabolismo bacteriano del colon, aumentan de un modo precoz30. Ello se explica por el aumento de la permeabilidad de la pared intestinal en condiciones de hipoxia. Una gran proporción de los pacientes con CI presentan una elevación de los valores del dímero D en el momento del ingreso. Al menos en un 30% de los casos se detecta hipoalbuminemia.
Radiografía simple de abdomen
En el momento de la presentación, especialmente en las formas que cursan con un abdomen agudo, la radiografía simple de abdomen permite descartar otras afecciones clínicas, como la oclusión o la perforación. En las formas leves, los hallazgos que proporciona la radiografía sim ple son inespecíficos e incluyen asas moderadamente dilatadas, pérdida de haustración y engrosamiento de la pared13. Aproximadamente un 20% de los pacientes muestran típicas impresiones dactilares (thumbprinting) que reflejan la presencia de edema y hemorragia submucosa en la pared del colon. La presencia de neumatosis coli, neumoperitoneo o gas en el territorio venoso portal puede aparecer en formas gangrenosas y sugiere un pronóstico infausto31.
Enema opaco
El enema opaco con doble contraste tiene una mayor sensibilidad que la radiografía simple de abdomen para mostrar impresiones dactilares («signo de las huellas de dedo») y otros signos de colitis segmentaria32. Sin embargo, el bario representa un problema en los casos en que se precisa una angiografía (v. más adelante), y supone una dificultad añadida en el caso en que sea necesario planificar una laparotomía13.
Colonoscopia
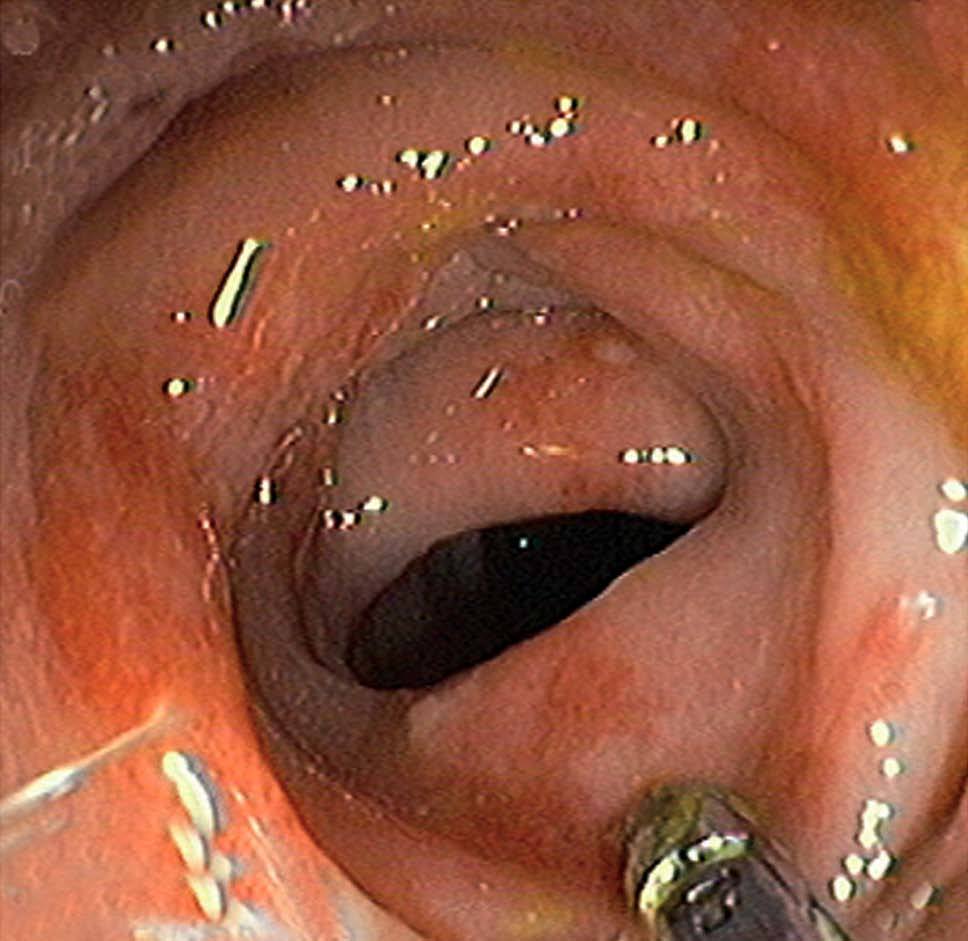
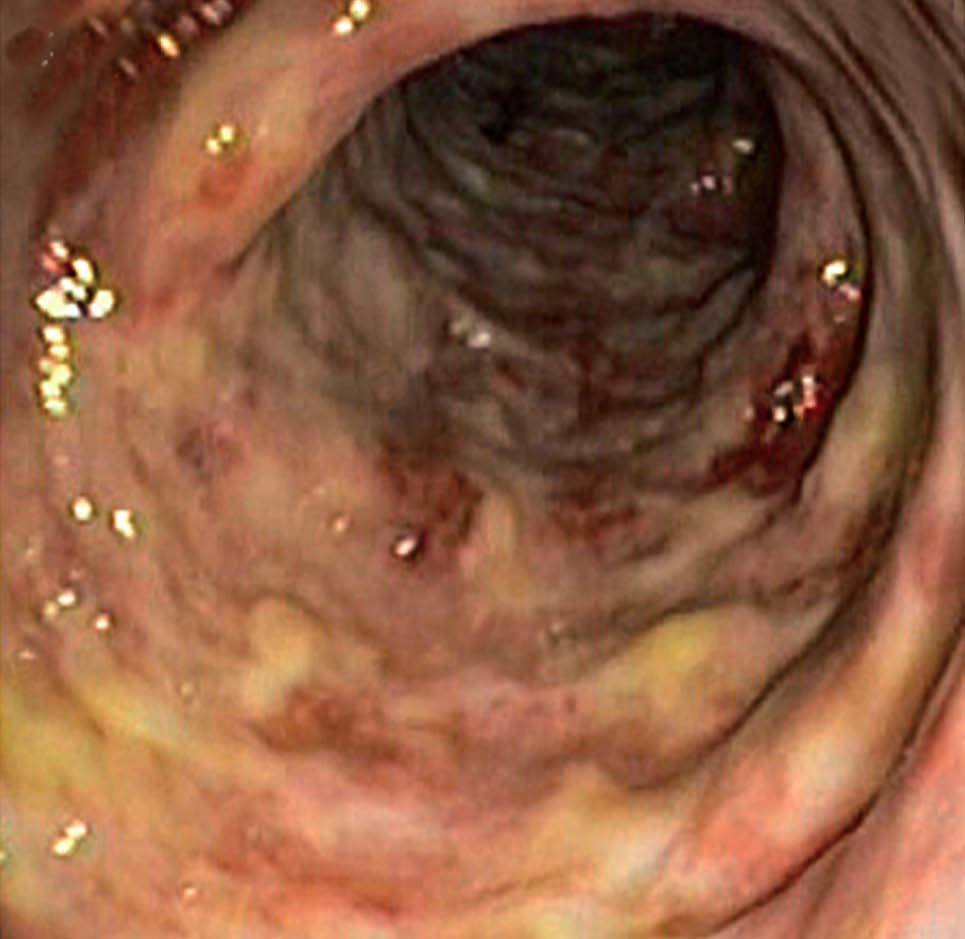
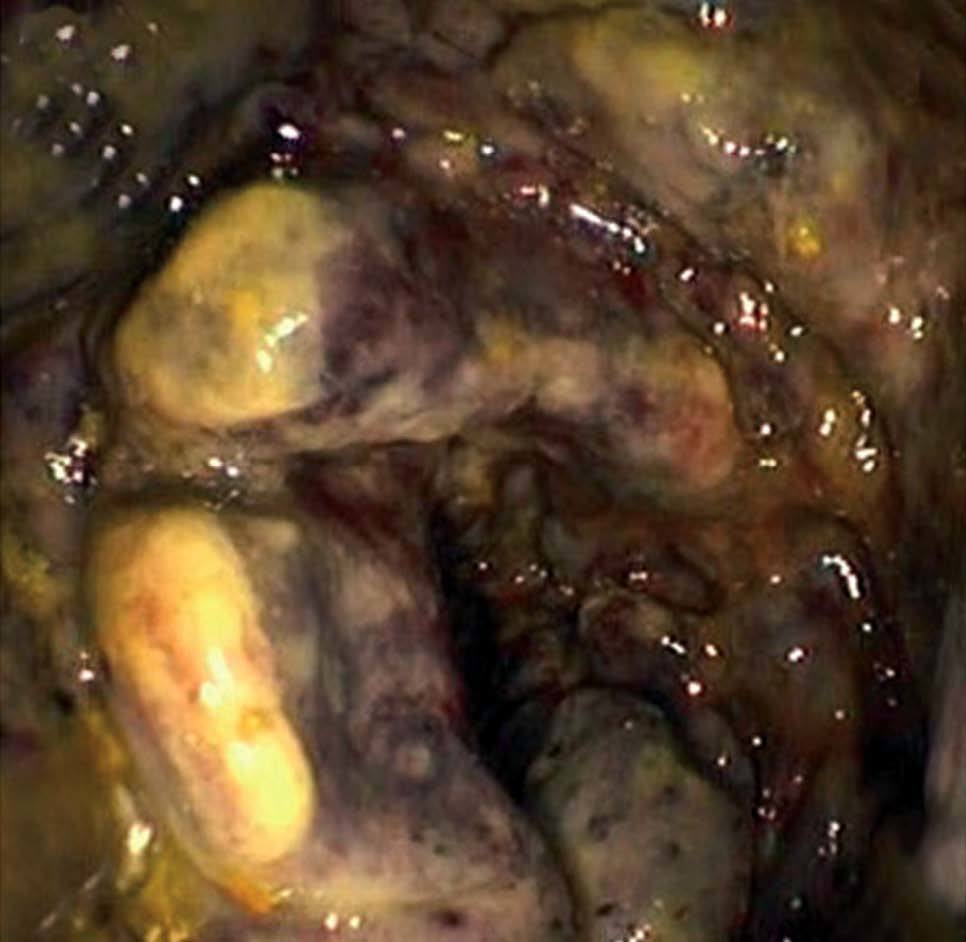
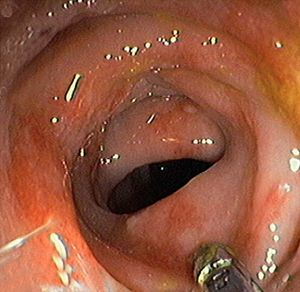
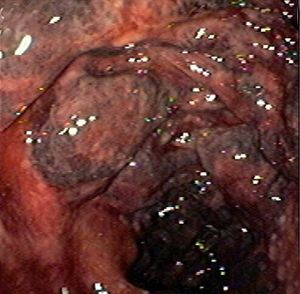
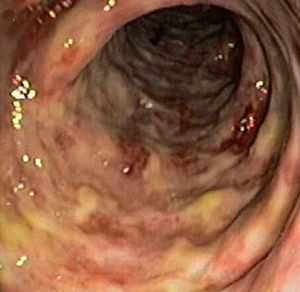
La colonocopia ofrece ventajas en relación con otras pruebas de imagen debido a su mayor sensibilidad para evaluar las alteraciones de la mucosa y a la posibilidad de tomar biopsias4,7. Está contraindicada en los casos de peritonitis, e idealmente debería realizarse sin preparación (las soluciones de polietilenglicol pueden agravar la isquemia), con baja insuflación y en un intervalo inferior a 48 h, momento en que es más probable la presencia de típicos nódulos rojo-violáceos característicos de la enfermedad (fig. 2). Cuando la colonoscopia se realiza 3-5 días después, la apariencia de la mucosa refleja la evolución natural de la enfermedad: restitutio ad íntegrum de la mucosa o aparición de un patrón de ulceración segmentaria que hace difícil su distinción con otras entidades. En los casos más graves, la endoscopia muestra áreas de mucosa negruzca que reflejan la presencia de gangrena (fig. 2). En estos casos, debe interrumpirse la exploración por el riesgo de perforación.
Fig. 2. Imágenes endoscópicas de colitis isquémica. A) Colopatía reversible (edema y hemorragia submucosos). B) Nódulos rojo-violáceos. C) Ulceración segmentaria. D) Necrosis.
Anatomía patológica
El examen histológico es importante, dado que puede certificar el caso como definitivo, si bien sólo hay dos hallazgos patognomónicos: el infarto de la mucosa y la presencia de células sombra (ghost cells). Otros ha llazgos, como la presencia de macrófagos cargados de hemosiderina, son muy indicativos de la enfermedad, pero poco frecuentes. Es habitual el hallazgo de edema y hemorragia submucosa, la presencia de trombos de fibrina y la infiltración de la mucosa por células inflamatorias, así como los fenómenos de reparación cicatricial (fibrosis)33. En la tabla IV se incluyen los criterios utilizados por Brandt para establecer un diagnósti co como definitivo, probable o posible, en función de los hallazgos clínicos, endoscópicos y anatomopatológicos.
Ecografía y tomografía computarizada abdominal
Cuando la endoscopia está contraindicada, la ecografía y la tomografía computarizada (TC) del abdomen pueden ser de utilidad, al mostrar el engrosamiento de la pared y la extensión del segmento afectado. Se ha establecido que el engrosamiento de la pared permite graduar la CI como leve (3-6 mm), moderada (6-12 mm) y grave (> 12 mm). Algunos signos tomográficos, como el signo del «doble halo», la presencia de líquido libre en el peritoneo, la neumatosi coli o el gas en el territorio venoso portal, comportan gravedad34. Recientes estudios indican que la ultrasonografía (US) Doppler aporta datos de interés en el diagnóstico de la CI, especialmente cuando se plantea el diagnóstico diferencial con la EII. Su especificidad oscila entre el 92 y el 100%, aunque su sensibilidad es inferior. La ausencia de flujo vascular en la pared del colon no sólo permite establecer el diagnóstico, sino que constituye un marcador de mal pronóstico35-37. A medida que aumente la disponibilidad de esta técnica, su papel en e>
Esta exploración rara vez está indicada en la CI debido a que en la mayoría de los casos el flujo vascular se ha restablecido cuando aparecen los primeros síntomas. Únicamente debe plantearse una angiografía cuando la isquemia mesentérica aguda (IMA) se contempla en el diagnóstico diferencial38. Debe recordarse que la IMA surge como consecuencia de un déficit del aporte sanguíneo dependiente de la AMS. En este caso, los síntomas aparecen coincidiendo con el comienzo del episodio isquémico y el diagnóstico no admite dilación debido a que un retraso en él suele tener consecuencias dramáticas. El clínico debe de considerar esta opción diagnóstica cuando las lesiones se circunscriben al colon derecho (irrigado por ramas de la AMS) o cuando la forma de presentación no permite distinguir con claridad ambas entidades. En tal caso, la angiografía permite resolver el diagnóstico con precisión (embolia, trombosis o isquemia no oclusiva) y proporciona la posibilidad de neutralizar el vasospasmo asociado mediante la perfusión intraarterial de fármacos vasodilatadores39-41.
Otras exploraciones
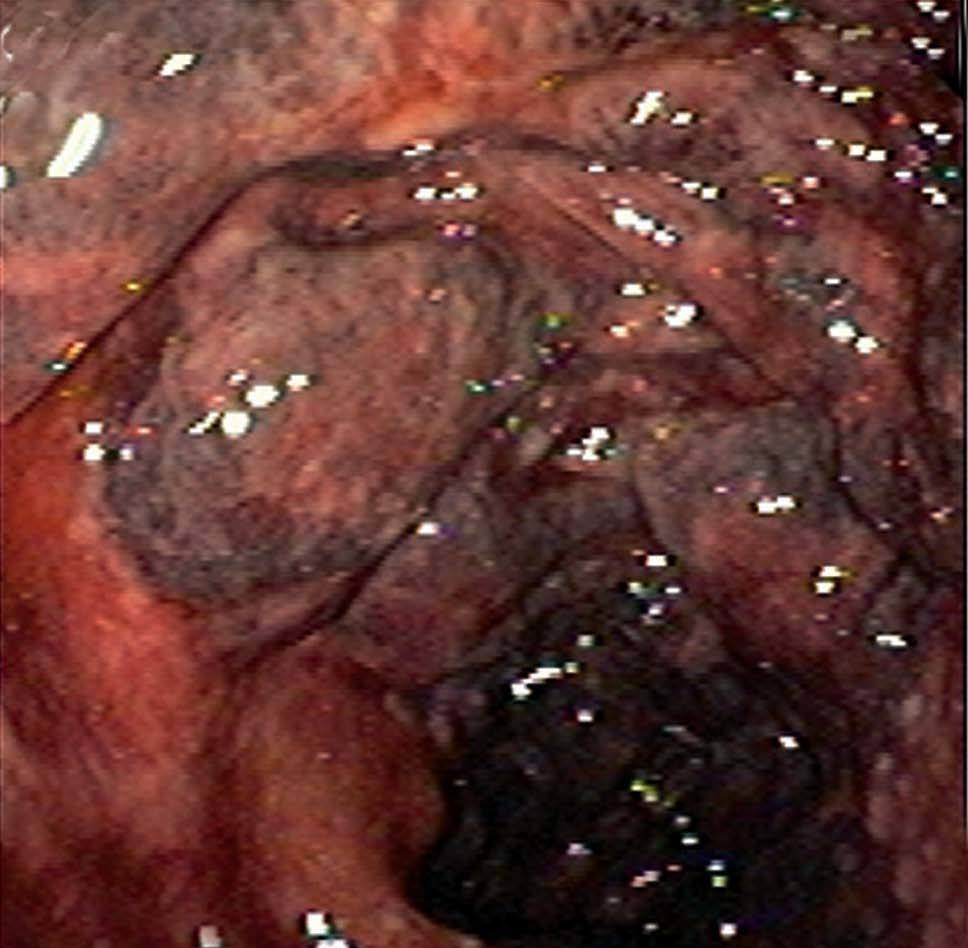
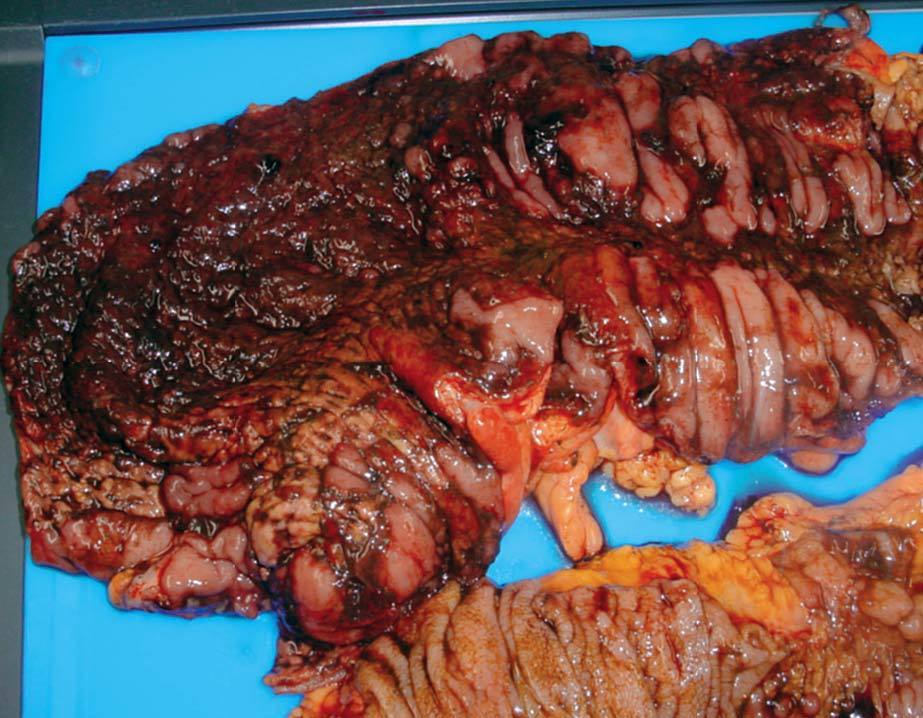
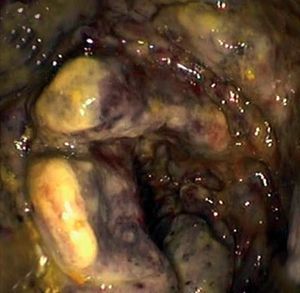
Se han propuesto algunas técnicas pare evaluar la viabilidad de los márgenes mucosos antes de proceder a la exéresis del colon afectado, cuando se plantea una indicación quirúrgica. En estos casos debe subrayarse que el aspecto de la serosa puede ser engañoso y no concordante con la presencia de signos de infarto en la muco sa (fig. 3). Se han descrito numerosas técnicas intraoperatorias para verificar este aspecto, incluyendo la US-Doppler, la fotopletismografía y la medición del gradiente de oxígeno transcólico por tonometría8,42,43. Desde un punto de vista práctico, la colonoscopia intraoperatoria puede ser suficiente en la mayoría de los casos8.
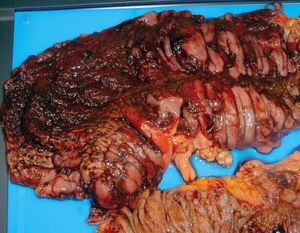
Fig. 3. Pieza de resección de una colitis isquémica gangrenosa. Obsérvese cómo los bordes de resección están afectados por la necrosis. Cortesía del Dr. Baqué.
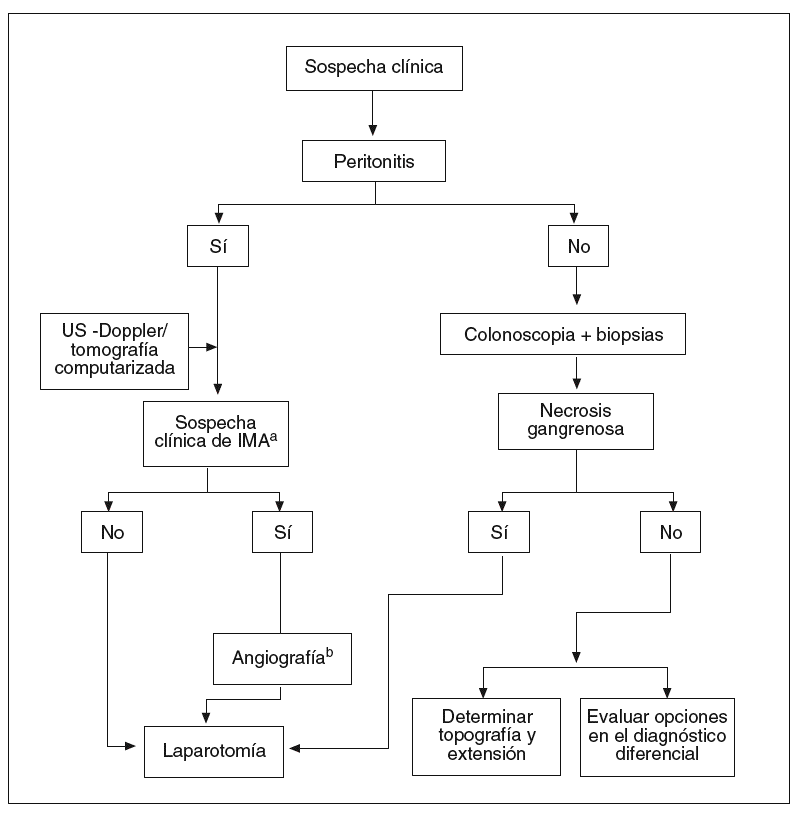
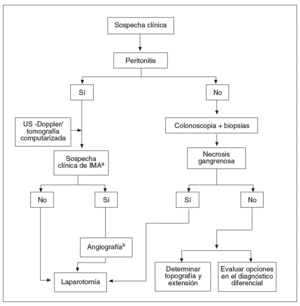
Pauta de actuación (fig. 4)
Fig. 4. Algoritmo diagnóstico en la colitis isquémica.
aIMA: isquemia mesentérica aguda (interruptor del flujo vascular dependiente de la arteria mesentérica superior). bIMA: únicamente si el procedimiento puede realizarse con celeridad y en ausencia de shock y/o fracso renal.
La estrategia diagnóstica depende de la forma de presentación clínica. Deben contemplarse 2 situaciones diferentes:
El paciente no presenta signos de peritonitis
En estos pacientes, el diagnóstico puede confirmarse mediante una colonoscopia. Ya se ha mencionado la importancia de efectuar esta exploración precozmente (< 24 48 h), sin preparación y con baja insuflación para no agravar las consecuencias de la hipoxia. Si el endoscopista detecta áreas de mucosa negruzca compatibles con necrosis gangrenosa, la exploración debe interrumpirse y realizar una consulta para valorar la posible intervención quirúrgica. Algunas pruebas de imagen, como la US-Doppler y la TC, pueden ser útiles para delimitar la topografía y la extensión de las lesiones, antes de la intervención. Si la necrosis está circunscrita al colon derecho, debe recordarse la posibilidad de una IMA. En tal caso, la angiografía permite confirmar la presencia de lesiones concomitantes en el intestino delgado y actuar en consecuencia. En el resto de los casos, la colonoscopia permite establecer la localización del segmento afectado por la isquemia y tomar biopsias para establecer el diagnóstico como definitivo (tabla IV). Debe considerarse que el informe anatomopatológico no siempre aporta datos concluyentes y que únicamente algunos rasgos, como el infarto de la mucosa o la presencia de ghost cells, son patognomónicos de CI. Por esta razón, tanto el clínico como el endoscopista deben tener muy en consideración otras opciones en el diagnóstico diferencial (v. más adelante).
El paciente presenta signos de peritonitis
En presencia de peritonitis, la endoscopia está contraindicada y debe indicarse cirugía. Antes de proceder a la laparotomía, puede llevarse a cabo una US-Doppler o una TC abdominal que, en manos experimentadas, aportan una valiosa información para confirmar el diagnóstico. Las mayores dificultades estriban en el paciente cuyos síntomas no permiten discernir con claridad si el caso corresponde a una CI grave (forma gangrenosa) o a una IMA (dependiente de la AMS). En el último caso puede haber una afección concomitante del intestino delgado y del colon derecho. Conceptualmente, la IMA puede beneficiarse de un examen angiográfico del territorio esplácnico, no solamente con intención diagnóstica, sino terapéutica (perfusión de fármacos vaso dilatadores o de agentes trombolíticos). Si el proce dimiento no puede llevarse a cabo con celeridad, o hay una contraindicación formal para que éste se lleve a cabo (shock o insuficiencia renal), es preferible prescindir de esta exploración y optar por la laparoto mía, precedida en lo posible de una TC abdominal con multidetector. Esta exploración goza de una sensibilidad muy alta para la detección de oclusiones, no sólo de los vasos de grueso calibre, sino de los vasos distales (si bien no ofrece las posibilidades terapéuticas de la angiografía).
Diagnóstico diferencial
Como ya se ha mencionado, la coexistencia de tres síntomas que, a su vez, forman parte de tres grandes síndromes (dolor abdominal agudo, hemorragia gastrointestinal y diarrea aguda) hace difícil orientar el diagnóstico, que obliga necesariamente a situar el cuadro en un contexto determinado. La cronología de los síntomas (dolor abdominal, urgencia por la defecación y rectorragia) y la presencia de factores de riesgo son críticos para establecer el diagnóstico (tabla II)33,38,41,44. Las dificultades aumentan cuando los síntomas inciden en pacientes ancianos, en quienes son más prevalentes algunas entidades, como la enfermedad diverticular, la colopatía por AINE y el cáncer colorrectal. Algunos factores, como las deficiencias del sistema inmune del anciano (inmunosenescencia), aumentan la probabilidad de que una colitis hemorrágica tenga su origen en una infección bacteriana del colon45,46. Por este motivo, resulta pertinente solicitar pruebas para la detección de gérmenes enteroinvasivos, incluidos Salmonella, Shigella, Campylobacter y, muy especialmente, el serotipo 0157:H7 de E. coli. Este último suele hallarse en la carne (p. ej., hamburguesas poco hechas o ternera poco cocinada) y puede originar un cuadro indistinguible de una CI e incluso ser causa de isquemia cólica47. Otros agentes microbianos implicados como posibles causantes de CI son algunos parásitos (Entamoeba histolytica y Angiostrongylus costaricensis) y algunos virus (citomegalovirus). La toxina de Clostridium difficile debe investigarse en especial si el paciente ha recibido antibióticos o permanece hospitalizado en el momento de aparecer los síntomas. La EII debe ser igualmente considerada, con independencia de la edad de aparición de los síntomas. Un estudio de Brandt et al48 demostró que una proporción significativa de pacientes diagnosticados de EII a una edad superior a los 50 años (segundo pico de incidencia de la EII) correspondía en realidad a casos probables o definitivos de CI. La distinción con la colitis ulcerosa suele ser más fácil, dado que la afección del recto es habitual en la colitis ulcerosa y una excepción en la CI (menos del 6% de los casos). Además, la CI suele tener un carácter segmentario. La distinción con la enfermedad de Crohn puede ser más difícil debido a la concomitancia de algunas características, como el carácter segmentario y la indemnidad macroscópica del recto. Algunos rasgos apoyan la enfermedad de Crohn, incluida la presencia de fístulas o abscesos, la afección del íleon o la demostración de granulomas en el examen histológico. Respecto al cáncer colorrectal, el diagnóstico diferencial entre ambas entidades es fácil, sobre la base de los hallazgos histológicos, pero se ha descrito la coexistencia de ambas entidades cuando el carcinoma provoca estenosis. En estos casos, es característica la interposición de un segmento de colon con mucosa normal entre la neoformación y el segmento afectado por la isquemia. Finalmente, la enfermedad diverticular complicada puede ser difícil de distinguir de algunas formas leves de CI, especialmente cuando la diarrea y/o la rectorragia están presentes. La colitis segmentaria asociada a diverticulosis, una entidad bien reconocida, cuya patogenia podría relacionarse con fenó menos inflamatorios inducidos por la proliferación de bacterias en el residuo fecal (especialmente Aeromona sp.), puede provocar un cuadro clínico, endoscópico e histológico similar al de una EII. Los rasgos histológicos de esta entidad, incluida la depleción de células caliciformes, la infiltración por células inflamatorias crónicas y los abscesos crípticos, difieren de los observados en la CI49. La asociación entre CI y diverticulitis aguda también es posible7.
Marcadores pronósticos
Diversos estudios han investigado los factores que podrían predecir un peor pronóstico en los pacientes con CI27,28,50,51. Entre ellos, se han identificado el antecedente de diabetes mellitus, la presencia de hipotensión grave o inestabilidad hemodinámica en el momento de la admisión, el íleo y la acidosis metabólica. Todas estas variables son marcadores de mala evolución y se relacionan con la necesidad de cirugía y la mortalidad27,28. Si la mortalidad global de la CI puede estimarse en un 8-10%, ésta supera el 50-60% en los casos que requieren cirugía. Por este motivo, una vez establecido el diagnóstico es importante monitorizar estrechamente la evolución de los pacientes para detectar de forma precoz cualquier situación de deterioro clínico. Tiene especial relevancia la aparición de signos peritoneales, así como la aparición o persistencia de íleo, fiebre, leucocitosis con desviación izquierda y/o acidosis metabólica. Todos estos signos son una señal inequívoca de mala evolución7. En los casos graves es importante obtener radiografías seriadas de abdomen para detectar cualquier signo de alarma. Igualmente, la persistencia de diarrea con sangre y la hipoalbuminemia asociada a la enteropatía con pérdida de proteínas es un marcador predictivo de mala evolución con elevado riesgo de perforación a partir de las 2 semanas. Otros factores que se relacionan con una elevada mortalidad son la presencia de una colitis fulminante universal y la CI que aparece en el postoperatorio de una cirugía de reemplazamiento aórtico, especialmente cuando se requiere la exéresis del colon afectado por el infarto.
Estudio de hipercoagulabilidad
Después de un episodio de CI se plantea el interrogante de si el paciente precisará en el futuro una descoagulación sistémica. Realmente, la probabilidad de que un paciente con el antecedente de CI vuelva a presentar un nuevo episodio es baja (< 2% en nuestra experiencia)5. Sin embargo, un subgrupo de pacientes, que podría estimarse en una proporción del 20-25%17-18, muestra un estado de hipercoagulabilidad que incrementa la probabilidad de presentar nuevos episodios de isquemia en ésta u otras localizaciones. Son necesarios estudios prospectivos y controlados que permitan identificar la verdadera prevalencia de estados procoagulantes en la CI para establecer una aproximación coste-efectiva a este problema. Entre tanto, parece razonable solicitar un estudio de hipercoagulabilidad a todos los pacientes que han presentado un episodio de CI antes de los 60 años o cuando no se logra identificar ninguno de los factores de riesgo implicados en su patogenia (tabla II). En la tabla V se muestran los parámetros que deben solicitarse para disponer de un estudio completo de trombofilia.