La terapia celular y el uso de células madre para el tratamiento de las enfermedades hepáticas está todavía en una fase temprana de investigación. No obstante, la diversidad de células madre en cuanto a su origen, características y potencial de diferenciación abre un amplio abanico de posibilidades para el tratamiento de las enfermedades hepáticas. En este artículo se describen los principales tipos de células madre y su potencial para el tratamiento de las hepatopatías, así como las principales estrategias terapéuticas que se están explorando para el tratamiento de enfermedades hepáticas mediante terapia celular. Además, se recogen los principales estudios preclínicos y clínicos que indican que las células madre pueden llegar a ser una buena alternativa terapéutica en diferentes enfermedades hepáticas.
Cell therapy and the use of stem cells in the treatment of liver diseases is still in the research phase. Nevertheless, the diversity of stem cells in terms of their origin, characteristics and potential for differentiation provides a wide spectrum of possibilities for the treatment of liver diseases. The present article describes the main types of stem cells and their potential for the treatment of liver diseases, as well as the main therapeutic strategies that are currently being explored for the treatment of these diseases through cell therapy. In addition, the main preclinical and clinical studies suggesting that stem cells could become an effective therapeutic alternative in distinct liver diseases are discussed.
La terapia celular se refiere al tratamiento de enfermedades mediante el uso de células, ya sea a través de la sustitución celular o mediante la mejora del funcionamiento de un órgano o tejido dañado. La aplicación de la terapia celular para el tratamiento de enfermedades hepáticas no es un concepto nuevo. La hipótesis que los hepatocitos pueden ser aislados y trasplantados para la corrección de una alteración metabólica o un daño hepático fue propuesta hace más de 30 años1,2. No obstante, la experiencia clínica en el trasplante de hepatocitos se limita a algunos casos aislados o series cortas de pacientes, principalmente dirigidos al tratamiento de enfermedades metabólicas, hepatitis fulminantes, o para mantener la función hepática durante el tiempo de espera para el trasplante hepático3–6. El principal impedimento para el desarrollo de una terapia celular con hepatocitos adultos es la dificultad de obtención de un número suficiente de hepatocitos viables, los cuales sólo pueden ser obtenidos de hígados humanos en buen estado y por tanto aptos para el trasplante hepático. Además, los hepatocitos son difíciles de manipular, criopreservar y no pueden ser expandidos en cultivo. Otra aplicación de la terapia celular es el desarrollo de hígados artificiales, los cuales pueden llegar a ser una buena herramienta de soporte para el mantenimiento de la función hepática. No obstante, el desarrollo de estos dispositivos se ha visto también limitado por la falta de hepatocitos funcionales y de células estromales de soporte. Por estas razones se está realizando un importante esfuerzo para encontrar nuevas fuentes de hepatocitos para su utilización en terapia celular. Entre ellas, la más prometedora es la utilización de células madre para la diferenciación y obtención de hepatocitos7. Una fuente inagotable de hepatocitos como las células madre sería clave para el desarrollo de terapias celulares para aquellas patologías en las que los hepatocitos presentan alteraciones genéticas, pérdida de la capacidad regenerativa o que el parénquima resulta dañado hasta el punto de no poder mantener la función hepática. No obstante, gracias a la capacidad regenerativa del hígado, situaciones clínicas como la hepatitis fulminante pueden no necesitar de la administración exógena de hepatocitos, pero sí requerir la modulación del microambiente del hígado y la estimulación de la regeneración endógena. En este sentido, algunos tipos de células madre secretan gran cantidad de factores capaces de inducir regeneración tisular, angiogénesis o modulación local de la respuesta inflamatoria, y por tanto están siendo consideradas como biofármacos.
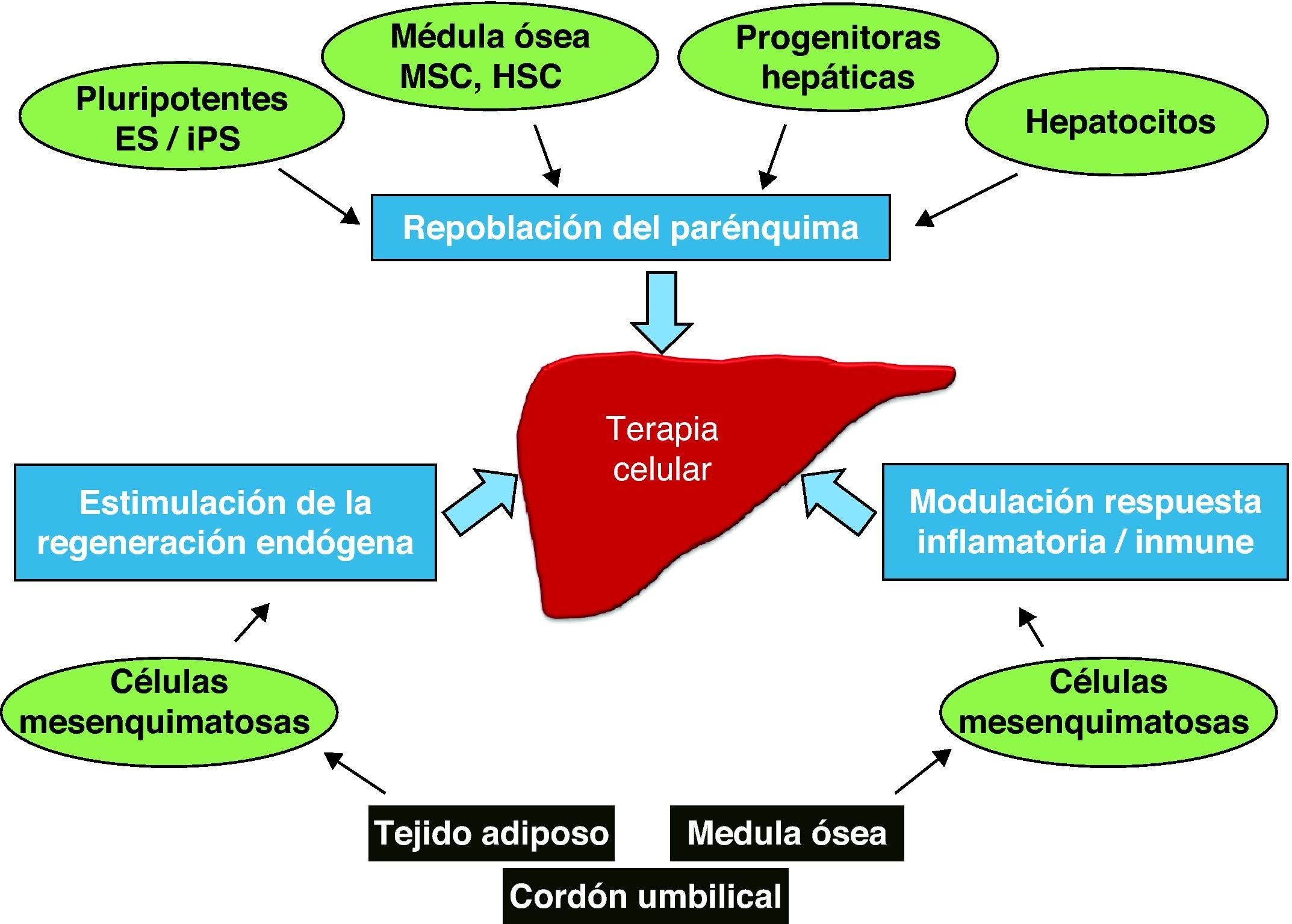
La diversidad de células madre en cuanto a su origen, características y potencia puede llegar a ofrecer un amplio abanico de posibilidades para el tratamiento de las enfermedades del hígado que va más allá de la generación de hepatocitos y su trasplante para la sustitución y regeneración del parénquima hepático o para la generación de hígados artificiales. Así pues, el trasplante de células madre puede ir dirigido a: a) el reemplazo de hepatocitos dañados o no funcionales, b) la promoción de la regeneración endógena del parénquima, y c) la modulación de la respuesta inflamatoria y inmunológica (fig. 1).
Terapia celular en enfermedades del hígado. La terapia celular puede abordarse a partir de 3 estrategias diferenciadas: en primer lugar, la sustitución o repoblación del parénquima hepático dañado. Estrategia en fase de experimentación preclínica que implica la diferenciación de las células madre y su integración funcional en el órgano. En segundo lugar, la estimulación de la regeneración hepática, explorada en casos clínicos mediante el uso de células mesenquimatosas las cuales promueven la estimulación y la proliferación de diferentes tipos celulares del hígado. En tercer lugar, la regulación de la respuesta inmunológica y inflamatoria mediante el trasplante de células mesenquimatosas, estrategia que se encuentra en fase de investigación clínica. ES: células embrionarias; iPS: células pluripotenciales inducidas; HSC: células hematopoyéticas; MSC: células mesenquimatosas.
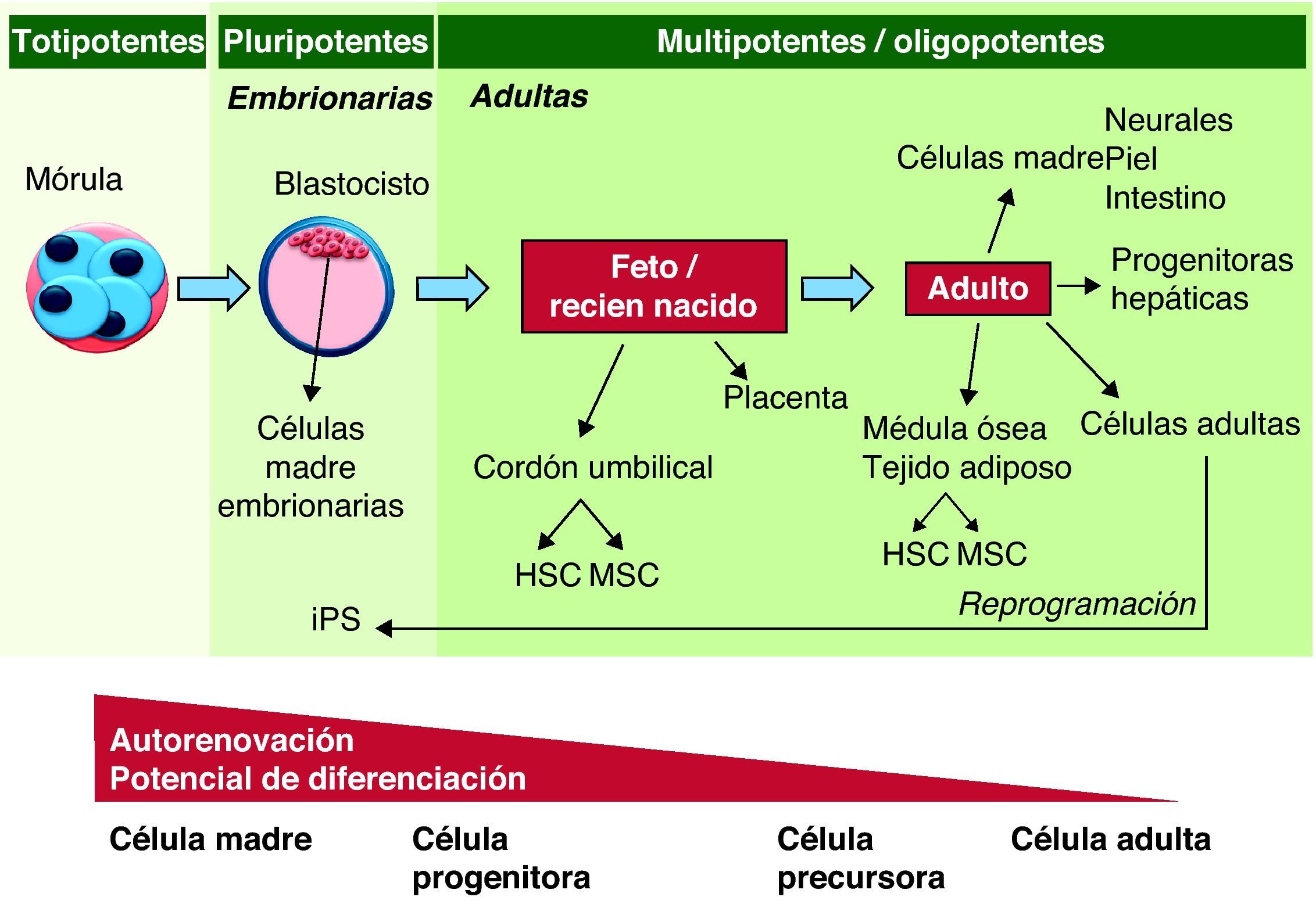
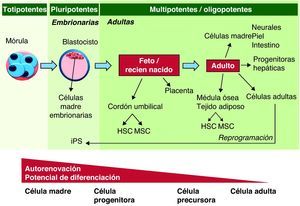
Las células madre son células inmaduras con capacidad de autorrenovarse y por tanto de dar lugar al menos a una células hija idéntica a la célula madre, y a la vez, con capacidad de adquirir características de linaje celular, dando lugar a células adultas totalmente diferenciadas. Una tercera característica que una célula madre debe cumplir para poder ser utilizada en terapia celular es la capacidad de repoblar un tejido y participar en el funcionamiento del órgano. Diferentes tipos de células madre cumplen estos criterios, pero no todos ellos presentan las mismas características en cuanto su capacidad de autorrenovación y su potencia8. Las células pluripotentes (células madre embrionarias y células madre pluripotentes inducidas) son aquellas capaces de generar células de las 3 hojas embrionarias y generar todos los tejidos adultos de un organismo. Las células multipotentes (células mesenquimatosas, hematopoyéticas, células madre neurales, etc.) pueden ser aisladas de tejidos adultos, y tienen capacidad de diferenciarse a un número más limitado de tipos celulares pero comprendiendo células de más de un linaje celular. Las células progenitoras (progenitoras endoteliales, musculares, etc.) son células adultas con una potencia restringida a uno o pocos tipos celulares de un mismo órgano y con una capacidad de autorrenovación reducida. Estas células en muchos casos corresponden a poblaciones de amplificación que participan en la regeneración del tejido (fig. 2).
Capacidad de diferenciación y auto-renovación de las células madre. Las células madre pueden clasificarse según su potencia y capacidad de autorrenovación. Las células madre totipotentes tienen la capacidad de formar todos los tejidos embrionarios y extraembrionarios; las pluripotenciales son capaces de dar lugar a células de las 3 líneas germinales; las células multipotentes pueden diferenciarse a células de más de una línea germinal; las oligopotentes tienen la capacidad de diferenciarse a más de un tipo celular de un mismo órgano. Finalmente, las células progenitoras son células ya determinadas las cuales presentan una capacidad de autorrenovación y diferenciación más restringida. HSC: células hematopoyéticas; MSC: células mesenquimatosas.
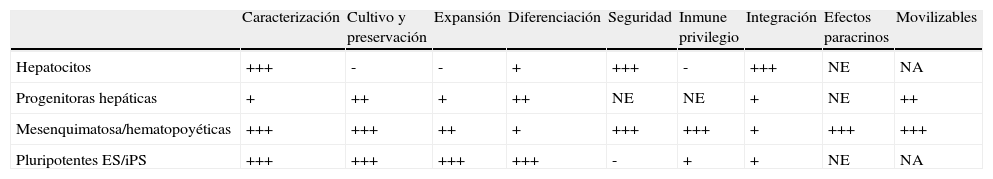
Para que un tipo de célula madre sea un buen candidato para ser utilizado en terapia celular, idealmente debe cumplir características como: estar bien caracterizada, ser fácilmente cultivable y fácil de preservar, tener gran capacidad de expansión, buena capacidad de diferenciación a hepatocitos, tener un buen perfil de seguridad, ser inmunoprivilegiada, buena capacidad de integración en el órgano y a ser posible estimular la regeneración endógena del tejido. En la tabla 1 se resumen las características de diferentes tipos celulares propuestos para ser utilizados en terapia celular.
Principales características de los tipos celulares candidatos a ser usados en terapia celular en enfermedades hepáticas
| Caracterización | Cultivo y preservación | Expansión | Diferenciación | Seguridad | Inmune privilegio | Integración | Efectos paracrinos | Movilizables | |
| Hepatocitos | +++ | - | - | + | +++ | - | +++ | NE | NA |
| Progenitoras hepáticas | + | ++ | + | ++ | NE | NE | + | NE | ++ |
| Mesenquimatosa/hematopoyéticas | +++ | +++ | ++ | + | +++ | +++ | + | +++ | +++ |
| Pluripotentes ES/iPS | +++ | +++ | +++ | +++ | - | + | + | NE | NA |
NA: no aplicable; NE: no evaluado.
La repoblación del parénquima hepático con células madre depende de una eficiente diferenciación a hepatocitos funcionales. La diferenciación a hepatocitos ha sido descrita a partir de prácticamente todos los tipos de células madre descritos7,9,10. Indistintamente de su origen mesenquimatoso o endodérmico, o de su aislamiento a partir de órganos adultos o embrionarios, un gran número de publicaciones muestran su capacidad de adquirir un fenotipo «hepático». Un análisis crítico de estos estudios revela que en muchos casos esto se reduce a la adquisición de algunas de las características típicas de hepatocitos. En los últimos tiempos se ha puesto en cuestión si la presencia de algunas propiedades de hepatocitos cualifica una célula para ser designada como «hepatocito». La realidad es que la mayoría de publicaciones presentan una caracterización muy superficial de las células diferenciadas, y que estas distan mucho de tener las características funcionales de hepatocitos maduros. Para que una célula pueda ser considerada un hepatocito requiere la expresión génica y proteica de marcadores específicos de hepatocito, capacidad funcional de síntesis, almacenamiento y destoxificación, y finalmente que sea capaz de integrarse en el hígado ejerciendo funciones propias7,10. Las diferentes características de las células usadas para la diferenciación de hepatocitos, la variedad de protocolos y la falta de estandarización de los criterios que definen una buena diferenciación hace que sea muy difícil identificar la mejor estrategia para la obtención de hepatocitos a partir de células madre. En el anexo al final del artículo se describen los principales resultados obtenidos en la diferenciación de células madre a hepatocitos.
La experiencia adquirida con el trasplante de hepatocitos en diferentes enfermedades hepáticas, sobre todo en errores del metabolismo, hace prever que muchos de los problemas detectados serán comunes para el trasplante de células madre. Estudios realizados en diferentes órganos señalan que es necesaria una amplia sustitución de las células del órgano dañado para la recuperación de su función, no obstante, el trasplante de hepatocitos ha demostrado que la sustitución de entre un 5 y un 15% del parénquima hepático con hepatocitos trasplantados es suficiente para la corrección o mejora de enfermedades metabólicas11. Si bien una sustitución del 5% puede no revertir completamente un déficit metabólico, sí que puede convertir una enfermedad con un déficit total y alteraciones muy graves en una enfermedad tratable11.
Debido a la gran capacidad regenerativa del hígado, para que una célula trasplantada pueda integrarse y proliferar en el hígado, son necesarias al menos 3 condiciones: 1) que haya «espacio», pérdida de parénquima hepático o daño hepatocitario; 2) que las células trasplantadas tengan una ventaja proliferativa respecto a los hepatocitos, y 3) que haya un ambiente idóneo para el mantenimiento o adquisición del fenotipo adecuado. La falta de espacio es un problema común en muchas de las enfermedades metabólicas del hígado, donde la alteración de un gen no comporta necesariamente el daño del parénquima. Estudios preclínicos en modelos animales han demostrado un mayor éxito en la terapia celular sustitutiva cuando el trasplante de hepatocitos era combinado con la aplicación de un daño en el parénquima, por ejemplo, la hepatectomía parcial, irradiación o isquemia de reperfusión en combinación con el bloqueo de la proliferación de los hepatocitos endógenos12–14. En la actualidad hay un amplio debate sobre las posibles maniobras aptas para ser utilizadas en pacientes para generar este espacio necesario, entre ellas, la isquemia reperfusión y la irradiación de parte del parénquima hepático son las que presentan una mayor viabilidad por su facilidad de ejecución y seguridad. La capacidad regenerativa del hígado es una de las principales causas de la pobre expansión de las células trasplantadas. Es por tanto necesario que las células trasplantadas tengan una ventaja proliferativa respecto a los hepatocitos endógenos para que tengan capacidad de repoblación del parénquima15,16. La hepatitis fulminante o el fallo hepático por daño agudo sobre crónico son situaciones en las que hay una pérdida importante de parénquima hepático, y los hepatocitos presentan una marcada reducción de su capacidad proliferativa, y por tanto podrían ser buenas candidatas para ser tratadas con terapia celular. No obstante, el importante componente inflamatorio, con presencia de citocinas, factores de crecimiento y gran cantidad de radicales libres, hace que sea dudoso que las células trasplantadas den lugar a células sanas capaces de repoblar el hígado. En este sentido, diferentes grupos han levantado la voz de alarma advirtiendo que el trasplante de células mesenquimatosas en hígados cirróticos contribuye de manera muy pobre a la generación de hepatocitos pero da lugar a fibroblastos, pudiendo así contribuir a la fibrogénesis17.
La otra gran aplicación de los hepatocitos derivados de células madre para la terapia celular es el desarrollo de hígados artificiales. Estos son dispositivos mixtos que combinan componentes artificiales con un componente celular, normalmente hepatocitos. Los hígados artificiales han sido utilizados en ensayos clínicos como soporte a la función hepática en pacientes con fallo hepático18,19. No obstante, los resultados obtenidos en estos estudios han sido dispares y en muchos casos no concluyentes o negativos. Los malos resultados obtenidos son debidos principalmente a la variabilidad de los pacientes y enfermedades tratadas, y a la deficiente calidad del componente celular utilizado, hepatocitos porcinos o líneas tumorales18–20. Una complicación añadida es la desdiferenciación y pérdida de función de los hepatocitos en estos dispositivos. En este sentido, se ha sugerido que el cocultivo de hepatocitos con células de origen mesenquimatoso permite la prolongación de la viabilidad y función del componente celular, pero esta estrategia no ha sido explorada en estudios con biorreactores de uso clínico. Es evidente que una fuente renovable de hepatocitos y células de soporte humanas permitirá la estandarización del componente celular en estos dispositivos facilitando su desarrollo y aplicación terapéutica.
Trasplante de células madre para estimular la regeneración hepática endógenaEs ampliamente aceptado que en la mayoría de enfermedades hepáticas, la restitución de la masa perdida del parénquima hepático se da gracias a la proliferación de los hepatocitos maduros, los cuales entran sincrónicamente en el ciclo celular para dar lugar a una respuesta proliferativa bien regulada. En circunstancias de daño hepático extremo y cuando los hepatocitos presentan una capacidad proliferativa disminuida, las células progenitoras hepáticas proliferan dando lugar a la reacción ductular contribuyendo a la generación de nuevos hepatocitos y colangiocitos21. El conocimiento de los mecanismos que controlan la capacidad regenerativa del hígado abre la posibilidad a la intervención en las principales vías implicadas en la proliferación de hepatocitos o células progenitoras en situaciones de daño22–24. En este sentido, la farmacología convencional nos ofrece la posibilidad de actuar sobre vías implicadas en la regeneración hepática, pero esta es claramente una estrategia reduccionista teniendo en cuenta que la regeneración hepática es un proceso complejo en el que intervienen multitud de estímulos, procesos y tipos celulares. Recientemente se ha sugerido que el trasplante de células madre (principalmente mesenquimatosas) puede ser una estrategia alternativa, ya que inducen un efecto pleiotrópico, actuando sobre la proliferación de los hepatocitos, pero también sobre células endoteliales, estrelladas y progenitoras, y a su vez teniendo un efecto modulador sobre la reacción inflamatoria necesaria para la regeneración hepática pero desfavorable para proliferación de los hepatocitos25–29.
En la actualidad las únicas células madre usadas en estudios clínicos para el tratamiento de las enfermedades hepáticas son las células madre derivadas de la médula ósea, cordón umbilical o células mesenquimatosas aisladas de tejido adiposo26,30. La presencia de células derivadas del donante de la médula ósea en el hígado del receptor llevó a la creencia que estas podían dar lugar a hepatocitos mediante el fenómeno de transdiferenciación31,32. No obstante, poco después fue demostrado que estas células derivaban de la fusión con hepatocitos y no de la diferenciación legítima de las células madre33-35. En la actualidad la generación de hepatocitos derivados de células de la médula ósea se ha excluido como proceso fisiológicamente relevante y sobre todo como alternativa clínicamente viable.
El daño hepático tanto agudo como crónico moviliza células de la médula ósea, las cuales migran a los focos de inflamación y participan en los procesos de remodelado tisular29,36,37. Como se ha comentado anteriormente, estas células contribuyen principalmente a la formación de células de origen mesenquimatoso del hígado, y en raras ocasiones pueden dar lugar a hepatocitos17,38,39. La participación de células de la médula ósea en la regeneración hepática sugiere que mediante la diferenciación a tipos celulares hepáticos o mediante la síntesis de factores solubles pueden promover la reparación tisular. Las células de la médula ósea pueden ser obtenidas mediante la aspiración directa, cultivadas y trasplantadas, o bien pueden ser movilizadas con G-CSF para promover su migración al hígado o ser obtenidas por aféresis40,41. Ambas estrategias han sido utilizadas para la terapia celular en enfermedades hepáticas. Estudios en ratones han demostrado que el tratamiento con G-CSF aumenta el número de células de la médula ósea en el hígado, reduce el daño hepatocelular, mejora la función hepática y reduce la fibrosis en modelos animales de daño agudo y crónico42–44. En la actualidad diferentes ensayos han investigado la idoneidad y seguridad del uso de G-CSF en pacientes con cirrosis hepática45. Todos los estudios se han realizado con pocos pacientes y por tanto tienen que ser valorarlos con cautela. Aunque la mayoría de estudios no evalúan la función hepática, la movilización de células de la médula ósea es segura en pacientes cirróticos y los resultados muestran que el tratamiento con G-CSF disminuye los niveles de transaminasas y baja la bilirrubina, indicando que podría desempeñar un papel en la protección frente al daño hepático y a la vez participar en la regeneración como ocurre en los modelos animales46,47.
El trasplante de células derivadas de la médula ósea en modelos animales de regeneración y daño hepático se ha asociado a una mayor regeneración y una mejora de la función hepática. La promoción de la regeneración es debida a una multitud de factores: la estimulación de la proliferación y la disminución de la apoptosis de los hepatocitos, un aumento de la proliferación de células progenitoras, una disminución de la activación de las células estrelladas y por tanto una disminución de la deposición de matriz extracelular, y una modulación de la inflamación hepática25,27–29. Además, en modelos de hepatitis fulminante, el trasplante de células mesenquimatosas (MSC) se asocia a una disminución de la mortalidad48,49. Los mecanismos responsables de esta respuesta son ampliamente desconocidos. Además, pocos estudios han evaluado específicamente la distribución intrahepática de las células trasplantadas, su persistencia in vivo y su fenotipo después del trasplante. Pero la mayoría de estudios concluyen que las células mesenquimatosas (MSC) trasplantadas actuarían de manera paracrina, promoviendo la angiogénesis y por tanto la perfusión del hígado dañado, y mediante factores de crecimiento la proliferación y supervivencia de los hepatocitos. No obstante, algunos estudios son críticos con la utilización de MSC en procesos de fibrogénesis activa por la posible contribución de las células mesenquimatosas a la población de miofibroblastos del hígado y por tanto a la progresión de la fibrosis17,50. Además, debido a la acción de las MSC sobre el sistema inmunitario y la síntesis de factores de crecimiento, algunos estudios han alertado que podrían promover el desarrollo de tumores, aunque en ningún caso el trasplante de MSC se haya asociado a su aparición.
Los resultados positivos con el uso de células de la médula ósea para la estimulación de la regeneración hepática en modelos animales, sumado al excelente perfil de seguridad que presenta el trasplante de estas células, ha hecho que se haya pasado rápidamente a la fase de ensayos clínicos. Se ha sugerido el trasplante de MSC para promover la regeneración hepática en situaciones tan diferentes como el trasplante de donante vivo, el trasplante de hígados pequeños, las resecciones hepáticas o la hepatitis fulminante. Diferentes poblaciones de células de la médula ósea han sido utilizadas en ensayos de terapia celular, poblaciones mixtas de la médula ósea, células CD34+, CD133 o mesenquimatosas. El tratamiento con G-CSF y la infusión de células madre de la médula ósea en pacientes con cirrosis induce la mejora en la función hepática y la proliferación de células progenitoras del hígado, pero se desconoce la relevancia de este proceso ni su papel en la promoción de la regeneración hepática40,47,51,52. Asimismo, el trasplante de MSC se ha demostrado seguro y eficaz en pacientes cirróticos para inducir una mejora en la función hepática o como adyuvante para pacientes que han recibido resección hepática53–55.
Trasplante de células madre para regular la respuesta inflamatoria-inmunitariaLos efectos de las MSC son pleiotrópicos y por tanto es difícil discernir si sus efectos sobre la regeneración hepática son debidos a su acción paracrina induciendo la proliferación celular y la angiogénesis, o bien debido a su capacidad moduladora de la respuesta inmunológica y inflamatoria. Es evidente que en enfermedades con un fuerte componente inflamatorio, como la hepatitis fulminante, el trasplante de células mesenquimatosas tendrá un efecto dual ejerciendo un efecto sobre la respuesta inflamatoria pero también sobre la proliferación hepatocelular. Cabe destacar que las MSC son consideradas inmuno-privilegiadas, es decir, que no son rechazadas por el organismo receptor, permitiendo el trasplante de células con HLA diferente sin necesidad de inmunosupresión56–58.
Las MSC presentan características únicas en cuanto a su capacidad de regular la respuesta inmunológica e inflamatoria. Las MSC responden al daño hepático migrando a la zona con inflamación y ejerciendo una acción inmunomoduladora56–58. Estas regulan tanto la respuesta inmunitaria innata como adaptativa. Inducen la supresión de la capacidad citotóxica de las células natural killers59,60, inhiben la maduración de monocitos y actúan sobre la capacidad de presentación de antígenos de las células dendríticas promoviendo un fenotipo regulador61,62. Los efectos de las MSC sobre el sistema inmunitario adaptativo también son múltiples. Las MSC inhiben la proliferación de linfocitos T, promoviendo así un fenotipo antiinflamatorio63,64. Además algunos estudios señalan que podrían reducir la citotoxicidad y la síntesis de citocinas en las células CD865. Estos efectos han estado extensamente estudiados in vitro, pero sus mecanismos son ampliamente desconocidos. No obstante, parece que el mecanismo es independiente del contacto y seguramente mediado por factores solubles58,66.
En muchas situaciones clínicas el trasplante de MSC tendrá lugar en ambientes con una elevada respuesta inflamatoria, por ello es importante tener en cuenta los efectos de las diferentes sustancias inflamatorias sobre el fenotipo y la acción de las MSC. Por un lado, la presencia de interferón-gamma juntamente con cualquiera de las citocinas proinflamatorias TNF-alfa, IL-1 alfa o IL-1beta promueve la síntesis de óxido nítrico y la actividad inmunosupresora de las MSC67, sugiriendo que es necesaria la estimulación de las MSC por sustancias inflamatorias para inducir un fenotipo inmunomodulador. No obstante, algunos estudios han demostrado que la activación de receptores TLR, y la acción de ligandos inflamatorios promueve su proliferación y secreción de citocinas, pudiendo adoptar un fenotipo proinflamatorio68,69.
Se han realizado pocos ensayos clínicos hasta la fecha para la evaluación del efecto inmunomodulador de las MSC. La mayoría consisten en casos aislados o pequeños grupos de pacientes que han permitido evaluar la seguridad más que la eficacia del tratamiento con MSC. Entre ellos encontramos estudios en fase I destinados a evaluar el tratamiento de las MSC en la enfermedad de Crohn70 o la esclerosis múltiple71. El tratamiento de la enfermedad del injerto contra el huésped es quizá la única excepción. Le Blanc et al publicaron en 2008 el primer estudio clínico en fase II utilizando MSC autólogas y alogenéticas para su tratamiento demostrando una respuesta en pacientes resistentes a esteroides con enfermedad aguda57. No obstante, otros ensayos han aportado resultados dispares en cuanto a la respuesta al tratamiento72, incluidos aquellos realizados por la compañía Osiris Therapeutics.
Otro importante campo de posible aplicación de las MSC es la modulación de la reacción inflamatoria por infecciones bacterianas. Factores solubles sintetizados por las MSC como el péptido antimicrobial LL-37 tienen un efecto antimicrobiano, reduciendo su crecimiento73. Además el trasplante de MSC atenúa la inflamación y mejora la supervivencia en sepsis experimental por un mecanismo dependiente de la síntesis de prostaglandina-E274–76.
Los resultados preliminares obtenidos en diferentes órganos sugieren que las MSC pueden tener un gran potencial para su uso en la modulación de la respuesta inflamatoria e inmunitaria en diferentes enfermedades hepáticas. No obstante, pocos estudios evalúan estos efectos moduladores en hepatopatías. El trasplante de MSC está siendo evaluado en modelos animales de daño hepático crónico49,77,78 y en ensayos clínicos en hepatopatía crónica o insuficiencia hepática terminal, donde las MSC pueden ejercer un efecto sobre la regeneración hepática y la respuesta inflamatoria y inmunológica. A la espera de la publicación de los resultados de ensayos clínicos en el tratamiento de enfermedades hepáticas, en la página web www.clinicaltrials.gov encontramos un buen número de ensayos clínicos dirigidos a evaluar la eficacia de las células mesenquimatosas en el tratamiento de la cirrosis hepática, la falla hepática aguda, la hipercolesterolemia familiar o para promover la regeneración después de una resección hepática.
Consideraciones finalesLas posibilidades terapéuticas de las células madre para el tratamiento de las hepatopatías son múltiples. No obstante, todavía falta recorrer un largo camino para que la terapia celular sea una realidad en la práctica clínica. Para ello es esencial determinar el perfil de seguridad de algunos tipos de células madre en cuanto a su capacidad de generar tumores, estudiar la estabilidad del fenotipo celular que vamos a trasplantar, y sobre todo conocer la función y los mecanismos de acción de estas células en el contexto de la enfermedad hepática. Además, la terapia celular no será una realidad hasta que todos los procesos implicados en el tratamiento estén estandarizados y validados. Esta estandarización es importante que tenga lugar a todos los niveles, empezando por la investigación básica, seguido de los estudios preclínicos y finalmente mediante ensayos clínicos bien controlados. Para que la terapia celular tenga éxito en el futuro, es importante 1) estandarizar el método de obtención, la caracterización y la manipulación de las células usadas para la terapia celular; 2) desarrollar modelos animales que reproduzcan fielmente las características de las enfermedades que se van a tratar; 3) estandarizar el método de administración y posibles maniobras necesarias para el trasplante celular; 4) identificar aquellos pacientes y enfermedades susceptibles de tratamiento; 5) definir los efectos y resultados deseados, y 6) diseñar ensayos clínicos bien controlados.
FinanciaciónPau Sancho-Bru tiene una beca del Ministerio de Ciencia e Innovación, Juan de la Cierva (JCI-2009-03849).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Estre trabajo ha sido realizado en el Centre Esther Koplowitz.
Células pluripotentes. Células madre embrionarias (ESC) y células pluripotenciales inducidas (iPS): Las células madre embrionarias ESC son células aisladas a partir del cultivo del embrioblasto79,80. En condiciones in vitro pueden ser cultivadas indefinidamente e inducidas a diferenciarse a células de las 3 líneas embrionarias. Esto hace que sean una fuente inagotable de células, pero a su vez constituye el principal problema para su aplicación en terapia celular, ya que cuando son trasplantadas indiferenciadas forman teratomas. Recientemente se ha descrito la generación de células pluripotenciales inducidas (iPS). Mediante la expresión de un reducido número de factores de crecimiento implicados en el mantenimiento de la pluripotencialidad es posible generar células con características de células embrionarias a partir de cualquier célula adulta. Este descubrimiento ha abierto un importante campo de investigación, ya que estas células pueden ser obtenidas de pacientes y ser usadas como modelos in vitro de enfermedades, y a su vez pueden llegar a permitir el autotrasplante, evitando el rechazo. Numerosos artículos describen la diferenciación de ESC e iPS a hepatocitos. Ambas pueden ser diferenciadas espontáneamente mediante la supresión de las condiciones de cultivo, o bien pueden ser estimuladas con sustancias que inducen su diferenciación a lo largo del desarrollo embrionario permitiendo obtener células con características fenotípicas y funcionales de hepatocitos81-86. El trasplante de células diferenciadas en modelos animales de daño hepático ha permitido la identificación de hepatocitos funcionales, pero la eficiencia es muy baja y ningún estudio ha logrado revertir el fenotipo del modelo animal de daño hepático87–90.
Células mesenquimatosas y hematopoyéticas: La médula ósea contiene al menos 2 poblaciones de células madre, las células mesenquimatosas (MSC) y las hematopoyéticas (HSC). Las HSC son una pequeña subpoblación de células de la médula ósea (< 0,01%) con la capacidad de mantener la población de todos los tipos celulares de la sangre. La mayoría de estudios que han investigando la diferenciación de HSC a hepatocitos lo han hecho mediante el trasplante de poblaciones no purificadas de células de la médula ósea en modelos animales de daño hepático. No obstante, pocos estudios han investigado la diferenciación directa in vitro o excluyendo la fusión in vivo91–93. Las MSC fueron inicialmente descritas como células de la médula ósea capaces de formar colonias y diferenciarse a tipos celulares mesenquimatosos. Principalmente han sido obtenidas de médula ósea, pero también de tejido adiposo94, placenta95, líquido amniótico96, etc. Los criterios mínimos que definen una MSC son la expresión de CD105, CD73 y CD90, pero no CD45, CD34 o CD1497, la adherencia en plástico y la capacidad de diferenciarse a adipositos, condorcitos y osteoblastos97. En los últimos años se ha descrito su capacidad de diferenciarse in vitro a células con algunas características de hepatiocitos98–101, y a integrarse en el parénquima hepático98,99 aunque con una eficiencia baja.
Progenitoras hepáticas: Las características fenotípicas y funcionales de las células progenitoras hepáticas no están bien definidas. Está aceptado que las células progenitoras se encuentran en los canales de Hearing102,103 y son activadas cuando hay un daño hepático importante, principalmente cuando la capacidad replicativa de los hepatocitos está afectada y hay una pérdida importante del parénquima. Este activación se da en hepatitis fulminante, daño agudo sobre crónico y en menor medida en la cirrosis104,105. Se asume que estas células proliferan y se diferencian dando lugar a hepatocitos y colangiocitos participando en la regeneración hepática. Aunque su fenotipo no está bien caracterizado, expresan marcadores descritos en otros tipos de células madre como CD133, CD44 y EpCAM, pero también marcadores hepatocitarios inmaduros como HNF4 y biliares como la queratina 7 y 9106,107. Las características del nicho de las células progenitoras humanas, y los factores que gobiernan su proliferación y diferenciación son ampliamente desconocidos, pero es esperable que un mejor conocimiento de estos permita estimular la participación de las células progenitoras en la regeneración hepática y eventualmente que puedan ser utilizadas en terapia celular.