El tratamiento inicial de elección en la mayoría de los casos de seudoquiste pancreático (SP) es el endoscópico, reservando la cirugía para los pacientes en que técnicamente no es factible, por ejemplo por reconstrucción en Y de Roux o cuando han fracasado otros procedimientos generalmente de mas de 4 semanas de evolucion y que se presenta como complicacion de una pancreatitis aguda (PA), cronica o postraumatica1,2. Este cambio en el manejo terapéutico ha sido posible gracias a los avances en terapéutica endoscópica (como resultado del desarrollo de guías, balones de dilatación, prótesis, técnicas de corte más seguras), así como el mejor conocimiento de la patogenia del SP.
El objetivo de este trabajo es describir los procedimientos endoscópicos para el drenaje de SP, en particular los aspectos técnicos claves para una máxima eficacia y seguridad de este procedimiento terapéutico.
The initial treatment of most cases of pancreatic pseudocyst is endoscopic while surgery has been relegated to patients who cannot undergo this procedure for technical reasons, such as roux-en-Y roux reconstruction, or to those in whom other procedures have been unsuccessful. This change in the management of this entity is due to advances in therapeutic endoscopy (as a result of the development of guidelines, dilatation balloons, prostheses, safer techniques) as well as to better knowledge of the pathogenesis of pancreatic pseudocyst.
The present study aims to describe endoscopic procedures for the drainage of pancreatic pseudocysts, particularly key technical features to ensure the maximum safety and effectiveness of this therapeutic technique.
El seudoquiste de páncreas (SP) se define como una colección líquida no infectada con una pared no epitelizada constituida por tejido de granulación, generalmente de más de 4 semanas de evolución y que se presenta como complicación de una pancreatitis aguda (PA), crónica o postraumática2.
Los SP se deben diferenciar de otras colecciones pancreáticas que también se desarrollan en relación con un proceso de pancreatitis y con implicaciones terapéuticas diferentes (tabla 1)2.
Clasificación de las colecciones pancreáticas según el Grupo de Trabajo para la Clasificación de la Pancreatitis Aguda
| (< 4 semanas después del inicio de la pancreatitis) |
| Colección líquida peripancreática aguda |
| Colección posnecrótica aguda |
| Necrosis pancreática con necrosis peripancreática |
| Necrosis pancreática sola |
| Necrosis peripancreática sola |
| (> 4 semanas después del inicio de la pancreatitis) |
| Seudoquiste pancreático |
| Necrosis pancreática organizada |
| Necrosis pancreática con necrosis peripancreática |
| Necrosis pancreática sola |
| Necrosis peripancreática sola |
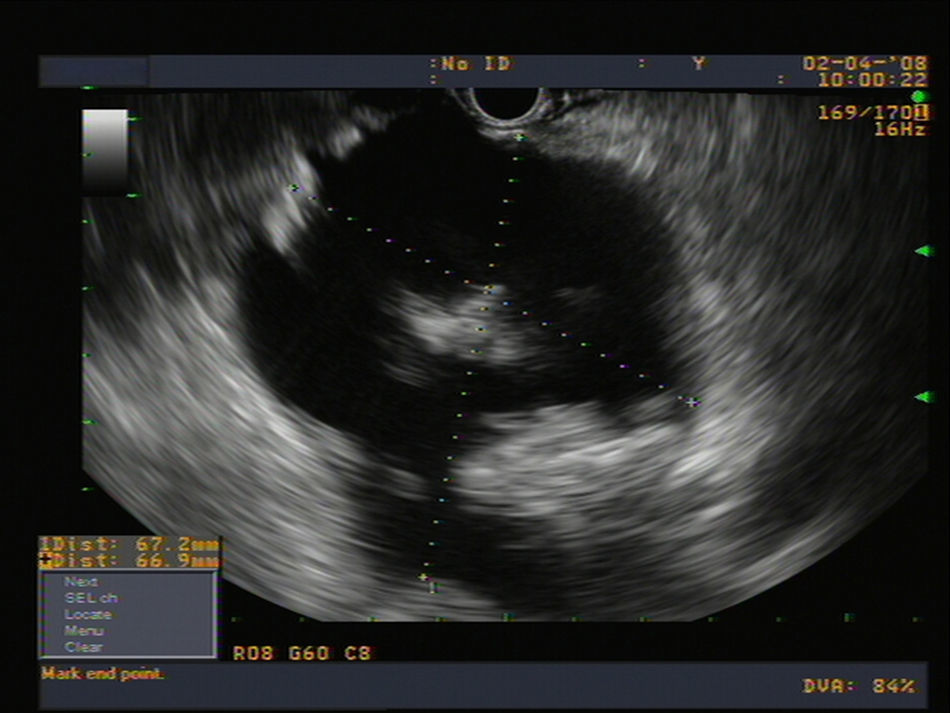
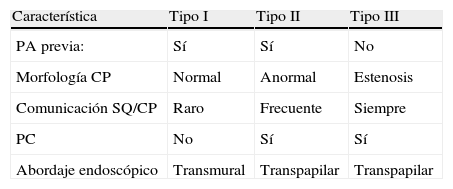
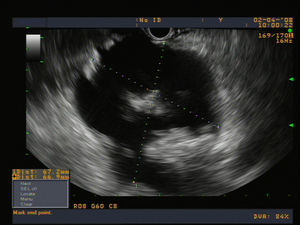
Los seudoquistes pancreáticos pueden diferenciarse en 3 tipos según la clasificación de D’Egidio y Schein3 (tabla 2), en función fundamentalmente de la comunicación entre el conducto pancreático y la cavidad del seudoquiste. Esta clasificación es de enorme importancia para escoger el abordaje terapéutico apropiado. En la figura 1 se puede observar la imagen característica de un seudoquiste por ecografía endoscópica.
Tipos de seudoquistes según la clasificación de D’Egidio y Schein3
| Característica | Tipo I | Tipo II | Tipo III |
| PA previa: | Sí | Sí | No |
| Morfología CP | Normal | Anormal | Estenosis |
| Comunicación SQ/CP | Raro | Frecuente | Siempre |
| PC | No | Sí | Sí |
| Abordaje endoscópico | Transmural | Transpapilar | Transpapilar |
CP: conducto pancreático; PA: pancreatitis aguda; PC: pancreatitis Crónica; SQ: seudoquiste.
Tomada de D’Egidio y Schein3.
Para el tratamiento apropiado de los PP es esencial conocer su historia natural. En estudios iniciales, la resolución espontánea se estimaba solo en el 8% a las 6 semanas de evolución, siendo la tasa de complicaciones de alrededor del 75% en los seudoquistes de más de13 semanas de evolución4,5. Sin embargo, con la mejora de las técnicas de imagen, se ha comprobado que la mayoría de seudoquistes se resuelven espontáneamente o se mantienen asintomáticos de forma prolongada (seguimiento mayor a un año)6.
Aun así, estas colecciones persisten en un 5 al 15% de los pacientes con pancreatitis aguda y en un 40% de los pacientes con pancreatitis crónica6,7, siendo el tamaño del seudoquiste uno de los principales factores asociados a la probabilidad de regresión. En este sentido, varios investigadores han corroborado que en el contexto de la pancreatitis aguda, los seudoquistes de menos de 4cm presentan un bajo riesgo de complicaciones y la gran mayoría se resuelven de forma espontánea antes de las 6 semanas8,9.
Otros factores asociados a una baja resolución son: localización extrapancreática, presencia de múltiples quistes, localización en la cola del páncreas, grosor de la pared de más de 1cm, ausencia de comunicación con el conducto de Wirsung, estenosis proximal o pancreatitis tras traumatismo10,11.
TratamientoEn el contexto de la PA, y si el diámetro del seudoquiste es menor de 4cm, se recomienda el control evolutivo. Nuevas evidencias demuestran la seguridad de la observación prolongada de seudoquistes de mayor tamaño (en PA), sin que se asocie a una mayor tasa de complicaciones4,9.
Por el contrario, será necesaria la intervención terapéutica en todos aquellos casos complicados y/o sintomáticos (tabla 3).
Indicaciones de tratamiento del seudoquiste pancreático
| Seudoquiste complicado |
| Compresión de grandes vasos |
| Compresión sintomática de estómago, duodeno |
| Compresión del conducto biliar principal |
| Asociación con ascitis pancreática o fistula pancreatopleural |
| Infección |
| Hemorragia |
| Seudoquiste sintomático |
| Distensión abdominal |
| Dolor abdominal y/o espalda que no responde a tratamiento médico óptimo |
| Seudoquiste asintomático con alguno de estos factores de riesgo |
| Seudoquiste con cápsula mayor de 1cm |
| Pancreatitis crónica |
| Conducto de Wirsung con estenosis o litiasis |
| Ausencia de comunicación entre el seudoquiste y el conducto pancreático principal |
| Sospecha de neoplasia |
Una vez establecida la necesidad de intervención terapéutica, la elección del procedimiento dependerá de las características del seudoquiste y según la clasificación de D’Egidio12.
Preparación del paciente para el drenaje endoscópicoEn la tabla 4 se resumen los puntos que se deben considerar de manera previa al drenaje endoscópico de un SP. Antes del procedimiento se debe disponer en todos los casos de sangre en reserva y contar con un equipo quirúrgico y de radiología intervencionista de apoyo en caso de ser necesario. El tratamiento profiláctico con antibióticos de amplio espectro (ciprofloxacino o levofloxacino)13 es una recomendación de consenso ampliamente aceptada14 y se iniciará por vía intravenosa antes del procedimiento y debe continuarse por vía oral entre 2 a 4 semanas, hasta la solución completa15. Tras el procedimiento es recomendable la hospitalización para observación durante 24 h.
Consideraciones previas al drenaje endoscópico de un seudoquiste pancreático
| - ¿Se trata realmente de un seudoquiste? |
| - ¿La pared del quiste es menor de 10mm de grosor y está libre de estructuras vasculares como varices? |
| - ¿Puede el paciente tolerar la sedación moderada a profunda? |
| - ¿Existe una obvia compresión extrínseca hacia la luz del estómago o el duodeno? |
| - ¿El paciente tiene una coagulación normal (o corregida)? |
| - ¿Hay un cirujano o radiólogo de «respaldo» cerca, en caso de una hemorragia incontrolable? |
| - ¿Están informados los pacientes de que la cirugía o la radiología intervencionista de urgencia puede ser necesaria en caso de una complicación hemorrágica del procedimiento? |
Modificada de Baillie36.
El procedimiento se suele realizar con el paciente en decúbito lateral izquierdo y debe valorarse el uso de anestesia general con intubación orotraqueal para evitar el riesgo de broncoaspiración, sobre todo en seudoquistes de gran tamaño13.
Técnicas de drenaje endoscópicoDrenaje transmuralLocalizaciónLa técnica de drenaje endoscópico no está estandarizada y el tipo de endoscopio utilizado puede variar según la disponibilidad y las necesidades técnicas. En aquellos casos en que la compresión sea evidente por visualización directa, se puede realizar el drenaje completo con un duodenoscopio y apoyo por fluoroscopia. Sin embargo, se recomienda realizar el drenaje guiado por ecoendoscopia ya que permite identificar la presencia de vasos sanguíneos y medir la distancia entre la luz gastroduodenal y la cavidad del seudoquiste. Una distancia mayor de 1cm se asocia a un mayor riesgo de perforación. Los ecoendoscopios sectoriales con canal terapéutico permiten realizar todo el procedimiento y son cada vez más los autores que recomiendan siempre su uso en el abordaje inicial11,13,16. Si no se dispone de ecoendoscopio terapéutico, se puede identificar el sitio óptimo de punción mediante ecoendoscopia y a continuación realizar la punción, dilatación y drenaje con un duodenoscopio con apoyo de la fluoroscopia.
En la actualidad se desarrollan prototipos de ecoendoscopios terapéuticos de visión frontal que podrían facilitar el drenaje de seudoquistes de difícil acceso con ecoendoscopios convencionales17.
Punción del seudoquisteBajo control ecoendoscópico y con apoyo de fluoroscopia, se realiza la punción en el punto seleccionado en la pared del estómago o del duodeno, con una aguja de aguja de 18 o 19 G hasta penetrar en la cavidad del seudoquiste13. La aspiración del líquido del seudoquiste y la inyección de contraste confirma la correcta posición de la aguja18. No se deben administrar más de 4 o 5ml de contraste para tal fin, para evitar el aumento de la tensión en la pared del seudoquiste que puedan llevar a una fuga por sobredistensión.
El abordaje perpendicular de la aguja con respecto al seudoquiste permite la instrumentación con mayor facilidad. Esta comunicación se puede ampliar con el uso de cistostomos debido a que el espesor de la pared gástrica con frecuencia impide la entrada del dilatador18–20.
Otras formas descritas para realizar esta comunicación entre la cavidad quística y la luz gastrointestinal son el uso directo del needle-knife, o a través de electrocauterio usando la punta de un asa de polipectomía21.
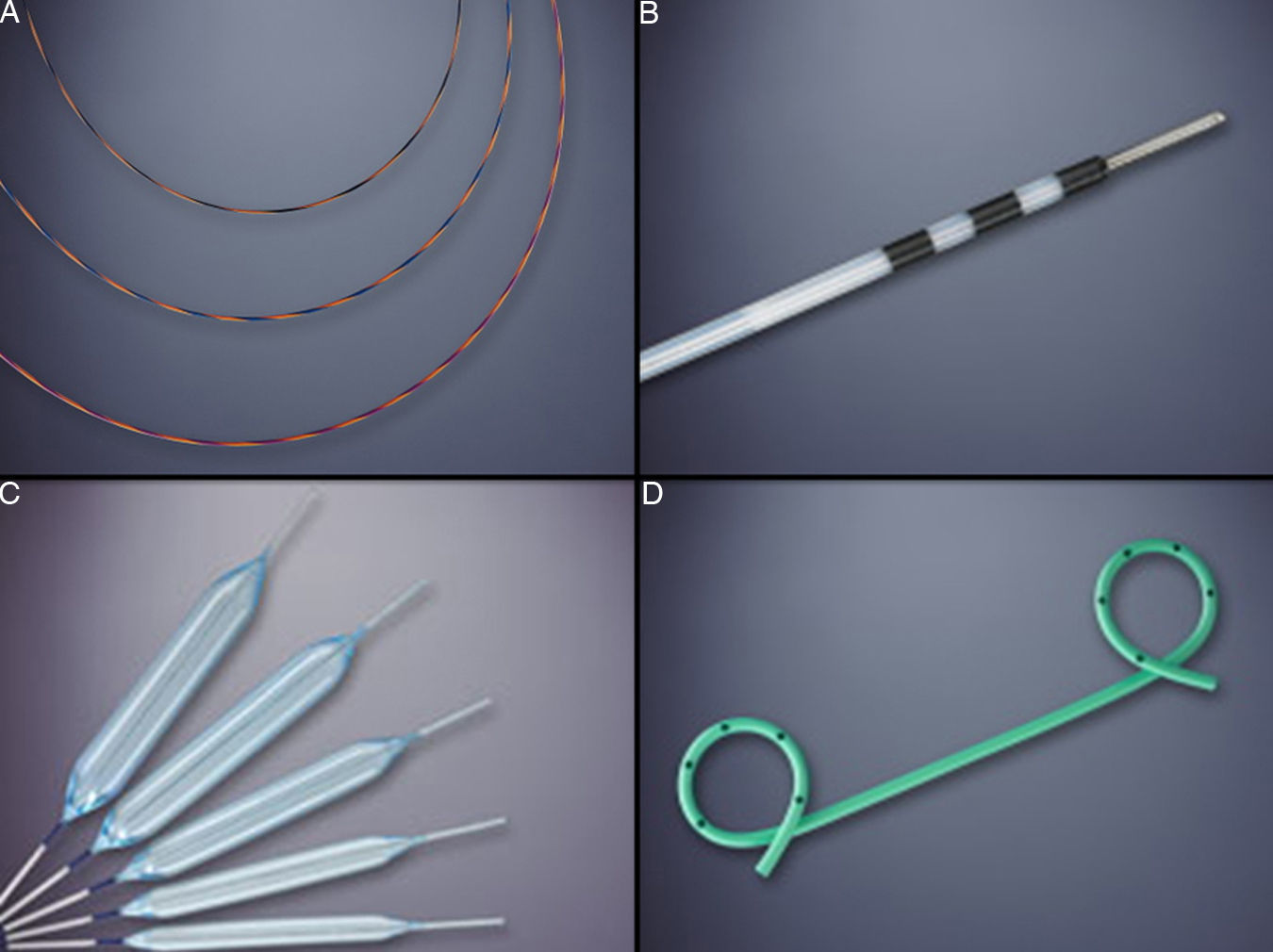
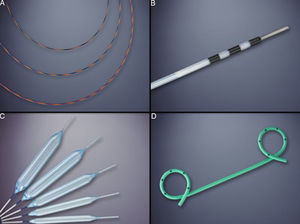
Inserción de la guíaLa inserción de la guía hidrofílica angulada (0,035-inch × 450cm) dentro del seudoquiste asegura la posición y permite el paso de instrumentos accesorios dentro de la cavidad11. La guía es avanzada bajo control radiológico, hasta lograr varios loops dentro de la cavidad del seudoquiste y evitar su salida.
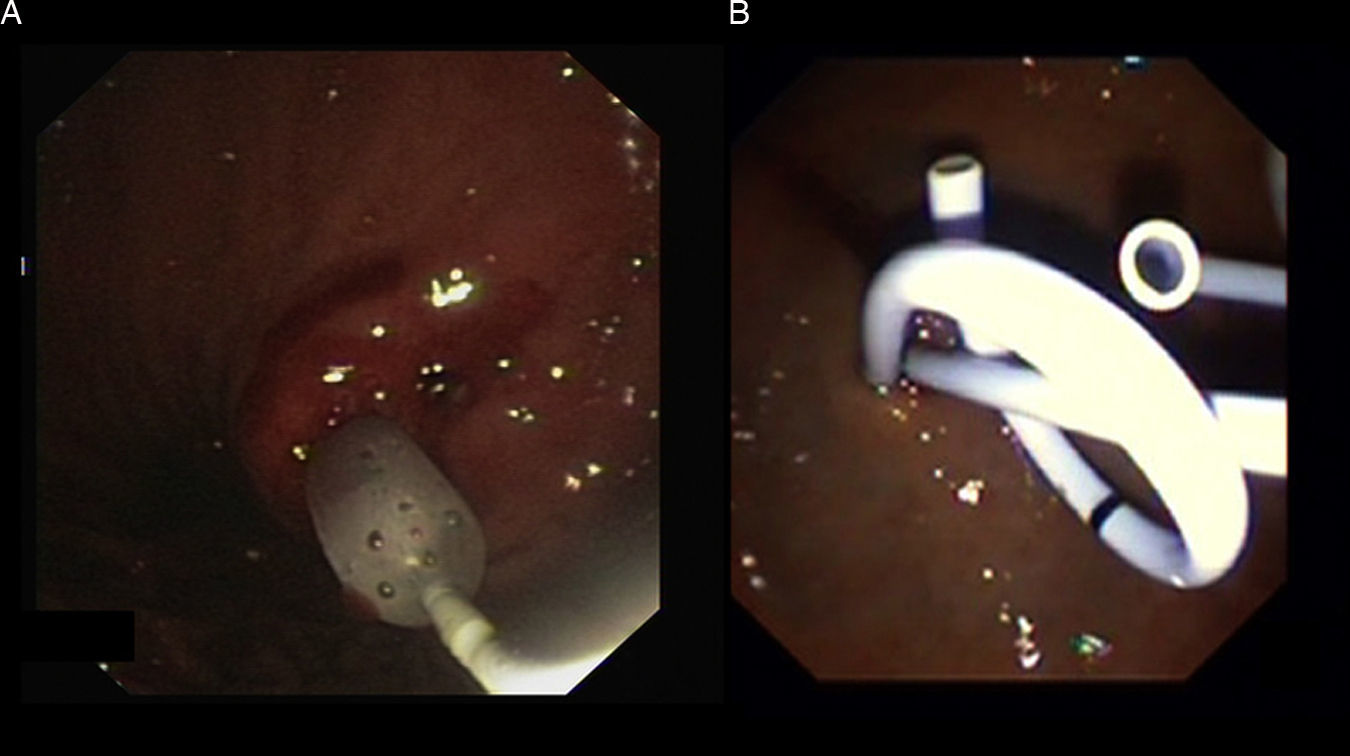
DilataciónLa dilatación y el mantenimiento de la permeabilidad del punto de punción es clave para el drenaje completo y la resolución completa del seudoquiste. Para ello, la dilatación requiere la utilización de un balón de un mínimo de 6mm de diámetro (figuras 2B y 3A) y preferiblemente de 10mm en caso de contenido con detritos o seudoquistes grandes.
Debe evitarse la ampliación del orificio a través del corte con bisturí de aguja o un papilótomo, porque este es el principal factor de riesgo para la hemorragia asociada al procedimiento.
Mantenimiento de la permeabilidad de la cistogastrostomíaLa permeabilidad de la comunicación (cistogastrostomía) y drenaje se mantiene mediante la colocación de varias prótesis plásticas (Doble pigtailed) (figuras 2D y 3B). Una de las ventajas del drenaje endoscópico es la capacidad de colocar múltiples drenajes a través del punto de punción. La naturaleza y la cantidad del contenido del seudoquiste determinan el número de prótesis. Los grandes seudoquistes con la presencia de detritos deben ser drenados con por lo menos con 3 prótesis (10 F). Un estudio reciente demostró que las tasas de éxito aumentan cuando se usan numerosas prótesis del mayor diámetro posible, sin aumentar por ello el número de complicaciones22. Debe evitarse el uso de prótesis rectas para el drenaje debido a su mayor tasa de migración, perforación y hemorragia producto de la necrosis por presión23.
La presencia de detritos sólidos en grandes seudoquistes puede beneficiarse de la colocación de una sonda nasoquística, junto con las prótesis de doble pigtail. La irrigación continua o intermitente con solución salina ayuda a evacuar los detritos y evitaría la infección del seudoquiste13. Tras algunos días de lavado a través de la sonda, esta se puede retirar con apoyo de fluoroscopia, dejando solo las prótesis in situ.
Drenaje transpapilarEl drenaje transpapilar requiere la comunicación del seudoquiste con el conducto pancreático. Las lesiones obstructivas del conducto pancreático distal, como estenosis y litiasis, pueden perpetuar o agravar las fugas pancreáticas, forzando las secreciones pancreáticas a salir a través del defecto hacia la cavidad del seudoquiste. Las estenosis y las litiasis deben ser tratadas previamente a la colocación de la prótesis para el drenaje transpapilar. Dependiendo del tamaño del conducto pancreático, se colocará una prótesis de 7 a 10 F, extendiéndose desde el duodeno, y preferiblemente superando el defecto en el conducto. Si no es posible sobrepasar el defecto, se puede avanzar a través del defecto hacia la cavidad del seudoquiste. Esta técnica presenta mejores resultados en pequeños seudoquistes de la cabeza o el cuerpo del páncreas. Las ventajas del drenaje transpapilar es la menor frecuencia de sangrado o perforación. Sus desventajas son el riesgo de infección (sobre todo en grandes seudoquistes) y el riesgo de estenosis del conducto pancreático debido a la prótesis.
SeguimientoLos seudoquistes tratados endoscópicamente, usualmente se resuelven tras un periodo de 4 a 8 semanas. Por ello se debe realizar una TC entre 4 a 8 semanas para comprobar evolución del seudoquiste. La resolución radiológica permite la extracción endoscópica de las prótesis. Si el PP persiste, las prótesis deben ser cambiadas cada 8 a 12 semanas. Existe un estudio que sugiere que la prolongación del uso de las prótesis, a pesar de la resolución radiológica, se asocia a una menor tasa de recurrencia24.
Complicaciones del drenaje endoscópico de seudoquistesLas complicaciones principales de la terapéutica endoscópica son la hemorragia, la infección y la migración de las prótesis.
La hemorragia es una de las complicaciones más temidas del tratamiento endoscópico. Una de las maniobras que más se asocia a esta complicación es la ampliación del sitio de punción. Este problema ha disminuido con el uso de balones de dilatación para completar la comunicación de las cavidades. La radiología intervencionista puede ser necesaria para localizar y controlar el vaso sangrante.
Cuando existe sospecha de infección, se debe realizar la revisión endoscópica para excluir la posible oclusión o mala posición de las prótesis15.
La migración de la prótesis al interior del seudoquiste es una complicación infrecuente y que ha disminuido con la utilización de las prótesis pig tailed, pero puede requerir cirugía.
Resultados de los estudios publicadosDesde los trabajos pioneros de Kozarek et al. en 198525, se han publicado varias series no controladas de tratamiento endoscópico de los seudoquistes pancreáticos23,26–33. Entre estas, una de las más extensas es la de Hookey et al.22, donde realizan un seguimiento prospectivo de 116 pacientes. En este estudio el tratamiento endoscópico consiguió la resolución completa en un 88% de los casos. Se presentaron complicaciones asociadas al procedimiento en 13 pacientes (11%), incluyendo hemorragia (6/13), neumoperitoneo (4/13), infección sistémica (1/13) y pancreatitis poscolangiopancreatografía retrógrada endoscópica (CPRE) (1/13).
En un estudio comparativo aleatorizado, Park et al.34 obtuvieron una mayor tasa de éxito técnico mediante el drenaje asistido por ecoendoscopia en comparación con la endoscopia convencional, debido a la falta de visualización de la compresión directa con la endoscopia convencional en algunos casos. No hubo diferencias en la tasa de complicaciones o recurrencia.
Globalmente, el éxito en el drenaje endoscópico publicados en las series más recientes se sitúa alrededor del 70 y 90%, con una tasa de complicaciones del 12% y una recurrencia del 8%.
Aunque no disponemos de estudios controlados comparativos con la cirugía, estos resultados son por lo menos similares. Sin embargo, el abordaje quirúrgico inicial es preferible sobre el tratamiento endoscópico en algunas circunstancias como por ejemplo los seudoquistes multiloculados, aquellos con abundantes detritos, con asociación estrecha con vasos esplénicos, o cuando exista la sospecha de un proceso neoplásico35.
ConclusiónEn conclusión, el drenaje endoscópico es el tratamiento inicial de elección en la mayoría de los seudoquistes pancreáticos sintomáticos y/o complicados. Aunque no existen estudios controlados comparativos con otras alternativas terapéuticas, el abordaje endoscópico es un procedimiento menos invasivo, con una elevada tasa de respuesta, menor morbilidad y una recurrencia comparable a las otras técnicas de drenaje. Una cuidadosa selección del paciente tras el análisis detallado de las características del seudoquiste y la experiencia en aspectos técnicos claves garantizan el éxito de este procedimiento endoscópico y la rápida solución de posibles complicaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.