La colonoscopia es el método de elección para el cribado de cáncer colorrectal. Para lograr su objetivo es imprescindible que la colonoscopia de cribado presente unos estándares de calidad elevados. En este contexto la calidad de la preparación es un elemento clave. Sin embargo, hasta un 20% de los pacientes siguen presentando una preparación inadecuada y el lavado anterógrado es actualmente la parte peor tolerada por los pacientes. A la hora de escoger el tipo de preparación, la seguridad es un prerrequisito y la eficacia es prioritaria. La tolerancia es un aspecto secundario, pero influyente en la calidad de la preparación, motivo por el cual ha protagonizado gran parte de los estudios recientes. En estos últimos años hemos asistido a una eclosión de estudios evaluando nuevos fármacos, posologías o medidas adyuvantes para mejorar la eficacia y la tolerancia. De forma colateral, estos estudios han demostrado que la preparación inadecuada y la falta de adherencia a la pauta prescrita pueden ser predecibles en cierto grado, por lo que es indispensable identificar este grupo de individuos e invertir el esfuerzo necesario en su instrucción. Se vislumbran nuevos enfoques de forma individualizada y flexible para cada situación clínica. La búsqueda de la preparación ideal para colonoscopia, tolerable, segura y sobre todo eficaz sigue abierta.
Colonoscopy is the method of choice for colorectal cancer screening. To be effective, screening colonoscopy must have high quality standards. The key element is the quality of the preparation. However, up to 20% of patients are inadequately prepared and, at present, anterograde washing is the least tolerated part of the procedure. In the choice of preparation, safety is a prerequisite and efficacy is a priority. Tolerance is a secondary but nevertheless influential factor in the quality of preparation and has consequently been the primary focus of many recent studies. In the last few years, a rapidly increasing number of studies have evaluated new drugs, dosages and adjuvant therapies to improve efficacy and tolerability. These studies have collaterally shown that inadequate preparation and lack of adherence to the prescribed regimen can be partially predicted, making it essential to identify this patient subgroup and invest the necessary effort in their instruction. New individualized and flexible approaches are expected for the different clinical scenarios. The search for the ideal colonoscopy preparation, which would be tolerable, safe and above all effective, remains open.
La colonoscopia es el método de elección para el cribado de cáncer colorrectal (CCR)1. Los indicadores de calidad que debe reunir la colonoscopia de cribado están claramente establecidos2. La tasa de detección de adenomas es el indicador de calidad más importante y depende directamente, entre otras cosas, de la calidad de la preparación2,3. Está establecido que esta debe ser considerada excelente o buena por lo menos en un 90% de las colonoscopias de cribado2. Las consecuencias de la inadecuada preparación de una colonoscopia son ampliamente conocidas4,5, siendo la más trascendental el incremento en el porcentaje de lesiones no detectadas, y como resultado un mayor riesgo de aparición de cáncer de intervalo6–9. Esta situación es preocupante en las colonoscopias de cribado poblacional y/o vigilancia, incluyendo también a aquellos pacientes donde la vía de la carcinogénesis está acelerada10–12. Es por ello que las pautas de seguimiento y vigilancia pospolipectomía solo son aplicables después de una colonoscopia basal de alta calidad y completa resección de todas las lesiones neoplásicas detectadas13,14. Las preparaciones inadecuadas obligan a la reprogramación de pruebas y también se relacionan con un acortamiento de los intervalos de vigilancia con la sobrecarga del sistema y encarecimiento del proceso que esto comporta6,14,15. Por otro lado, la preparación inadecuada también se ha relacionado con una mayor tasa de complicaciones, mayor tasa de colonoscopias incompletas, tiempo de exploración prolongado y requerimientos más elevados de anestesia4,5,16.
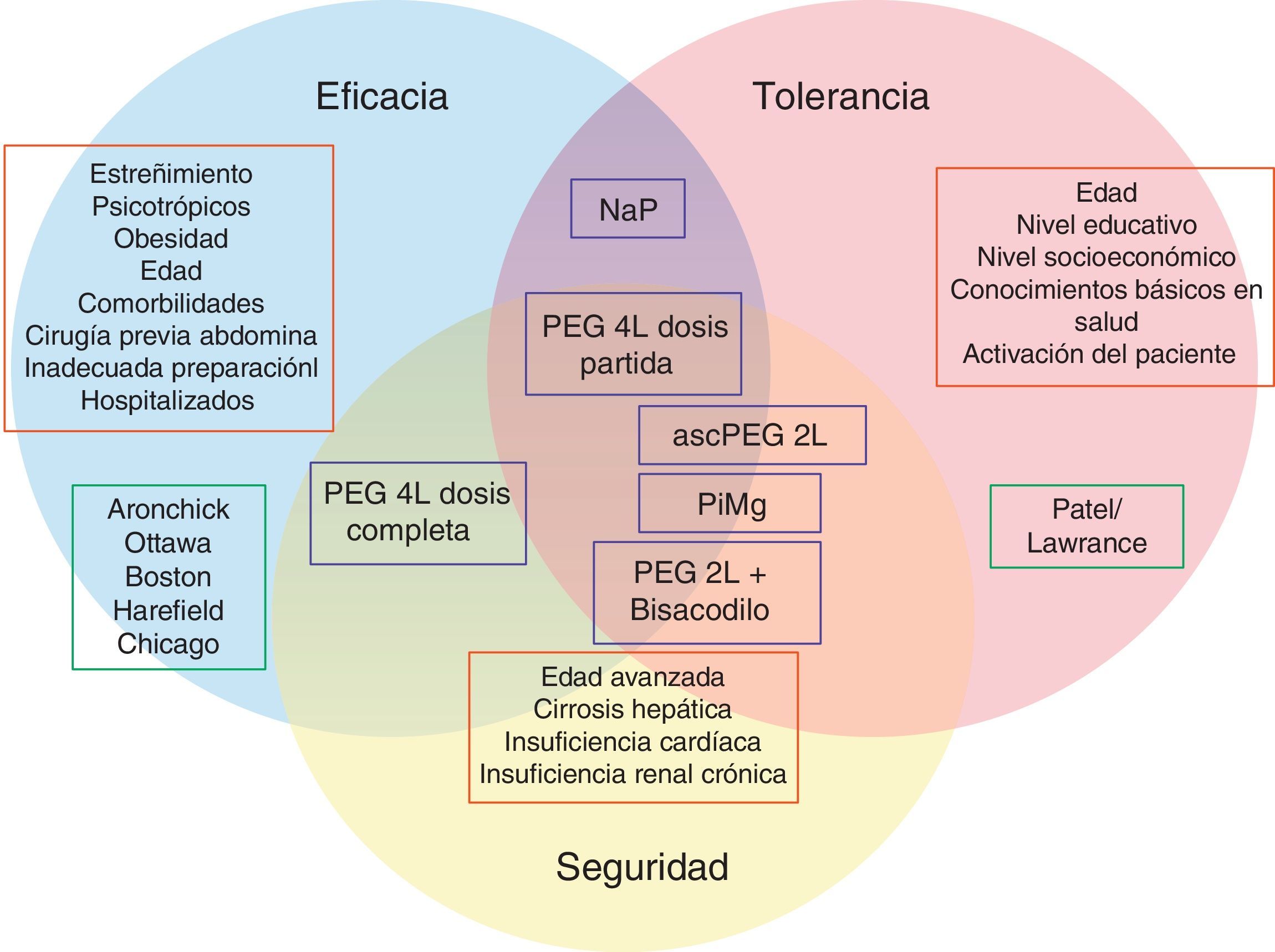
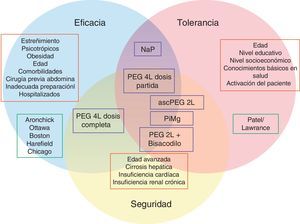
Hoy en día hasta un 20-40% de colonoscopias se consideran inadecuadamente preparadas6,17, y teniendo en cuenta las graves consecuencias, es indiscutible que la eficacia debe ser la prioridad a la hora de escoger un producto para limpieza anterógrada. No obstante, la eficacia está estrechamente relacionada con la tolerancia. Por esta razón, más allá del desarrollo de nuevos productos y pautas, también se han investigado otros factores que influyen en la limpieza colónica, con el objetivo de alcanzar el equilibrio entre eficacia y tolerancia bajo el prerrequisito de la seguridad (fig. 1).
Representación gráfica de la confluencia entre eficacia, seguridad y tolerancia de una preparación para colonoscopia. La eficacia y tolerancia pueden ser evaluadas con escalas validadas de medición (recuadro verde). Los factores influyentes en cada uno de los aspectos conocidos se muestran en los recuadros rojos. Las preparaciones más utilizadas (recuadros azules) están ubicadas en los círculos según su perfil de eficacia, seguridad o tolerancia. Por ejemplo el polietilenglicol 4l (PEG 4l) en dosis partida se encuentra en la confluencia de los 3 círculos, es decir tiene buen perfil de eficacia, seguridad y tolerancia, a diferencia del fosfato sódico (NaP), que tiene buen perfil de tolerancia y eficacia pero no de seguridad, por lo que se encuentra fuera del círculo amarillo.
ascPEG 2l: ácido ascórbico con polietilenglicol 2l;NaP: fosfato de sodio; PEG: polietilenglicol; PiMg: picosulfato de sodio y citrato de magnesio.
Una adecuada preparación es aquella que permite una óptima visualización de la mucosa (>95%) y detectar lesiones mayores de 5mm16. El colon derecho es el tramo más difícil de limpiar correctamente, y es además donde suelen asentar los pólipos planos más dificultosos de visualizar y que pueden albergar displasia o cáncer3,8,18–20. Las maniobras de limpieza durante la colonoscopia forman parte del procedimiento y la calidad de la preparación debe ser evaluada al final de la misma, ya que lo que cuenta es el grado de visualización final de la mucosa21.
Las últimas guías clínicas de la European Society of Gastrointestinal Endoscopy (ESGE) y del consenso de expertos15,22 recomiendan el uso sistemático de las escalas validadas como Aronchik (Aronchick Bowel Preparation Score [ABPS])23, Ottawa (OBPS)24, Boston (BBPS)25 y Harefield26 sin inclinación por ninguna de ellas, a pesar de que cada una tiene ventajas y desventajas. Recientemente se ha publicado la escala de Chicago validada en 150 colonoscopias, que incluye el esfuerzo requerido para lavar el colon y la cantidad de fluido residual en el colon. En este estudio los autores compararon las escalas de Boston, Ottawa y Chicago entre sí, y posteriormente cada una respecto a una escala dicotómica (adecuada>95% visualización de la mucosa, inadecuada<95% de la mucosa). La escala de Chicago se correlacionó de forma significativa con la escala de Boston (ambas evalúan el colon después de maniobras de limpieza) y además presentó un solapamiento no significativo con la escala dicotómica, mientras que la escala de Ottawa (que también incluye la cantidad de fluido residual en su puntación) presentó una considerable baja correlación con la escala de Chicago y con la escala dicotómica. Estos resultados demostraron que la impresión subjetiva de una limpieza «adecuada» no siempre es objetivada por la puntuación total de las diferentes escalas que evalúan la limpieza colónica por segmentos. La buena correlación de la escala de Chicago con la escala de Boston probablemente se deba a que ambas evalúan el colon después de maniobras de limpieza, y contrariamente la baja correlación con la escala de Ottawa porque esta evalúa la calidad de la preparación antes de las maniobras de limpieza27.
Las escalas de Harefield y de Chicago incluyen más detalles en sus cálculos, y por lo tanto tienden a ser más exahustivas a la hora de evaluar la limpieza del colon global y por segmentos. Sin embargo, las escalas de Ottawa y de Boston, al ser mucho más sencillas de reportar y haber sido validadas, han sido mejor aceptadas tanto a nivel asistencial como en el contexto de ensayos clínicos24,25,28. La tabla 1 ilustra las diferentes escalas validadas hasta la fecha con sus características más relevantes.
Escalas validadas que evalúan la calidad de la preparación
| Escalas | Descripción | Adecuada preparación | Ventajas | Desventajas |
|---|---|---|---|---|
| Aronchick23 | % superficie de la mucosa visualizadaDel 1-5, donde 5=insuficientey 1=excelente (>95% de la mucosa visualizada) | ≤2 adecuada (≥90%) | Fácil de aplicar | No distingue entre segmentos intestinalesMucha variabilidad interobservador |
| Ottawa24 | CD, CT y RS individualmente.Del 0-4 para cada segmento y cantidad de líquido en todo el colon del 0-2Puntuación total entre 14 (muy mala) a 0 (excelente) | ≤7 adecuada | Fácil de aplicarObjetiva | Evalúa antes de maniobras de limpiezaLa puntuación total no siempre es objetiva |
| Boston25 | CD, CT y CI individualmente.Del 0 al 3 para cada segmento. Puntuación BBPS entre 0 (muy mala) a 9 (excelente) | ≥5 adecuada | Fácil de aplicarEvalúa después de maniobras para lavarObjetiva | La puntuación total no siempre es objetiva |
| Harefield26 | Recto, sigma, descendente, transverso y ascendente/ciego individualmenteDel 0 al 4 para cada segmento donde 0=heces sólidas y 4=limpioGrado A=en todos los segmentos 3-4 puntos; grado B=≥1 segmento 2 puntos; grado C=≥1segmento 1 punto; grado D=≥1 segmento 0 puntosA y B=adecuada; C y D=inadecuada | ≥2adecuada | Evalúa por segmentos y luego de forma globalMás objetiva | Más compleja de aplicar |
| Chicago27 | CD, CT y CI reportados individualmenteDel 0 (heces no aspirables <15% visualización)al 12 (buena visualización sin necesidad de lavar) en cada segmentoPuntuación total entre 0 (muy mala) a 36 (excepcional)Cantidad de líquido en todo el colon del 0 (poco <50cc) al 3 (gran cantidad>300cc) se presenta por separado | 15-22 puede ser adecuada≥25=>95% visualización de la mucosa | Evalúa la preparación antes y después de lavar y el esfuerzo requerido. Más objetiva | Más compleja de aplicar |
CD: colon derecho; CI: colon izquierdo; CT: colon transverso; RS: rectosigma.
Cada vez existe mayor evidencia de que el intervalo transcurrido entre la última dosis de preparación y el inicio de la colonoscopia es clave en la calidad de limpieza del colon29–37. La ESGE recomienda que este intervalo no sea mayor de 4h, mientras que el consenso de expertos recomienda que debería ser de 3-8h, independientemente de la pauta de preparación (completa o fraccionada). Dos estudios controlados y aleatorizados (RCT)33,35 demostraron una significativa mejoría en la calidad de preparación global y por segmentos cuando el intervalo transcurrido entre la última dosis de preparación y el inicio de la colonoscopia era<7h35 o 4-8h33. Dichos hallazgos son similares a los de otros 2 estudios observacionales30,32 con intervalo entre la última dosis de preparación y el inicio de la colonoscopia menor a 5h, destacando incluso una calidad excelente en el colon derecho con intervalos<3-4h30,35.
Durante un tiempo ha existido cierta reticencia a pautar la preparación el mismo día de la colonoscopia en los pacientes programados por la mañana porque esto les obliga a madrugar. Sin embargo, se ha demostrado que los pacientes toleran de forma similar el hecho de madrugar para ingerir la preparación o tomarla completa la tarde antes30,36,38,39. Además, la dosis partida permite reducir a la mitad el volumen a ingerir de madrugada. De hecho, además de demostrar mejor eficacia, la dosis partida ha demostrado ser mejor tolerada32,37.
El tiempo transcurrido entre la preparación y la colonoscopia se pudiera adoptar como aspecto prioritario más allá del tipo o pauta. Esto es aún más relevante en la preparación de pacientes con factores de riesgo de inadecuada preparación.
Hay que tener en cuenta que estas recomendaciones podrían entrar en conflicto con el ayuno a líquidos necesario para la anestesia. Sin embargo, esto ha dejado de suponer un problema desde que las diferentes sociedades recomiendan un ayuno a líquidos de 2-4h para la sedación profunda o anestesia de las colonoscopias40,41.
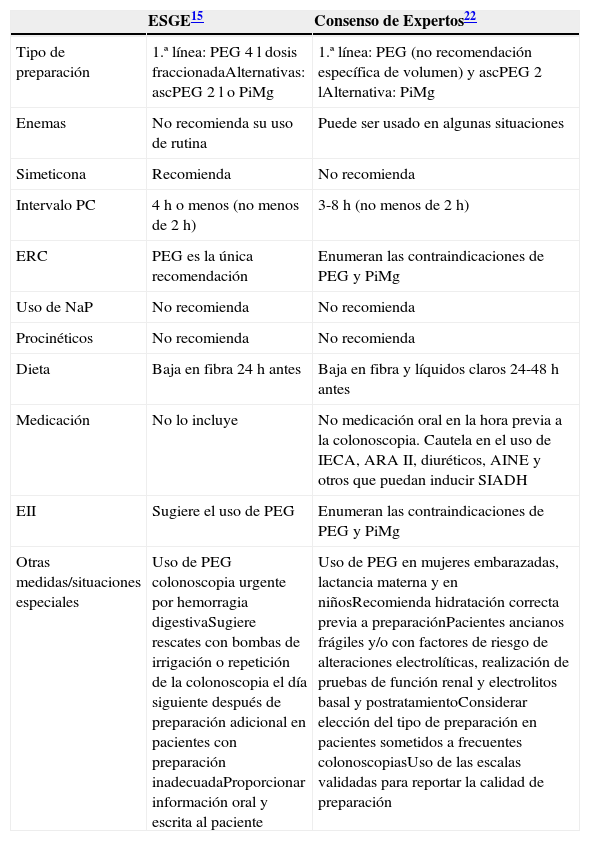
Poco avance hay en relación con otros aspectos no farmacológicos que pueden optimizar la calidad de la preparación de la colonoscopia. En general, la dieta baja en residuos es mejor tolerada respecto a la dieta a base de líquidos claros, y contribuye en una mayor eficacia de limpieza colónica42–45. Existe insuficiente evidencia para recomendar un tipo de dieta y su duración previa a la preparación (tabla 2). Así mismo ocurre con el uso de procinéticos y de simeticona, aunque esta última sí es recomendada con bajo nivel de evidencia por la ESGE. La tabla 2 muestra las principales recomendaciones y sugerencias respecto a la preparación para colonoscopia de ambas guías.
Actuales recomendaciones y sugerencias de la ESGE y el consenso de expertos
| ESGE15 | Consenso de Expertos22 | |
|---|---|---|
| Tipo de preparación | 1.ª línea: PEG 4l dosis fraccionadaAlternativas: ascPEG 2l o PiMg | 1.ª línea: PEG (no recomendación específica de volumen) y ascPEG 2lAlternativa: PiMg |
| Enemas | No recomienda su uso de rutina | Puede ser usado en algunas situaciones |
| Simeticona | Recomienda | No recomienda |
| Intervalo PC | 4h o menos (no menos de 2h) | 3-8h (no menos de 2h) |
| ERC | PEG es la única recomendación | Enumeran las contraindicaciones de PEG y PiMg |
| Uso de NaP | No recomienda | No recomienda |
| Procinéticos | No recomienda | No recomienda |
| Dieta | Baja en fibra 24h antes | Baja en fibra y líquidos claros 24-48h antes |
| Medicación | No lo incluye | No medicación oral en la hora previa a la colonoscopia. Cautela en el uso de IECA, ARA II, diuréticos, AINE y otros que puedan inducir SIADH |
| EII | Sugiere el uso de PEG | Enumeran las contraindicaciones de PEG y PiMg |
| Otras medidas/situaciones especiales | Uso de PEG colonoscopia urgente por hemorragia digestivaSugiere rescates con bombas de irrigación o repetición de la colonoscopia el día siguiente después de preparación adicional en pacientes con preparación inadecuadaProporcionar información oral y escrita al paciente | Uso de PEG en mujeres embarazadas, lactancia materna y en niñosRecomienda hidratación correcta previa a preparaciónPacientes ancianos frágiles y/o con factores de riesgo de alteraciones electrolíticas, realización de pruebas de función renal y electrolitos basal y postratamientoConsiderar elección del tipo de preparación en pacientes sometidos a frecuentes colonoscopiasUso de las escalas validadas para reportar la calidad de preparación |
AINE: antiinflamatorios no esteroideos; ARA II: antagonistas de los receptores de angiotensina ii; ascPEG 2l: ácido ascórbico con polietilenglicol 2l; EII: enfermedad inflamatoria intestinal; ERC: enfermedad renal crónica; ESGE: European Society Gastrointestinal Endoscopy; IECA: inhibidores de la enzima convertidora de angiotensina; NaP: fosfato de sodio; PC: preparación-colonoscopia (tiempo transcurrido entre última dosis de preparación y la realización de la colonoscopia); PEG: polietilenglicol; PiMg: picosulfato de sodio y citrato de magnesio; SIADH: síndrome de secreción inapropiada de la hormona antidiurética.
La tolerancia es un aspecto central en la preparación de la colonoscopia, que lleva implícita la adherencia del paciente a la pauta prescrita. Sin embargo, por definición es un término subjetivo que habitualmente se «mide» a través de cuestionarios no validados en los diferentes estudios clínicos. Lawrance et al.46 desarrollaron un cuestionario de tolerancia en el contexto de un estudio comparativo de 3 tipos de preparaciones en 634 pacientes. El cuestionario fue validado inicialmente en 125 pacientes con una consistencia interna satisfactoria y con reproductibilidad test-retest de bueno a excelente. Posteriormente, Patel et al.47 desarrollaron otro cuestionario probado inicialmente en 25 personas y finalmente validado en 100 pacientes, con una excelente concordancia respecto a una entrevista estructurada (coeficiente kappa de 0,77 a 1,00). Aunque muy probablemente tengan escaso beneficio en la práctica clínica, sería de gran utilidad aplicarlas en estudios clínicos comparativos. En la tabla 3 se detallan estas 2 escalas validadas de tolerancia.
Escalas validadas de tolerancia
| Autor | Características del cuestionario | Validación | Observaciones |
|---|---|---|---|
| Lawrance et al.46(2013) | 1. Severidad de 9 síntomas (1-5 puntos).2. Preguntas con respuesta dicotómica (sí/no): a) interrupción de jornada laboral; b) disponibilidad de repetir la misma preparación en una futura colonoscopia.3. VAS sobre tolerancia global | Diseño y primera evaluación: 125 pacientesReproductibilidad y validación final: aplicado a 634 pacientes en RCT (PiMg versus PEG 4l versus NaP) | Excluidos pacientes con sospecha de EII, AINE, insuficiencia cardíaca(NYHA>2), insuficiencia renal (FG<30), mayores de 75 años |
| Patel et al.47(2014) | 8 preguntas selección simple: 1) hábito deposicional basal; 2) cantidad de solución no tomada; 3) tolerancia global de la preparación; 4) disponibilidad de repetir la misma preparación en una futura colonoscopia; 5) problema de salud que haya influido en la poca tolerancia (en caso de); 6) severidad de 7 síntomas; 7) Si es la 1.ª colonoscopia o no; 8) tipo de preparación en la exploración previa y comparar la tolerancia de la preparación actual con la previa | Diseño y primera evaluación: 25 pacientesReproductibilidad y validación final: 100 pacientes | Incluidos todos los pacientes programados para colonoscopia electiva |
AINE: antinflamatorios no esteroideos; EII: enfermedad inflamatoria intestinal; FG: filtrado glomerular; NaP: fosfato de sodio; NYHA: escala de la New York Heart Association; PEG: polietilenglicol; PiMg: picosulfato de sodio y citrato de magnesio; VAS: escala visual analógica.
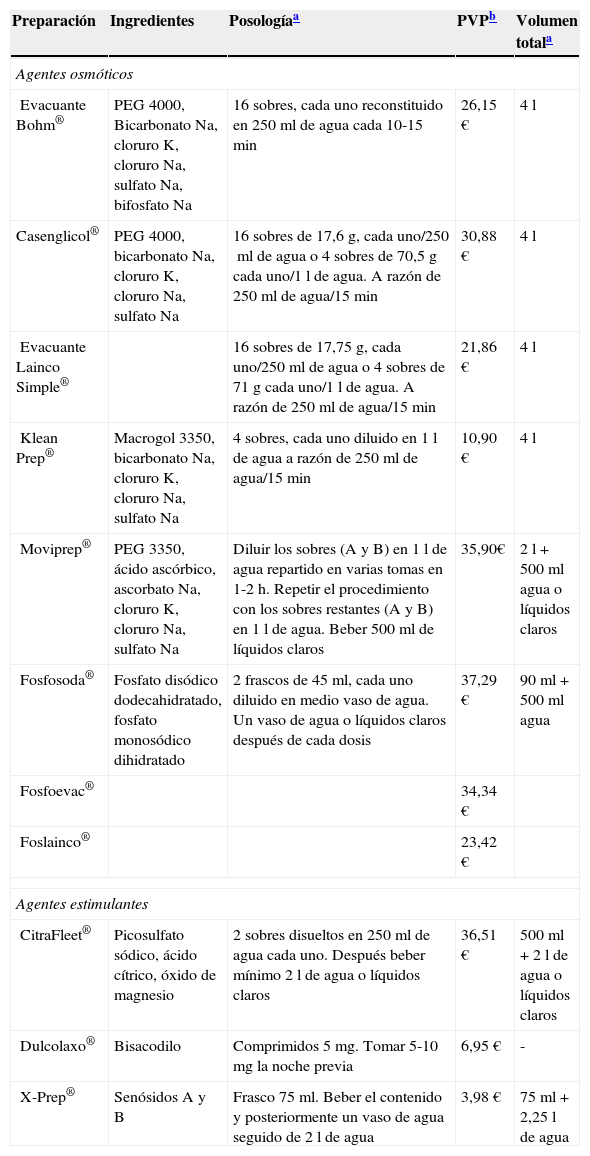
El producto ideal para preparar el colon sería aquel que eliminase de forma rápida todo el material fecal en la totalidad de los individuos, sin producir alteraciones en la mucosa ni efectos adversos y a un coste reducido. Actualmente a grandes rasgos existen 2 tipos de productos de limpieza: 1) laxantes osmóticos como el polietilenglicol (PEG) (sustancia no absorbible que funciona por arrastre y requiere importante ingesta de líquidos), el fosfato sódico o el citrato de magnesio (sales hiperosmolares que arrastran agua del espacio intravascular al interior del tubo digestivo) y 2) agentes estimulantes como el picosulfato sódico, bisacodilo o senósidos que actuán estimulando las contracciones del colon y favoreciendo su vaciamiento. La tabla 4 muestra los productos actualmente disponibles en España. Los 2 productos utilizados clásicamente han sido el PEG y el fosfato de sodio (NaP).
Productos de preparación para colonoscopia actualmente disponibles en España
| Preparación | Ingredientes | Posologíaa | PVPb | Volumen totala |
|---|---|---|---|---|
| Agentes osmóticos | ||||
| Evacuante Bohm® | PEG 4000, Bicarbonato Na, cloruro K, cloruro Na, sulfato Na, bifosfato Na | 16 sobres, cada uno reconstituido en 250ml de agua cada 10-15min | 26,15€ | 4l |
| Casenglicol® | PEG 4000, bicarbonato Na, cloruro K, cloruro Na, sulfato Na | 16 sobres de 17,6g, cada uno/250ml de agua o 4 sobres de 70,5g cada uno/1l de agua. A razón de 250ml de agua/15min | 30,88€ | 4l |
| Evacuante Lainco Simple® | 16 sobres de 17,75g, cada uno/250ml de agua o 4 sobres de 71g cada uno/1l de agua. A razón de 250ml de agua/15min | 21,86€ | 4l | |
| Klean Prep® | Macrogol 3350, bicarbonato Na, cloruro K, cloruro Na, sulfato Na | 4 sobres, cada uno diluido en 1l de agua a razón de 250ml de agua/15min | 10,90€ | 4l |
| Moviprep® | PEG 3350, ácido ascórbico, ascorbato Na, cloruro K, cloruro Na, sulfato Na | Diluir los sobres (A y B) en 1l de agua repartido en varias tomas en 1-2h. Repetir el procedimiento con los sobres restantes (A y B) en 1l de agua. Beber 500ml de líquidos claros | 35,90€ | 2l+500ml agua o líquidos claros |
| Fosfosoda® | Fosfato disódico dodecahidratado, fosfato monosódico dihidratado | 2 frascos de 45ml, cada uno diluido en medio vaso de agua. Un vaso de agua o líquidos claros después de cada dosis | 37,29€ | 90ml+500ml agua |
| Fosfoevac® | 34,34€ | |||
| Foslainco® | 23,42€ | |||
| Agentes estimulantes | ||||
| CitraFleet® | Picosulfato sódico, ácido cítrico, óxido de magnesio | 2 sobres disueltos en 250ml de agua cada uno. Después beber mínimo 2l de agua o líquidos claros | 36,51€ | 500ml+2l de agua o líquidos claros |
| Dulcolaxo® | Bisacodilo | Comprimidos 5mg. Tomar 5-10mg la noche previa | 6,95€ | - |
| X-Prep® | Senósidos A y B | Frasco 75ml. Beber el contenido y posteriormente un vaso de agua seguido de 2l de agua | 3,98€ | 75ml+2,25l de agua |
K: potásico; Na: sódico.
El NaP tiene la ventaja de requerir ingesta de poco volumen (2 viales de 45ml), por lo que es mejor tolerado y logra una adecuada limpieza colónica equivalente al PEG48,49. Sin embargo, al tratarse de una sal hiperosmolar, su uso se ha relacionado con alteraciones electrolíticas e insuficiencia renal aguda y crónica secundaria a nefropatía por depósito de fosfatos. Por este motivo, en 2008, la Food and Drug Administration (FDA) se posicionó en contra de su uso. Hay que tener en cuenta sin embargo que la mayoría de estos casos ocurrieron en población de riesgo, con contraindicaciones médicas. En la actualidad la seguridad del NaP sigue estando en debate y los resultados de los estudios siguen siendo contradictorios. Un reciente estudio en 1.105 pacientes mayores de 50 años demostró un considerable riesgo de un primer episodio de fallo renal agudo (odds ratio 2,5; IC 95%: 1,98-3,16) en pacientes sin comorbilidades, en un período de ventana de 8 semanas después de la ingesta de NaP50. Por el contrario, en un estudio poblacional analizaron el riesgo de fallo renal agudo hasta 6 meses después de la preparación con NaP en individuos entre 50-75 años (de 121.266 pacientes) versus PEG (429.430 pacientes). El 0,2% de pacientes preparados con NaP (hazard ratio [HR] 0,85, intervalo de confianza [IC] 95%) versus el 0,3% de los pacientes preparados con PEG (HR 0,86, IC 95%) presentaron fallo renal agudo. Subanalizaron por subgrupos de pacientes (con insuficiencia renal crónica, litiasis renal, hipertensión arterial, diabetes mellitus, fármacos antihipertensivos y/o consumo de anitiinflamatorios no esterioideos) sin evidenciar un consistente aumento del riesgo de fallo renal agudo51.
PolietilenglicolEl PEG es un laxante osmótico que no produce una absorción ni excreción neta de agua o iones. Su administración en grandes volúmenes no causa cambios relevantes en el balance hidroelectrolítico, lo cual le confiere un excelente perfil de seguridad. Disuelto en 4l de líquidos (PEG 4l) administrado en dosis fraccionada es la pauta más eficaz, tal y como lo demostraron 2 metaanálisis que evaluaron diferentes fármacos y pautas de administración37,52. Basándose en esos resultados la ESGE y el consenso de expertos15,22 recomiendan el uso de soluciones basadas en PEG 4l en dosis fraccionada como tratamiento de elección (pauta estándar) (tabla 2).
La desventaja del PEG es que se trata de un producto salado, poco agradable al paladar y requiere la ingesta de abundante cantidad de líquido para ser eficaz. Numerosos estudios demuestran que es mal tolerado y se asocia a náuseas, vómitos, dolor y distensión abdominal, que con cierta frecuencia motivan el incumplimiento terapéutico y la consiguiente preparación insuficiente del colon. Es por ello que se han desarrollado soluciones de menor volumen y con mejor sabor, asociados o no a adyuvantes. A continuación se van a exponer los nuevos productos y la evidencia sobre su eficacia, tolerancia y perfil de seguridad:
Ácido ascórbico±polietilenglicolEl ácido ascórbico, además de actuar como saborizante, ejerce una acción osmótica sinérgica a la del PEG, lo cual permite disminuir a la mitad el volumen de líquido a ingerir (2l). La combinación ha mostrado ser una alternativa válida a la pauta estándar de PEG, con el mismo perfil de seguridad y eficacia pero mayor tolerancia. En estudios comparativos recientes el ácido ascórbico±polietilenglicol (ascPEG) ha demostrado ser igual de eficaz que PEG 4l en dosis fraccionada39,53,54, y más eficaz para limpiar el colon derecho39,53,55. El consenso de expertos recomienda su uso como primera línea y la ESGE como alternativa a la pauta estándar de PEG 4l (tabla 2).
Polietilenglicol±bisacodiloEl bisacodilo es un agente estimulante que incrementa la motilidad intestinal, inhibe la absorción y estimula la secreción de agua y electrolitos, usualmente consumido unas 6-10h previo a la ingesta de 2l de PEG. Respecto a esta combinación Clark et al., en un reciente metaanálisis de 6 RCT, no demostraron diferencias estadísticamente significativas en cuanto a eficacia, pero sí superioridad en cuanto a tolerancia y efectos adversos respecto a la dosis estándar de PEG56. Estos resultados fueron corroborados por 3 recientes estudios controlados aleatorizados57–59. Un estudio multicéntrico con 408 pacientes comparó PEG+bisacodilo (10-20mg) versus ascPEG, demostrando superioridad del primero en cuanto a calidad de preparación60. Sin embargo, hay que tener en cuenta que a raíz de unos casos de colitis isquémica atribuidos a dosis altas de bisacodilo (10-20mg) la FDA recomienda reducir la dosis a un máximo de 5mg por preparación61,62.
Picosulfato sódico con citrato de magnesioEs un laxante osmótico no absorbible combinado con una sal hiperosmolar. La ESGE recomienda este preparado como alternativa a la pauta estándar de PEG. Un estudio multicéntrico en fase i (SEE CLEAR I) comparó en 601 pacientes picosulfato sódico con citrato de magnesio (PiMg) en dosis fraccionada frente a PEG 2l+bisacodilo (10mg) dosis simple la noche previa, encontrando superioridad del PiMg en términos de eficacia global y por segmentos del colon, así como mayor tolerancia63. En la fase 2 del estudio (SEE CLEAR II) compararon en 603 pacientes las mismas preparaciones, pero esta vez administradas en dosis simple en la noche previa, encontrando eficacia global y por segmentos del colon similar en ambos grupos64. Esto refuerza una vez más que la dosis fraccionada es un factor clave en la calidad de la preparación63,65,66.
Respecto al perfil de seguridad del PiMg, en estos 2 estudios se evaluaron efectos secundarios mediante examen físico, electrocardiograma y analítica. No evidenciaron eventos adversos graves relacionados con la preparación, solamente un mayor porcentaje de pacientes (8,7% versus 0,3%) con mínimos cambios transitorios en niveles de magnesio (por el componente del citrato de magnesio). El Australian Adverse Drug Advisory Committee (ADRAC) recibió 16 reportes de síncope y 5 casos de convulsiones secundarios a hiponatremia relacionados con preparaciones de PiMg67. Otros trabajos han descrito un mayor riesgo de hiponatremia, sobre todo en pacientes de edad avanzada o con factores de riesgo para alteraciones hidroelectrolíticas por sobreingesta de agua libre con la preparación68–71. El citrato de magnesio, debido a su actividad osmótica, puede causar deshidratación e hipermagnesemia, por lo que sebe ser usado con precaución en pacientes de edad avanzada o con alteración de la función renal, insuficiencia cardíaca o tratamiento concomitante (diuréticos) que afecten el balance hidroelectrolítico63,64,67. La tabla 5 muestra en detalle los estudios que han comparado el volumen reducido de PEG versus la dosis estándar y la tabla 6 ilustra los estudios que han comparado preparaciones de volumen reducido entre sí.
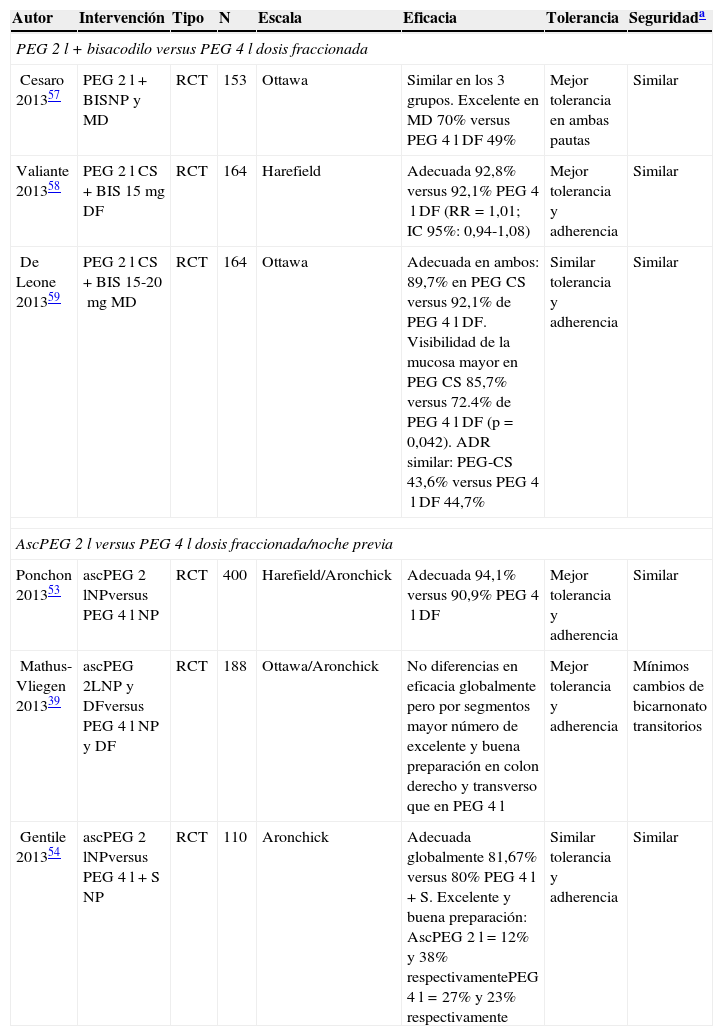
Estudios que han comparado el volumen reducido de PEG+adyuvantes versus la dosis estándar de PEG 4l (dosis fraccionada o dosis completa la noche previa)
| Autor | Intervención | Tipo | N | Escala | Eficacia | Tolerancia | Seguridada |
|---|---|---|---|---|---|---|---|
| PEG 2l+bisacodilo versus PEG 4l dosis fraccionada | |||||||
| Cesaro 201357 | PEG 2l+BISNP y MD | RCT | 153 | Ottawa | Similar en los 3 grupos. Excelente en MD 70% versus PEG 4l DF 49% | Mejor tolerancia en ambas pautas | Similar |
| Valiante 201358 | PEG 2l CS+BIS 15mg DF | RCT | 164 | Harefield | Adecuada 92,8% versus 92,1% PEG 4l DF (RR=1,01; IC 95%: 0,94-1,08) | Mejor tolerancia y adherencia | Similar |
| De Leone 201359 | PEG 2l CS+BIS 15-20mg MD | RCT | 164 | Ottawa | Adecuada en ambos: 89,7% en PEG CS versus 92,1% de PEG 4l DF. Visibilidad de la mucosa mayor en PEG CS 85,7% versus 72.4% de PEG 4l DF (p=0,042). ADR similar: PEG-CS 43,6% versus PEG 4l DF 44,7% | Similar tolerancia y adherencia | Similar |
| AscPEG 2l versus PEG 4l dosis fraccionada/noche previa | |||||||
| Ponchon 201353 | ascPEG 2lNPversus PEG 4l NP | RCT | 400 | Harefield/Aronchick | Adecuada 94,1% versus 90,9% PEG 4l DF | Mejor tolerancia y adherencia | Similar |
| Mathus-Vliegen 201339 | ascPEG 2LNP y DFversus PEG 4l NP y DF | RCT | 188 | Ottawa/Aronchick | No diferencias en eficacia globalmente pero por segmentos mayor número de excelente y buena preparación en colon derecho y transverso que en PEG 4l | Mejor tolerancia y adherencia | Mínimos cambios de bicarnonato transitorios |
| Gentile 201354 | ascPEG 2lNPversus PEG 4l+S NP | RCT | 110 | Aronchick | Adecuada globalmente 81,67% versus 80% PEG 4l+S. Excelente y buena preparación: AscPEG 2l=12% y 38% respectivamentePEG 4l=27% y 23% respectivamente | Similar tolerancia y adherencia | Similar |
BIS: bisacodilo; CS: citrato-simeticona; DF: dosis fraccionada del PEG; MD: mismo día del procedimiento; NP: noche previa; S: simeticona.
Estudios que han comparado preparaciones de volumen reducido entre sí
| Autor | Intervención | Tipo | N | Escala | Eficacia | Tolerancia | Seguridada |
|---|---|---|---|---|---|---|---|
| Rex et al.63(2013) | PiMg (DF) versus PEG 2l+BIS 10mg(NP) | RCT multicéntrico SEE CLEAR I | 601 | Aronchick y Ottawa | Eficacia global superior. Excelente o buena: PiMg 84,2% versus PEG+BIS 74,4% y por segmentos (OBPS): ascendente 89,5% versus 78,8%; medio 92,4% versus 85,9% y rectosigma 92,4% versus 87,2% respectivamente | Tolerancia y aceptabilidad mayor en PiMg | Similar |
| Katz et al.64(2013) | PiMg (NP) versus PEG 2l+BIS 10mg (NP) | RCT multicéntricoSEE CLEAR II | 603 | Aronchick y Ottawa | Eficacia global similar. Adecuada (ABPS): PiMg 83,0%versus PEG+BIS 79,3% y por segmentos (OBPS): CA 81% versus 85%; medio 95% versus 88% y RS 94% versus 90% respectivamente. No inferioridad | Tolerancia y aceptabilidad mayor en PiMg | Similar |
| Manes et al.65 (2013) | PiMg (NP o DF) versus ascPEG 2l (NP o DF) | RCT | 285 | Boston | Eficacia global similar. Adecuada PiMg 75,7% versus ascPEG 2L 76,5%Media de BBPS global (6,8 versus 6,6) y colon derecho (1,95 versus 1,6) similares | Mayor tolerancia en PiMg (97,8% versus 83,4%) | Más frecuente en ascPEG 2l |
| Repici et al.60 (2012) | PEG-CS+BIS 10-20mg (NP)versus ascPEG-2l (NP) | RCT multicéntrico | 480 | Boston | Eficacia global superior. Adecuada.PEG-CS+BIS 79,1% versus ascPEG 70%. Visibilidad óptima de la mucosa 56,1% versus 46,3% | Similar en ambos grupos | Similar |
| Martín-Noguerol et al.66 (2013) | PiMg (DF) versus PiMg (NP) | RCT | 193 | Boston | Eficacia global superior. AdecuadaPiMg (DF) 71% versus PiMg (NP) 30%BBPS media global 7 versus 5,2; ciego 2,4 versus 1,4; CA 2,5 versus 1,6; CT 2,4 versus 2 | Mejor tolerancia en DF pero menores horas de sueño | Similar |
ascPEG 2l: ácido ascórbico con polietilenglicol 2l; BIS: bisacodilo; CA: colon ascendente; CS: citrato-simenticona; CT: colon transverso; DF: dosis fraccionada del PEG; MD: mismo día del procedimiento; NaP: fosfato de sodio; NP: noche previa; PiMg: picosulfato de sodio y citrato de magnesio; RS rectosigma; S: simeticona.
Es una solución hipertónica de volumen reducido (946ml) y libre de fosfato, compuesta por la combinación de 3 sales de sulfato que pudieran producir una mínima absorción o secreción neta de sodio, potasio y magnesio. Comparado con el fosfato, el sulfato de sodio tiene menor probabilidad de producir precipitación de sales de calcio en los túbulos renales72. En estudios recientes el sulfato de sodio administrado en dosis partida ha demostrado una eficacia superior al PEG 4l administrado en dosis simple la tarde antes (excelente o buena preparación 98,4% versus 89,6%; p<0,04)73 y al PiMg en dosis partida (94,7% versus 85,7%; p<0,006)74, así como eficacia equivalente al ascPEG en dosis partida (97,2% versus 95,6%)75. Presenta además un buen perfil de seguridad (incluyendo pacientes >65 años) y de tolerancia. Fue aprobado por la FDA en 2010, pero actualmente no se encuentra disponible en España.
¿Tiempo de individualizar? Pacientes de alto riesgo de inadecuada preparaciónExisten varios factores que pueden predecir una inadecuada preparación y que por lo tanto deben alertar al gastroenterólogo para prescribir un tipo de solución, pauta y horario específicos en estos pacientes. Los factores de riesgo relacionados con una preparación insuficiente son: estreñimiento crónico, edad avanzada, tratamiento crónico con opioides y tricíclicos, obesidad, coexistencia de comorbilidades (cirrosis hepática, diabetes mellitus, enfermedad de Parkinson), antecedente de cirugía previa abdominal, antecedente de preparación inadecuada del colon a pesar de un buen cumplimiento, bajo nivel socioeconómico y educativo, así como bajos conocimientos básicos en salud76–81 y el hecho de estar hospitalizado (fig. 1)4,78,81–84.
Un grupo con elevada tasa de preparación inadecuada especialmente importante es el de los pacientes hospitalizados. En ellos generalmente confluyen varios factores de riesgo como la edad avanzada, las frecuentes comorbilidades, la inactividad y la menor tolerancia a las preparaciones de gran volumen84. Existen pocos estudios que evalúen alternativas en este subgrupo de pacientes. Basándonos en lo previamente expuesto, estos pacientes se beneficiarían especialmente de las pautas en dosis fraccionada33,85 y/o de asegurar que el intervalo entre la última dosis de preparación y la colonoscopia sea de máximo 4-8h33. Ell et al. compararon ascPEG con PEG 4l en 359 pacientes ingresados (ambos en dosis fraccionada) demostrando similar eficacia y adherencia86. Actualmente no existen claras recomendaciones para este grupo de alto riesgo.
Otro factor para la inadecuada preparación es el hecho de haber presentado previamente una preparación insuficiente. De estos pacientes solo un 20% aproximadamente está relacionado con una incorrecta adherencia a las instrucciones81. Existen pocos estudios dedicados a evaluar pautas de rescate. Un estudio prospectivo evaluó 2 métodos de rescate en 85 pacientes inadecuadamente preparados (con dieta baja en residuos durante 3 días, seguida de PEG 4l en pauta fraccionada o simple). Estos métodos consistieron en PEG 2l administrado el mismo día versus PEG 4l+bisacodilo 20mg+dieta baja en residuos una semana después, y evidenció que un 20% de los pacientes volvieron a presentar una inadecuada preparación en la segunda colonoscopia. No hubo diferencias significativas en cuanto al método de rescate utilizado87. Se desconocen los factores que intervienen en estos casos, sin embargo es evidente que en estos pacientes el método de rescate debe ser más intensivo.
Recientemente Serper et al.17 ha introducido el término «activación del paciente», demostrando mediante una escala validada que un bajo grado de activación del paciente es un factor predictivo independiente de inadecuada preparación. Por otra parte, en un estudio francés basado en encuestas, con 202 pacientes y 101 gastroenterólogos, demostró que solo el 55% de los pacientes eran conscientes de las consecuencias de una inadecuada preparación, mientras que el 96% de sus médicos refirieron dar correctas instrucciones88. En este sentido se han desarrollado varios trabajos con la intención de aumentar la activación y adherencia, en los cuales se ha demostrado un mayor rendimiento de la preparación en los pacientes que se les proporcionaron instrucciones ilustradas en forma de caricaturas25,89,90 y vídeos91. La implicación y el apoyo del personal de enfermería en la instrucción del paciente también es un factor clave en el porcentaje de pacientes adecuadamente preparados en una determinada unidad de endoscopia36.
Así pues, parece evidente que se debe invertir el tiempo necesario en identificar a este tipo de pacientes y en su adecuada instrucción sobre la pauta a seguir, haciendo uso de las herramientas que hoy en día ofrece el avance de la tecnología, comunicaciones e informática, con el objetivo de aumentar su participación activa y adherencia, factores que indudablemente determinan en la eficacia de la preparación.
Dispositivos de rescateEn el caso de colonoscopias fallidas por inadecuada preparación, la ESGE recomienda utilizar métodos intensivos de rescate (incluyendo bombas de irrigación endoscópicas) y repetir la colonoscopia el día siguiente según disponibilidad de cada centro15. Se han desarrollado dispositivos para ayudar a limpiar el colon durante la colonoscopia, como por ejemplo el MedJet®, que a través del canal de trabajo del endoscopio libera un chorro de agua estéril y CO2 que desintegra y remueve los restos fecales durante la retirada92, y el JetPrep® que consiste en un catéter con una ducha en la punta que proporciona un lavado más potente que la jeringa de agua93. El «ColonoScoPrep» es un dispositivo de inserción/evacuación que permite la instilación simultánea de agua en el colon y la evacuación de fluídos. Consiste en un manguito que se coloca en el ano para evitar que el material fecal se escape, a través del cual se introduce un tubo maleable de polietileno conectado a una fuente externa de agua a 37°C, que se hace avanzar manualmente hasta el colon derecho mientras el agua es bombeada. El dispositivo tiene un lumen para el fluido residual que es conectado al desagüe. Este dispositivo fue evaluado en un estudio con 125 pacientes a los que se administró bisacodilo la noche antes. El aparato fue introducido aproximadamente 30min antes de la colonoscopia. Se logró una preparación buena-excelente en el 89% de los pacientes sin complicaciones, con lo cual sería un mecanismo potencialmente útil como medida de rescate. Sin embargo, como es esperable, supondría inconvenientes desde el punto de vista logístico94.
ConclusionesEl proceso de preparación para la colonoscopia comienza desde la visita previa. Se debe invertir el tiempo adecuado en realizar una correcta historia clínica, identificando a los pacientes de riesgo para inadecuada preparación y/o mal cumplimiento, emplear el esfuerzo necesario en instruir al paciente haciendo uso del personal y las herramientas disponibles, haciendo énfasis en el objetivo principal de la preparación de la colonoscopia, es decir, que la eficacia debe ser la prioridad para la detección de lesiones premalignas. La pauta de administración tiene una importancia capital, por lo que se debe hacer un esfuerzo en adecuar el tipo de pauta a prescribir en función de los horarios de las diferentes unidades de endoscopia para reducir el intervalo entre la última dosis de preparación y la realización de la prueba. Con el propósito de tener un buen control de calidad es importante reportar la calidad de la preparación utilizando las escalas validadas. De igual forma ya se dispone de algunas escalas de tolerancia con una utilidad prometedora de cara a los futuros estudios clínicos.
En la nueva era de la endoscopia con anestesia, la tolerancia a la preparación anterógrada es el caballo de batalla pendiente de ganar. En estos momentos existen nuevos preparados de volumen reducido que han demostrado similar eficacia y perfil de seguridad que el PEG 4l y suponen una mejora en la tolerancia. Es de esperar que estos nuevos productos se impongan, especialmente a medida que su coste se ajuste.
Sin embargo, y a pesar de utilizar los compuestos y posologías más eficaces, hasta un 20% de los individuos pueden presentar una preparación inadecuada. Los grupos de riesgos están bien establecidos, es importante conocerlos y parece obvio que se deben extremar todas las medidas conocidas e intensificar la pauta de preparación en estos casos, y así intentar disminuir al máximo la reprogramación de colonoscopias por preparación insuficiente. Existe poca evidencia sobre pautas de rescate, por lo que esta es un área por desarrollar en los próximos años.
Así pues, se vislumbran importantes avances en la preparación para colonoscopia gracias a las nuevas herramientas tecnológicas que permitirán una interfase más eficaz médico-paciente, y una consiguiente mayor adherencia a las pautas de preparación, la aplicación de pautas individualizadas y flexibles teniendo en cuenta la hora de la colonoscopia y los nuevos preparados de volumen reducido mejor tolerados.
Conflicto de interesesLiseth Rivero-Sánchez no tiene ningún conflicto de intereses. Maria Pellisé es consultora para Norgine Iberia.