El prurito es un síntoma frecuentemente asociado a las enfermedades que cursan con colestasis y muestran una gran variabilidad interindividual. En la valoración clínica del prurito es útil tener en cuenta la presencia de lesiones por rascado, así como la escala subjetiva visual analógica. Aunque su fisiopatología no es del todo bien conocida, en los últimos años se ha progresado en el conocimiento de la vía pruritoceptiva, la que muestra ciertas semejanzas con la vía nociceptiva, si bien existen otras características distintivas, como la acción de un neurotransmisor específico —el gastrin releasing peptide— en la primera sinapsis en el asta posterior medular. Entre los mecanismos reguladores de esta vía pruritoceptiva se encuentra la acción de los opioides endógenos, cuyo aumento en las situaciones de colestasis es la hipótesis más aceptada actualmente para explicar el prurito de estos pacientes. Existen varios tratamientos que han demostrado eficacia en los ensayos clínicos aleatorizados en pacientes con colestasis, como las resinas de intercambio aniónico, la rifampicina, los antagonistas opioides o el ácido ursodeoxicólico, este último en el caso particular de la colestasis gravídica.
Pruritus is commonly associated with cholestatic disorders and shows wide interindividual variability. The presence of skin lesions due to scratching and the application of a visual analogue scale are useful for clinical evaluation. Although the pathophysiology of this entity is not well understood, advances have recently been made in understanding of the pruritoceptive neural pathway, which shares certain similarities with the nociceptive pathway, although there are other distinguishing characteristics such as the action of a specific neurotransmitter, GPR, on the first synapsis at the posterior horn of the spinal cord. Amongst the modulator systems of the pruritoceptive pathway is the action of the endogenous opioids. An increase of these opioids in cholestatic situations is the most widely accepted hypothesis for pruritus in these patients. Some treatments have proven efficacy in randomized clinical trials in patients with cholestatic disorders, such as anion exchange resins, rifampicin, opioid antagonists and ursodeoxycholic acid; the latter is especially useful in intrahepatic cholestasis of pregnancy.
El prurito es un síntoma relevante en muchas enfermedades cutáneas, pero también puede ser capital en algunas enfermedades sistémicas, como la insuficiencia renal crónica, el cáncer o la colestasis. Desde el punto de vista hepatobiliar, el prurito es un síntoma frecuente en los pacientes con colestasis intrahepáticas, como la cirrosis biliar primaria (CBP), la colangitis esclerosante primaria (CEP), la colestasis gravídica (CG), las hepatopatías crónicas (virales u otras), o la hepatitis alcohólica o la producida por toxicidad farmacológica. Además, también podemos encontrar pacientes con prurito en situaciones con colestasis extrahepática, como por ejemplo en estenosis u obstrucciones de la vía biliar, bien sean benignas o malignas. Este conjunto de entidades con diferente etiología y con otras muchas diferencias clínicas comparten, no obstante, una característica común como es una disfunción en la excreción biliar1. En la presente revisión nos centraremos en la fisiopatología y en los tratamientos disponibles para el prurito asociado a la colestasis sobre la base de las evidencias científicas actuales.
Características clínicasEl prurito de la colestasis afecta típicamente a las palmas y a las plantas, pero puede ser generalizado. A diferencia de las enfermedades dermatológicas, no encontramos lesiones cutáneas causantes del prurito en estos pacientes, aunque en los casos graves podemos observar lesiones secundarias al rascado, tales como excoriaciones o prurigo nodularis, en el que aparecen pápulas o nódulos hiperpigmentados y se debe a cambios crónicos secundarios al rascado. La incidencia y la intensidad del prurito son muy variables entre las diferentes etiologías, así como entre los diferentes pacientes dentro de una misma enfermedad. La prevalencia del prurito en la enfermedad hepatobiliar se estima que oscila entre un 5% en la hepatopatía crónica por el virus de la hepatitis C y un 80% en la CBP2. Recientemente se han publicado algunos trabajos que intentan explicar la variabilidad interindividual mediante el estudio de determinados polimorfismos genéticos en pacientes con CBP. Por un lado, Wei et al proponen que la sustitución de asparagina (Asn) por aspartato (Asp) (A118G) en el dominio extracelular del receptor opioide μ-1 podría modificar la respuesta a la morfina y proteger a estos pacientes frente al prurito3. Por otro lado, Hoffmaster et al proponen que la sustitución de valina (Val) por glutamato (Glu) (V1188E) en la proteína MRP (multidrug resistance protein)-2 podría alterar el transporte de pruritógenos en la zona hepatobiliar y afectar así a la “capacidad” de desarrollar prurito4.
Clínicamente, nos encontramos ante un síntoma a menudo infravalorado, debido a que el propio paciente puede no manifestarlo durante la entrevista clínica por no relacionarlo con su enfermedad hepática; mientras que en otras ocasiones es el propio facultativo quien no le presta la suficiente atención. Una encuesta en línea realizada a 238 pacientes (231 mujeres) con CBP en Estados Unidos recoge que hasta el 69% de los pacientes presentaba prurito, que en el 69% de los casos no había sido evaluado, mientras que en el 28% de los casos identificados no se había establecido ninguna medida para su control5. Estos datos muestran la necesidad de realizar una aproximación sistemática y bien dirigida hacia este síntoma que puede llegar a ser muy invalidante, de modo que incluso hay casos de suicidio relacionados con éste. Para realizar una correcta valoración clínica del prurito, en primer lugar, debe tenerse en cuenta la presencia de lesiones por rascado como las arriba mencionadas. Por otra parte, existen escalas subjetivas que, a pesar de los inconvenientes que esto presenta, se utilizan ampliamente tanto en la práctica como en los ensayos clínicos. Entre las más utilizadas se encuentra la escala visual analógica que determina la intensidad del prurito en una escala habitualmente de 0 a 10 puntos, donde 10 corresponde al peor prurito imaginable. Otras escalas útiles pueden ser las que se destinan a valorar la calidad de vida o del sueño nocturno. Más objetivos para la evaluación del prurito son los sistemas piezoeléctricos para la monitorización de la actividad de rascado durante el sueño, aunque no parecen tener utilidad en la práctica clínica por la complejidad en su realización y por el coste elevado6.
Además de la propia presencia o no del prurito, existen otras condiciones que actúan modulándolo y son, en parte, responsables de la variabilidad interindividual tanto en su percepción como en la respuesta a las eventuales terapéuticas. Buena parte de éstas se conocen gracias a la experiencia clínica, algunas de las cuales se recogen en la encuesta en línea comentada previamente y se exponen en la tabla 15.
Características clínicas asociadas al prurito de la colestasis*
| Alteración del sueño | 74% |
| Empeoramiento nocturno | 65% |
| Mejoría con temperaturas frescas | 64% |
| Empeoramiento estival | 46% |
| Empeoramiento premenstrual | 25% |
| Empeoramiento tras la ingesta | 14% |
| Alivio con el rascado | 14% |
| Rascado hasta provocar hemorragia | 4% |
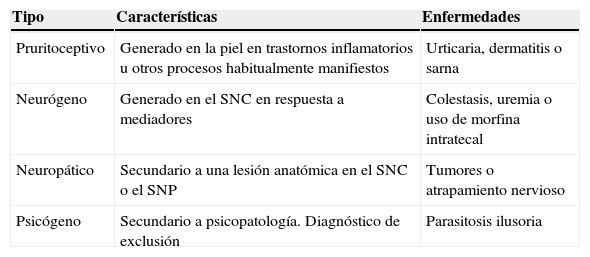
La fisiopatología del prurito no es del todo conocida, si bien en los últimos años se han realizado importantes avances al respecto. Como se ha comentado anteriormente, nos encontramos ante un síntoma común a muy diversas enfermedades y existen, además, diferencias entre éstas en cuanto a los mecanismos que conducen a la aparición de éste. Al intentar aclarar estos conceptos se ha establecido una clasificación del prurito en relación con la enfermedad de base, tal y como se muestra en la tabla 27. A continuación, se detallarán las vías nerviosas encargadas de transmitir los estímulos pruritógenos, así como los mecanismos fisiopatológicos conocidos en la aparición del prurito en las enfermedades colestásicas.
Clasificación fisiopatológica del prurito
| Tipo | Características | Enfermedades |
| Pruritoceptivo | Generado en la piel en trastornos inflamatorios u otros procesos habitualmente manifiestos | Urticaria, dermatitis o sarna |
| Neurógeno | Generado en el SNC en respuesta a mediadores | Colestasis, uremia o uso de morfina intratecal |
| Neuropático | Secundario a una lesión anatómica en el SNC o el SNP | Tumores o atrapamiento nervioso |
| Psicógeno | Secundario a psicopatología. Diagnóstico de exclusión | Parasitosis ilusoria |
SNC: sistema nervioso central; SNP: sistema nervioso periférico.
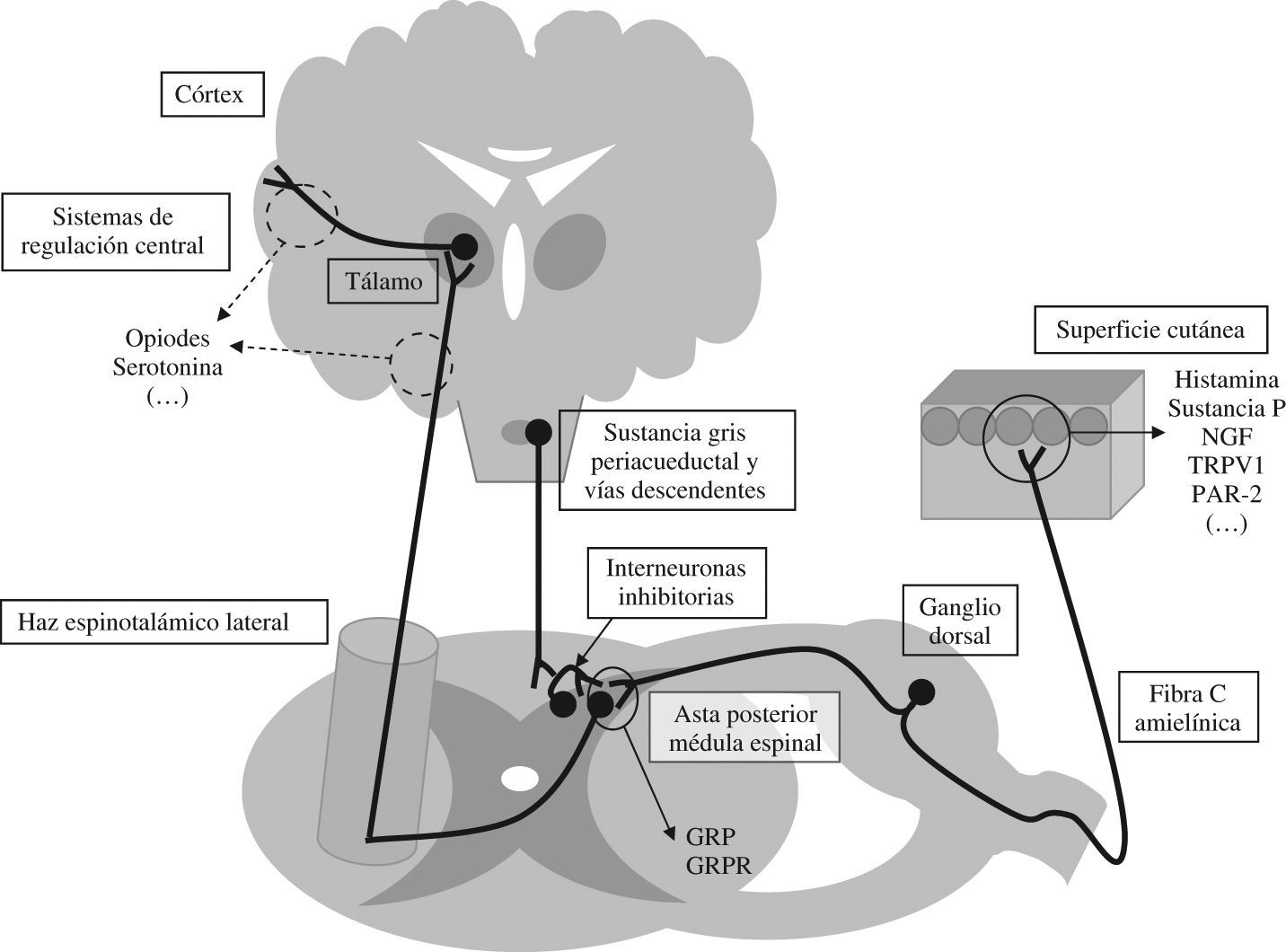
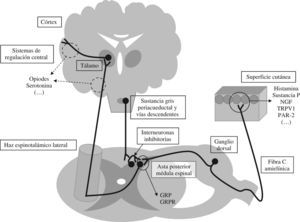
Buena parte de los conocimientos sobre las vías sensitivas que recogen la información pruritoceptiva se basa en la nocicepción, aunque hoy se conoce que no se trata de las mismas vías aferentes como inicialmente se creía. En la figura 1 se muestra un esquema de las vías de transmisión del prurito junto con los sistemas reguladores.
Vías de transmisión y regulación de la sensibilidad pruritoceptiva. NGF: neural growth factor; TRPV1: transient receptor potential vanilloid-1 ‘receptor vaniloide de tipo 1’; PAR-2: proteinase-activated receptor-2; GRP: gastrin releasing peptide; GRPR: gastrin releasing peptide receptor.
Periféricamente, en la dermis, los propios queratinocitos junto con las terminaciones sensitivas de las fibras C amielínicas asociadas pueden considerarse como un auténtico receptor específico para el prurito. Algunos de los mediadores implicados en esta zona son el neural growth factor o la sustancia P; es relevante también a presencia en ambas células del receptor vaniloide de tipo 1, a través del cual ejerce la capsaicina su efecto deplecionador de mediadores una depleción de mediadores8,9. En la dermis también es importante la acción de los mastocitos (aunque su participación en el prurito de la colestasis es controvertida) a través de diferentes mediadores, como la histamina que actúa sobre los receptores H1 y H4 en el terminal de las fibras C10 o la triptasa que lo hace sobre el receptor proteinase-activated receptor-2 y que promueve la liberación de la sustancia P11.
A partir de aquí el estímulo pruritoceptivo se transmite a través de las fibras C amielínicas específicas12 y establece la primera sinapsis de la vía en la lámina i del asta posterior de la médula espinal. En esta primera sinapsis se ha identificado recientemente el papel del GRP (gastrin releasing peptide) como neurotransmisor que actúa sobre su receptor específico, el gastrin releasing peptide receptor, en la membrana postsináptica de la segunda neurona de la vía. Este hecho es específico de la vía pruritoceptiva, a diferencia de la nociceptiva13. A continuación, la vía se cruza y el estímulo viaja por el haz espinotalámico contralateral, con una segunda sinapsis en el núcleo dorsomedial del tálamo14. Davidson et al han mostrado recientemente que diferentes estímulos pruritógenos pueden viajar a través de diferentes fibras dentro de este haz espinotalámico de modo similar a lo que ocurre en la nocicepción15. Finalmente, el estímulo se transmite hasta el córtex cerebral donde no se ha identificado un área específica, aunque mediante técnicas de neuroimagen funcional se ha registrado actividad en córtex sensitivo primario, área motora suplementaria, córtex cingulado anterior y lóbulo parietal inferior, con un predominio hemisférico izquierdo16.
En último lugar, es necesario señalar la presencia de diferentes sistemas de regulación que interactúan con la vía sensitiva a varios niveles y modulan así la percepción del prurito. Las vías de transmisión del prurito y del dolor se encuentran estrechamente interrelacionadas, de tal modo que la vía nociceptiva es capaz de inhibir la transmisión del prurito17. Así, por ejemplo, el rascado, que actúa mediante la estimulación de fibras mielínicas A y β de conducción rápida, y a través de interneuronas inhibitorias de la sustancia gelatinosa del asta posterior medular, es capaz de disminuir la percepción del prurito1. Esta red de interneuronas inhibitorias del asta posterior resulta importante, debido a su acción como mecanismo de entrada que regula el tráfico aferente pruritoceptivo. Se encuentran también influidas por vías descendentes con origen en núcleos superiores como la sustancia gris periacueductal, lo que condiciona un aumento en su actividad inhibitoria en respuesta a otros estímulos como los visuales o auditivos. De este modo, disminuiría la percepción del prurito, mientras que al desaparecer estos estímulos como ocurre por la noche, la sensación de prurito aumentaría1. Asimismo, se considera que en el SNC existen otras vías con una probable acción moduladora sobre la percepción del prurito. Algunas de éstas podrían ser vías serotoninérgicas o de otras aminas endógenas, no bien conocidas en cuanto la regulación del prurito y cuyo papel en las hipótesis fisiopatológicas se deriva de resultados de estudios clínicos y experimentales, en ocasiones contradictorios. Se postula que dichas vías serotoninérgicas actuarían mediante la inhibición de la vía aferente pruritoceptiva en el SNC, y pueden además modular la respuesta emocional al prurito18.
Prurito asociado a colestasisLa presencia de prurito asociado a las situaciones de colestasis se ha relacionado con el defecto en la excreción biliar de determinadas sustancias pruritógenas de producción hepática, con su consiguiente acumulación a nivel plasmático y tisular. Esto se basa principalmente en la observación clínica de la desaparición del prurito tras la resolución de la enfermedad causante de la colestasis, como ocurre por ejemplo en la obstrucción biliar. Algunas de las sustancias propuestas como pruritógenos fueron los ácidos biliares, los cuales se acumulan en los tejidos de pacientes con colestasis. En la década de1970 se publicaron algunos trabajos en los que se reproducía el prurito tras la inyección intradérmica de ácidos biliares19,20. Además, el uso de una sal biliar como la colilsarcosina parecía aumentar el prurito en los pacientes con CBP21. No obstante, los estudios de inyección intradérmica se llevaron a cabo en condiciones experimentales y no se reprodujeron posteriormente. Por otra parte, el prurito no está presente en todos los pacientes con el mismo “grado de colestasis”, ni tampoco su intensidad se correlaciona con los niveles de ácidos biliares plasmáticos. Más aún, en casos de fallo hepático se observa una tendencia a la desaparición del prurito a pesar de que los valores de ácidos biliares se encuentran elevados en esta situación22–24. Este último dato pone de manifiesto la necesaria presencia de otro u otros mecanismos pruritógenos, y además refleja el hecho de que parece necesaria una función hepática adecuada, de acuerdo con la teoría de un pruritógeno de síntesis hepática. Por otro lado, también existen otras hipótesis que han intentado unir ambas ideas mediante el planteamiento de una posible toxicidad hepatocitaria por el acúmulo de ácidos biliares con la consiguiente liberación al torrente sanguíneo de sustancias intrahepatocitarias pruritógenas25.
Actualmente la teoría más aceptada para explicar el prurito asociado a las situaciones de colestasis es la presencia de un “tono opioide” endógeno aumentado en estos pacientes. Es bien conocido que el aumento en la actividad opioide en la zona central puede provocar prurito a través de receptores de tipo μ, lo que se demuestra con la administración de morfina intratecal26. La participación de los diferentes tipos de receptores opioides en el prurito se hace patente en el estudio de Ko et al, donde se observa la reproducción del prurito con el uso de agonistas-μ, algo que no ocurre en el caso del agonista-κ o del agonista-δ, y puede prevenirse la aparición de éste con la administración previa de antagonistas-μ27. Además, en modelos animales, el uso de diferentes agonistas-κ reduce el prurito inducido por agonistas-μ28. Existen varias evidencias clínicas que apoyan la teoría del aumento del “tono opioide”. En primer lugar, se encuentra la provocación de un síndrome de abstinencia a opiáceos en los pacientes con colestasis tras el empleo de antagonistas opioides, a pesar de no haber recibido nunca fármacos agonistas29,30. Por otra parte, el uso de antagonistas opiáceos disminuye el prurito en los pacientes con colestasis, como se ha demostrado en varios ensayos clínicos30–37. Bergasa et al han sido muy prolíficos en su aportación al conocimiento de la fisiopatología del prurito de la colestasis en la línea de los opioides endógenos. Así, en uno de sus estudios demostraron un aumento de la producción hepática de opioides endógenos en animales con colestasis38. En otro estudio observaron la reproducción de prurito en monos tras la inyección intratecal de suero de los pacientes con colestasis39, reversible con la administración de naloxona. Adicionalmente, este grupo también ha demostrado un cierto “estatus de analgesia” en roedores con colestasis, reversible con el uso de naloxona40, así como la presencia de un mecanismo de down-regulation de receptores-μ opioides en el SNC ratas con resección de la vía biliar41.
Los opioides y su tono aumentado también se han relacionado con otros neurotransmisores como la sustancia P, cuya administración central provoca respuestas de rascado en ratones42 y su concentración aumenta en el ganglio dorsal de la médula espinal en respuesta a la administración crónica de morfina (al igual que el GRP)43.
TratamientoMedidas generalesComo parece obvio, la primera medida en los pacientes que presentan prurito asociado a colestasis deberá ser la resolución de ésta siempre que sea posible. Habitualmente esto es sólo factible en la colestasis secundaria a obstrucción biliar, que suele resolverse mediante cirugía o colangiopancreatografía retrógrada endoscópica. Dentro de las colestasis intrahepáticas destaca el caso de la CG, que se resuelve con la finalización de la gestación. Por otra parte, otras medidas que también pueden ser de utilidad para aliviar el prurito son una buena hidratación cutánea, evitar temperaturas elevadas o evitar el uso de medicaciones que puedan exacerbarlo.
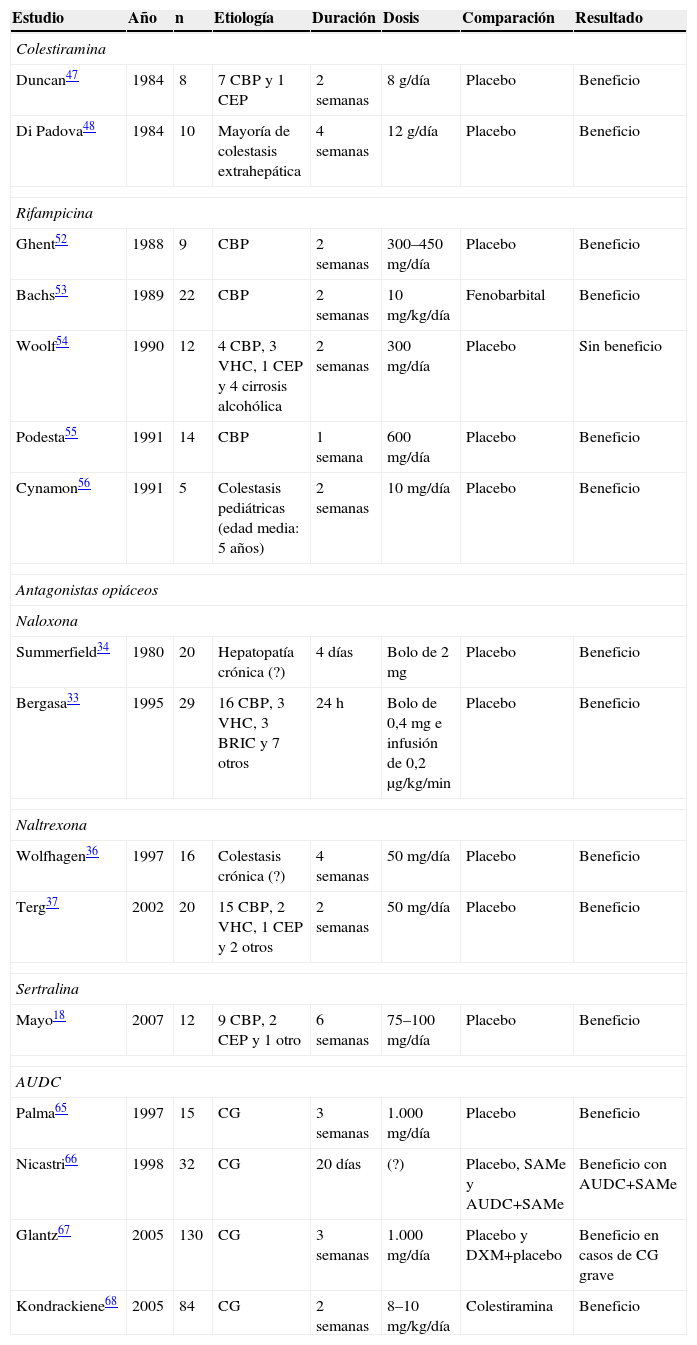
Tratamiento farmacológico basado en la evidenciaSe ha empleado una gran diversidad de fármacos para tratar el prurito asociado a la colestasis, la mayor parte de forma empírica. En este apartado nos referiremos en detalle a aquellos cuyo empleo está basado en la evidencia. En la tabla 3 se presentan los ensayos clínicos aleatorizados publicados que utilizan dichos fármacos en pacientes con colestasis y prurito. En primer lugar, se encuentran las resinas de intercambio aniónico, como la colestiramina (más ampliamente utilizada), el colestipol y el colesevalán, fármacos orales utilizados en el tratamiento de la hipercolesterolemia. Su mecanismo de acción se basa en la fijación de las sales biliares, y quizá otro tipo de pruritógenos excretados en la bilis, en la luz intestinal lo que impide su reabsorción. Sin embargo, debido a una cierta eficacia en el prurito asociado a policitemia vera, su acción también se ha relacionado con la liberación de colecistoquinina44, que parece poseer una determinada acción antiopioide endógena45. La eficacia de la colestiramina se ha probado en 2 ensayos clínicos aleatorizados46,47 y posteriormente se ha recogido en un metaanálisis48, si bien de éste no pueden extraerse conclusiones firmes debido a la disparidad entre los estudios. El estudio de Di Padova et al presenta una gran mayoría de pacientes con colestasis extrahepática47, lo que imposibilita extrapolar directamente los resultados a las situaciones de colestasis intrahepática crónica. Sin embargo, dada su buena tolerancia clínica y sus escasos efectos secundarios como pueden ser las molestias gastrointestinales y la interacción con otros medicamentos, estos fármacos constituyen la primera línea de tratamiento ante un paciente con prurito asociado a colestasis. La pauta recomendada para el tratamiento con colestiramina es la toma inicial de 4g justo antes y después del desayuno, de acuerdo con la teoría de una posible liberación de pruritógenos acumulados en la vesícula biliar durante el ayuno nocturno. Si esta dosis es insuficiente, pueden administrarse otros 4g en la comida y en la cena, sin exceder los 16g/día. En los niños la dosis recomendada es de 240mg/kg/día, sin exceder los 4g/día en los menores de 10 años, ni los 8g/día en los niños mayores de 10 años6. Asimismo, se recomienda separar la toma de la colestiramina unas 2h de la administración de otros fármacos por su posible interferencia en la absorción de éstos1.
Ensayos clínicos controlados y aleatorizados en el tratamiento del prurito asociado a la colestasis
| Estudio | Año | n | Etiología | Duración | Dosis | Comparación | Resultado |
| Colestiramina | |||||||
| Duncan47 | 1984 | 8 | 7 CBP y 1 CEP | 2 semanas | 8g/día | Placebo | Beneficio |
| Di Padova48 | 1984 | 10 | Mayoría de colestasis extrahepática | 4 semanas | 12g/día | Placebo | Beneficio |
| Rifampicina | |||||||
| Ghent52 | 1988 | 9 | CBP | 2 semanas | 300–450mg/día | Placebo | Beneficio |
| Bachs53 | 1989 | 22 | CBP | 2 semanas | 10mg/kg/día | Fenobarbital | Beneficio |
| Woolf54 | 1990 | 12 | 4 CBP, 3 VHC, 1 CEP y 4 cirrosis alcohólica | 2 semanas | 300mg/día | Placebo | Sin beneficio |
| Podesta55 | 1991 | 14 | CBP | 1 semana | 600mg/día | Placebo | Beneficio |
| Cynamon56 | 1991 | 5 | Colestasis pediátricas (edad media: 5 años) | 2 semanas | 10mg/día | Placebo | Beneficio |
| Antagonistas opiáceos | |||||||
| Naloxona | |||||||
| Summerfield34 | 1980 | 20 | Hepatopatía crónica (?) | 4 días | Bolo de 2mg | Placebo | Beneficio |
| Bergasa33 | 1995 | 29 | 16 CBP, 3 VHC, 3 BRIC y 7 otros | 24h | Bolo de 0,4mg e infusión de 0,2μg/kg/min | Placebo | Beneficio |
| Naltrexona | |||||||
| Wolfhagen36 | 1997 | 16 | Colestasis crónica (?) | 4 semanas | 50mg/día | Placebo | Beneficio |
| Terg37 | 2002 | 20 | 15 CBP, 2 VHC, 1 CEP y 2 otros | 2 semanas | 50mg/día | Placebo | Beneficio |
| Sertralina | |||||||
| Mayo18 | 2007 | 12 | 9 CBP, 2 CEP y 1 otro | 6 semanas | 75–100mg/día | Placebo | Beneficio |
| AUDC | |||||||
| Palma65 | 1997 | 15 | CG | 3 semanas | 1.000mg/día | Placebo | Beneficio |
| Nicastri66 | 1998 | 32 | CG | 20 días | (?) | Placebo, SAMe y AUDC+SAMe | Beneficio con AUDC+SAMe |
| Glantz67 | 2005 | 130 | CG | 3 semanas | 1.000mg/día | Placebo y DXM+placebo | Beneficio en casos de CG grave |
| Kondrackiene68 | 2005 | 84 | CG | 2 semanas | 8–10mg/kg/día | Colestiramina | Beneficio |
AUDC: ácido ursodeoxicólico; BRIC: colestasis benigna recurrente familiar; CBP: cirrosis biliar primaria; CEP: colangitis esclerosante primaria; CG: colestasis gravídica; DXM: dexametasona; SAMe: S-adenosil-L-metionina; VHC: hepatopatía crónica por virus de la hepatitis C.
En caso de no haber eficacia o pérdida de ésta, el siguiente escalón terapéutico lo constituyen la rifampicina, los antagonistas opiáceos y la sertralina49,50. La rifampicina es un antibiótico ampliamente utilizado en el tratamiento antituberculoso que actúa como ligando del receptor del pregnano X, cuya estimulación induce la síntesis de enzimas metabolizadoras del complejo del citocromo P 450 (CYP34A) y mecanismos de transporte hacia el canalículo biliar (MRP-2, entre otros)51, y puede influir así en la eliminación de los posibles pruritógenos. Existen varios ensayos aleatorizados52–56 que, recogidos en 2 metaanálisis48,57, han demostrado la eficacia de la rifampicina en el control del prurito sin una significativa presencia de efectos adversos. Sin embargo, dado que la hepatotoxicidad por este fármaco es bien conocida, se recomienda monitorizar las pruebas de función hepática durante su uso y debe retirarse en caso de aparecer incremento en las aminotransferasas48. Otros efectos adversos descritos son interacciones medicamentosas, insuficiencia renal o anemia hemolítica. La dosis recomendada es de 10mg/kg/día o bien 150mg 3 veces al día siempre que la bilirrubina sérica sea menor de 3mg/dl, y se reduce a 2 tomas diarias si ésta es mayor de 3mg/dl48.
La utilización de antagonistas opiáceos se basa tanto en los conocimientos experimentales expuestos con anterioridad como en varios ensayos clínicos aleatorizados33,35–37 que, agrupados en el metaanálisis de Tandon et al48, han demostrado una eficacia en la reducción del prurito asociado a colestasis. El principal efecto adverso de estos fármacos, previamente mencionado, es la aparición de un síndrome de abstinencia a opiáceos incluso en los pacientes que no han tomado nunca fármacos agonistas. Por tanto, estos tratamientos deben comenzarse con dosis bajas e ir aumentando progresivamente hasta titular la dosis eficaz. En casos de prurito incapacitante, puede iniciarse el tratamiento con naloxona i.v. mediante un bolo lento de 0,4mg, seguido de una infusión de 0,2μg/kg/min en 250 o 500cm3 de suero salino. En algunos casos se han utilizado dosis mucho menores (0,002μg/kg/min) con el fin de prevenir la aparición del síndrome de abstinencia a opiáceos. Posteriormente, habrá de aumentarse el ritmo de infusión cada 2–4h hasta lograr la resolución del prurito o hasta lograr una dosis máxima de 0,8μg/kg/min. Finalmente, después de 24 o 48h puede introducirse la naltrexona oral en dosis de 12,5mg/día y debe retirarse entonces la naloxona i.v. En estos casos y en aquéllos en que se emplee el fármaco oral como primera opción, la dosis inicial será de 12,5mg/día para posteriormente ir aumentando12,5mg cada 1–2 semanas hasta los 50–100mg/día. Cuando aparezcan síntomas de abstinencia leves puede bastar con mantener la misma dosis, ya que existe una tendencia a la desaparición espontánea de éstos. Estos fármacos estarán contraindicados en los pacientes que tomen agonistas opioides por otras indicaciones. Durante el tratamiento con naltrexona se aconseja monitorizar las pruebas de función hepática ya que existen casos descritos de hepatotoxicidad, si bien éstos son poco frecuentes y no se describe ninguno en los ensayos recogidos en el metaanálisis referido1,48. Existe un estudio con un tercer antagonista opioide oral como es el nalmefene, también con resultado positivo, aunque se trata de un único ensayo clínico con un reducido número de pacientes30. Como se ha comentado previamente, el prurito es un efecto opioide mediado a través del receptor-μ, mientras que el receptor-κ ejerce una acción antipruriginosa. Esto plantea la posibilidad futura de emplear eficazmente fármacos agonistas-κ en el tratamiento del prurito asociado a colestasis, algo ya realizado a nivel experimental con la nalfurafina (agonista puro κ), lo que disminuye las respuestas de rascado en ratones con colestasis58. Además, la nalfurafina se ha empleado satisfactoriamente en un ensayo clínico aleatorizado en los pacientes con prurito asociado a uremia sin observarse síndrome de abstinencia en ningún caso59. Del mismo modo, en la línea de los antagonistas opiáceos cabe señalar el butorfanol, disponible en spray nasal. Se trata de un fármaco con actividad antagonista-μ y agonista-κ, con eficacia en las primeras experiencias clínicas60, si bien su principal problema es la producción de dependencia y no puede recomendarse por el momento su uso de forma extensiva1.
El fármaco que podemos situar a continuación en la “escalera terapeútica” del prurito, y a falta de estudios que lo comparen con los anteriores, es la sertralina, un inhibidor selectivo de la recaptación de serotonina (ISRS). Este antidepresivo también ha demostrado ser útil en el tratamiento del prurito asociado a colestasis en un único ensayo clínico cruzado y aleatorizado18. La dosis necesaria para la reducción del prurito fue de 75–100mg/día, aunque la recomendación es iniciar el tratamiento con una dosis de 25mg/día e ir aumentando progresivamente 25mg cada 4 semanas. En dicho estudio se observó además una mejoría en el estado de ánimo que puede actuar como adyuvante, pero que parece ser independiente de la mejoría del prurito. Entre los posibles efectos secundarios de este fármaco cabe destacar molestias gastrointestinales, mareo o cefalea, aunque el estudio comentado mostró una buena tolerancia incluso con la dosis completa. Aunque no se han estudiado en el contexto de la colestasis, existen otros ISRS, como la paroxetina o la fluvoxamina61, y un inhibidor de la recaptación de serotonina y noradrenalina, la mirtazapina62, que han demostrado un beneficio en el control del prurito crónico asociado a enfermedades tanto dermatológicas como sistémicas.
En último lugar, nos referiremos al ácido ursodeoxicólico (AUDC), un ácido biliar presente en menos del 3% en la composición fisiológica de la bilis, que actúa mediante la estimulación de la secreción biliar a través de la regulación postranscripcional de la bomba transportadora de sales biliares y otros transportadores como la MRP-263. Este fármaco, empleado como primera línea en el tratamiento de la CBP, no ha demostrado, sin embargo, beneficio en el control del prurito, tal y como se recoge en una revisión reciente de la Cochrane Library64. Aunque también se utiliza en el tratamiento de otras enfermedades colestásicas, el AUDC no se ha estudiado específicamente como antipruriginoso salvo en la CG, donde existen varios estudios aleatorizados que apoyan su uso como tratamiento de primera línea en esta entidad, y reduce tanto el prurito como las complicaciones maternofetales65–68. En uno de dichos estudios, el AUDC se muestra superior a la colestiramina, por lo que debería situarse en el primer lugar de la “escalera terapéutica” en el caso de la CG68,70. La dosis recomendada es de 10–15mg/kg/día, si bien pueden utilizarse dosis de hasta 20mg/kg/día, y presenta habitualmente pocos efectos secundarios, entre los que se encuentra la diarrea69,70.
Otras medidas terapéuticasLos fármacos antihistamínicos, ampliamente utilizados en el prurito secundario a otras etiologías, no parecen tener lugar en el tratamiento de los pacientes con prurito y colestasis, dado que la histamina no interviene en su fisiopatología y no aporta más allá del efecto placebo o el efecto sedante de los de primera generación. Finalmente, encontramos publicados en la literatura médica múltiples artículos que relatan el beneficio de diversos fármacos en casos aislados y pequeños ensayos no reproducidos posteriormente. Algunos ejemplos son el metronidazol en pacientes con CBP71, el dronabinol (agonista cannabinoide B1)72, el propofol (agonista GABA) en dosis subhipnóticas73, la lidocaína74, el ondansetrón (antagonista del receptor 5-HT3 de la serotonina) con resultados contradictorios75,76, el fenobarbital (inductor enzimático)77, los andrógenos78 y la S-adenosil-L-metionina79.
En un escalón ulterior al farmacológico se encuentran los sistemas de diálisis extracorpórea con albúmina tipo molecular adsorbent recirculating system, medida terapéutica que ha mostrado eficacia en pequeños grupos de pacientes con prurito refractario a las medidas habituales80,81. No obstante, no existen estudios aleatorizados que establezcan su situación dentro del arsenal terapéutico y contribuyan a aclarar otros hechos como el posible efecto placebo de dichos tratamientos. Por último, el propio prurito intratable que condiciona una gran alteración de la calidad de vida puede constituir la indicación de trasplante hepático en algunos pacientes con colestasis, principalmente con CBP, aunque también puede ocurrir en CEP o en colestasis pediátricas82.
Algoritmo terapéuticoEn la figura 2 se representa esquemáticamente el algoritmo terapéutico que proponemos para el prurito asociado a la colestasis. Dado que no existen ensayos que comparen directamente la rifampicina y los antagonistas opiáceos, y puesto que han demostrado sobradamente su eficacia clínica, ambos podrían situarse en el mismo escalón terapéutico tras la colestiramina e intercambiarse en aquellos casos que se muestren resistentes a uno u otro. Del mismo modo, la sertralina podría también en determinados casos situarse como segundo fármaco tras la colestiramina, puesto que tampoco se ha comparado directamente con los 2 anteriores. No obstante, dado que la sertralina sólo fue eficaz en un único ensayo clínico, la situamos por detrás de la rifampicina y los antagonistas opiáceos. Por último, en el caso particular de la CG, el primer escalón debe corresponder al AUDC.
Algoritmo terapéutico para el prurito asociado a colestasis. Las flechas con línea continua muestran la secuencia terapéutica habitual, mientras que aquéllas con línea discontinua indican la posibilidad de pasar directamente a otros escalones en determinados pacientes. Ta: temperatura; CPRE: colangiopancreatografía retrógada endoscópica; CG: colestasis gravídica; AUDC: ácido ursodeoxicólico; Bil.: bilirrubina total sérica; NLX: naloxona; i.v.: intravenosa; NTX: naltrexona; v.o.: vía oral; MARS: molecular adsorbent recirculating system; TH: trasplante hepático.