Los cannabinoides (CB) endógenos son moléculas lipídicas capaces de mimetizar los efectos producidos por el Δ9-tetrahidrocannabinol, el compuesto causante de los efectos psicológicos de la marihuana. Los endocannabinoides son derivados del ácido araquidónico y participan en numerosos efectos fisiológicos. Esta familia de sustancias está formada por la anandamida (araquidoniletanolamida), el 2-araquidonilglicerol, el éter de noladina y la virodamina. La interacción de estas sustancias con los receptores de CB1 y de CB2 da lugar a la mayoría de sus efectos biológicos. El sistema endocannabinoide está implicado en la patogénesis de la disfunción vascular que se produce en la enfermedad hepática avanzada y desempeña un papel importante en la patogénesis de la hipertensión portal y de la fibrosis hepática. Además, este sistema también se encuentra alterado en otros procesos asociados a la disfunción hepática, como la encefalopatía, la obesidad y la esteatosis. Este sistema podría representar una nueva diana terapéutica para la fibrosis y la hipertensión portal.
Endogenous cannabinoids are ubiquitous lipid-signaling molecules able to partially mimic the actions produced by Δ9-tetrahydrocannabinol, the compound responsible for most of the psychological effects of marijuana. Endocannabinoids are derived from arachidonic acid and are involved in many physiological effects. This family of substances includes anandamide (arachidonylethanolamide), 2-arachydonylglycerol, noladin ether and virodhamine. The interaction of these substances with CB1 and CB2 receptors results in most of their biological effects. The endocannabinoid system is involved in the pathogenesis of the cardiovascular dysfunction occurring in advanced liver disease and also plays a role in the pathogenesis of portal hypertension and liver fibrosis. Moreover, this system is also altered in other processes associated with hepatic dysfunction, including encephalopathy, obesity and steatosis. These findings indicate that the endocannabinoid system may open new avenues for the therapeutic regulation of fibrosis and portal hypertension in advanced liver disease.
La cirrosis hepática es una enfermedad conocida desde la antigüedad y en la actualidad constituye una de las causas de muerte más frecuentes en los países occidentales. La cirrosis es la fase final de la enfermedad hepática crónica y se caracteriza histológicamente por la existencia de importantes alteraciones en la arquitectura tisular como la aparición de fibrosis y la formación de nódulos de regeneración. El deterioro en la estructura hepática se asocia a una disfunción circulatoria, sus rasgos más característicos son la hipertensión portal, la hipotensión arterial, el aumento del gasto cardíaco y la disminución de las resistencias periféricas. La progresión de la enfermedad hepática conlleva el desarrollo de ascitis, hemorragia gastrointestinal, peritonitis bacteriana espontánea, encefalopatía hepática y síndrome hepatorenal1. A pesar de los avances que se han producido en la caracterización de los mecanismos fisiopatológicos que intervienen en la cirrosis hepática, existen todavía numerosas incógnitas pendientes de resolución. En este sentido, estudios realizados en los últimos años han puesto de manifiesto la importancia de los cannabinoides (CB) endógenos en la patogénesis de algunas de las complicaciones asociadas a la disfunción hepática crónica2,3. Así, se ha demostrado que las alteraciones en la síntesis, en la degradación o en las vías de señalización de los endocannabinoides forman parte de los mecanismos relacionados con las alteraciones hemodinámicas, los procesos fibroproliferativos, la obesidad y la esteatosis hepática4–6.
El sistema cannabinoideLos CB derivados de las plantas se han utilizado tradicionalmente con fines médicos y recreativos. Sin embargo, las correspondientes dianas tisulares no se identificaron en el organismo hasta los años 1980–1990. Durante este período de tiempo se caracterizaron los receptores de CB 1 y 27,8 y se identificó la anandamida o araquidonil-etanolamida (AEA)9, el primer endocannabinoide descrito. El sistema endocannabinoide está formado por los receptores de CB, sus ligandos endógenos (o endocannabinoides) y las proteínas implicadas en su síntesis e inactivación10. Recientemente, se ha demostrado mediante estudios farmacológicos la presencia de otro receptor de CB aunque todavía no se ha clonado11. Por último, se ha propuesto al receptor huérfano GPR55 como un nuevo miembro de la familia de los receptores de CB12.
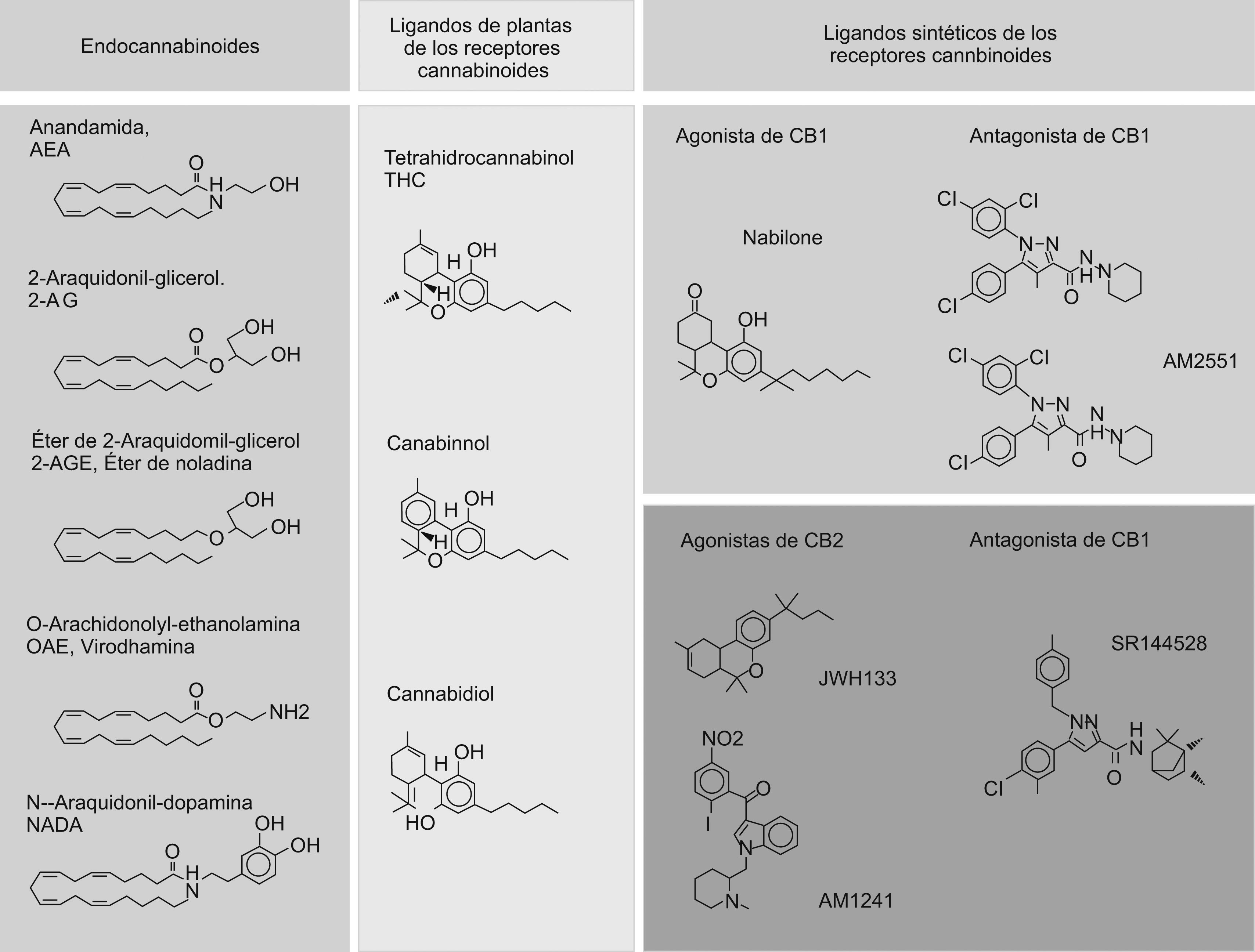
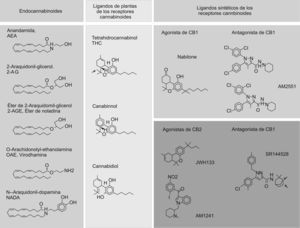
La familia de los endocannabinoides comprende la AEA, el 2-araquidonil-glicerol (2-AG), la araquidonil-etanolamina (virodhamina), el éter del 2-AG (éter de noladina) y la N-araquidonil-dopamina (fig. 1). Estas sustancias ejercen sus funciones a través de los receptores de CB. Además, la AEA también interacciona con el receptor de vanilloides de tipo 1 (TRPV1), conocido también como VR1. Los endocannabinoides son sustancias muy lipofílicas, que a diferencia de los neurotransmisores clásicos no se almacenan en vesículas antes de liberarse y se sintetizan según la demanda. Por consiguiente, las vías de señalización de los endocannabinoides están finamente reguladas a través de su síntesis, liberación, transporte y degradación.
Estructura química de los endocannabinoides o cannabinoides (CB) endógenos, de los ligandos de plantas de los receptores de CB y de los ligandos sintéticos de los receptores de CB. Estructura química de los endocannabinoides identificados hasta la fecha (columna de la izquierda). Estructura química de los 3 CB de plantas más abundantes (columna central): el psicotrópico delta9- tetrahidrocannabinol, y los no psicoactivos cannabidiol y cannabinol. Estructura química de algunos ligandos sintéticos de los receptores de CB (columna de la derecha): en el panel superior se muestra un agonista del receptor de CB1 nabilone y 2 antagonistas, el rimonabant y el AM251; en el panel inferior se muestran los agonistas del receptor de CB2, el JWH-133 y el AM1241, y el antagonista SR144528.
Los primeros estudios publicados sobre las enfermedades asociadas a los CB estaban relacionados con desórdenes neurológicos y psiquiátricos. Sin embargo, investigaciones más recientes han demostrado que el sistema endocannabinoide también está implicado en procesos patológicos gastrointestinales, reproductivos, endocrinos, metabólicos, tumorales, óseos, cardíacos y hepáticos2,3,10.
Disfunción hemodinámica y endocannabinoideEstudios iniciales realizados en animales de experimentación demostraron que la inducción de un shock hemorrágico o la administración intravenosa de lipopolisacárido bacteriano, estimula la producción de la AEA en monocitos circulantes de las ratas control. Estas células, a su vez, son capaces de producir un marcado efecto hipotensor cuando se administran por vía intravenosa a animales receptores normovolémicos13,14. Estos resultados permitieron formular la hipótesis de que los CB podrían estar implicados en la homeostasis de la presión arterial en la cirrosis. Así pues, en esta línea diversos estudios han demostrado que los endocannabinoides participan en la patogénesis de la disfunción cardiovascular que se produce en la enfermedad hepática avanzada. La administración sistémica de un antagonista selectivo del receptor de CB1 aumentó la presión arterial y las resistencias periféricas totales y disminuyó el flujo sanguíneo mesentérico y la presión portal en las ratas cirróticas con ascitis, pero no en las ratas control15,16. En estos mismos estudios, la administración del antagonista en el cuarto ventrículo cerebral no produjo ningún efecto hemodinámico, lo que indica que los cambios observados no están regulados centralmente, sino que éstos tienen lugar en la circulación sistémica16. Además, la administración de un concentrado de células sanguíneas obtenidas de ratas cirróticas con ascitis produjo una disminución significativa de la presión arterial en ratas normales. Este patrón de respuesta cardiovascular fue muy similar cuando únicamente se administraron monocitos circulantes de ratas cirróticas. El efecto hipotensor producido por los monocitos de ratas cirróticas en las ratas receptoras no se observó cuando estas últimas se pretrataron con un antagonista específico del receptor de CB1. Bátkai et al15 obtuvieron resultados similares al administrar monocitos aislados de pacientes cirróticos a ratas normales. Puesto que se ha demostrado que la AEA produce hipotensión arterial al interactuar con el receptor de CB1, es muy probable que éste u otros endocannabinoides medien total o parcialmente el efecto hipotensor producido por los monocitos de las ratas cirróticas. Bátkai et al15 también determinaron la expresión génica y la abundancia proteica del receptor de CB1 en las células endoteliales aisladas de las arterias hepáticas de sujetos sanos y de pacientes cirróticos. Estos investigadores demostraron que existe una marcada sobreexpresión del receptor de CB1 en las células procedentes de los pacientes cirróticos. También se ha descrito un incremento en los niveles circulantes de la AEA en los individuos cirróticos17,18.
Recientemente, experimentos realizados con arterias mesentéricas de resistencia aisladas de ratas con cirrosis y ascitis han mostrado que estos vasos presentan una respuesta alterada a la AEA19. Este endocannabinoide provocó que en los vasos mesentéricos de las ratas cirróticas con ascitis se produjese un mayor efecto vasorrelajante que en los vasos de las ratas control. Este patrón de respuesta no se modificó al preincubar los vasos en presencia de L-NAME (un inhibidor del enzima sintasa del óxido nítrico), o bien al realizar los ensayos de reactividad vascular en vasos desprovistos de endotelio. Estos resultados indicaron que el efecto diferencial de la AEA en las arterias de resistencia de los animales cirróticos es independiente de la integridad funcional del endotelio. Por otra parte, el efecto de la AEA es selectivo para los vasos mesentéricos, puesto que no se observó ningún efecto al realizar los experimentos de reactividad vascular en las arterias femorales distales de las ratas cirróticas y control. Domenicali et al19 también demostraron la presencia del receptor de CB1 y del TRPV1 en las arterias mesentéricas de resistencia, éstos fueron superiores en las ratas cirróticas. Por último, ambos receptores se localizaron mayoritariamente en las terminales nerviosas perivasculares de las arterias mesentéricas de resistencia de las ratas cirróticas con ascitis. Estos resultados coinciden con los de Moezi et al20, quienes estudiaron los efectos cardiovasculares de la AEA en las ratas con ligadura del colédoco (BDL). La AEA aumentó el diámetro de los vasos mesentéricos y el flujo mesentérico en las ratas con BDL, pero no se observaron cambios en las ratas control. Mediante la utilización de antagonistas específicos para los receptores de CB y capsazepina (un antagonista del TRPV1), los autores demostraron que los efectos hemodinámicos de la AEA estaban mediados por el receptor de CB1 y el TRPV1. Asimismo, estudios recientes han demostrado que el bloqueo de los receptores de CB1 mejora la excreción de sodio y atrasa la aparición de ascitis en ratas con cirrosis. Este efecto es secundario a la mejora en la hemodinámica sistémica y renal que resulta de la inhibición del receptor de CB121. En conjunto, estos resultados indican que los endocannabinoides contribuyen a la circulación hiperdinámica e hiperemia mesentérica en 2 modelos bien diferenciados de cirrosis, ratas con BDL y animales tratados con CCl4 y fenobarbital.
El corazón es otro órgano que se encuentra afectado en los pacientes cirróticos. Sin embargo, hasta qué punto esto es consecuencia de la vasodilatación arterial o se debe a una cardiopatía específica de la cirrosis22 ha sido sujeto de discusión. En la cirrosis, las anomalías funcionales cardíacas no son evidentes, así los pacientes cirróticos presentan una disminución del volumen ventricular derecho, que es probablemente una consecuencia de la disminución del retorno venoso de la circulación sistémica. Además, también presentan una mayor precarga y volumen en el ventrículo izquierdo, lo que evidencia una disfunción ventricular izquierda23,24. Esta anomalía puede permanecer en estado latente debido a la disminución en las resistencias vasculares o, en otras palabras, a causa de la reducción en la poscarga. La existencia de esta anomalía en el comportamiento ventricular puede ponerse de manifiesto durante una prueba de esfuerzo25,26. Además, también se han descrito anomalías estructurales cardíacas, como por ejemplo un incremento en el grosor del ventrículo izquierdo27.
Gaskari et al28 han demostrado la implicación de los CB endógenos y del receptor de CB1 en los trastornos en la contractibilidad miocárdica que se producen en la enfermedad hepática. Estos investigadores aislaron músculos papilares del ventrículo izquierdo de las ratas control y la BDL para determinar el papel de los endocannabinoides en la patogénesis de la cardiomiopatía cirrótica. Los músculos papilares de las ratas con BDL mostraron una respuesta disminuida al isoproterenol que fue completamente restablecida al incubarlos en presencia de un antagonista selectivo del receptor de CB1, AM251. Además, no se observaron diferencias en la expresión de los receptores de CB y de la enzima que interviene en la degradación de la AEA (la amidohidrolasa de los ácidos grasos [FAAH]) entre los músculos papilares de las ratas control y la BDL. No obstante, cuando los experimentos se realizaron con dosis elevadas de AEA, la administración de agentes bloqueantes del transporte de la AEA (VDM11 y AM404) mejoraron significativamente la relajación de los músculos papilares en las ratas con BDL, pero no se observó ningún cambio en las ratas control. La presencia de AM251 y de la toxina pertúsica previno este efecto, por lo que estos resultados evidencian que en la miocardiopatía cirrótica se produce un incremento local en la producción de endocannabinoides y que éstos actúan a través de los receptores de CB1. En otro estudio independiente, Ippolito et al29 observaron que en las aurículas aisladas de las ratas con BDL previamente tratadas con AM251 se normalizaba completamente la respuesta disminuida al isoproterenol sin modificar el equilibrio simpatovagal. Por consiguiente, estos autores concluyeron que la posible participación del receptor de CB1 en la patogenia de la disfunción cardíaca asociada a la cirrosis, no estaba asociada a la actividad simpática.
Finalmente, Bátkai et al30 estudiaron los efectos del bloqueo del receptor de CB1 (en condiciones dependientes e independientes de la precarga), sobre el inotropismo cardíaco en las ratas cirróticas y control. La administración del antagonista de CB1 mejoró significativamente todos los parámetros de función sistólica ventricular izquierda en las ratas cirróticas, pero no en las ratas control. Además, los niveles tisulares cardíacos de la AEA fueron 2,7 veces superiores en los animales cirróticos que en las ratas control. Estos resultados ponen de manifiesto la existencia de una alteración intrínseca en el inotropismo cardíaco de las ratas cirróticas que podría estar relacionada con un incremento en la producción local de la AEA. No se observaron diferencias en la expresión del receptor de CB1 o de la FAAH. En conjunto, estos estudios apoyan la hipótesis de que el sistema CB participa en la patogénesis de la miocardiopatía cirrótica.
Fibrosis hepática y endocannabinoidesAlgunos estudios en pacientes con hepatitis crónica C han demostrado que el consumo diario de cannabis es un factor predictivo independiente de progresión de fibrosis31. Estos resultados constituyen una de las primeras evidencias e indican que, además de intervenir en la etiopatogénesis de la disfunción circulatoria en la cirrosis descompensada, el sistema endocannabinoide también puede ser relevante en la patogenia de la fibrosis hepática. En este sentido, Siegmund et al32 demostraron que la AEA estimula in vitro la muerte celular selectiva de las células hepáticas estrelladas activadas (CHE) y propusieron que la AEA podría utilizarse como un posible agente terapéutico antifibrogénico. Estos autores también demostraron que la AEA es inductora de necrosis en las CHE en el rango μM. Puesto que este fenómeno no depende de la activación de los receptores CB1, CB2 o TRPV1, estos mismos autores indicaron que la necrosis inducida por la AEA se produce a través de la interacción con el colesterol de membrana, lo que daría lugar a la formación de especies reactivas del oxígeno, liberación de Ca2+ intracelular y, finalmente, la muerte celular32. Hasta qué punto la necrosis inducida por la AEA es un efecto específico para las CHE y no ocurre también en hepatocitos no está completamente definido y genera controversias. Algunos estudios previos realizados por Biswas et al17 demostraron que la AEA es capaz de inducir apoptosis en líneas celulares hepatocitarias (células HepG2) y hepatocitos primarios. La mayoría de estos experimentos se realizaron, sin embargo, en la línea celular HepG2, que podría presentar una sensibilidad alterada a la muerte celular inducida por la AEA en comparación con los hepatocitos primarios.
La primera indicación concluyente de que los endocannabinoides endógenos también podrían ejercer una función relacionada con los procesos fibroproliferativos se obtuvieron por parte de Teixera-Clerc et al33 en diversos modelos experimentales de lesión hepática. Estos investigadores demostraron que el bloqueo del receptor de CB1 es capaz de atenuar los procesos de cicatrización tisular cuando se produce una lesión hepática aguda. De esta forma se estableció una base racional de los tratamientos antifibrogénicos fundamentados en bloquear farmacológicamente el receptor de CB1.
A diferencia de lo que ocurre con los receptores CB1, diversos estudios experimentales indican que la activación del receptor CB2 tiene efecto antifibrogénico e inhibe el crecimiento y la apoptosis celular en miofibroblastos hepáticos humanos y en CHE. Julien et al34 demostraron que el receptor CB2 está marcadamente inducido en la cirrosis hepática humana y que se encuentra expresado en células no parenquimales y en células biliares localizadas en los septos fibrosos. Estos autores también demostraron que los ratones genéticamente modificados para la carencia del gen del receptor CB2 son más susceptibles a la fibrosis inducida por inhalación de CCl4 que los animales control34. Hay que tener en cuenta que a priori la activación del receptor de CB2 puede ser una estrategia terapéutica más segura que el bloqueo del receptor CB1, ya que el receptor CB2 apenas se expresa en el sistema nervioso central (SNC) y su activación da lugar a efectos antiinflamatorios y no presenta acciones psicotrópicas35. El bloqueo del receptor CB1 ofrece como ventaja adicional la mejora de la hemodinámica sistémica16; sin embargo, hay argumentos importantes en contra de esta estrategia, ya que el receptor CB1 se expresa de forma muy abundante en el SNC y media importantes funciones relacionadas con el apetito, la locomoción y el comportamiento3. En este sentido, se han descrito efectos adversos (náuseas, mareos, ansiedad, diarrea y depresión) en pacientes tratados con elevadas dosis del antagonista de CB136.
Con el objeto de evaluar los efectos de la estimulación crónica del receptor de CB2, Muñoz-Luque et al37 administraron un agonista selectivo de CB2 a ratas cirróticas con ascitis. A diferencia de los resultados observados en los animales cirróticos tratados con vehículo, la estimulación crónica del receptor de CB2 en las ratas cirróticas con ascitis mejoró la hemodinámica sistémica, redujo el infiltrado inflamatorio, disminuyó el número de las CHE, incrementó la apoptosis de monocitos y miofibroblastos localizados en los márgenes de los septos fibrosos y disminuyó la fibrosis. Estas observaciones se asociaron a una disminución en la abundancia de actina del músculo liso de tipo α, de colágeno de tipo i y de metaloproteinasa de matriz celular de tipo 2 en el tejido hepático de las ratas cirróticas tratadas con el agonista del receptor CB2. Este patrón de respuesta coincide con el que se observa después de una isquemia reperfusión hepática. En este último caso, la estimulación del receptor de CB2 protege contra el daño hepático mediante la disminución de la activación de las células endoteliales, la respuesta inflamatoria, la expresión de las moléculas de adhesión y de citoquinas inflamatorias y el reclutamiento, adhesión y activación de las células inflamatorias38,39. Estos resultados, por tanto, indican que la estimulación selectiva crónica del receptor CB2 podría ser efectiva para detener, retrasar o revertir los procesos fibroproliferativos en la enfermedad hepática avanzada.
Desórdenes neurológicos y el sistema endocannabinoideLa encefalopatía hepática es otra complicación asociada a la fase final de la cirrosis y se caracteriza por presentar trastornos mentales en los pacientes con fallo hepático agudo o crónico. Existen varios mecanismos involucrados en la génesis de la encefalopatía hepática. Berry et al40 investigaron la implicación del sistema endocannabinoide en los desórdenes neurológicos asociados al fallo hepático agudo o crónico y para esto utilizaron un modelo experimental de fallo hepático fulminante inducido por tioacetamida en ratones y demostraron que la administración de un agonista de CB2 o un antagonista de CB1 mejora la puntuación neurológica y la actividad y la función cognitiva40. Además, trabajos posteriores realizados en el mismo laboratorio demostraron que los endocannabinoides regulan la proteína quinasa cerebral activada por AMP, un importante sensor de energía intracelular involucrado en la respuesta compensatoria al fallo hepático41. Estos resultados sugieren que los endocannabinoides pueden tener un papel importante en la patogenia de la encefalopatía hepática.
Obesidad, desórdenes metabólicos, hígado graso y el sistema endocannabinoideLa enfermedad hepática grasa no alcohólica (EHNA) incluye un amplio espectro de enfermedades hepáticas, como la esteatosis, la esteatohepatitis no alcohólica, la cirrosis y la enfermedad hepática avanzada. La EHNA se asocia a diversos componentes de síndromes metabólicos, como la obesidad, la diabetes mellitus de tipo 2, la resistencia a la insulina y la hipertrigliceridemia. No obstante, la naturaleza del trastorno metabólico y la progresión de la fibrosis no están bien definidas. Cota et al42 propusieron las primeras indicaciones que mostraron que el sistema endocannabinoide podría estar involucrado en la regulación de la ingesta mediante unos experimentos realizados en ratones modificados genéticamente para el receptor CB1. Estos autores demostraron que el sistema endocannabinoide desempeña un doble papel en la regulación de la homeostasis energética a través de mecanismos orexigénicos centrales y mecanismos lipogénicos periféricos. Posteriormente, Osei-Hyiaman et al43 investigaron la participación de los endocannabinoides en la lipogénesis hepática y observaron que la activación del receptor CB1 incrementa la síntesis de ácidos grasos hepáticos en ratones y en hepatocitos aislados. Asimismo, demostraron que la AEA contribuye a la obesidad inducida por la dieta en estos animales. Estos mismos investigadores demostraron que los receptores hepáticos de CB1 contribuyen a la esteatosis, la dislipidemia, la resistencia a la insulina y al aumento de los niveles de leptina observada cuando se suministra una dieta con alto contenido en grasa44. En concordancia con estas investigaciones, Hézode et al45 demostraron que la gravedad de la esteatosis está estrechamente relacionada con el consumo de cannabis en los pacientes con hepatitis crónica C. Además, 2 estudios recientes han propuesto que el receptor CB2 podría estar también involucrado en la patogenia de la EHNA. En primer lugar, la expresión hepática del receptor de CB2 es superior en los pacientes con EHNA que en los pacientes sanos46. En segundo lugar, estudios recientes realizados por el grupo de Lotersztajn47 indican que los ratones deficientes para el receptor de CB2 que realizan una dieta rica en grasa presentan una menor gravedad de esteatosis hepática, resistencia a la insulina y respuesta inflamatoria que los animales normales. Por último, el sistema endocannabinoide también se ha relacionado con la esteatohepatitis alcohólica; así pues, Jeong et al48 demostraron que la activación paracrina del receptor de CB1 hepático por el 2-AG liberado por las CHE media la esteatosis inducida por el alcohol, con lo que aumenta la lipogénesis y disminuye la eliminación de grasa en estos roedores.
ConclusionesEn resumen, disponemos de resultados convincentes que indican que el sistema endocannabinoide desempeña un papel muy importante en numerosos procesos fisiopatológicos asociados a la enfermedad hepática. Los receptores CB1 funcionan como importantes mediadores en el desarrollo de algunas de las complicaciones de la cirrosis, entre éstos podemos incluir la vasodilatación esplácnica, la hipertensión portal y la cardiomiopatía cirrótica. Se ha demostrado que el bloqueo del receptor de CB1 es efectivo para reducir la hipertensión portal y la cardiomiopatía en la cirrosis. Además, la estimulación del receptor de CB1 favorece la acumulación de grasa, induce la inflamación en la EHNA y en la enfermedad alcohólica y contribuye a la progresión de los procesos fibroproliferativos hepáticos. Por otra parte, el receptor CB2 media efectos antifibrogénicos y desempeña un papel importante en la regulación de la respuesta inflamatoria. En conjunto, estos datos indican que la activación de los receptores de CB da lugar a una respuesta dual, la activación del receptor CB1 acentúa la progresión de la enfermedad hepática y alguna de sus complicaciones, mientras que los receptores CB2 están más relacionados con propiedades antifibrogénicas. Por tanto, el sistema endocannabinoide podría ser una diana terapéutica en la enfermedad hepática. Aunque actualmente se disponga de mayor evidencia experimental relacionada con el receptor CB1 cualquier estrategia terapéutica futura deberá considerar que este receptor se encuentra densamente representado en el SNC y que, por tanto, su modulación inespecífica podría originar efectos secundarios no deseados. En este sentido, hay grandes expectativas puestas en el desarrollo de nuevos antagonistas para el receptor CB1 dirigidos a diseñar compuestos que no atraviesen la barrera hematoencefálica. Alternativamente, no se descarta la utilización de agonistas selectivos del receptor de CB2 ya que éstos están exentos de propiedades psicoactivas. Finalmente, cabe citar una tercera vía para tener en cuenta como posible acción terapéutica mediante la aplicación de moléculas que actúen sobre las vías reguladoras de la síntesis, la degradación o el transporte celular de los endocannabinoides y que deberían también explorarse.
FinanciaciónLos proyectos de la Dirección General de Investigación Científica y Técnica (SAF03-02597, SAF2006-07053 y SAF2009-08839 otorgados a Wladimiro Jiménez), el Fondo de Investigación Sanitaria (FS02/0588 otorgado a Josefa Ros) han financiado, en parte, las investigaciones sobre el sistema endocannabinoide llevado a cabo por los investigadores. Vedrana Reichenbach obtuvo una beca de la Dirección General de Investigación Científica y Técnica (DGICYT) (SAF2006-07053).