Los tumores neuroendocrinos pancreáticos (TNE) son infrecuentes, presentando una incidencia aproximada de 1/100.000, lo que representa solo un 1–2% de las neoplasias pancreáticas. La localización y estadiaje de los TNE previa a la cirugía es de enorme utilidad, ya que permite optimizar su tratamiento. Sin embargo, su localización es a menudo difícil ya que suelen ser de pequeño tamaño. El aspecto ecográfico más característico de estas lesiones es el de una tumoración redondeada, hipoecogénica, homogénea, con límites precisos y refuerzo periférico en relación a su importante vascularización. La ultrasonografía endoscópica (USE) ha demostrado ser la técnica más precisa para el diagnóstico y localización de los TNE, alcanzando una sensibilidad y especificidad cercanas al 95%, claramente superior a otras técnicas de imagen. La precisión diagnóstica puede incluso incrementarse si se asocia la punción aspiración con aguja fina.
Neuroendocrine pancreatic tumors (NEPT) are relatively infrequent tumors, with an incidence of approximately 1 case per 100.000 inhabitants, representing only 1–2% of pancreatic neoplasms. Localization and staging of NEPT prior to surgery is essential to allow treatment optimization. However, localizing these tumors is often difficult, mainly because of their small size. On ultrasound, NEPT usually appear as rounded, hypoechoic and homogeneous lesions, with precise limits and peripheral enhancement due to their significant vascularization. The most precise technique for the diagnosis and localization of NEPT is endoscopic ultrasound (EUS), with a sensitivity and specificity as high as 95%, clearly superior to those of other imaging procedures. Overall diagnostic accuracy may even be increased by associating EUS-guided fine-needle aspiration.
Los tumores neuroendocrinos de páncreas (TNE) son tumores infrecuentes con una incidencia aproximada de 1/100.000 lo que representa solo un 1–2% de las neoplasias pancreáticas. No hay una clara predilección por sexo, pudiendo presentarse a cualquier edad, con un pico de incidencia entre los 30 y 60 años1.
La localización y estadiaje de los TNE previa a la cirugía es de enorme utilidad, ya que permite optimizar su tratamiento. La localización del tumor es a menudo difícil sobre todo en el caso de los gastrinomas e insulinomas, que suelen medir menos de 2cm de diámetro. El aspecto más característico de los tumores neuroendocrinos es el de una tumoración redondeada, hipoecogénica, homogénea, con límites precisos y refuerzo periférico producto de su abundante vascularización. Mientras que los insulinomas son intrapancreáticos en el 99% de los casos, los gastrinomas solo lo son en el 40 al 70% de los casos2.
La ultrasonografía endoscópica (USE) ha demostrado ser la técnica más precisa para el diagnóstico de tumores neuroendocrinos y su localización, alcanzando una sensibilidad y especificidad cercanas al 95% superior a otras técnicas de imagen, con una alta precisión diagnóstica (>90%) si se asocia a la punción aspiración con aguja fina (PAAF). Esta elevada eficacia diagnóstica suele disminuir en el caso de incluir los gastrinomas, dado que pueden presentar una localización extrapancreática2. Por ello, la realización de una PAAF guiada por USE se considera una estrategia coste-efectiva en tumores con baja capacidad metastásica (insulinoma), mientras que en tumores con alta probabilidad de enfermedad metastásica (gastrinoma) sería más coste-efectivo comenzar el estudio con una tomografía axial computerizada (TAC), resonancia magnética (RM) u octreoscan3.
Además de la localización del tumor primario, la USE permite la estadificación locorregional, incluyendo la invasión vascular, con mayor precisión que otras técnicas de imagen, por lo que en muchas ocasiones permite que técnicas más invasivas como la arteriografía hayan sido desplazadas. Otras técnicas de imagen (TAC y RM) siguen siendo decisivas en el cribado de metástasis a distancia4.
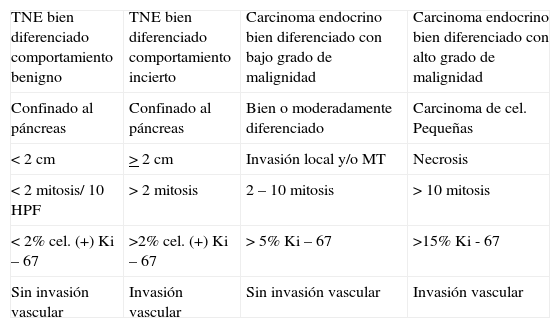
ClasificaciónLos TNE, aunque raras, son las neoplasias endocrinas intraabdominales más frecuentes. Si bien en la actualidad la Organización Mundial de la Salud ha establecido una nueva clasificación diagnóstica (tabla 1), en la mayoría de los estudios y trabajos publicados, estos tumores suelen dividirse en dos grandes grupos: tumores funcionantes productores de hormonas y tumores endocrinos no funcionantes. La frecuencia de los insulinomas, los tumores endocrinos no funcionantes y los gastrinomas es similar, siendo de 2 a 8 veces más frecuentes que los VIPomas y de 17–30 veces más frecuentes que los glucagonomas5,6 (tabla 2).
Clasificación de los TNE según la Organización Mundial de la Salud (OMS)
| TNE bien diferenciado comportamiento benigno | TNE bien diferenciado comportamiento incierto | Carcinoma endocrino bien diferenciado con bajo grado de malignidad | Carcinoma endocrino bien diferenciado con alto grado de malignidad |
| Confinado al páncreas | Confinado al páncreas | Bien o moderadamente diferenciado | Carcinoma de cel. Pequeñas |
| < 2 cm | > 2 cm | Invasión local y/o MT | Necrosis |
| < 2 mitosis/ 10 HPF | > 2 mitosis | 2 – 10 mitosis | > 10 mitosis |
| < 2% cel. (+) Ki – 67 | >2% cel. (+) Ki – 67 | > 5% Ki – 67 | >15% Ki - 67 |
| Sin invasión vascular | Invasión vascular | Sin invasión vascular | Invasión vascular |
En esta tabla se muestra la eficia media de las diferentes pruebas de imagen en el diagnóstico de los insulinomas (de forma individual) y en general del resto de los TNE
| Estudio de imagen | Insulinomas (%) | Otros TEP (%) |
| Ecografía abdominal | 30 | 22 |
| TAC | 41 | 42 |
| RM | 40 | 45 |
| Arteriografía | 60 | 70 |
| Muestreo de la vena porta | 80 | 71 |
| Escintigrafía con octeótrido marcado | 54 | 70 |
| Ultrasonografía endoscópica | 91 | 90 |
| Ecografía intraoperatoria | 89 | 91 |
Más del 50% de los tumores funcionantes producen más de una hormona (hecho que se confirma cuando se realiza el estudio inmunohistoquímico de los mismos) aunque habitualmente solo un péptido es activo biológicamente y por tanto el causante de producir los síntomas si se secreta en cantidades suficientes5. Sin embargo, debido a la multitud de hormonas que pueden estar presentes en los tumores funcionantes es incluso difícil determinar mediante el estudio inmunohistoquímico qué hormona es clínicamente relevante. El diagnóstico debería realizarse mediante la clínica y la determinación en sangre periférica de la hormona. Incluso los tumores neuroendocrinos no funcionantes, los cuales representan un 15–30%, pueden sintetizar hormonas pero habitualmente en cantidades insuficientes como para producir síntomas o bien el propio tumor secreta péptidos que inhiben la acción de dichas hormonas7,8.
Dado que los tumores neuroendocrinos no funcionantes no cursan con síntomas relacionados con la secreción de hormonas, su diagnóstico suele ser accidental (incidentalomas) o por presentar síntomas inespecíficos dependientes de su crecimiento local o a distancia. Alrededor de 2/3 se localizan en la cabeza de páncreas y por consiguiente en su evolución pueden llegar a presentarse como un cuadro de ictericia obstructiva. El más frecuente de este grupo es el Ppoma (tumor secretor de polipéptido pancreático). Otro grupo son los tumores asociados a la neoplasia endocrina multiple (MEN). En general el tratamiento de estos tumores depende de su comportamiento benigno o maligno, siendo el pilar terapéutico la cirugía9.
Dentro de los tumores funcionantes, el insulinoma es el más frecuente10. Generalmente es un tumor con características de benignidad, que suele medir alrededor de 1 cm de diámetro, y que se caracteriza clínicamente por cuadros de hipoglucemia más hiperinsulinismo, siendo su tratamiento esencial el quirúrgico. El gastrinoma es el responsable de la gran hipergastrinemia del síndrome de Zollinger-Ellison. El dolor abdominal es el síntoma más común y el diagnóstico se basa en la hipergastrinemia más hiperclorhidria con aumento de la gastrina > 200pg/ml tras la estimulación con secretina. El somatostinoma es generalmente maligno y de gran tamaño por lo que la sintomatología es secundaria al crecimiento tumoral. El VIPoma provoca el síndrome de Verner-Morrison: diarrea hipersecretora, rubicundez facial, hipopotasemia y aclorhidria. El glucagonoma (tumor maligno habitualmente) se manifiesta con diabetes mellitus, tromboembolismo pulmonar y eritema necrolítico migratorio pruriginoso. El diagnóstico se confirma por el valor elevado de glucagón plasmático (>1.000pg/ml). El ACTHoma es de crecimiento rápido y precozmente presentan metástasis11.
Diagnóstico por imagenLa localización de los TNE es fundamental para la optimización del tratamiento, sin embargo con frecuencia constituye un problema por el pequeño tamaño de la mayoría de estas lesiones, lo que las hace difícilmente detectables por las técnicas de imagen convencionales (ecografía abdominal, TAC y RM). La sensibilidad diagnóstica de estas técnicas suele ser baja, pudiendo llegar a no ser identificadas entre un 40 y un 70%4. Sin embargo, en un trabajo publicado por Thoeni et al, sobre 28 pacientes con sospecha clínica de tumores de células de islotes, la sensibilidad diagnóstica en la localización de los tumores mediante la RM alcanzó 85%12.
Dado que los TNE son tumores hipervascularizados, la arteriografía podría ser de utilidad en su diagnóstico. Sin embargo los estudios muestran datos muy variables, con una sensibilidad que oscila del 17 al 55%8. La inyección intraarterial de sustancias específicas (secretina en los gastrinomas y calcio en los insulinomas) parece mejorar los resultados4.
Muchos TNE tienen altas concentraciones de receptores de somatostatina, lo que podría detectarse mediante análogos de la somatostatina (octeótrido) marcados radiactivamente (indio111), técnica conocida como escintigrafía con octeótrido marcado. Esta técnica es particularmente efectiva para visualizar gastrinomas, glucagonomas, tumores pancreáticos no funcionantes y tumores carcinoides; no mostrando la misma utilidad en el caso de los insulinomas. En algunas series, la sensibilidad para detectar el tumor primario alcanza el 58%, igualando a la sensibilidad alcanzada por la combinación de otras técnicas de imagen (TAC, RM y arteriografía). Sin embargo, la sensibilidad para la detección de metástasis parece ser mayor que para la localización del tumor primario y algunos estudios obtienen en este sentido mejores resultados que con las técnicas de imagen convencional. Una limitación de esta técnica es la dificultad para determinar el tamaño de las lesiones. La asociación de la escintigrafía con octeótrido con la tomografía por emisión de positrones parece aumentar la sensibilidad en la localización de estos tumores4,13.
Ultrasonografía endoscópica (USE)La USE aporta imágenes de alta resolución del parénquima pancreático por lo que puede distinguir lesiones de hasta 2–3mm de diámetro. Los TNE generalmente son tumores pequeños (fig. 1), de hecho los insulinomas suelen ser inferiores a 1cm, y solo los no secretantes o no funcionantes suelen ser voluminosos (más de 3cm). Las lesiones son hipo o isoecogénicas, estando bien delimitadas, pareciéndose a las adenopatías; cuando tengan aspecto quístico o irregular deberá establecerse el diagnóstico diferencial con los tumores mucinosos y con el adenocarcinoma14 (fig. 2).
Rosch et al evaluaron 37 casos con 39 TNE no detectados por ecografía abdominal o TAC, con un tamaño medio de 1,4cm. En esta serie, la USE alcanzó una precisión diagnóstica del 82% con una especificidad del 95%15. Anderson et al, realizaron un estudio amplio sobre 82 pacientes (91 exploraciones). 30 pacientes tenían un MEN tipo i. Se identificaron 100 tumores pancreáticos por USE en 54 pacientes diferentes. En los otros 28 pacientes no se detectó ningún tumor pancreático ni extrapancreático. Se obtuvo confirmación histológica quirúrgica en 75 pacientes. El tamaño medio de los tumores fue de 1,51cm y un 71% de los tumores fueron ≤2cm de diámetro. De las 54 exploraciones con confirmación histológica, la USE localizó el tumor en 50 pacientes (93%). Veintiún fueron insulinomas, 18 gastrinomas, un glucagonoma, un tumor carcinoide y un somatostinoma. La localización más frecuente de los tumores fue en cabeza de páncreas (46 pacientes). La mayoría de los tumores fueron hipoecogénicos, homogéneos y bien delimitados. La USE alcanzó una especificidad del 95% y fue más eficaz que la arteriografía con y sin test de estimulación, ecografía abdominal y que el TAC abdominal. Sin embargo, no fue eficaz en localizar tumores extrapancreáticos. Los autores concluyen que la USE se puede considerar como el método diagnóstico inicial de elección para la evaluación y manejo de pacientes con sospecha de TNE16. Palazzo et al realizaron un estudio retrospectivo sobre 13 pacientes con insulinomas y 15 pacientes con síndrome de Zollinger-Ellison. Del grupo de los insulinomas, el 78% fueron menores de 1,5cm de diámetro y la USE fue más eficaz (79%) que la ecografía convencional (7%) y que el TAC (14%). Sobre los gastrinomas, la USE detectó 7 de los 9 gastrinomas pancreáticos, 2 gastrinomas duodenales y 2 gastrinomas localizados en ganglios peripancreáticos. La ecografía y el TAC solo fueron capaces de localizar uno de los gastrinomas peripancreáticos17. Bansal et al concluyen que la USE además de ser muy altamente eficaz en la localización de los TNE, es más coste-efectiva si se realiza de forma precoz. En su estudio compararon los costes por TNE encontrado en un grupo de 36 pacientes estudiados solo por USE frente a otro grupo de 36 pacientes estudiados por arteriografía y métodos de laboratorio. Obtuvieron uno gasto por paciente de 2.620 dólares frente a 4.846 (p<0,05), mientras que si los costes se analizaban por tumor encontrado, también se observaba una relación favorable a la USE, 3.144 dólares frente a 5.628 (p<0,05)18. La USE, además de ser útil para la localización de los TNE, también aporta información fundamental sobre la extensión locorregional19. Kann et al analizaron las características diferenciales ecográficas de los TNE benignos de los malignos. Estudiaron 6 insulinomas benignos, 4 tumores neuroendocrinos en pacientes con MEN tipo i y 3 carcinomas neuroendocrinos malignos no metastáticos. El tamaño del tumor fue mayor en los tumores malignos. Ambos tumores presentaron una ecogenidad similiar (hipoecoica). Sin embargo, la heterogenicidad o estructura multinodular fue un criterio exclusivo de los tumores malignos. La presencia de áreas hiperecogénicas y la invasión vascular se consideraron como criterio de malignidad20. Uno de los últimos estudios, presentado por Alsohaibani et al, confirma a la USE como la mejor prueba en el diagnostico preoperatorio de los TNE (con una sensibilidad diagnóstica superior al TAC (100 vs 77%), llegando a modificar el posible tratamiento quirúrgico en un 36% de los pacientes21. Sin embargo, también otros estudios no consiguieron la misma eficacia, alcanzando una sensibilidad del 75% y una especificidad del 83%14. Recientemente ha sido publicada una revisión sistemática, en la que destaca la importancia de la USE en el diagnóstico y optimización del manejo de los TNE, confirmandose la USE como la prueba diagnóstica de mayor importancia en este contexto22.
A pesar de todos estos datos, no hay que olvidar que las pruebas de imagen convencionales siguen siendo decisivas para la detección de metástasis a distancia.
¿Qué aporta el desarrollo de la USE en los últimos años?La posibilidad de realizar PAAF mediante la USE aumenta la rentabilidad diagnóstica de forma sencilla y segura permitiendo obtener el diagnóstico cito-histológico de confirmación23 (fig. 3). En un estudio presentado por Ardengh et al24, la sensibilidad, especificidad y eficacia diagnóstica de la punción guiada por USE, en un grupo de 30 pacientes, fue del 83%, 86% y 83% respectivamente. Por su parte, Ginés et al25, demostraron un sensibilidad diagnóstica del 90% en 10 pacientes. Un estudio reciente, publicado por Jani et al26, muestras resultados similares. Chatzipantelis et al en un estudio reciente observaron que los hallazgos citológicos más frecuentes en los TNE son muestras muy celulares, homogéneas y con pobre adhesión entre las células de pequeño y mediano tamaño con cromatina granular y morfología plasmocitaria27.
El empleo de contrastes como el SHU-A (bolo de 4g) puede ayudar en el diagnóstico diferencial de lesiones tumorales pancreáticas. En estudio de Dietrich et al, que incluye 300 pacientes con lesiones pancreáticas estudiadas con USE y contrastes, incluyeron en el estudio 93 pacientes con lesiones pancreáticas indeterminadas, únicas, predominantemente sólidas de tamaño igual o inferior a 4cm. Después de la administración en bolo del contraste se comparó el patrón vascular de la lesión durante la fase arterial con la vascularización del parénquima pancreático sano. En 57 pacientes de 62 con adenocarcinoma ductal se objetivó una hipovascularización tras la administración del contraste. El resto de las lesiones mostraron un patrón isovascular o hipervascular (20 tumores neuroendocrinos, 10 adenomas microquísticos serosos y un teratoma). La hipovascularización tras el empleo del contraste significó un criterio de malignidad con una sensibilidad del 92% (82–97) y un especificidad del 100%28.
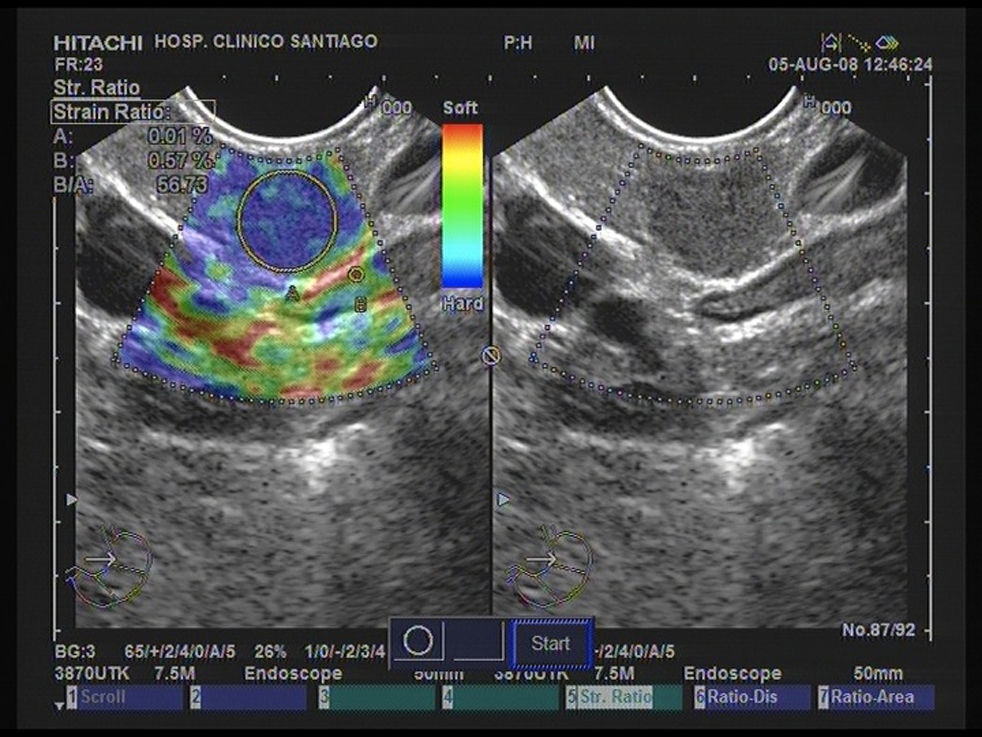
La elastografía es un nuevo desarrollo que utiliza la técnica de ultrasonido para proporcionar una estimación de la rigidez del tejido, midiendo el grado de distorsión en virtud de la aplicación de una fuerza externa. Esta técnica se está empleando ya para el diagnóstico diferencial de lesiones pancreáticas destacando en líneas generales la mayor dureza (patrón heterogéneo de predominio azul) de las lesiones tumorales frente a las lesiones inflamatorias (color verde). Destaca que los TNE malignos mediante el estudio elastrográfico muestran un patrón homogeneo azul29 (fig. 4). En la actualidad se puede realizar un estudio elastográfico cuantitativo, mostrando los TNE los valores más altos en el coeficiente de elasticidad30 (fig. 5).
Los TNE son tumores raros que causan síndromes clínicos debido a la secreción excesiva de hormonas gastrointestinales específicas. Los dos tumores más frecuentes son los insulinomas y los gastrinomas. En el manejo de estos pacientes, se recomienda iniciar el estudio realizando un TAC y una ecografía abdominal, sabiendo que ambas presentan una sensibilidad baja, siendo especialmente útiles en la detección de metástasis a distancia. La arteriografía y la escintigrafia con octeotrido marcado son pruebas de segunda elección con resultados contradictorios8.
Sin embargo, la USE ha surgido recientemente como una técnica segura, muy sensible y coste-efectiva para la localización preoperatoria de estos tumores lo cual es tremendamente útil, sobre todo para los de pequeño tamaño que mediante otras técnicas de imagen sería imposible su localización. Además, la posibilidad de realizar PAAF guiada por USE aumenta la sensibilidad de esta exploración y puede ser especialmente útil en los tumores no funcionantes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.