Los fármacos biológicos han revolucionado el tratamiento de la enfermedad inflamatoria intestinal (EII) en la última década. Tras la introducción del infliximab (IFX) en el tratamiento de la enfermedad de Crohn (EC), el Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) publicó unas primeras recomendaciones de uso en 20021. Los cambios se sucedieron tan rápido, que fue preciso actualizarlas en 20052 y completarlas con una guía específica para la prevención de la tuberculosis (TBC), que también fue actualizada3,4. Posteriormente se publicó una guía rápida de actuación al inicio del tratamiento con adalimumab (ADA)5. El uso de estos agentes en la EII ha variado considerablemente, tanto por la ampliación de sus indicaciones6 (aprobándose el uso de ADA en la EC en 2007, el de IFX en la colitis ulcerosa [CU] en 2009 y el del ADA en la CU en 2012), como por la disponibilidad de nuevos datos sobre eficacia y seguridad a largo plazo que han permitido la modificación de algunas estrategias de tratamiento. Además, en Estados Unidos y Suiza se aprobó el uso de certolizumab en la EC, y cada vez se recurre con más frecuencia al uso compasivo de natalizumab y ustekinumab en la enfermedad de Crohn resistente7,8. La acumulación constante de información ha llevado a la publicación de numerosos consensos y recomendaciones en otros países9–14. Conscientes de la necesidad de actualizar las recomendaciones, además de adaptarlas a las particularidades de nuestro país, GETECCU ha considerado necesario llevar a cabo este nuevo documento de consenso, que cumple con nuestro compromiso de actualización periódica.
El documento ha sido elaborado por un grupo de miembros del GETECCU en distintas fases, que han incluido su discusión libre durante varios meses. Se ha puesto especial énfasis en aportar los conocimientos más actuales sobre las indicaciones, estrategias terapéuticas y seguridad de estos fármacos, desde una perspectiva científica, con el objetivo de proporcionar un documento útil, aplicable a las necesidades de la práctica clínica en el año 2013.
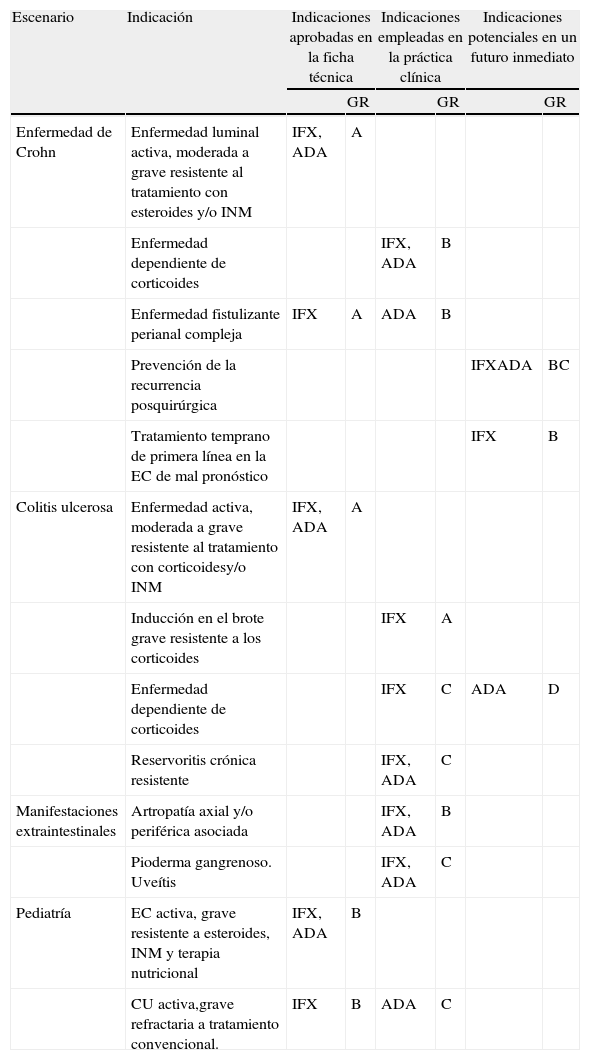
Indicaciones (tabla 1)Enfermedad de CrohnInducción y mantenimiento de la remisión en la enfermedad luminal resistenteEstudios prospectivos controlados con placebo específicamente diseñados y metaanálisis de los mismos, así como estudios observacionales de adecuada calidad, confirman como principal indicación para el empleo de agentes antifactor de necrosis tumoral (TNF) en la EC, la inducción de la remisión de la enfermedad luminal activa de moderada a grave, resistente o con intolerancia al tratamiento convencional con corticoides y/o inmunomoduladores (INM) y el mantenimiento de la remisión en aquellos pacientes que han respondido a la inducción, con eficacia confirmada y seguridad razonable al menos durante un año de tratamiento15–20. A más largo plazo disponemos de estudios abiertos y datos de práctica clínica21–23. El ADA ha mostrado ser eficaz para mantener la remisión más de 2 años en pacientes con respuesta inicial al mismo24 y el IFX presenta un buen perfil de eficacia a largo plazo en estudios de cohortes25. Al plantear un tratamiento a largo plazo, deben evaluarse los posibles riesgos y beneficios de forma individualizada. En caso de pérdida de respuesta o intolerancia a un fármaco puede indicarse un segundo anti-TNF26,27, si bien la disponibilidad de tan solo 2 fármacos anti-TNF aprobados para la EII y la menor eficacia de un segundo anti-TNF13,18,26 hacen preferible la intensificación del tratamiento (aumento de dosis o acortamiento del periodo de administración) que el cambio de fármaco, al menos ante la pérdida de respuesta.
Indicaciones de tratamiento con agentes antifactor de necrosis tumoral α en la enfermedad inflamatoria intestinal
| Escenario | Indicación | Indicaciones aprobadas en la ficha técnica | Indicaciones empleadas en la práctica clínica | Indicaciones potenciales en un futuro inmediato | |||
| GR | GR | GR | |||||
| Enfermedad de Crohn | Enfermedad luminal activa, moderada a grave resistente al tratamiento con esteroides y/o INM | IFX, ADA | A | ||||
| Enfermedad dependiente de corticoides | IFX, ADA | B | |||||
| Enfermedad fistulizante perianal compleja | IFX | A | ADA | B | |||
| Prevención de la recurrencia posquirúrgica | IFXADA | BC | |||||
| Tratamiento temprano de primera línea en la EC de mal pronóstico | IFX | B | |||||
| Colitis ulcerosa | Enfermedad activa, moderada a grave resistente al tratamiento con corticoidesy/o INM | IFX, ADA | A | ||||
| Inducción en el brote grave resistente a los corticoides | IFX | A | |||||
| Enfermedad dependiente de corticoides | IFX | C | ADA | D | |||
| Reservoritis crónica resistente | IFX, ADA | C | |||||
| Manifestaciones extraintestinales | Artropatía axial y/o periférica asociada | IFX, ADA | B | ||||
| Pioderma gangrenoso. Uveítis | IFX, ADA | C | |||||
| Pediatría | EC activa, grave resistente a esteroides, INM y terapia nutricional | IFX, ADA | B | ||||
| CU activa,grave refractaria a tratamiento convencional. | IFX | B | ADA | C | |||
ADA: adalimumab; IFX: infliximab; INM: inmunomoduladores.
Grado de recomendación (GR): A = claramente recomendable; B = recomendación favorable; C = recomendación favorable pero no concluyente; D = ni se recomienda ni se desaprueba.
Esta indicación supone el empleo de los agentes anti-TNF en tercera línea, tras el fracaso de corticoides e INM, pero también se está planteando su uso como tratamiento inicial en la EC con factores predictivos de mal pronóstico. En un reciente ensayo controlado abierto en 133 pacientes con EC moderada-grave de menos de 4 años de evolución y que no habían recibido tratamiento con corticoides o INM, la introducción precoz del tratamiento con azatioprina asociada a IFX como inducción (estrategia «top-down») se mostró superior en términos de remisión libre de esteroides y de cirugía a los 6 y 12 meses respecto a la estrategia convencional de tratamiento con corticoides, empleando azatioprina en caso de resistencia o dependencia de los mismos (estrategia «step-up»)28. Por otra parte, la tasa de cicatrización mucosa fue superior en los pacientes con inmunosupresión precoz y la cicatrización mucosa influyó favorablemente en la remisión mantenida a 4 años29. Un subanálisis del estudio CHARM mostró una tendencia favorable a una mayor probabilidad de remisión clínica en los pacientes tratados con ADA con una enfermedad menos evolucionada30. Otros estudios también señalan mejores resultados si se utilizan en una fase más temprana de la enfermedad31,32.
En general, el empleo más temprano de un tratamiento, no solo de los agentes anti-TNF, conlleva unos resultados más favorables; pero no puede realizarse una recomendación de forma generalizada, porque se «sobretrataría» a muchos pacientes. Se han señalado algunos factores clínicos que se asocian a un curso más agresivo de la EC, y que pudieran ser de ayuda en este sentido (una edad joven al diagnóstico, la necesidad precoz de corticoides, el comportamiento fistulizante o la enfermedad perianal); no obstante, algunos de ellos ya traducen una enfermedad evolucionada33–36. Por otro lado, la pérdida de respuesta a medio plazo de los agentes anti-TNF puede suponer una limitación para la introducción del tratamiento de forma inicial. Además está aún por confirmar si la utilización temprana de anti-TNF en estos casos sería capaz de limitar la progresión de la enfermedad. Así, hoy en día lo más recomendable, en la mayoría de los casos, sería emplear un tratamiento convencional, secuencial con plazos de tiempo bien prefijados en función del curso evolutivo de la enfermedad para introducir el tratamiento inmunomodulador-biológico sin demora, lo que ha sido denominado como estrategia «step-up acelerada».
Enfermedad de Crohn dependiente de corticoidesExisten muy pocos estudios controlados que hayan evaluado el efecto de los agentes anti-TNF en la EC dependiente de corticoides. Un único estudio francés, controlado con placebo y a doble ciego, demostró que la remisión libre de corticoides en la semana 24 era significativamente superior si al tratamiento con azatioprina se añadían 3 infusiones de IFX (57 vs 29%; p = 0,003), siendo esto especialmente favorable en el subgrupo de individuos naïve a azatioprina37. En este subgrupo, la rapidez de respuesta de la terapia anti-TNF permite su utilización como tratamiento «puente» con el fin de ahorrar esteroides hasta la aparición de la respuesta de los INM, o para evitar recaídas en dicho periodo37,38. No obstante, en los pacientes respondedores a la inducción, la retirada del biológico se sigue de un progresivo incremento de las recaídas con el tiempo, y esta estrategia es menos eficaz que el mantenimiento programado del agente anti-TNF por tiempo más prolongado39.
Su papel sobre la reducción de las necesidades de corticoides puede extrapolarse principalmente de los estudios ACCENT-I y ACT1 y 2 para IFX17,40 y CHARM para ADA18. Aunque no disponemos de estudios específicos, los datos de estos trabajos y de estudios observacionales señalan la eficacia clínica de los anti-TNF en el mantenimiento de la remisión libre de esteroides en EC dependiente de corticoides con fracaso previo de INM, constituyendo en la actualidad una de sus principales indicaciones en la práctica clínica9.
Complicaciones fistulizantes (fístulas perianales, rectovaginales y enterocutáneas)La inducción y el mantenimiento de la remisión de las complicaciones fistulizantes de la EC (fístulas perianales, enterocutáneas y rectovaginales) constituye otra firme indicación del tratamiento anti-TNF41–44. Las fístulas perianales simples no son, en general, indicación de tratamiento anti-TNF dada la buena respuesta al tratamiento con antibióticos, INM o cirugía local. En la enfermedad perianal compleja el tratamiento anti-TNF puede considerarse una opción de primera línea. Previo al inicio del tratamiento deben drenarse los abscesos y las cavidades sépticas si existieran10,13,14. El empleo de sedales laxos de drenaje y el tratamiento antibiótico asociado mejoran los resultados45–49. En pacientes con remisión clínica mantenida solo debiera plantearse la retirada del fármaco biológico ante la resolución de la enfermedad perianal en prueba de imagen (preferiblemente RM pélvica), dada la persistencia de trayectos fistulosos activos aún en pacientes sin evidencia de enfermedad activa a la inspección50–54. En este sentido se ha constatado la eficacia a largo plazo de este tratamiento con respuesta mantenida incluso a 3 años43. La inyección local de IFX en las fístulas perianales se ha utilizado en casos aislados55,56.
Los agentes anti-TNF también pueden utilizarse en las fístulas enterocutáneas y rectovaginales57,58, pero su eficacia es más limitada en este tipo de fístulas que, por otro lado, están representadas en número escaso en los estudios controlados42,43. La experiencia en fístulas enteroentéricas es muy reducida y, en el caso de las fístulas enterovesicales, solo disponemos de descripciones aisladas con IFX, con resultados limitados59,60, por lo que el tratamiento quirúrgico sigue siendo de elección y solo debería optarse por el tratamiento médico es casos individualizados.
Prevención de la recurrencia posquirúrgicaEl papel de IFX en la prevención de la recurrencia posquirúrgica de la EC mostrado en los primeros estudios observacionales61,62 se ha visto avalado por 2 recientes estudios controlados frente a placebo que, aunque con reducido número de pacientes, señalan una elevada eficacia de IFX en esta indicación63,64. También existen algunos datos preliminares que señalan la utilidad de ADA en este escenario65–67. La azatioprina asociada a metronidazol ha demostrado prevenir la recurrencia hasta en el 50% de los pacientes de alto riesgo en 2 estudios controlados68,69, por lo que, a falta de datos comparativos con estrategias como esta, es probable que el uso de anti-TNF deba limitarse, por el momento, a pacientes seleccionados por su gravedad previa o por intolerancia o fracaso de tiopurínicos en la misma indicación10,14.
Colitis ulcerosaInducción y mantenimiento de la remisión en la colitis ulcerosa resistente al tratamiento convencionalLa principal indicación de los fármacos anti-TNF en la CU la constituye la enfermedad activa de moderada a grave resistente a los corticoides y/o INM. Dos revisiones sistemáticas concluyen que IFX es más eficaz que el placebo en inducir la remisión y respuesta clínica tanto a corto como a largo plazo, en obtener la cicatrización mucosa y en disminuir la necesidad de colectomía a corto plazo70,71. Los ensayos controlados ACT40 muestran la eficacia de IFX en la inducción y el mantenimiento de la remisión clínica durante un año. El IFX también muestra un efecto favorable sobre la colectomía72, con una reducción del riesgo absoluto de colectomía al año de tratamiento de un 7% con respecto al placebo73. El ADA, en dosis de 160/80mg por vía s.c., es eficaz en inducir la remisión a las 8 semanas, en este mismo escenario en pacientes naïve a anti-TNF, como apunta un reciente ensayo controlado con diseño similar a los estudios ACT74. En cuanto al mantenimiento de la remisión, estudios controlados75,76 y algunos estudios observacionales77–80 indican que la remisión clínica obtenida con ADA se mantiene a largo plazo tanto en pacientes naïve a IFX como tras fracaso o intolerancia al mismo.
Colitis ulcerosa activa grave resistente a los corticoidesUn ensayo controlado y a doble ciego evidenció la eficacia de una única dosis de IFX para inducir la remisión en los pacientes con CU activa grave resistente a los corticoides intravenosos, reduciendo la necesidad de colectomía a los 3 meses81. Este beneficio se mantuvo a los 3 años en un estudio de seguimiento posterior82. No existe consenso sobre cuál debe ser el tratamiento de mantenimiento tras la inducción de la remisión con IFX en el brote grave resistente a los corticoides. El mantenimiento periódico con IFX puede ser una opción especialmente tras la falta de eficacia o los efectos adversos de la azatioprina, pudiendo emplearse los INM tiopurínicos si el paciente no ha sido previamente tratado con ellos. A este respecto no conocemos datos procedentes de estudios específicamente diseñados.
Un reciente estudio controlado abierto que evalúa la eficacia ciclosporina (CsA) versus IFX en este escenario (estudio CYSIF) ha mostrado tasas similares de fracaso al tratamiento tanto a los 7 días como a los 3 meses para ambos fármacos83. Por tanto, la elección de uno u otro deberá realizarse en función de las características del paciente, la experiencia del equipo médico o la disponibilidad de medios en cada centro. En este sentido, la presencia de fracaso previo al tratamiento INM puede ser, en la práctica, un factor determinante para el empleo de IFX. Asimismo, existen algunas series no controladas que señalan que en pacientes seleccionados puede plantearse el tratamiento secuencial (fundamentalmente CsA en primer lugar e IFX de rescate) en la CU resistente a corticoides, pero debe considerarse siempre el elevado riesgo de complicaciones infecciosas a la que se asocia esta estrategia terapéutica84–87. Debe recordarse que la colectomía constituye una alternativa en la CU resistente a corticoides.
La eficacia de ADA en la CU grave resistente a corticoides no ha sido evaluada y no está aún establecida.
Colitis ulcerosa dependiente de corticoidesEn la CU dependiente de corticoides, las tiopurinas siguen siendo el tratamiento de elección11, sin embargo, en más del 40% de los pacientes no se logra retirar los corticoides y hasta otro 20% tienen que abandonar el tratamiento como consecuencia de los efectos adversos. Por todo ello, los agentes anti-TNF constituyen una alternativa razonable en este tipo de pacientes. Aunque no existen estudios controlados específicos en CU dependiente de corticoides, los datos procedentes de los ensayos controlados40,76 y de series observacionales80,88,89, revelan la capacidad de ahorro de esteroides de estos fármacos y su eficacia en la dependencia de corticoides, especialmente tras el fracaso o la intolerancia a INM tiopurínicos.
Al igual que en las anteriores indicaciones, antes de iniciar tratamiento anti-TNF, debiera valorarse la opción de colectomía.
Reservoritis crónica resistenteLa reservoritis crónica resistente al tratamiento antibiótico constituye un proceso de difícil manejo. La evidencia clínica de la eficacia de los agentes anti-TNF en esta indicación es limitada. En estudios abiertos y series de casos, tanto IFX como ADA se han mostrado eficaces en pacientes seleccionados incluso tras el fracaso de otras opciones, como budesonida oral o azatioprina12,90–92. El tratamiento anti-TNF se podría considerar en casos resistentes al tratamiento convencional antes de recurrir a la excisión quirúrgica del reservorio14.
Otras situacionesManifestaciones extraintestinalesExiste evidencia firme para considerar a IFX y ADA como tratamientos de primera línea en la espondilitis anquilosante93,94. En función de estudios abiertos, los agentes anti-TNF se consideran eficaces en la artropatía axial y en la artropatía periférica asociadas a EII que no responden al tratamiento convencional (salazopirina, corticoides o inmunosupresores)95,96. Algún estudio controlado de pequeño tamaño muestral y series de casos indican que los fármacos anti-TNF pueden ser eficaces en el pioderma gangrenoso, limitando su progresión, y en la uveítis resistente97–101.
Edad pediátricaDe forma similar a los adultos, aunque con un menor nivel de evidencia, en la EII pediátrica los fármacos anti-TNF son eficaces en inducir y mantener la remisión de la enfermedad moderada o grave resistente al tratamiento convencional102. Con la IFX existen datos controlados tanto en EC como en CU103,104. Se ha descrito la eficacia de ADA en series de casos, generalmente tras fracaso o intolerancia a IFX, y recientemente en un estudio controlado doble ciego en EC pediátrica105. Los agentes anti-TNF tienen un efecto beneficioso sobre el crecimiento y el desarrollo puberal, probablemente al permitir obtener y mantener la remisión de la actividad inflamatoria sin necesidad de esteroides102.
Pautas de tratamiento con agentes antifactor de necrosis tumoral α antifactor de necrosis tumoralLos objetivos del tratamiento en la EII son, por un lado, la obtención de la remisión en la enfermedad activa, tanto desde el punto de vista sintomático, como biológico e idealmente endoscópico y, por otro, el mantenimiento de la remisión a largo plazo.
Los esteroides, si bien permiten obtener la remisión clínica, son de eficacia limitada respecto a la remisión endoscópica y no son eficaces para el mantenimiento. Solamente uno de cada 4 pacientes tratados con esteroides que alcanzan la remisión clínica se mantienen en remisión al cabo del año106–108. La toxicidad asociada a estos fármacos es frecuente y diversa, destacando la elevada tasa de infecciones109,110, lo que hace recomendable un uso ponderado de los mismos, evitando cursos largos o repetidos.
La terapia biológica con anti-TNF presenta 2 características especialmente atractivas para su empleo en la EII: a) rapidez de acción en la inducción de la remisión clínica, y b) eficacia en el mantenimiento de la remisión inducida por el propio fármaco. La eficacia y el perfil de seguridad de los 2 agentes anti-TNF aprobados en España es similar, por lo que la elección depende de la preferencia del paciente, la disponibilidad, el coste y las recomendaciones de las guías nacionales9,13.
Pautas de inducciónInfliximabEn el ensayo clínico de Targan et al.15, una única perfusión de IFX obtuvo una tasa de respuesta significativamente superior al placebo en la EC moderada-grave y resistente a los aminosalicilatos (5-ASA), corticoides y/o inmunosupresores. Posteriormente el estudio ACCENT-I mostró una tasa de respuesta clínica a la semana 8 superior en los pacientes que habían recibido 3 dosis de 5mg/kg en las semanas 0, 2 y 6 frente a aquellos que recibieron una dosis única17. En una cohorte amplia de la Universidad de Lovaina se alcanzó la respuesta clínica, definida mediante la evaluación del clínico, en el 89% de los pacientes utilizando la pauta de inducción con 3 infusiones en 6 semanas25. En la EC perianal solo se ha evaluado la pauta de inducción con 3 infusiones de IFX41.
La pauta de inducción con 3 dosis es la misma para la CU. El estudio ACT1 incluyó 364 pacientes con enfermedad moderadamente activa y resistente a corticoides y/o tiopurinas, mostrando, con esta pauta, unas tasas de respuesta clínica superiores al 60%, de remisión clínica superiores al 30% y cicatrización de la mucosa superiores al 60% con IFX, con diferencias significativas respecto al placebo, manteniéndose la duración del efecto hasta la semana 54. Lo mismo ocurrió con el ensayo ACT2, realizado sobre un número idéntico de pacientes con CU moderadamente activa y resistente a los mismos fármacos que el ACT 1 o también a aminosalicilatos. La duración del estudio fue de 6 meses, con tasas de respuesta y remisión superponibles al ACT140.
AdalimumabEn el estudio CLASSIC-I se incluyeron pacientes con EC activa naïve a IFX. Se comparó placebo frente a diferentes dosis de ADA (40/20, 80/40 y 160/80), alcanzándose una tasa de remisión clínica significativamente superior respecto a placebo únicamente en los pacientes tratados con 160mg seguidos de 80mg 2 semanas más tarde16. En el estudio GAIN se evaluó la eficacia de ADA, como anti-TNF de segunda línea, en pacientes con EC activa y pérdida de respuesta o intolerancia a IFX. La remisión clínica con la pauta de inducción de 160/80mg fue significativamente superior al placebo, aunque con una tasa inferior a la alcanzada en el CLASSIC-I, lo cual señala que la pérdida de respuesta a un primer anti-TNF podría condicionar la respuesta al segundo26.
En un ensayo clínico en CU resistente, moderada o grave se obtuvo una tasa de remisión del 18,5% con la dosis de inducción de 160/80 mg. Con dosis inferiores (80/40 mg) no se demostraron diferencias con placebo74. Estos resultados se han reproducido recientemente en otro ensayo clínico76. Las dosis y pautas de tratamiento recomendadas son las mismas que en la EC.
Pautas de mantenimientoEl tratamiento con anti-TNF no consigue respuesta clínica alguna tras la pauta de inducción en el 20-40% de los pacientes tratados con EC y en el 30-40% de los pacientes con CU, fenómeno que se conoce como fallo primario o falta de respuesta primaria111. En general, el periodo que se debe considerar para establecer el fallo primario del tratamiento en la enfermedad luminal suele estar entre 8 y 12 semanas desde su inicio, por lo que para IFX se valoraría tras la administración de 3 dosis y para ADA tras 5 dosis del fármaco13. La falta de respuesta primaria a un primer anti-TNF implica la necesidad de retirar este fármaco dada la baja probabilidad de obtener respuesta clínica en caso de seguir con el mismo. Por otra parte, el fallo primario suele asociarse a una menor probabilidad de respuesta a un segundo anti-TNF26,111, si bien no todos los estudios coinciden en este extremo112. Probablemente, en la enfermedad perianal no deba evaluarse la respuesta de la misma forma que en la enfermedad luminal, ya que la exploración física no parece ser suficiente y la rapidez para alcanzar la máxima respuesta podría ser distinta y podría depender de factores adicionales como la complejidad y número de fístulas o la asociación a tratamiento antibiótico o a cirugía local (incluida la colocación de sedales).
La opción más recomendable tras la respuesta inicial a un agente anti-TNF es su mantenimiento al menos durante un año. La duración del tratamiento no está establecida y puede valorarse su retirada si se cumplen los factores predictivos favorables que se mencionan con posterioridad. También deben tenerse en consideración factores como el curso previo de la enfermedad y los tratamientos recibidos; la localización, extensión y grado de afectación de las lesiones; los costes económicos y las preferencias del paciente tras una información adecuada.
InfliximabEl mayor estudio controlado para valorar el mantenimiento de la remisión con IFX en EC17 demostró que IFX a dosis de 5 o 10mg/kg administradas cada 8 semanas fue significativamente superior al tratamiento «a demanda» (con administración de IFX solo en las ocasiones en que el paciente presentaba recidiva clínica) tras un año de tratamiento, pero sin diferencias entre ambas dosificaciones. Por otro lado, los pacientes que siguieron tratamiento de mantenimiento mostraron mayores tasas de cicatrización de la mucosa113, menos hospitalizaciones, menores requerimientos quirúrgicos20,114, una mejor calidad de vida115, así como una tasa menor de anticuerpos antiinfliximab (ATI) con el tratamiento de mantenimiento frente al episódico116–118. Previamente, Rutgeerts et al.119 habían comunicado la eficacia superior del mantenimiento con 10mg/kg cada 8 semanas frente al placebo. En la EC perianal, en el único estudio controlado de mantenimiento con IFX, la administración cada 8 semanas fue también superior al tratamiento «a demanda» tras un año de tratamiento, pero sin diferencias entre la dosificación de 5 o 10mg/kg42.
En los estudios ACT, en CU, las tasas de remisión con una pauta de administración cada 8 semanas son superiores al 30% a los 6 y 12 meses, tanto con 5 como con 10mg/kg y alrededor del doble de las obtenidas con placebo40. Recientemente se han publicado los resultados del estudio de extensión de los estudios ACT 1 y 2, describiéndose tasas de retirada de IFX del 30% a los 3 años (10% por efectos adversos, 4,8% por pérdida de eficacia, 0,4% necesidad de colectomía y 15% por otras razones). Los autores concluyen que el tratamiento con IFX por encima de los 3 años fue efectivo y bien tolerado120.
En función de los estudios ACCENT y ACT, se recomienda la administración de IFX en dosis de 5mg/kg de peso cada 8 semanas si se pretende mantener la respuesta inicial obtenida con el este fármaco.
AdalimumabEl estudio CHARM18 valoró la utilidad de ADA como tratamiento de mantenimiento en la EC luminal con actividad moderada o grave y resistente al tratamiento convencional, incluido IFX y con respuesta a una pauta inicial de 80/40mg de ADA. Los pacientes fueron aleatorizados a recibir 40mg de ADA cada 2 semanas, cada semana o placebo. Las tasas de remisión en las semanas 26 y 56 fueron significativamente mayores en los grupos tratados con ADA, sin diferencias entre las 2 pautas. La respuesta no varió según existiese uso previo de IFX.
En el estudio CLASSIC-II, ADA también resultó superior al placebo para el mantenimiento de la remisión clínica hasta la semana 54 y no existieron diferencias significativas entre la administración de 40mg de forma semanal o quincenal121. Por tanto, a tenor de los resultados expuestos, inicialmente es recomendable la utilización de dosis de 40mg administradas cada 2 semanas para el mantenimiento de la remisión inducida por ADA, independientemente de si el paciente ha sido tratado previamente con IFX.
Pérdida de respuestaEl empeoramiento clínico después de haberse constatado una respuesta inicial al tratamiento con un agente biológico es lo que se conoce como fallo secundario o pérdida de respuesta (PR), a diferencia del fallo primario en el que los pacientes no responden inicialmente al tratamiento de inducción. La PR afecta al 30-40% de los pacientes durante el primer año de tratamiento17,18,21. Dos revisiones sistemáticas han concluido que la PR no es un fenómeno infrecuente, estimándose el riesgo en un 13% por paciente-año para IFX122 y en un 20% para ADA123.
Ante esta situación primeramente deben descartarse complicaciones de la propia enfermedad (sobre todo infecciosas). La verdadera PR al fármaco puede estar en relación con la inmunogenicidad, problemas de aclaramiento o mecanismos de escape biológico124. La presencia de anticuerpos contra el fármaco (ACF) se ha relacionado con el descenso de los niveles séricos de IFX y con una duración menor de la respuesta117,118,125. La probabilidad de desarrollar ACF es mayor con el tratamiento episódico que con el programado25,125 y también en aquellos pacientes sin tratamiento concomitante con INM126.
Con ADA ocurre algo similar, es decir, la PR también se ha asociado a menores concentraciones del fármaco, atribuidas a la presencia de ACF127. La estimación del riesgo anual de pérdida de respuesta a ADA por paciente y año parece ser mayor en los individuos expuestos previamente a IFX respecto a los no expuestos (22 frente a 8%)128. Además de los factores predictivos de PR ya mencionados, se han descrito el tabaquismo, la historia familiar de EII, la localización cólica, las manifestaciones extraintestinales, la pauta de inducción con dosis 80/40, la duración prolongada de la enfermedad y el uso simultáneo de corticoides como otros factores potencialmente asociados a una mayor probabilidad de PR123.
Ante la pérdida de respuesta se contemplan 2 opciones: la «intensificación» del tratamiento (el aumento de la dosis o la reducción del intervalo entre las administraciones del fármaco) y el cambio de biológico.
En los pacientes tratados con 5mg/kg de IFX que presentan PR se ha comunicado la restauración de respuesta en el 56-77% tras el incremento de la dosis a 10mg/kg17 y en el 40-69% de los que acortaron el intervalo entre las administraciones21,25, sin hallarse diferencias significativas entre ambas estrategias129,130. Por tanto, ambas estrategias (acortamiento del intervalo y aumento de la dosis) parecen igualmente válidas en pacientes tratados con IFX y PR. En opinión de algunos autores, ante la reaparición o empeoramiento de la sintomatología antes de la siguiente administración parece recomendable el acortamiento del intervalo, mientras que cuando se aprecia una respuesta incompleta lo adecuado sería incrementar la dosis131.
En una revisión sistemática de 39 estudios con ADA, la intensificación del tratamiento consiguió tasas de respuesta y remisión al año de 71 y 40%, respectivamente123. En caso de disminución o respuesta subóptima a ADA se recomienda el acortamiento del intervalo a una pauta semanal131.
Se está planteando la posibilidad de «desintensificar» o reducir de nuevo la dosis incrementada del biológico en aquellos pacientes que han alcanzado una remisión mantenida con la «intensificación». Sin embargo, aún carecemos de evidencia suficiente para marcar la pauta de actuación en este sentido y algunos datos comunicados hasta la fecha muestran una pérdida de respuesta elevada tras la «desintensificación»132.
Respecto al cambio de agente anti-TNF, los datos son mucho más escasos y en su mayoría empleando IFX como primer fármaco y ADA como segundo. La tasa de respuesta obtenida con ADA ante el fallo de respuesta a IFX se ha situado en el 77%, con un 64% de beneficio clínico sostenido133. En este mismo trabajo los autores hallaron que el 44% de los pacientes con fallo primario a IFX responden a ADA. También disponemos de algunos datos del cambio inverso, es decir, el cambio a IFX tras pérdida de respuesta a ADA. En el estudio de Chaparro et al.134, que incluyó 15 pacientes (5 por pérdida de respuesta, 3 por efectos adversos y 7 por ausencia de respuesta primaria), IFX fue útil en todos los pacientes que lo recibieron por efectos adversos o por PR, mientras que no lo fue en ninguno de los pacientes con fallo primario a ADA. Parece razonable valorar el cambio de anti-TNF ante la falta de eficacia de la intensificación o en caso de intolerancia131.
Una posible optimización terapéutica pasaría por la determinación de niveles «valle» del fármaco y, en caso de niveles indetectables, cuantificar los anticuerpos contra el fármaco (ACF). Ante niveles indetectables con ACF negativos se recomendaría la intensificación del tratamiento. El mismo escenario con ACF positivos a títulos elevados nos podría conducir a iniciar tratamiento INM si no se utilizaba previamente, pero la opción más adecuada es el cambio de anti-TNF. No solo la presencia, sino también los niveles de ACF, pudieran condicionar la actitud a seguir, dado que en caso de ACF positivos a título bajo, la intensificación puede ser eficaz en un porcentaje importante de casos135,136. No obstante, en los estudios actuales aún existen discrepancias, pendientes de resolver, entre la respuesta a la intensificación y los niveles del fármaco127,137.
Duración del tratamientoSe ha planteado la posibilidad de suspender el tratamiento anti-TNF en aquellos pacientes que presentan una remisión clínica y biológica mantenida. En los trabajos publicados hasta ahora (prácticamente todos con IFX) los resultados han sido discrepantes. Es importante considerar que de los pacientes que suspenden IFX manteniendo el tratamiento INM, el 88% responden con la reintroducción en caso de presentarse una recidiva clínica138. Además, si la inducción se ha realizado con 3 dosis, la reintroducción del tratamiento tras su retirada no se acompaña de una mayor tasa de reacciones infusionales asociadas139. Por tanto, es posible suspender el tratamiento anti-TNF en algunos pacientes, aunque deberíamos realizar una selección adecuada de los casos. La situación de bajo riesgo de recidiva (riesgo de un 15% de recaída durante un año) tras retirar de la terapia combinada IFX manteniendo la azatioprina vendría definida por la presencia de no más de 2 factores de los indicados a continuación: sexo masculino, ausencia de resección quirúrgica previa, cifra de leucocitos > 6 × 109/l, Hb ≤ 14,5g/dl, PCR ≥ 5mg/l, calprotectina fecal ≥ 300μg/g)138.
En cualquier caso, antes de suspender el tratamiento recomendamos confirmar la remisión tanto clínica como biológica y endoscópica de la enfermedad.
Tratamiento concomitante con inmunomoduladoresUno de los aspectos más debatidos sobre el tratamiento con anti-TNF en la EII ha sido la administración concomitante de INM, también denominada tratamiento combinado. En comparación a la monoterapia con anti-TNF, el tratamiento combinado podría ofrecer como beneficios potenciales: a) incremento de la eficacia clínica, y b) reducción de la inmunogenicidad de los anti-TNF y, por tanto, mejorar el rendimiento a largo plazo del fármaco y reducir las necesidades de intensificación. Por contra, el tratamiento combinado podría conllevar un incremento en el riesgo de efectos adversos (especialmente infecciones y neoplasias). Consecuentemente, debe plantearse si el tratamiento combinado ofrece beneficios reales sobre la monoterapia con anti-TNF y, si es así, durante cuánto tiempo se mantienen estos beneficios.
Tratamiento combinado y eficacia clínicaDurante casi una década, el debate acerca de si el tratamiento combinado aumentaba la eficacia clínica de la monoterapia se basó en análisis post hoc de estudios controlados y series retrospectivas, con resultados controvertidos1,140,141. Recientemente disponemos de los resultados de 2 estudios prospectivos, controlados, aleatorios y a doble ciego, cuyo objetivo primario fue evaluar la eficacia de IFX asociado a tiopurinas en comparación a cualquiera de los 2 fármacos en monoterapia. En el primer estudio, se incluyeron 508 pacientes con EC activa, todos ellos naïve para IFX e INM, y se aleatorizaron para recibir una pauta habitual de inducción y mantenimiento de IFX, tiopurinas a razón de 2,5mg/kg de peso y día, o ambos fármacos, durante un periodo de 30 semanas142. La proporción de pacientes en remisión clínica libre de esteroides a las 26 semanas fue del 57% en el grupo de tratamiento combinado por 44% en el grupo de IFX en monoterapia (p = 0,02). Estos resultados no variaron cuando se evaluaron al año de la inclusión. En cuanto a la proporción de pacientes con curación mucosa a las 26 semanas (evaluada como la ausencia de úlceras en la ileocolonoscopia), si bien existió una clara tendencia también a favor del tratamiento combinado, las diferencias no alcanzaron significación estadística (44 y 30% para tratamiento combinado e IFX en monoterapia, respectivamente, p = 0,06). En estos pacientes, naïve para IFX e INM, la estrategia óptima transcurrido el periodo inicial no está establecida, pero el mantenimiento a largo plazo con tiopurínicos en monoterapia es eficaz y puede ser una opción a seguir38,143.
El segundo estudio, con un diseño prácticamente idéntico y publicado únicamente en forma de resumen, evaluó las mismas pautas de tratamiento pero durante un período más corto (16 semanas), en 231 pacientes con CU activa también naïve para IFX e INM144. De forma similar a lo observado en la EC, la proporción de pacientes en remisión clínica libre de esteroides a las 16 semanas fue significativamente superior en el grupo de tratamiento combinado en relación con el grupo tratado con IFX en monoterapia (40 vs. 22%, p < 0,05). También la proporción de pacientes que alcanzó la curación mucosa completa (definida por un subíndice endoscópico de Mayo igual a 0) fue superior en el grupo de tratamiento combinado (30 vs. 12%, p < 0,05). Por el momento, esta superioridad del tratamiento combinado con tiopurinas sobre la monoterapia con anti-TNF no se ha demostrado utilizando otros INM. Un único estudio prospectivo, aleatorio y controlado (también publicado solo en forma de resumen) ha comparado IFX en monoterapia con IFX asociado a metotrexato semanal en dosis de 25mg por vía subcutánea, durante 50 semanas, en 126 pacientes con EC activa145. La tasa de pacientes en remisión clínica libre de esteroides a las 14 y 50 semanas resultó del 57 y 56% en el grupo monoterapia y combinado, respectivamente. Cabe destacar que, a diferencia de los estudios previamente mencionados, todos los pacientes recibieron corticoides orales en el momento de su inclusión en el estudio; además, antes de cada infusión de IFX se administraba hidrocortisona intravenosa. Estos aspectos podrían explicar, al menos en parte, la elevada tasa de remisión libre de esteroides obtenida en ambos grupos de tratamiento, pero también dificultan la correcta valoración del papel de metotrexato.
Todos estos resultados parecen confirmarse en un estudio francés derivado de la práctica clínica que, aunque retrospectivo, utilizó un cuidado diseño y tratamiento estadístico146. El estudio incluyó un total de 121 pacientes con EII en tratamiento combinado (IFX asociado a tiopurinas o metotrexato) durante un mínimo de 6 meses y a los que se les retiró el INM siguiendo con IFX un mínimo de 3 meses más. Ambas pautas se compararon a modo de semestres de tratamiento, sin incluir el primer semestre (inducción). El análisis demostró que la incidencia de nuevos brotes de EII fue significativamente mayor en los semestres de monoterapia en comparación con los semestres de tratamiento combinado (p = 0,003), incluso cuando este análisis se repetía utilizando cada paciente como su propio control. Además, estos resultados no cambiaron dependiendo de si el paciente había presentado resistencia previa o era naïve a INM al inicio del anti-TNF. Sin embargo, sí variaron en función del INM utilizado, de forma que la mayor eficacia del tratamiento combinado solo se confirmó con tiopurinas y no con metotrexato. Datos muy parecidos se han comunicado recientemente en un estudio de idéntico diseño incluyendo 181 pacientes con EC tratados con ADA en 2 centros europeos147. Un estudio retrospectivo ha evaluado la evolución clínica de pacientes con EC a los que, estando en remisión clínica bajo tratamiento combinado, se les retiró el INM148. La probabilidad acumulada de mantenerse en remisión clínica a los 2 años fue tan solo del 40%, a pesar de que el 80% de los pacientes habían presentado fracaso previo del INM en monoterapia. El estudio halló como factores predictivos de recidiva clínica un tiempo bajo tratamiento combinado inferior a 811 días o la existencia de parámetros biológicos de actividad inflamatoria (proteína C reactiva, plaquetas) en el momento del paso a monoterapia.
Por tanto, los datos disponibles a día de hoy hacen aconsejable la utilización concomitante con tiopurinas, independientemente de si el paciente había presentado fracaso previo a las mismas, cuando se inicie tratamiento con agentes anti-TNF con el fin de aumentar la eficacia tanto a corto como a largo plazo.
Tratamiento combinado e inmunogenicidadTodos los anticuerpos monoclonales aprobados en terapéutica humana han demostrado ser inmunogénicos. Diversos factores pueden contribuir al desarrollo de ACF, como la exposición previa a anticuerpos estructuralmente similares o la propia vía de administración (considerándose menos inmunogénicos cuando se administran por vía intravenosa)149. Estos anticuerpos facilitan la aparición de reacciones agudas a la infusión (RAI) –cuando el fármaco se administra por vía intravenosa– y/o la PR. Por tanto, el desarrollo de ACF reduce el rendimiento a medio plazo de estos fármacos, ya sea por efectos adversos o por pérdida de eficacia. Vermeire et al.126, en un estudio prospectivo y abierto que incluyó 174 pacientes con EC tratados con IFX, demostraron que el tratamiento concomitante con tiopurinas o metotrexato reducía la probabilidad de presentar positividad para ACF. Además, una proporción significativamente menor de pacientes bajo tratamiento combinado presentaron RAI (16 vs.40%, p = 0,04). Sin embargo, la relevancia de los hallazgos de este estudio es cuestionable en varios aspectos. En primer lugar, todos los pacientes recibían IFX de forma episódica y no regular, lo cual no refleja la práctica clínica habitual y aumenta su inmunogenicidad. En segundo lugar, la relevancia clínica real de los ACF está todavía por establecer y son los niveles valle del fármaco los que constituyen el factor que más se ha asociado al mantenimiento de la respuesta a los anti-TNF en la EII150,151. En este sentido, aunque hasta el momento no se ha publicado ningún estudio prospectivo diseñado específicamente para evaluar el efecto de los INM sobre la inmunogenicidad de los anti-TNF administrados de forma regular, el estudio SONIC no solo halló una menor tasa de positivización de ATI (0,9 vs. 15%), sino también unos niveles valle de fármaco significativamente más elevados (3,5 vs. 1,5μg/ml, p < 0,001) y una incidencia significativamente menor de RAI (5 vs. 17%, p < 0,001) en los pacientes tratados con terapia combinada comparados con los que recibían IFX en monoterapia142.
Otro aspecto muy debatido ha sido la necesidad de mantener el tratamiento con INM para prevenir la inmunogenicidad de los anti-TNF. Van Assche et al.152 llevaron a cabo un estudio prospectivo en el que 80 pacientes con EC en remisión bajo tratamiento combinado (INM e IFX) durante un periodo mínimo de 6 meses, fueron distribuidos al azar para seguir o interrumpir el tratamiento con INM mientras seguían con IFX cada 8 semanas. Tras un seguimiento de casi 2 años no se hallaron diferencias entre ambos grupos de tratamiento en relación con la necesidad de intensificar o detener el tratamiento con anti-TNF, en la presencia de ATI, ni en la presencia de úlceras en la ileocolonoscopia realizada al final del seguimiento. Esto condujo a los autores a concluir que el mantener los INM asociados a IFX más allá de 6 meses no aportaba ningún beneficio terapéutico evidente. Sin embargo, el estudio demostró nuevamente que los niveles valle de IFX eran significativamente menores en los pacientes tratados con monoterapia, lo cual induce a pensar que el estudio no tenía poder estadístico suficiente para sostener tales afirmaciones. Por otra parte, existen importantes defectos metodológicos en el estudio que invalidan las conclusiones a las que llegaron los autores. En primer lugar, el 35% de los pacientes recibían IFX de forma episódica y un 14% de forma regular cada 9-12 semanas en el momento de la inclusión en el estudio, lo que significa que en casi la mitad de los pacientes se «intensificó» el tratamiento con IFX a cada 8 semanas tras la inclusión en el estudio. En segundo lugar, la mediana de tiempo bajo tratamiento combinado en el grupo de pacientes en el que se retiraron los INM fue de 24 meses (rango: 6-90), lo que significa que la mayoría de ellos llevaban 2 años o más bajo tratamiento combinado y no solamente 6 meses.
Por tanto, el tratamiento combinado parece asociarse a niveles valle de IFX más elevados que los que se obtienen en monoterapia (incluso a largo plazo), por lo que parece aconsejable seguir con tratamiento combinado de forma indefinida con el objetivo de optimizar el rendimiento del tratamiento anti-TNF a largo plazo.
Tratamiento combinado y perfil de seguridadLas diferencias en el perfil de seguridad constituyen, probablemente, el aspecto más difícilmente evaluable entre ambas estrategias de tratamiento. Los ensayos clínicos controlados incluyen poblaciones muy seleccionadas y no tienen suficiente poder estadístico ni tiempo de seguimiento para detectar diferencias en la incidencia de determinados efectos adversos. Las series observacionales amplias y los registros de seguridad, aunque pueden identificar efectos adversos infrecuentes, no son aleatorios y pueden infravalorar sesgos que inclinen al clínico a utilizar una u otra estrategia terapéutica. Con estas limitaciones en mente, los datos disponibles no parecen indicar que el tratamiento combinado aumente el riesgo de infecciones graves u oportunistas en comparación a la monoterapia con anti-TNF109,142,153 pero no es posible conocer el efecto de una u otra estrategia terapéutica sobre el riesgo de infecciones graves en determinados grupos de riesgo (por ejemplo, pacientes con neumopatía crónica concomitante o edad avanzada)154. Así la combinación de 2 o más tratamientos inmunosupresores es un factor predictivo de reactivación de determinadas infecciones previas como la infección por el virus B de la hepatitis (VHB)155.
Sabemos que las tiopurinas incrementan el riesgo de linfomas no hodgkinianos (especialmente en pacientes de edad avanzada)156 y también de neoplasias cutáneas distintas al melanoma157, aunque incluso en estos pacientes su incidencia es baja. No obstante, no disponemos de estudios con suficiente poder estadístico para comparar cuál es el riesgo de neoplasia en pacientes bajo tratamiento combinado o monoterapia con anti-TNF. Además, la mayoría de pacientes tratados con anti-TNF han estado expuestos a tiopurinas en algún momento, por lo que el riesgo asociado a la monoterapia es prácticamente imposible de evaluar. Un reciente modelo de decisión parece indicar que los riesgos de la terapia combinada no sobrepasan los beneficios en un análisis a un año de tratamiento158.
En resumen, la introducción de agentes anti-TNF en pacientes con EII debería acompañarse de forma sistemática de tratamiento concomitante con INM (tiopurinas, cuando sea posible) con el fin de aumentar la eficacia clínica y prolongar su rendimiento. La retirada del INM solo debería plantearse en algunos subgrupos de pacientes con especial riesgo de linfoma (niños y edad avanzada), siempre que el paciente haya permanecido en remisión clínica, biológica y morfológica de forma prolongada bajo tratamiento combinado.
SeguridadEl análisis de los efectos adversos de los agentes biológicos no es sencillo, y el diseño actual de los ensayos clínicos controlados no lo facilita. Siendo los ensayos clínicos la fuente de información metodológicamente más rigurosa, todas las pérdidas de pacientes y efectos adversos que suceden en la rama de tratamiento se atribuyen por defecto al tratamiento, cuando pueden ser causados por la propia enfermedad, por otros tratamientos o por factores externos. Cuando se aplican técnicas de análisis riesgo-beneficio tanto a los resultados terapéuticos como a los efectos adversos, la rama tratada con biológicos muestra menos efectos adversos que la rama control, al menos en algunos ensayos159. Las complicaciones que observamos durante el curso clínico de la EII pueden deberse al azar, a la propia enfermedad, a otros factores como el tabaquismo, a otros tratamientos concomitantes como los esteroides (que además pueden tener repercusiones inmediatas o duraderas)160 o al propio agente biológico161. Por último, cabe considerar que estos efectos pueden ser de clase (correspondientes a cualquier tratamiento anti-TNF) o particulares del fármaco: no todos los agentes anti-TNF son iguales en sus riesgos162,163. Otros factores como la edad pueden ser un determinante esencial164 y las diferencias entre clases y fármacos pueden ser cualitativas (un efecto se da o no se da) o cuantitativas (un efecto se da con más o menos probabilidad). Toda esta complejidad obliga a un análisis muy cuidadoso, con una metodología muy estricta, siendo especialmente importantes el número de pacientes y la selección del grupo control. Para efectos adversos infrecuentes solo son útiles aquellos estudios que incluyen muestras amplias de pacientes, mientras que para los estudios comparativos las conclusiones solo son válidas con respecto a la población control escogida.
La experiencia acumulada durante más de una década con el uso de agentes anti-TNF en diversas enfermedades nos permiten extraer algunas conclusiones que detallamos a continuación:
- •
El uso de agentes anti-TNF es razonablemente seguro y puede serlo aún más con el empleo de las medidas preventivas adecuadas. Su empleo no se asocia a un aumento del riesgo de mortalidad cuando se compara con la población control, o con los pacientes no tratados con biológicos165–168.
- •
El uso de agentes anti-TNF se asocia a un riesgo de enfermedades infecciosas mayor al observado en las poblaciones control. Estas infecciones pueden tener consecuencias graves puesto que se pueden asociar a mortalidad169,170. No todos los estudios corroboran este aumento de riesgo, cuando se considera de forma global y se valoran otros factores168,171. Sin embargo, las revisiones más completas confirman un aumento en el riesgo relativo de desarrollar infecciones, con OR de 1,19 (IC 95%: 1,09-1,30)163. Los datos a 5 años del registro TREAT confirman un mayor riesgo de infecciones graves para estos agentes que, no obstante, sigue siendo inferior al asociado a la prednisona153. Por otro lado, se ha definido con claridad el aumento en el riesgo de desarrollar algunas infecciones específicas como el de reactivación de una TBC latente (OR 4,7; IC 95%: 1,18-18,60), reactivación de la hepatitis B, listeriosis, histoplasmosis y otras infecciones oportunistas163.
- •
El uso de agentes anti-TNF no se ha asociado a un aumento en el riesgo de desarrollar tumores malignos. Tampoco se ha podido demostrar un mayor riesgo de desarrollo de linfomas en las poblaciones expuestas a estos agentes166,172. Los datos más recientes del registro de la FDA en pacientes tratados con agentes anti-TNF para todas las indicaciones aprobadas sugieren un mayor riesgo de desarrollo de linfomas no hodgkinianos en pacientes en tratamiento combinado173. Estos datos son contrarios a los obtenidos en la extensa revisión Cochrane disponible163 en la que la OR para linfomas resultó de 0,53 (IC 95%: 0,17-1,66). Sin embargo, ni para todas las enfermedades ni para todos los agentes biológicos los riesgos son idénticos, por lo que no puede descartarse un riesgo específico por la propia EII, o bien por la combinación con otros fármacos174,175. Así, se ha descrito la asociación de un tipo poco frecuente de linfoma, el linfoma hepatoesplénico, con la combinación de tiopurinas y agentes anti-TNF en varones jóvenes, pero es un riesgo numéricamente muy pequeño, y desconocemos si se debe a algún otro factor de riesgo no conocido176.
- •
El uso de agentes anti-TNF se asocia a un aumento cuantitativamente pequeño pero real del riesgo de desencadenar enfermedades desmielinizantes177.
- •
El uso de agentes anti-TNF se asocia con un mayor riesgo de descompensación de una insuficiencia cardíaca congestiva (ICC) en casos individuales, puesto que en los análisis globales este riesgo no se ha probado, siendo el OR de insuficiencia cardíaca congestiva de 0,69 frente a individuos no tratados con agentes biológicos163. Sin embargo, se ha descrito un aumento de la mortalidad en los casos de ICC de grado más avanzado178.
- •
El uso de agentes anti-TNF se asocia con un riesgo bien definido de reacciones inmunológicas. Las más comunes se asocian con la generación de ACF, que a su vez se pueden asociar con RAI o PR117,118,179. La aparición de otros cuadros autoinmunes es bastante más rara.
- •
El uso de agentes anti-TNF se asocia con cierta frecuencia a la aparición de lesiones cutáneas de tipo psoriasiforme, de gravedad variable180–182. La alteración de diversas citocinas y la predisposición genética parecen constituir los principales mecanismos de desarrollo de fenómenos de inflamación paradójica tras exposición prolongada a estos fármacos. Esta inflamación paradójica se presenta sobre todo a nivel cutáneo y con menos frecuencia articular y pulmonar183.
- •
No está bien establecido si los agentes anti-TNF contribuyen de forma independiente al riesgo de complicaciones posquirúrgicas184.
- •
En resumen, los agentes anti-TNF permiten restaurar la calidad de vida de los pacientes185 con un perfil de seguridad general favorable a largo plazo. Por otra parte, y a nivel teórico, es posible que el mejor control de la inflamación crónica pudiera redundar en un descenso del riesgo de otras comorbilidades, como la diabetes y las complicaciones cardiovasculares, como ha sido descrito en la artritis reumatoide167,186.
Desde la aprobación de los distintos agentes anti-TNF se han implementado una serie de medidas dirigidas a la prevención de algunas de estas complicaciones del tratamiento que pueden disminuir los riesgos asociados no solo a los agentes biológicos sino también a la enfermedad inflamatoria en sí misma187. La descripción del aumento en el riesgo de reactivación de TBC latente condujo a la adopción de estrategias de prevención que se siguieron de una drástica reducción en la incidencia de casos de TBC activa. Pero este solo es el ejemplo más paradigmático de las medidas que se recomiendan y que globalmente deben seguir estas consideraciones:
- •
Llevar a cabo siempre una evaluación completa, que puede facilitarse mediante un simple listado sistemático de verificación (checklist), antes de iniciar el tratamiento con un agente biológico como se recoge en el siguiente apartado. Debe prestarse especial atención a la evaluación de una posible TBC latente, a la situación de la infección por virus de la hepatitis B, y al calendario vacunal187.
- •
Las vacunaciones con gérmenes inactivados no suponen un riesgo aumentado, aunque su eficacia puede ser menor tanto por condicionantes de la propia enfermedad, del propio paciente (por ejemplo, la respuesta a la vacunación para la hepatitis B es menor en los pacientes ancianos) o del tratamiento administrado188. Aunque el riesgo absoluto de reactivación no se conoce bien y probablemente no sea elevado189, parece prudente no recomendar las vacunaciones con virus vivos mientras se administra el tratamiento biológico y hasta los 3 meses de su retirada190,191.
- •
Se recomienda adelantar estas evaluaciones al momento del diagnóstico de la EII, lo que puede proporcionar algunas ventajas como no retrasar la administración de anti-TNF cuando sea necesario o el empleo de algunas vacunaciones solo administrables si el paciente no está recibiendo ya tratamiento inmunosupresor. Además, el tratamiento activo puede condicionar el éxito de algunas vacunaciones como ya hemos mencionado.
- •
Evitar en lo posible el uso de tratamientos combinados con corticoides durante periodos largos de tiempo. En estudios realizados con muy diversa metodología se ha confirmado que la asociación entre corticoides y anti-TNF aumenta el riesgo de infecciones de forma muy significativa109,110.
Las contraindicaciones del tratamiento anti-TNF en pacientes con EII han presentado modificaciones significativas con respecto a las publicadas en los consensos previos de GETECCU1,2. Las principales contraindicaciones están expuestas de forma general en la tabla 2. Sin embargo, algunos aspectos, bien por las últimas novedades, bien porque los datos son contradictorios, merecen ser tratados individualmente.
Contraindicaciones para el uso de tratamiento con agentes antifactor de necrosis tumoral
| Absolutas |
| Alergia a proteínas de origen murino (para IFX) |
| Insuficiencia cardíaca congestiva moderada-grave |
| Enfermedades neurológicas desmielinizantes |
| Infecciones bacterianas activas (especial atención a abscesos) |
| Infecciones virales activas no tratadas (especial atención al VHB) |
| TBC activa o latente no tratada |
| Vacunación reciente (< 3 semanas) con gérmenes vivos |
| Relativas |
| Reacciones graves previas al fármaco |
| Estenosis intestinales no inflamatorias |
| Infección por VIH |
| Lupus eritematoso sistémico |
| Antecedentes de neoplasia (individualizar casos) |
En los pacientes con antecedente de neoplasia reciente se suele establecer la recomendación general de no emplear agentes biológicos hasta al menos 5-10 años libres de enfermedad tumoral192. No obstante, el hecho de que apenas existan estudios sobre la seguridad del tratamiento biológico en pacientes oncológicos193, siendo la mayor parte de los mismos series de casos, unido a que en los ensayos clínicos controlados el antecedente de neoplasia (independientemente de los años transcurridos libres de enfermedad) suele ser un motivo de exclusión, no permiten establecer recomendaciones firmes al respecto. No existen evidencias de que los agentes biológicos influyan negativamente en la evolución o la recidiva de una neoplasia. La toma de decisiones en esta situación requiere coordinación multidisciplinaria con oncólogos y hematólogos, y debe tener en cuenta diversos factores como el tipo histológico de la neoplasia, su estadificación, la edad, las comorbilidades añadidas a la EII y a la neoplasia, el grado de actividad inflamatoria de la EII y, finalmente, la opinión del propio paciente.
Infecciones y vacunasLos pacientes con infecciones activas no deben recibir agentes anti-TNF hasta que la infección esté bajo control. Los abscesos deben de ser previamente drenados antes de comenzar el tratamiento. Con respecto a la TBC y a la infección por el virus de la hepatitis B, nos remitimos a los consensos previos de GETECCU2,4 y a la tabla 3. Los datos más recientes inclinan a pensar que los agentes anti-TNF son seguros en los pacientes con infección crónica por el virus de la hepatitis C, aunque no deben obviarse los controles estrictos de la función hepática en estos pacientes194. Se recomienda investigar el status de la infección por VIH antes de iniciar tratamiento anti-TNF. Sin embargo, en función de datos en los que los anti-TNF no han perjudicado ni empeorado la situación195, la infección por VIH no debería constituir una contraindicación absoluta para estos tratamientos. La vacunación reciente (en un periodo inferior a 3 semanas, como mínimo) con microorganismos vivos se considera una contraindicación temporal para iniciar el tratamiento.
Listado de comprobación de inicio y seguimiento del tratamiento con agentes antifactor de necrosis tumoral
| Procesos | Actitud clínica | Indicación-contraindicación de anti-TNF |
| Infección activaa | Fiebre, signos de alarmaCultivo y serologías apropiados | Contraindicación hasta resolución |
| Absceso abdominal o perianal | Sospecha clínicaPruebas de imagen | Drenaje. Contraindicación hasta resolución |
| Infección intestinal | Estudio coproparasitario con ausencia de infección por Clostridium difficile | Contraindicación hasta resolución |
| Revisar calendario e indicación de vacunasb | Varicela: antecedente o vacunaciónSerología si antecedentes no conocidos | Vacunas con microorganismos vivos:Inicio de anti-TNF: contraindicación si no han transcurrido al menos 3 semanasBajo tratamiento anti-TNF: retirar el tratamiento al menos 3 meses antes de la vacunación |
| TBCc | Anamnesis adecuadaRadiografía de tóraxPPD-booster. Test de interferón (IGRA) especialmente si hay inmunosupresión o vacunación BCG previa | TBC latente: quimioprofilaxis. Inicio anti-TNF no antes de un mesTBC activa: tratamiento. Inicio anti-TNF tras curación o al menos 2 meses de tratamiento antituberculosoPaciente en tratamiento anti-TNF: retestar periódicamente (anual). |
| VHBd | Investigar status de la infección:HBsAg, HBcAc, HBsAcSi HBsAg (+) o HBcAc (+) determinar ADN-VHB | HBsAg (+): tratamiento antiviral (al menos desde 2 semanas antes de iniciar anti-TNF)HBsAg (−) y HBcAc (+): monitorizar periódicamente ADN-VHB: si se positiviza tratamiento antiviral |
| VHC | Serología. Si VHC Ac (+), determinar ARN-VHC | No contraindicación. Seguimiento y monitorización de la función y biología hepática |
| VIH | Determinación IgG-VIH | Contraindicación relativa |
| Herpes | Antecedentes de herpes oral o genital | No contraindica anti-TNF salvo infección grave activaAntiviral oral si hay herpes recidivante |
| Pneumocystis jirovecii | Quimioprofilaxis con cotrimoxazol si hay triple inmunosupresión | |
| Viajes a zonas endémicas | Fiebre amarilla (vacuna de virus vivos)Strongylodes: eosinofilia, serología | Vacuna contraindicada si hay inmunosupresiónNo iniciar inmunosupresión hasta 3 semanas después de la vacunación |
| Neoplasia previa | Historia clínica | Contraindicación relativa. Individualizar casos. Decisión multidisciplinaria |
| Enfermedad neurológica desmielinizante | Historia clínica | No recomendable (consulta con neurología si es preciso) |
| Insuficiencia cardíaca | Sospecha clínica | Contraindicación si moderada-grave (grado iii-iv de la NYHA) |
| Embarazoe | Interrogar. Test de embarazo si dudas | Individualizar |
| Lupus | Historia clínica | No recomendable |
Incluidos infección activa por varicela, virus de Epstein-Barr (VEB), herpes, gripe, infecciones por hongos y parásitos.
VHB:
Tratamiento antiviral. Lamivudina 100mg/día, en los casos que se estime un tratamiento corto (< 1 año). El tratamiento debe comenzar 1 o 2 semanas antes de iniciar el anti-TNF y mantenerse durante todo el tiempo que este dure y hasta 12 meses después de su suspensión. Si se espera que el tratamiento con anti-TNF se prolongue más de un año, se recomienda entecavir o tenofovir a las dosis habituales durante el tiempo que dure el tratamiento anti-TNF y hasta 12 meses después de su retirada.
Vacunación de la hepatitis B en todos los pacientes seronegativos. Se sugiere utilizar pauta rápida (0, 1 o 2 meses) con doble dosis dada la alta tasa de fracaso a la vacunación en caso de estar con tratamiento anti-TNF215. Comprobar niveles de HBsAc posvacunación y revacunación siguiendo la misma pauta con dosis doble si no se consiguen valores de HBsAc > 100 U/ml tras la primera vacunación.
No se han descrito mayores tasas de malformaciones o complicaciones en los embarazos de las pacientes tratadas con agentes anti-TNF que en los de pacientes con EII no expuestas a estos fármacos196–198. Los estudios más recientes no muestran evidencia de que estos fármacos sean inseguros en el embarazo199. Sin embargo, a partir de la semana 20 la placenta es permeable para el paso de anticuerpos IgG por la presencia de transportadores que reconocen el fragmento Fc, determinando que paulatinamente la concentración del anticuerpo vaya siendo mayor en la sangre fetal que en la materna200. Se ha detectado niveles sanguíneos elevados, tanto de IFX como de ADA, en el cordón umbilical de recién nacidos de madres tratadas201. Hasta el momento se ha comunicado un único caso de muerte en lactantes relacionado con la vacunación BCG202 y recientemente se ha referido un incremento de las infecciones entre los 9 y 12 meses posparto203. Por lo demás no se han descrito otros efectos adversos ni una menor respuesta a las vacunas en los niños de madres tratadas. Sin embargo, el seguimiento en los estudios disponibles ha sido corto (inferior a un año en la mayoría de ellos), y no pueden descartarse efectos a largo plazo por cambios en la maduración del sistema inmunológico. Por otra parte, en series cortas de pacientes con EII, la retirada del agente anti-TNF a partir de la semana 20 no se ha seguido de complicaciones.
Teniendo en cuenta estas consideraciones, la decisión de retirar el tratamiento con agentes anti-TNF en caso de gestación debiera individualizarse en dependencia del curso previo de la enfermedad102,204 y en ningún caso debe considerarse la inducción de un aborto solo por haber recibido terapia anti-TNF. En los casos en los que la EII ha sido de difícil control, o se halla activa a pesar del tratamiento, puede plantearse mantener el tratamiento anti-TNF durante todo el embarazo. En el resto de casos, debe valorarse la retirada del agente anti-TNF a partir de la semana 20. En cualquier caso, el recién nacido de una madre expuesta no debe recibir vacunas de virus vivos los primeros 6 meses de vida.
Respecto a la lactancia, recientemente se ha detectado la presencia tanto de IFX como de ADA en leche materna205,206, pero las bajas concentraciones detectadas y el hecho de que las IgG no sean absorbibles por vía oral hacen presuponer que el efecto inmunosupresor no debiera afectar al lactante y, de esta manera, no se ha comunicado toxicidad hasta la fecha207. Por tanto, con la limitación de la escasa evidencia científica disponible, se sugiere que la lactancia no tiene por qué ser restringida si se está recibiendo este tratamiento102,197,208.
Enfermedad estenosanteLos pacientes con EC estenosante en los que no se observan datos de inflamación, incluyendo marcadores biológicos (proteína C reactiva o calprotectina fecal) o por técnicas de imagen (ya sean endoscópicas o radiológicas), normalmente presentan una pobre respuesta al tratamiento anti-TNF209. Sin embargo, puede alcanzarse cierto grado de respuesta clínica en caso de estenosis con componente inflamatorio. Se trata por tanto de una contraindicación relativa referida exclusivamente a los pacientes con enfermedad fibroestenosante.
Evaluación de inicio y seguimientoLa mejor manera de evitar complicaciones tempranas o problemas inesperados al iniciar tratamiento con agentes anti-TNF sería seguir un listado de comprobación antes de empezar el tratamiento178, como el reseñado en la tabla 3.
Una vez iniciado el tratamiento, se recomienda realizar una valoración clínica de su eficacia y monitorizar las posibles complicaciones asociadas a este. Parece razonable el control clínico y biológico cada 2 a 4 meses que puede variar en función de la indicación con la que se ha utilizado el anti-TNF. Además, la educación del paciente en relación con la detección precoz de complicaciones (aparición de fiebre, adenopatías, pérdida de peso, etc.) debe formar parte de las medidas informativas al inicio del tratamiento y de esta manera se facilite la consulta no programada en caso de sospecha.
Monitorización de posibles efectos secundarios
- a)
Preguntar por posibles efectos secundarios, especialmente las infecciones187 y, entre ellas, las del tracto respiratorio superior. Interrogar acerca de la presencia de fiebre, tos y/u otros síntomas respiratorios, síndrome miccional, pérdida de peso y/o presencia de adenopatías palpables. En caso de infección, incluyendo TBC e infecciones oportunistas, debe suspenderse el tratamiento anti-TNF, realizar tratamiento adecuado del cuadro infeccioso, pudiéndose reanudar cuando la infección esté controlada210.
- b)
Síndrome lupus-like inducido por fármacos. Se presenta como un cuadro de malestar general, artralgias o artritis, mialgias, fiebre y pérdida de peso. El cuadro clínico suele tener un inicio subagudo y, en general, los síntomas son leves en la mayoría de los pacientes, la afectación renal y del sistema nervioso central es excepcional. Se caracteriza por la positividad de los ANA y de los anti-ADN211.
- c)
No existen medidas de prevención de desarrollo de neoplasias, pero debe recomendarse a los pacientes con EII hábitos de vida saludables (abandono del tabaco, dieta equilibrada con corrección de carencias nutricionales, evitar la exposición solar excesiva con uso de protección solar si se recibe tratamiento con tiopurinas, etc.) y consultar a la mayor brevedad posible la aparición de lesiones cutáneas o cambios en lesiones ya existentes dada la mayor incidencia de tumores cutáneos no melánicos. Asimismo, deben realizarse los exámenes de salud recomendados para su grupo de edad y de sexo, dirigidos al diagnóstico precoz y al cribado de determinados tipos de cáncer (colon, mama, cuello uterino, próstata). Especial atención se debe prestar al riesgo de linfoma en los pacientes mayores de 65 años, y al de linfomas hepatoesplénicos en menores de 35 años en tratamiento combinado de inmunosupresores tiopurínicos y anti-TNF.
- d)
En los pacientes que vayan a realizar viajes, se recomienda una consulta previa valorando la necesidad de medidas preventivas212. A la vuelta del viaje, si este es a países con parasitosis endémicas como Strongyloides, sería recomendable un estudio de heces que incluya parásitos y una analítica para descartar eosinofilia187.
- e)
Antes de iniciar tratamiento con agentes anti-TNF es importante la revisión del estado de las vacunaciones (tabla 4), como es el caso de la vacuna del neumococo cada 3-5 años, anualmente la de la gripe y cada 10 años la del tétanos. También se recomiendan controles periódicos posvacunación del VHB213 y retestar periódicamente, probablemente de forma anual, la infección tuberculosa latente, especialmente en sujetos con mayor riesgo de contacto (condiciones laborales, viajes, etc.)214.
Tabla 4.Indicación de vacunas en caso de inmunocompromiso
Vacuna Tipo vacuna Indicación Vacuna del tétanos y la difteria Anatoxina purificada Personas seronegativas (tétanos: recuerdo cada 10 años) Vacuna de la hepatitis A Viriones inactivados Personas seronegativas Vacuna de la hepatitis B Péptido recombinante Personas seronegativas (testar niveles HBsAc) Vacuna de la gripe Virus inactivado Personas no vacunadas el año presente Vacuna del neumococo Antígeno purificado 23 valente Personas seronegativas (recuerdo cada 5 años) Vacuna del sarampión, rubéola y parotiditis Viva atenuada Contraindicada (virus vivos atenuados) Vacuna de la varicela Viva atenuada Contraindicada (virus vivos atenuados) Vacuna del virus del papiloma humano Proteína L1 recombinante Mujeres ≤ 26 años (exámenes ginecológicos y valorar riesgos de contagio) Vacuna de meningococo del grupo C Polisacáridos bacterianos capsulares purificados Personas seronegativas Vacuna de Haemophilus influenzae tipo b Vacuna de polisacáridos (polisacárido capsular PRP) conjugados con proteína del toxoide tetánico Personas seronegativas
J. Cabriada, E. Domènech, J.P. Gisbert y F. Gomollón han participado en asesoramiento científico, actividades formativas y han recibido soporte para investigación por parte de Abbott y MSD; M. Esteve ha participado en asesoramiento científico y actividades formativas para Abbott, MSD, y Shire Pharmaceuticals; I. Vera y M.Barreiro-de Acosta han participado en asesoramiento científico para Abbott y MSD; J. Panés ha participado en comités de Abbott, Boehringer Ingelheim, Bristol Myers Squibb, Genentech, Merk Sharp & Dohme, Roche, Shire y Tygenics, y ha recibido ayudas para la investigación de Abbott y Merck Sharp & Dohme.