La reversibilidad de la fibrosis hepática se describe en hepatitis autoinmune(HAI) con tratamiento inmunosupresor (TI).
ObjetivoComparar fibrosis inicial y con TI en HAI.
MétodosIngresaron 54 pacientes con anticuerpos antinucleares y/o antimúsculo liso (+), IgG elevada y biopsia compatible, edad promedio 39 años (rango 13-65), 47 mujeres (87%), en tratamiento con prednisona y azatioprina. Se comparó grado de inflamación (0-18) y fibrosis (0-6) según score de Ishak entre biopsia inicial y control (prom 28±8 meses).
ResultadosLa fibrosis disminuyó de 2,9±0,3 a 2,2±0,3 (p=0,005) y el índice de actividad histológica de 6,8±0,45 a 2,6±0,2 (p<0,001). En subgrupos esta disminuyó de 3,6±0,4 a 1,4±0,3 (p<0,001) en 22 pacientes (41%), no varió en 27 (50%) y aumentó en 5 (9%); 4/7 con cirrosis histológica inicial mejoraron a score 0-3 en control. La evolución de transaminasas no permitió predecir la mejoría histológica.
ConclusiónEn pacientes con HAI el TI mejora significativamente la fibrosis, acentuando la importancia de estudiar factores pronósticos asociados a esta favorable respuesta.
Reversibility of liver fibrosis with immunosuppressive therapy (IT) has been described in autoimmune hepatitis (AIH)
ObjectiveTo compare initial fibrosis and fibrosis after IT in patients with AIH.
MethodsA total of 54 patients were admitted with positive ANA or AML antibodies, or both, elevated IgG immunoglobulins and who met international criteria for a diagnosis of AIH. The mean age was 39 years (range 13-65) and there were 47 women (87%). Two liver biopsies were taken: one at diagnosis and another at a mean of 28±8 months after initiation of IT with prednisone and azathioprine. The degree of inflammation (0-18) and fibrosis (0-6) according to Ishak score was compared between the initial and the follow-up biopsy.
ResultsFibrosis decreased from 2.9±0.3 to 2.2±0.3 (p=0.005) and histological activity index from 6.8±0.45 to 2.6±0.2 (P<.001). In subgroups, fibrosis decreased from 3.6±0.4 to 1.4±0.3 (P<.001) in 22 patients (41%), was unchanged in 27 (50%) and increased in five (9%). There were seven patients with histological cirrhosis at IT initiation. After IT, four showed a reduction in Ishak score (achieving scores of 0-3). Transaminase values were not associated with histological improvement.
ConclusionFibrosis in patients with AIH significantly improved with IT, emphasizing the importance of studying the prognostic factors associated with this favorable response.
La hepatitis autoinmune (HAI) se caracteriza por una inflamación crónica y progresiva del hígado de causa desconocida, con mayor frecuencia en el sexo femenino y descrita con presentación bimodal alrededor de la pubertad y entre la 4a a 6a década de la vida1. Se plantea en su patogenia una compleja interacción entre factores gatillantes, autoantígenos, predisposición genética y el sistema inmunorregulador1.
En la HAI no tratada se ha descrito una mortalidad del 80% a los cinco años, habiéndose demostrado que la terapia inmunosupresora mejora la sobrevida a 5 años entre 85-90%. Utilizando prednisona o prednisolona con o sin azatioprina en diversos grupos estudiados2, se observa una franca mejoría clínica y de laboratorio. Sin embargo, existen pocos trabajos acerca del efecto de este tratamiento en la evolución de la fibrosis hepática presente al momento del diagnóstico clínico-histológico, como en su aparición posterior en biopsias de control.
La regresión de la fibrosis se ha descrito en varias hepatopatías crónicas al suprimir la causa patógena, como son el tratamiento antiviral de la hepatitis crónica por virus B y C3,4, la flebotomía en la hemocromatosis5, el ácido ursodeoxicólico en la cirrosis biliar primaria6 y la descompresión de la obstrucción crónica de la vía biliar7, entre otras.
Sin embargo, existen pocos trabajos que describan una disminución de la fibrosis e incluso desaparición de la cirrosis usando tratamiento inmunosupresor en pacientes con HAI, siendo en grupos pequeños8–10 y con eventuales errores de muestreo e interpretación. En dos estudios recientes, uno de mayor tamaño de Cjaza et al11 en 87 pacientes y otro de Mohamadnejad et al12, se observaron buenos resultados en este sentido, privilegiando la utilización de un score histológico estandarizado como el de Ishak13, con un patólogo experto focalizado en evaluar la fibrosis14. Se ha destacado a este índice como más efectivo para señalar cambios más leves en la fibrosis y con reconocida validez14,15.
El objetivo del presente trabajo es estudiar la regresión de la fibrosis en pacientes con HAI biopsiados prospectivamente utilizando el score de Ishak, para determinar la eficacia del tratamiento inmunosupresor.
Pacientes y métodosSe estudiaron 54 pacientes entre los años 1983 y 2007, edad promedio 39 años (rango 13 a 65), 47 mujeres (87%) que cumplían los criterios internacionales para el diagnóstico de HAI16 y contaban con dos biopsias hepáticas, una al momento del diagnóstico y otra a los 28±8 meses de iniciado el tratamiento inmunosupresor con prednisona (54/54) y azatioprina (48/54).
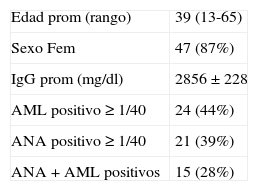
Todos los pacientes se evaluaron con exámenes de laboratorio al momento del diagnóstico, incluyendo pruebas hepáticas, inmunoglobulinas A, G y M, y anticuerpos antinucleares, antimúsculo liso y antimitocondriales, determinados con técnica de inmunofluorescencia indirecta (IFI). Las características clínicas al diagnóstico se muestran en la tabla 1.
Características clínicas iniciales al diagnóstico en casos de hepatitis autoinmune (n=54)
| Edad prom (rango) | 39 (13-65) |
| Sexo Fem | 47 (87%) |
| IgG prom (mg/dl) | 2856±228 |
| AML positivo ≥ 1/40 | 24 (44%) |
| ANA positivo ≥ 1/40 | 21 (39%) |
| ANA+AML positivos | 15 (28%) |
AML: anticuerpo antimúsculo liso; ANA: anticuerpos antinucleares; IgG: inmunoglobulina G.
El estudio inicial descartó además virus hepatotropos con HBsAg, Anti HBc total y anticuerpos anti VHC negativos por test de ELISA de tercera generación, y también se descartó la presencia de enfermedades de depósito con exámenes serológicos y la histología hepática basal. Luego se realizó el seguimiento clínico y bioquímico estándar en este tipo de pacientes cada 3 ó 4 meses y la biopsia hepática de control. Esta fue evaluada por un patólogo experto (GS), con una longitud promedio del cilindro de 28,2±10,5mm (rango 8 a 48) y un promedio de 13 espacios porta (rango 1 a 25) incluyendo todas las muestras al inicio y control.
El grado de inflamación y fibrosis fue registrado de acuerdo al índice histológico de Ishak, con un puntaje de actividad histológica inflamatoria (AH) entre 0-18 y de fibrosis 0-6, desde menor a mayor compromiso respectivamente13. El diagnóstico de cirrosis requirió de al menos un nódulo regenerativo con fibrosis circundante completa (tabla 2).
Indice de actividad histológica modificado por Ishak
| A. | Hepatitis de interfase periportal o periseptal (necrosis en saca bocado) |
| Ausente | 0 |
| Leve (focal, espacios porta ocasionales) | 1 |
| Leve/moderado (focal, más espacios porta) | 2 |
| Moderado (menos del 50% en septos o espacios porta) | 3 |
| Intenso (mayor 50% septos o espacios porta) | 4 |
| B. | Necrosis confluente |
| Ausente | 0 |
| Necrosis confluente focal | 1 |
| Zona 3 necrosis en algunas áreas | 2 |
| Zona 3 necrosis en muchas áreas | 3 |
| Zona 3 necrosis+ocasionales puentes porto centrales | 4 |
| Zona 3 necrosis+múltiples puentes porto centrales | 5 |
| Necrosis panacinar o multiacinar | 6 |
| C. | Necrosis líticas focales, apoptosis, inflamación focal |
| Ausente | 0 |
| Un foco o menos por objetivo 10x | 1 |
| 2 a 4 focos por objetivo 10x | 2 |
| 5 a 10 focos por objetivo 10x | 3 |
| Más de 10 focos por objetivo 10x | 4 |
| D. | Inflamación portal |
| Ninguna | 0 |
| Leve, algunas o todas las áreas porta | 1 |
| Moderado, algunas o todas las áreas porta | 2 |
| Moderado/a intenso, todas las áreas porta | 3 |
| Intenso, todas las áreas porta | 4 |
| Valor máximo posible | 18 |
| Cambios estructurales, fibrosis y cirrosis | |
| Sin cirrosis | 0 |
| Expansión fibrosa de algunos espacios porta, con o sin formación de septos fibrosos cortos | 1 |
| Expansión fibrosa de muchos espacios porta, con o sin formación de septos fibrosos cortos | 2 |
| Expansión fibrosa de muchos espacios porta con ocasionales puentes porto portales | 3 |
| Expansión fibrosa de áreas porta con formación de puentes porto-portales o porto-centrales | 4 |
| Múltiples puentes porto-portales y/o porto centrales con nódulos ocasionales (cirrosis incompleta) | 5 |
| Cirrosis, probable o definitiva | 6 |
| Índice máximo posible | 6 |
Para el análisis estadístico se usó t-test no pareado para comparar diferencias en promedios de variables contínuas y t-test pareado para comparar cambios en la inflamación y fibrosis en el mismo paciente. Los datos se presentan como promedio±error estándar en las tablas y texto. Un valor de p de 0,05 fue usado para determinar significación estadística.
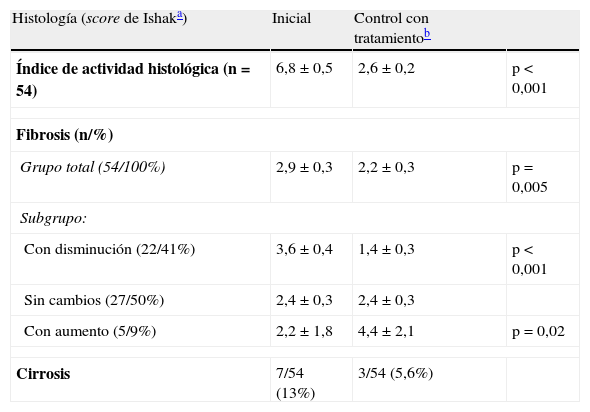
ResultadosEn el grupo estudiado el índice de fibrosis inicial fue de 2,9±0,3 para todos y disminuyó a 2,2±0,3 en la biopsia control (p=0,005) (tabla 3).
Cambios en la inflamación, fibrosis y cirrosis en 54 casos de hepatitis autoinmune bajo terapia inmunosupresora
| Histología (score de Ishaka) | Inicial | Control con tratamientob | |
| Índice de actividad histológica (n=54) | 6,8±0,5 | 2,6±0,2 | p<0,001 |
| Fibrosis (n/%) | |||
| Grupo total (54/100%) | 2,9±0,3 | 2,2±0,3 | p=0,005 |
| Subgrupo: | |||
| Con disminución (22/41%) | 3,6±0,4 | 1,4±0,3 | p<0,001 |
| Sin cambios (27/50%) | 2,4±0,3 | 2,4±0,3 | |
| Con aumento (5/9%) | 2,2±1,8 | 4,4±2,1 | p=0,02 |
| Cirrosis | 7/54 (13%) | 3/54 (5,6%) | |
En 22 pacientes (41%) disminuyó la fibrosis hepática, desde un valor de 3,6±0,4 a 1,4±0,3 (p<0,001). No hubo variación en el índice de fibrosis en la biopsia control de 27 pacientes (50%) y esta aumentó en 5 de ellos (9%), desde un índice de 2,2±0,8 a 4,4±0,9 (p=0,02). De 6 pacientes sin fibrosis al inicio, uno de ellos presentó un índice de 1 a los 24 meses de seguimiento, es decir, una leve progresión, con normalización absoluta de sus pruebas hepáticas, destacando el descenso de bilirrubina desde 16,2mg/dl a 0,3mg/dl. Los otros 5 pacientes no desarrollaron fibrosis en el control histológico a los 25 meses de tratamiento en promedio (rango 23-26). No hubo diferencias estadísticamente significativas en los subgrupos mencionados tanto en el intervalo de la biopsia control (p=0,14) como en su validez considerando longitud y número de espacios porta (tabla 4).
Características de la biopsia hepática (longitud, espacios porta e intervalo muestral) en relación a la evolución de la fibrosis en pacientes con hepatitis autoinmune
| Intervalo entre biopsias (meses±DE) | Biopsia inicial (longitud mm/n°espacios portaa) | Biopsia control (longitud mm / n° espacios portaa) | |
| Grupo total (N=54) | 28±8 | 28,2±9,6/14±5 | 28,2±11,5/13±6 |
| Subgrupo con fibrosis (N/%) | |||
| En disminución (22/41%) | 30±10,4 | 25,9±7,7/15±5 | 29,2±12,2/13±6 |
| Sin cambios (27/50%) | 25±5,6 | 28,5±9,1/14±6 | 25,6±10,6/12±7 |
| En aumento (5/9%) | 31±9,3 | 19±10,3/14±8 | 22,8±6,1/14±6 |
| (p=0,14) | (p=0,1/p=0,97) | (p=0,4/p=0,81) | |
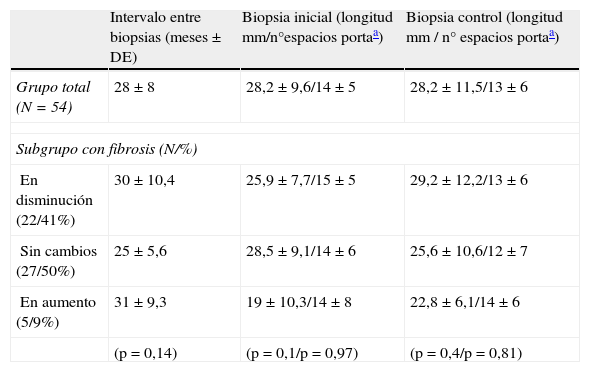
Al inicio tenían cirrosis histológica 7 pacientes y en el control posterior habían mejorado 4 de ellos, con una disminución del índice de al menos 3 puntos (llegando a índices entre 0 y 3), con un seguimiento promedio de 27±2 meses (fig. 1). En este subgrupo con resultado favorable, el tamaño de la muestra control fue en promedio de 20mm, con 11 espacios porta.
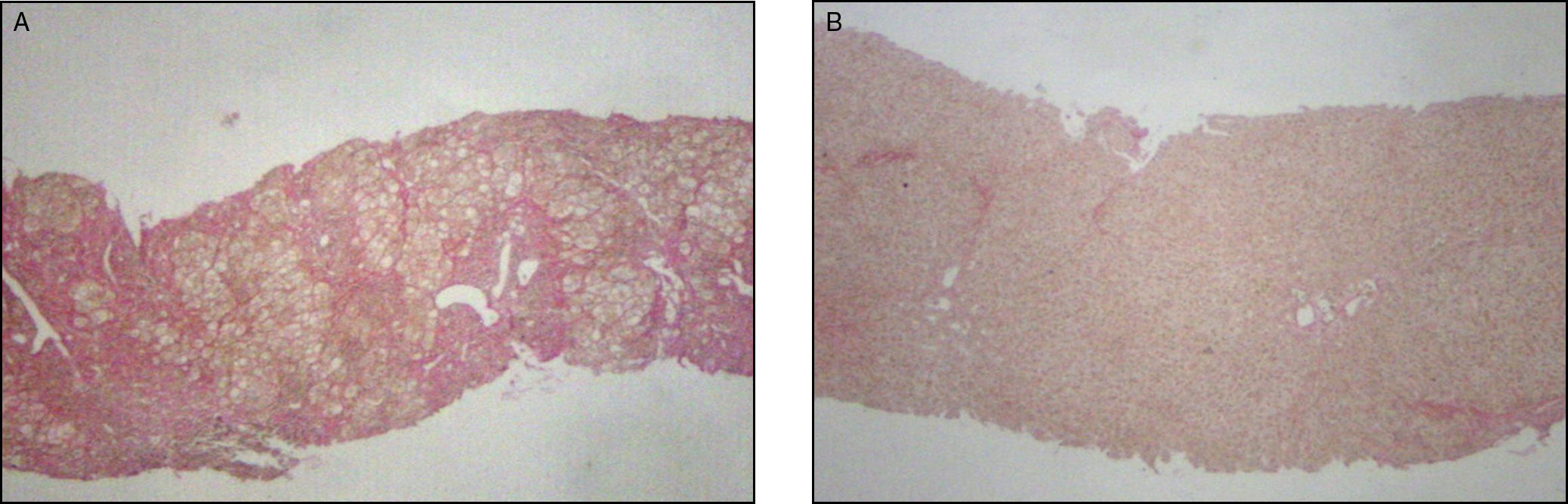
A) Biopsia hepática por aguja de punción aspirativa previa al inicio de tratamiento inmunosupresor. Se observa distorsión severa de la arquitectura hepática con formación de nódulos. HE 40x. B) Biopsia control tras 24 meses de tratamiento biasociado con prednisona y azatioprina con desaparición de la fibrosis, arquitectura normal. HE 40x.
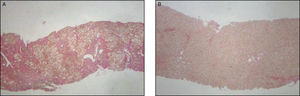
En todos los pacientes la AH disminuyó de 6,8±0,5 a 2,6±0,2 (p<0,001), incluyendo a 10/54 pacientes (18%) que se mantuvieron sin cambios (fig. 2), y sólo aumentó en uno de ellos que no desarrolló fibrosis (tabla 3).
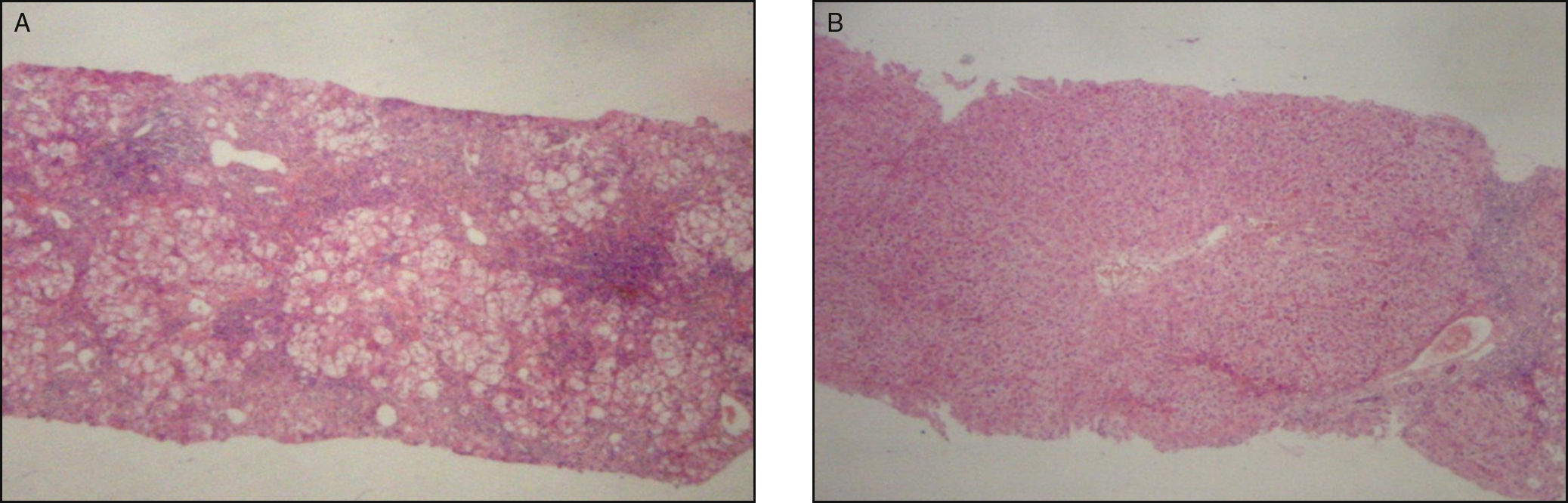
A) Biopsia hepática por aguja de punción previa a tratamiento inmunosupresor, que muestra actividad inflamatoria importante y fibrosis en puente. HE 40x. B) Biopsia control a los 24 meses de tratamiento inmunosupresor, con leve actividad inflamatoria y notoria disminución de la fibrosis. HE 40x.
En el subgrupo de pacientes en que disminuyó la fibrosis (41%), la AH mejoró de 8,1±0,7 a 2,2±0,3 (p<0,001), a su vez en aquellos en que se acentuó ésta (9%), la AH no disminuyó significativamente, de 8,3±0,8 a 5±1,2 (p=0,08). En los pacientes en que la fibrosis permaneció igual en el puntaje de la biopsia control (50%) la AH descendió de 5,7±0,6 a 2,5±0,3 (p<0,001), lo que fue significativamente inferior a la del grupo descrito con disminución de la fibrosis (p=0,01).
Todos los pacientes presentaron disminución significativa de sus parámetros bioquímicos, menor a 2 veces del límite normal de las transaminasas, no observándose diferencia con significado pronóstico en la respuesta favorable al tratamiento.
DiscusiónEn este estudio de 54 pacientes describimos que es posible mejorar o impedir que progrese la fibrosis hepática en pacientes con HAI en tratamiento inmunosupresor biasociado con prednisona y azatioprina. Más aún, observamos probable regresión de la cirrosis en algunos pacientes. Si bien en varios trabajos se ha descrito la mejoría clínica, bioquímica e incluso de la inflamación histológica en pacientes con HAI, existen pocos con un número significativo de pacientes que muestren reversibilidad de la fibrosis hepática, destacando el ya mencionado de Czaja et al11.
Se ha señalado que en la HAI el control de la inflamación hepática y necrosis hepatocelular puede inhibir el estímulo fibrogénico, favoreciendo la degradación del tejido fibrilar constituido por colágeno tipo I y III en la matriz extracelular, que puede hacerse más resistente a la degradación con el tiempo17. Además, se gatilla la apoptosis de las células estrelladas que sintetizan colágeno fibrilar y otras proteínas de la matriz18,19. En este sentido actuarían los corticoides, los que entre sus funciones inhiben la acción del factor de crecimiento transformante ß, conocido activador de las células estrelladas20,21, logrando respuestas altamente favorables.
Como se ha descrito previamente, es complejo asociar cambios de la fibrosis en relación al tamaño de la biopsia hepática, si bien debe considerarse que una muestra pequeña puede subestimar los hallazgos patológicos22, en nuestro estudio no encontramos diferencia significativa en las características de la biopsia (longitud, espacios porta) ni en el intervalo muestral con la evolución de la fibrosis hepática en los pacientes. En los casos con cirrosis es más difícil asegurar su regresión considerando el error de muestreo, más aún cuando el puntaje de fibrosis disminuye sólo 1 o 2 puntos. Nosotros observamos regresión de la cirrosis en 4/7 pacientes que la tenían al inicio, destacando un descenso mayor a 3 puntos e incluso 6 puntos en uno de ellos, lo cual hace más razonable la disminución de ésta. Como se describió además, en un buen número de pacientes disminuyó la fibrosis e inflamación en 3 o más puntos, lo cual es más reproducible y comparable en la práctica de acuerdo a estudios previos15,23,24. Incluso observamos que la AH se atenuó significativamente en todos los pacientes, siendo más significativo en los que la fibrosis mejoró o incluso se mantuvo sin cambios, si bien no es posible asegurar esto último dada la heterogeneidad del compromiso histológico.
Por otro lado, se confirmó nuevamente la relación entre la mejoría significativa del puntaje de inflamación histológica en el subgrupo de pacientes en que mejoró la fibrosis y más notorio aún, en los que este valor fue de al menos dos puntos. Esto refuerza la hipótesis del estímulo fibrogénico generado por la inflamación hepática.
En conclusión, el presente trabajo confirma que existe evidencia suficiente para plantear la mejoría de la fibrosis e inflamación con el tratamiento inmunosupresor en la HAI, incluyendo algunos casos con cirrosis histológica, mediado por su acción anti-inflamatoria, anti-fibrogénica y pro-degradación fibrilar en la matriz extracelular hepática. Esto puede explicar el excelente pronóstico observado en esta enfermedad, siendo interesante el estudio a futuro de marcadores no invasivos de fibrosis y los factores asociados a la respuesta individual a la terapia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.