Los enfermos de Crohn se encuentran en riesgo de desarrollar osteoporosis, en la que el proceso inflamatorio parece tener una importancia creciente. Presentamos un estudio transversal con el fin de valorar la situación del metabolismo óseo y los factores de osteoclastogénesis (ligando del receptor activador del NFκB -RANKL- y la osteoprotegerina -OPG-), además del receptor soluble del TNF-α tipo I (sTNF-RI) en enfermos de Crohn, comparando según el grado de actividad de la enfermedad.
MétodoSe determinó en 64 enfermos de Crohn de la provincia de Granada la densidad mineral ósea (DMO) mediante absorciometría dual por rayos X, y los marcadores de formación (fosfatasa alcalina ósea –bALP- y osteocalcina –OC-) y resorción ósea (fosfatasa ácida tartrato resistente –TRAP- y telopéptido carboxiterminal del procolágeno tipo I –CTX-), así como el RANKL, la OPG y el sTNF-RI, mediante inmunoensayo.
ResultadosEl porcentaje de pacientes con Z-score ≤-2 en CF o CL fue del 20,3%, siendo mayor en aquellos con enfermedad activa, aunque no de forma significativa. Este porcentaje fue solamente mayor en aquellos pacientes que tomaban corticoides (11,1 vs. 9,1%; p=0,001). Los enfermos más activos presentaron niveles de TRAP más elevados, sin encontrar diferencias significativas en cuanto a la DMO. Sí las hubo con relación a los niveles de TRAP con respecto a los niveles de proteína C reactiva. No se encontró relación entre los niveles de OPG, RANKL y sTNF-RI, y la DMO o la actividad de la enfermedad.
ConclusionesLa prevalencia de una DMO entre nuestros pacientes fue alta. Los resultados con respecto a los marcadores de recambio óseo sugieren que resorción ósea estaría incrementada, posiblemente en relación con la actividad de la enfermedad, sin un aumento compensatorio de la formación ósea.
Patients with Crohn's disease are at risk of developing osteoporosis, a disease in which the inflammatory process seems to be gaining importance. We performed a cross-sectional study to evaluate bone metabolism, osteoclastogenic factors [receptor activator of NF-kB ligand (RANK-L) and osteoprotegerin (OPG)] and soluble tumor necrosis factor-α receptor I (sTNF-RI) in patients with Crohn's disease and to correlate the findings with the degree of disease activity.
MethodSixty-four patients with Crohn's disease from the province of Granada (Spain) were included in this study. Bone mineral density (BMD) was studied through dual X-ray absorptiometry. Immunoassay was used to assess markers of bone formation [bone alkaline phosphatase (bALP) and osteocalcin (OC)] and bone resorption [tartrate resistant acid phosphatase (TRAP) and carboxyterminal telopeptide of type I procollagen (CTX)] as well as RANKL, OPG and sTNF-RI.
ResultsThe percentage of patients with a Z-score ≤-2 in the femoral neck or lumbar spine was 20.3% and was higher in patients with active disease, although this difference was not significant. This percentage was only higher in patients receiving corticosteroids (11.1 vs. 9.1%; P=.001). Patients with the highest disease activity had higher TRAP levels. No significant differences were found in BMD but significant differences were found in TRAP levels with respect to C-reactive protein concentrations. No association was found between levels of OPG, RANKL and sTNF-RI and BMD or disease activity.
ConclusionsA substantial proportion of our patients had low BMD. Levels of bone turnover markers suggested higher bone resorption, possibly in relation to disease activity, without a compensatory increase in bone formation.
La enfermedad de Crohn (EC) es un proceso inflamatorio crónico que puede presentar, además de la afectación gastrointestinal, diversas manifestaciones extraintestinales1. Recientemente existe un interés cada vez mayor por una de estas manifestaciones extraintestinales: la osteoporosis. La presencia de una densidad mineral ósea (DMO) baja en la enfermedad inflamatoria intestinal (EII) fue comunicada por primera vez por Genant et al en 19762. Son numerosos los estudios que han permitido documentar desde entonces la presencia de una pérdida de masa ósea, que oscila entre el 7 y el 42%3-12. Sin embargo, el incremento del riesgo de fracturas que cabría esperar en la EC respecto a la población general no está bien establecido. Mientras que, por ejemplo, algunos autores como Bernstein et al detectaron un aumento del riesgo total de fractura del 47%13, y Vestergaard et al encontraron un incremento del riesgo total de fractura en mujeres con EC (RR 2,5)14, otros no detectaron un aumento de la incidencia de fracturas15. Además, los estudios con marcadores de remodelado óseo (MRO) han tenido resultados contradictorios16.
La etiología de la osteoporosis en la EC tendría un origen multifactorial. A los factores comunes al resto de la población, habría que añadir otros más específicos, como la influencia genética, la deficiencia de vitamina D, y otros déficit nutricionales, el tratamiento con glucocorticoides, alteraciones hormonales y el proceso inflamatorio en sí14,17-19. Con respecto a este último, se piensa que la propia enfermedad provocaría disminución de la masa ósea, quizá mediada por un incremento de la producción de citoquinas, entre ellas el factor de necrosis tumoral α (TNF-α), a nivel intestinal producidas por los linfocitos T y otras células inflamatorias, lo cual daría lugar a una activación de los osteoclastos, sin un aumento compensatorio de la formación ósea10,20-22. El sistema constituido por el ligando del receptor activador del NFκB (RANKL) y la osteoprotegerina (OPG) representan un potencial nexo de unión entre la inflamación y la homeostasis ósea. El equilibrio entre el RANKL y la OPG es de vital importancia en la osteoclastogénesis, de modo que la interacción del RANK, en la superficie de los osteoclastos, con su ligando RANKL induce la osteoclastogénesis, mientras que la OPG procedente de los osteoblastos bloquea dicha interacción, inhibiendo la formación de osteoclastos. Las citoquinas pro-inflamatorias inducen la formación de RANKL, e incluso los linfocitos T activados pueden activar la osteoclastogénesis directamente a través del RANKL, con la consiguiente pérdida de masa ósea19. Estudios recientes sugieren que las alteraciones en el equilibrio entre RANKL y OPG podrían ser responsables de la pérdida de masa ósea en pacientes con EII. Así, los niveles plasmáticos de OPG y RANKL se correlacionan con la DMO y el tratamiento para la EII23. En un estudio se vio que los niveles plasmáticos de OPG se encontraban elevados 2,4 veces en la EC y 1,9 veces en la CU. Los niveles elevados de OPG podrían representar una respuesta homeostática continua, en un intento por contrarrestar la osteoclastogénesis inducida por el RANKL o el TNF-α, y así mantener una masa ósea normal24.
Se ha comprobado que los pacientes con EC presentan niveles elevados del receptor soluble del TNF-α tipo I (sTNF-RI) y tipo II (sTNF-RII) en suero, y que sus niveles se correlacionan con la actividad de la enfermedad25-29. Los niveles de los receptores solubles del TNF-α en suero se correlacionan bien con los de este, presentando la determinación de los receptores solubles la ventaja adicional de que éstos poseen una mayor estabilidad, puesto que el TNF-α es rápidamente eliminado de la circulación27.
El objetivo de este estudio transversal es la valoración de la prevalencia de la DMO baja en una cohorte de pacientes con EC, además de los niveles de marcadores bioquímicos de remodelado óseo, y los posibles factores relacionados, así como OPG, RANKL y sTNF-RI en los mismos, comparando entre enfermos según el grado de actividad.
Material y métodosPoblaciónSe incluyeron un total de 64 pacientes diagnosticados de EC de la provincia de Granada, con edades comprendidas entre los 18 y 65 años, tras la firma de un consentimiento informado. Fueron excluidos del estudio aquellos pacientes que hubiesen recibido tratamiento con algún fármaco anti-TNF en los dos años previos, o presentasen antecedentes de patología metabólica ósea, diferente de la osteoporosis, comprobado mediante la historia clínica, exploración y estudio analítico (determinaciones séricas de calcio, fósforo, creatinina y urea y en orina de calcio y creatinina). Las características clínico-demográficas de los mismos se describen en la tabla 1. Todas las mujeres incluidas en este estudio eran premenopáusicas.
Características clínico-demográficas de la población de estudio
| Variable | Valor |
| Edad (años) | 34,4±10,5 |
| Sexo (hombres/mujeres) | 52%/48% |
| IMC (kg/m2) | 23,3±4 |
| Fumadores | 41% |
| Forma de la enfermedad (luminar/fistulizante) | 68%/32% |
| CDAI | 263,1±122,2 |
| Activos (CDAI≥150)/inactivos (CDAI<150) | 20,3%/79,7% |
| PCR (mg/ml) | 1,5±2,2 |
| 25OHD3(ng/ml) | 18,8±9,8 |
| Tratamientos concomitantes: | |
| Prednisona | 17% |
| Mesalazina | 84% |
| Mercaptopurina | 5% |
| Azatioprina | 67% |
| Metotrexato | 1,6% |
25OHD3: 25-hidroxi-vitamina D; CDAI: índice de actividad de la enfermedad de Crohn (Crohn's Disease Activity Index); IMC: índice de masa corporal; PCR: proteína C reactiva.
Las variables continuas se expresan como media±DE. Las variables categóricas se presentan como n (%).
Se determinó la DMO (g/cm2) en cuello de fémur (CF) y columna lumbar (CL) mediante absorciometría dual por rayos X (DXA) (Hologic, Inc., Bedford, MA, EE. UU.). Atendiendo a las recomendaciones de la Internacional Society of Clinical Densitometry (ISCD), se definió una DMO anormal como un T-score ≤-2,5, o un Z-score ≤-2,0, en aquellos sujetos menores de 50 años30,31. Se empleó el índice CDAI (Crohn's Disease Activity Index) para valorar la actividad de la enfermedad32. Se consideraron como posibles factores relacionados el tabaquismo, un índice de masa corporal (IMC) bajo, el uso de esteroides orales, un proteína C reactiva (PCR) superior a 0,5mg/ml determinada mediante inmunoturbidimetría potenciada con partículas (Roche Diagnostics GmbH, Mannheim, Alemania), y un nivel bajo (<20 ng/ml) de 25-hidroxi-vitamina D (25OHD3)33 medida mediante inmunoensayo (DiaSorin, Stillwater, Minnesota, EE. UU.). Como marcadores de formación ósea se determinaron niveles en suero de fosfatasa alcalina ósea (bALP) mediante enzimoinmunoensayo (Immunodiagnostic Systems Ltd., Boldon, Reino Unido) y osteocalcina (OC) mediante inmunoensayo directo por quimiluminiscencia (DiaSorin, Stillwater, Minnesota, EE. UU. Finalmente, como marcadores de resorción ósea se valoraron los niveles en suero de fosfatasa ácida tartrato resistente (TRAP) mediante la técnica de ELISA (Immunodiagnostic Systems Ltd., Boldon, Reino Unido) y telopéptido carboxiterminal del procolágeno tipo I (CTX) mediante un inmunoensayo de electroquimioluminiscencia (Roche Diagnostics GmbH, Mannheim, Alemania). La OPG se determinó mediante enzimoinmunoensayo (OPG ELISA, BIOMEDICA-GRUPPE, Wien, Austria), al igual que el RANKL (ampli-sRANKL human, BIOMEDICA-GRUPPE, Wien, Austria) y el sTNF-RI (Quantikine Human sTNF RI Immunoassay, R&D Systems, Inc., Minneapolis, MN, EE. UU.).
Análisis estadísticoSe empleó el programa STATA versión 10.0 (StataCorp LP College Station, TX, EE. UU.). Para la descripción de las variables categóricas se calcularon porcentajes, y para la de las variables numéricas, se calcularon las medias ± desviación estándar. Para la comparación de porcentajes se utilizó el test de la Chi cuadrado y para la comparación de grupos con respecto a una variable cuantitativa se utilizó la t-Student o el test de Welch, según fuese necesario. La significación estadística se definió como una p<0,05.
ResultadosEn las tablas 2 y 3se presentan los valores de las determinaciones bioquímicas obtenidos, y en la tabla 4 los de las variables densitométricas obtenidas.
Valores de las determinaciones analíticas obtenidos (expresadas como media±DE) atendiendo al valor del Z-score
| Variable | Total | Z-score ≤-2 | Z-score >-2 | p |
| Marcadores de formación ósea | ||||
| bALP (μg/l) | 14,62±6,55 | 13,8±7,0 | 14,8±6,5 | NS |
| OC (ng/l) | 18,2±12,7 | 17,9±11,2 | 18,3±13,1 | NS |
| Marcadores de resorción ósea | ||||
| TRAP (U/l) | 2,10±0,77 | 2,16±0,70 | 2,09±0,80 | NS |
| CTX (ng/ml) | 0,547±0,349 | 0,564±0,232 | 0,543±0,374 | NS |
| OPG (pg/ml) | 77,0±30,0 | 70,6±21,2 | 78,6±30,6 | NS |
| RANKL (pg/ml) | 1,2±1,8 | 0,0±0,4 | 1,6±2,0 | 0,045 |
| sTNF-RI (pg/ml) | 271,61±92,79 | 281,08±78,70 | 269,20±96,97 | NS |
BALP: fosfatasa alcalina ósea; CDAI: índice de actividad de la enfermedad de Crohn (Crohn's disease activity index); CTX: telopéptido carboxiterminal del colágeno tipo I; NS: no significativo; OC: osteocalcina; OPG: osteoprotegerina; RANKL: ligando del receptor activador del NFκB; sTNF-RI: receptor soluble del TNF-α tipo I; TRAP: fosfatasa ácida tartrato resistente.
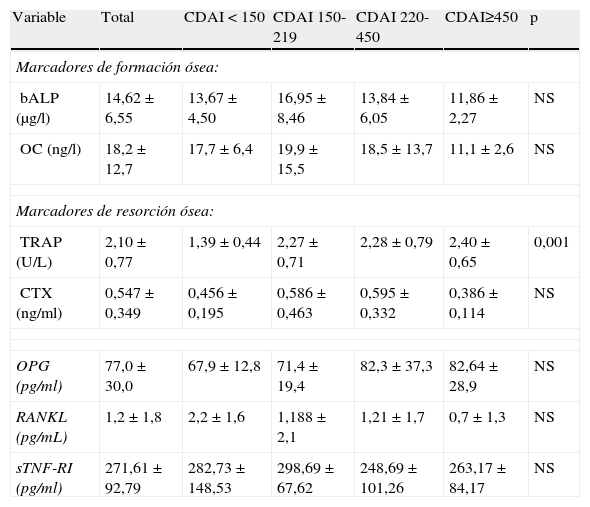
Valores de las determinaciones analíticas obtenidos (expresadas como media±DE) atendiendo al grado de actividad según la escala CDAI (inactivo [<150], leve [150-219], moderada [220-450] y grave [>450]
| Variable | Total | CDAI<150 | CDAI 150-219 | CDAI 220-450 | CDAI≥450 | p |
| Marcadores de formación ósea: | ||||||
| bALP (μg/l) | 14,62±6,55 | 13,67±4,50 | 16,95±8,46 | 13,84±6,05 | 11,86±2,27 | NS |
| OC (ng/l) | 18,2±12,7 | 17,7±6,4 | 19,9±15,5 | 18,5±13,7 | 11,1±2,6 | NS |
| Marcadores de resorción ósea: | ||||||
| TRAP (U/L) | 2,10±0,77 | 1,39±0,44 | 2,27±0,71 | 2,28±0,79 | 2,40±0,65 | 0,001 |
| CTX (ng/ml) | 0,547±0,349 | 0,456±0,195 | 0,586±0,463 | 0,595±0,332 | 0,386±0,114 | NS |
| OPG (pg/ml) | 77,0±30,0 | 67,9±12,8 | 71,4±19,4 | 82,3±37,3 | 82,64±28,9 | NS |
| RANKL (pg/mL) | 1,2±1,8 | 2,2±1,6 | 1,188±2,1 | 1,21±1,7 | 0,7±1,3 | NS |
| sTNF-RI (pg/ml) | 271,61±92,79 | 282,73±148,53 | 298,69±67,62 | 248,69±101,26 | 263,17±84,17 | NS |
BALP: fosfatasa alcalina ósea; CDAI: índice de actividad de la enfermedad de Crohn (Crohn's disease activity index); CTX: telopéptido carboxiterminal del colágeno tipo I; NS: no significativo; OC: osteocalcina; OPG: osteoprotegerina; RANKL: ligando del receptor activador del NFκ≡; sTNF-RI: receptor soluble del TNF-α tipo I; TRAP: fosfatasa ácida tartrato resistente.
Valores de las variables densitométricas obtenidos (expresadas como media±DE)
| Variable | Cuello de fémur | Columna lumbar |
| Total | ||
| Z-score | -0,72±0,94 | -0,90±1,23 |
| T-score | -0,98±0,96 | -1,08±1,24 |
| DMO (g/cm2) | 0,783±0,192 | 0,946±0,132 |
| CDAI<150 | ||
| Z-score | -0,63±1,02a | -0,90±1,10a |
| T-score | 0,76±1,00a | -0,98±1,10a |
| DMO (g/cm2) | 0,785±0,121a | 0,954±0,121a |
| CDAI 150-219 | ||
| Z-score | -0,53±1,06a | -0,98±1,25a |
| T-score | -0,87±1,15a | -1,15±1,24a |
| DMO (g/cm2) | 0,792±0,139a | 0,950±0,132a |
| CDAI 220-450 | ||
| Z-score | -,849±,8060a | -,868±1,2773a |
| T-score | -1,12±0,80a | -1,09±1,27a |
| DMO (g/cm2) | 0,784±0,260a | 0,936±0,136a |
| CDAI >450 | ||
| Z-score | -1,02±1,00a | -0,78±1,61a |
| T-score | -1,36±0,89a | -0,98±1,70a |
| DMO (g/cm2) | 0,739±0,192a | 0,954±0,178a |
CDAI: índice de actividad de la enfermedad de Crohn (Crohn's disease activity index); DMO: densidad mineral ósea.
Con respecto a la DMO, un 4,7% de los pacientes presentó un Z-score ≤-2 en CF, y un 20,3% en CL, siendo este valor de 20,3% para un Z-score ≤-2 en CF o CL. En función del T-score, el 4,69 y el 46,88% presentó, respectivamente, criterios de osteoporosis y de osteopenia en CF, mientras que dichos valores en CL fueron de 6,25 y 42,19%, respectivamente. El porcentaje de pacientes con Z-score ≤-2 en CF o CL era mayor en aquellos que presentaban un CDAI ≥150 (15,9 vs. 4,8%), aunque no de forma significativa. Los pacientes con mayor grado de actividad presentaban una tendencia a una menor masa ósea (sobre todo a nivel de CF de fémur), si bien no de forma significativa (tabla 4). El porcentaje antes referido fue igualmente mayor en aquellos que eran fumadores (12,7 vs. 7,9%), tomaban corticoides orales (11,1 vs. 9,1%), presentaban una PCR elevada (14,1 vs. 6,3%), niveles bajos de 25OHD3 (14,1 vs. 6,3%), y el tiempo de evolución de su enfermedad era igual o superior a 6 meses (66,7% vs. 33,3%), siendo menor en aquellos con un IMC inferior a 20kg/m2 (3,1 vs. 17,2%); sólo en la toma de corticoides orales diferencia fue estadísticamente significativa (p=0,001).
En cuanto a los de MRO, solamente encontramos elevados los niveles de CTX, mientras que los de TRAP, OC y bALP se encontraban dentro del rango de normalidad (aunque estos dos últimos próximos al límite inferior de normalidad). Los pacientes con Z-score ≤-2 presentaron niveles ligeramente menores de OC y bALP (17,9±11,2 vs. 18,3±13,1ng/ml, y 13,8±7,0 vs.14,8±6,5μg/ml, respectivamente), y similares de TRAP y CTX (2,16±0,70 vs. 2,09±0,80 U/l y 0,564±0,232 vs. 0,543±0,374 ng/ml) con respecto a los que presentaban un Z-score>-2, sin encontrarse diferencias estadísticamente significativas. Los niveles de TRAP aumentaban de forma significativa con el grado de activad de la enfermedad medida por el CDAI, pero no en el resto de MRO medidos (tabla 3). Los niveles de TRAP también se encontraban más elevados en aquellos con una PCR >0,5mg/dl (2,31±0,76 vs. 1,90±0,74 U/l; p=0,036), si bien no se encontraron diferencias significativas en otras circunstancias. Los pacientes que tomaban prednisona presentaban niveles más bajos de OC que los que no (9,9±3,3 vs. 19,9±13,2 ng/l), rozando esta diferencia la significación estadística. No hubo diferencias significativas en los niveles de bALP ni de CTX en ninguna de las circunstancias.
Por último, los niveles de OPG y RANKL fueron menores en los pacientes con un Z-score tanto en CF como en CL ≤-2 con respecto a los que presentaban un Z-score >-2 (tabla 2). Sólo en el caso de los niveles de RANKL en pacientes con un Z-score ≤-2 la diferencia fue estadísticamente significativa (p=0,045). Valorando según la actividad de la enfermedad, los pacientes con una mayor puntuación en la escala CDAI tenían mayores niveles de OPG y menores de RANKL, pero no de forma significativa (tabla 3). En relación a los niveles de sTNF-RI, éstos fueron algo más elevados, aunque no significativamente, en los pacientes con un Z-score tanto en CF como en CL ≤-2 (tabla 2), sin encontrarse diferencias estadísticamente significativas respecto al grado de actividad (tabla 3).
DiscusiónLos resultados obtenidos muestran un alto porcentaje de masa ósea baja, sobre todo a nivel de hueso trabecular. Esta prevalencia es significativa, teniendo en cuenta la edad de la población de estudio y la ausencia de mujeres posmenopáusicas. Desde la primera descripción de una DMO baja en la EII en 19762, son numerosos los estudios que han permitido documentar la presencia de una pérdida de masa ósea, que puede alcanzar hasta el 42%, según el estudio3-12. La amplia variabilidad en los resultados obtenidos en los mismos podría estar influenciada por diversos factores, incluyendo los criterios utilizados para el diagnóstico, el método y la localización del esqueleto donde se llevan a cabo las mediciones y la selección de los pacientes, entre otros. No obstante, estos datos han venido a poner de manifiesto que los pacientes con EII tienen una menor masa ósea cuando se comparan con una población de controles sanos6,34-36.
Respecto a la posible influencia de la actividad de la enfermedad sobre la DMO, no hemos encontrado diferencias estadísticamente significativas entre los enfermos activos e inactivos, si bien sí hemos observado una tendencia a una menor DMO entre los primeros. Dentro los otros factores valorados en relación a la osteoporosis, sólo los pacientes que toman corticosteroides orales han presentado una menor DMO de forma estadísticamente significativa. La pérdida de masa ósea es más frecuente en pacientes con EII que han recibido tratamiento con corticosteroides, sobre todo en los meses iniciales del tratamiento37. Estos inhiben la formación de hueso, aumentan su resorción, disminuyen la absorción de calcio y aumentan su excreción renal. En un estudio se comunicó que la incidencia de osteopenia era aproximadamente el doble en pacientes que habían recibido tratamiento con corticosteroides respecto a los que no (52% frente al 28%)21. En general, se acepta que la DMO en pacientes con EII se correlaciona de forma inversa con la dosis acumulada de GC a lo largo de la vida8,21,34,38. No obstante, es difícil distinguir el grado de contribución del uso de estos fármacos sobre el hueso en comparación con la actividad de la enfermedad, ya que una actividad elevada y un grado de inflamación elevado son indicaciones para el uso de esteroides. El resto de los factores valorados (tabaquismo, PCR elevada, niveles bajos de 25OHD3, y tiempo de evolución de su enfermedad era ≥6 meses), si bien alcanzaron una significación estadística, podrían tener algún efecto entre nuestros pacientes, en consonancia con otros estudios17. Llama la atención los datos referentes al IMC, que resultan un tanto contradictorios, ya que la DMO parece relacionarse de forma directamente proporcional a la masa corporal (sobre todo magra y a nivel de CL)39, sin que podamos dar una explicación lógica a los mismos.
En cuanto a los MRO, sólo los niveles de CTX se encontraban elevados en nuestro estudio. Atendiendo a la actividad de la enfermedad, en cambio, sólo los niveles de TRAP se encontraban elevados de forma significativa. También lo estaban en aquellos pacientes con una PCR >0,5mg/dl. Sin embargo, no se encontraron diferencias significativas en otras circunstancias. Los pacientes que tomaban prednisona presentaban niveles más bajos de OC que los que no (9,9±3,3 vs. 19,9±13,2 ng/l), rozando esta diferencia la significación estadística. No hubo diferencias significativas en los niveles de bALP en ninguna de las circunstancias. Si valoramos los MRO en relación a la DMO, los pacientes con Z-score ≤-2 presentaron niveles ligeramente menores de OC y bALP, y similares de TRAP y CTX con respecto a los que presentaban un Z-score >-2, pero sin alcanzarse la significación estadística. Aunque estos resultados no son concluyentes, podría deducirse que en nuestros pacientes existe un desequilibrio en el metabolismo mineral óseo. De este modo, la resorción ósea estaría incrementada, posiblemente en relación a la actividad de la enfermedad, sin que se produjese un aumento compensatorio de la formación, si no más bien, al contrario. Los estudios existentes en relación a los niveles MRO en la EII, tanto de formación como de resorción, tampoco han aportado resultados concluyentes sobre si aquéllos se encuentran alterados o no. Esta confusión se debe, en parte, a lo heterogéneo de los estudios, muchos de ellos de carácter transversal, con enfermos unos en fase activa y otros inactiva, y no siempre comparando con controles sanos, y con diferentes tratamientos, como los corticosteroides o inmunosupresores, que pueden tener una influencia sobre los marcadores de metabolismo mineral superior a la provocada por la propia enfermedad. Además, no hay uniformidad en los marcadores de formación y recambio óseos medidos16. De este modo, existe un grupo de autores que han detectado niveles bajos de OC en suero16,40, aunque algunos sólo en la colitis ulcerosa, y no en la EC41 o incluso también elevación de la bALP16. Otros, en cambio, encontraron una elevación en suero del CTX42-45, mientras que otros no encontraron alteración en los niveles de OC y/o CTX17,42,43. Existen también matizaciones en estos hallazgos, como la existencia de niveles de OC y CTX en los pacientes activos en el estudio de Silvennoinen et al17,43.
Finalmente, en lo que respecta la sistema OPG/RANKL, los niveles de OPG fueron más elevados en los pacientes activos y los de RANKL en los inactivos, aunque no de forma significativa. En cuanto a la DMO, los niveles de RANKL fueron menores en los pacientes con un Z-score tanto en CF como en CL ≤-2 con respecto a los que presentaban un Z-score >-2, si bien sólo en el caso de los niveles de RANKL se alcanzó significación estadística. Este hallazgo podría reflejar un incremento de la actividad resortiva osteoclástica sin una respuesta compensatoria por parte de los osteoblastos en nuestros pacientes. Con relación a los niveles de sTNF-RI, estos fueron algo más elevados en los pacientes con un Z-score tanto en CF como en CL ≤-2 respecto a los que presentaban un Z-score >-2, aunque sin alcanzarse la significación estadística, lo que podría apuntar al papel del proceso inflamatorio en la pérdida de mas ósea en la EC. Esto podría ir en consonancia con la teoría de la influencia de la actividad inflamatoria sobre la pérdida de masa ósea en la EC. No encontramos diferencias estadísticamente significativas en cuanto a los niveles de sTNF-RI en relación a la actividad de la enfermedad. Tampoco existe unanimidad en la literatura con respecto a los hallazgos en relación al sistema OPG/RANKL. Mientras que Moschen et al encontraron una elevación de los niveles de OPG con respecto a la población sana, que se correlacionaba negativamente con la DMO, pero sin encontrara diferencias con respecto al RANKL, otros autores sólo hallaron niveles elevados de OPG, únicamente en mujeres con EC23,24. Posteriormente, en otro estudio, los niveles de OPG y RANKL se encontraban elevados en los pacientes con EC, los cuales presentaban una correlación negativa y estadísticamente significativa con la DMO. En este mismo estudio, los niveles de TNF-α también estaban elevados en los pacientes que presentaban una DMO baja, los cuales además presentaban una fuerte asociación con los niveles de RANKL, y una correlación negativa con la DMO45.
En resumen, nuestro estudio muestra una prevalencia importante de una DMO baja entre nuestros pacientes, presentando éstos un aumento de la resorción ósea, posiblemente en relación con la actividad de la enfermedad. Con respecto al sistema OPG/RANKL y el sTNF-RI, aunque nuestros datos no son concluyentes, sugieren igualmente la participación de la inflamación activa en la pérdida de masa ósea en la EC. Nuestro estudio presenta una serie de inconvenientes. Además del limitado número de sujetos, existe una importante heterogeneidad de los mismos con respecto al grado de actividad y los tratamientos recibidos. No obstante, consideramos que estos datos contribuyen al continuo debate sobre la importancia de la pérdida de masa ósea y sus mecanismos fisiopatológicos, aportando información de un área geográfica poco estudiada a este respecto, como es la cuenca mediterránea, y más en concreto, España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren expresar su agradecimiento a B. Martínez, A. Abadía, R. Arcas y M. Quintana por su inestimable ayuda técnica en la realización de este estudio.