La colitis ulcerosa (CU) es una patología crónica del colon caracterizada por inflamación continua de la mucosa que afecta al recto, y en continuidad con el resto del colon con variabilidad en la extensión, con un curso intermitente. Aunque el arsenal terapéutico es amplio, en algunos pacientes no se consigue mantener la actividad inflamatoria en remisión. Los fármacos anti-TNFα son uno de los tratamientos con mayor eficacia y más empleados en los casos de actividad moderada-grave. La aparición de infecciones oportunistas es uno de los principales efectos secundarios de esta terapia. Otro efecto adverso menos frecuente es el desarrollo de enfermedad desmielinizante por afectación del sistema nervioso1-3.
A propósito de lo anterior, se presenta el caso de una mujer de 56 años de edad, diagnosticada de pancolitis ulcerosa a los 44 años de edad, tras debutar con un brote grave corticorrefractario que precisó ciclosporina de rescate y 6-mercaptopurina (6-MP) de mantenimiento. A los pocos meses, presentó un nuevo brote grave que precisó infliximab (anti-TNFα) 5 mg/kg a las semanas 0, 2 y 6, con posterior intensificación a 5 mg/kg cada cuatro semanas por actividad endoscópica grave. Tras un año de tratamiento con remisión clínica, se retiró infliximab, manteniendo 6-MP, que se suspendió por infecciones urinarias de repetición y leucopenia. Los siguientes cuatro años estuvo en tratamiento con mesalazina oral 2 g/día, con buena respuesta. Posteriormente, requirió reiniciar infliximab 5 mg/kg a las semanas 0, 2 y 6, por reagudización clínica moderada-grave. Sin embargo, tras la inducción presentó una reacción infusional grave a infliximab, y se cambió por adalimumab (anti-TNFα) 40 mg sc cada dos semanas de mantenimiento. No alcanzó una respuesta clínica adecuada, a pesar de añadir granulocitoaféresis y supositorios de tacrolimus.
Ante la falta de respuesta, se inició vedolizumab (antiintegrina α4β7) 300 mg iv cada ocho semanas, con intensificación posterior a cada cuatro semanas. Sin embargo, la CU se mantuvo crónicamente activa con niveles elevados de calprotectina fecal. Tras valorar tratamiento quirúrgico, éste fue desestimado por la paciente, se decidió iniciar golimumab (anti-TNFα) 200/100 mg a las 0 y dos semanas, intensificándose a 100 mg sc cada dos semanas de mantenimiento por respuesta parcial tras la inducción.
A los nueve meses del tratamiento, comenzó con disestesias en extremidades inferiores. En la RM cerebral se objetivaron lesiones de perfil desmielinizante, típicas de esclerosis múltiple (EM) en cuerpo calloso, periventriculares y yuxtacorticales. Se planteó el diagnóstico diferencial entre esclerosis múltiple (EM), neuromielitis óptica y encefalomielitis aguda diseminada. Ante la presencia de bandas oligoclonales intratecales (hallazgo encontrado en el 80% de EM) y las lesiones cerebrales típicas de esta enfermedad, se estableció el diagnóstico de EM.
Dado que el único tratamiento que llevaba la paciente era golimumab y la asociación descrita entre el tratamiento anti-TNFα y la EM1-3, se atribuyó al golimumab como desencadenante de la EM. Este evento adverso no guardó relación con la dosis utilizada.
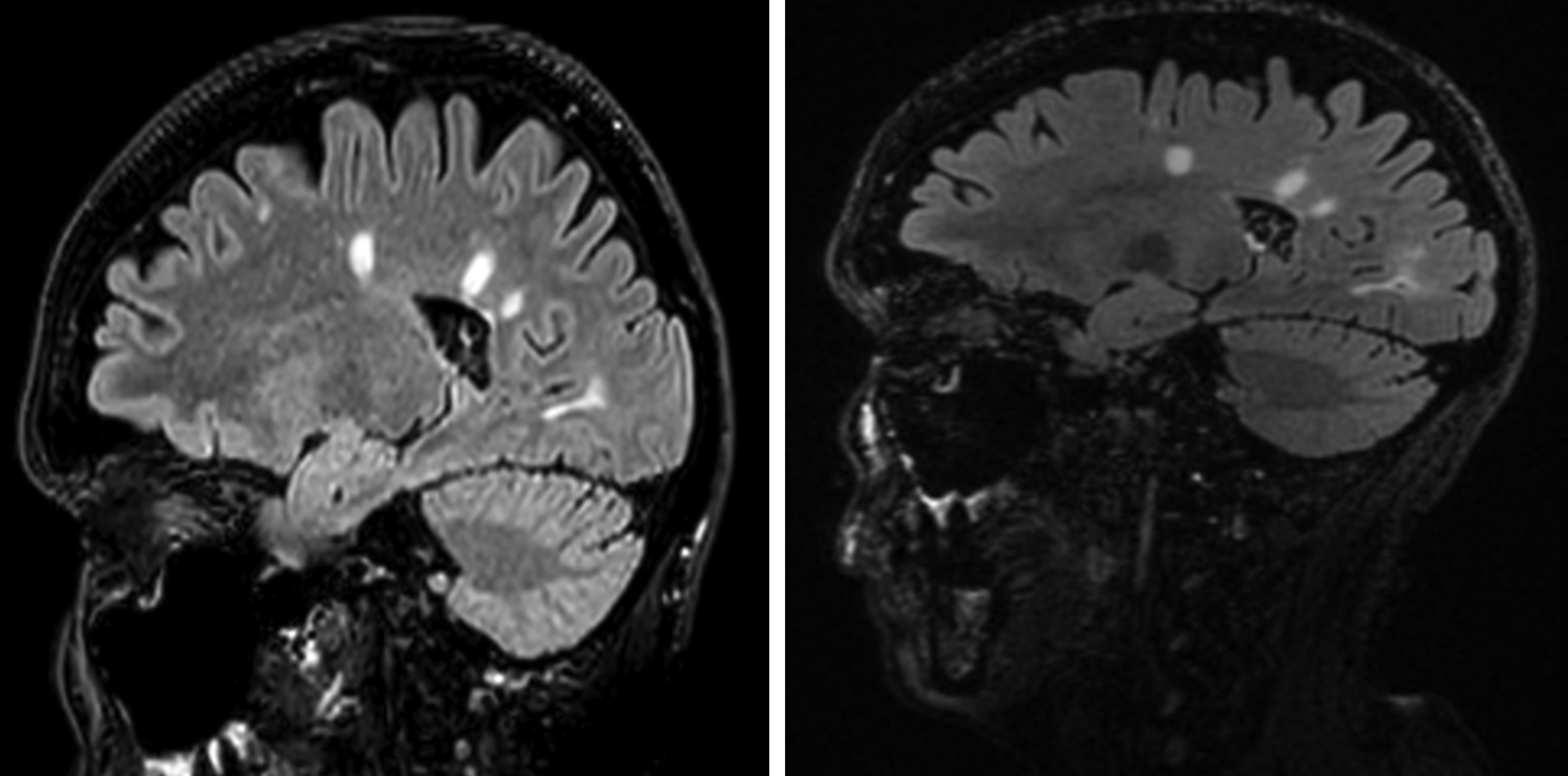
Ante la presencia de Ac antiVJC positivos, no se administró natalizumab y se inició fingolimod oral (modulador del receptor S1P) 0,5 mg/día y bolos de 6-metilprednisolona de 1 g al día vía oral durante tres días, con excelente respuesta. En la RMN de control al año del diagnóstico (fig. 1), se objetivó estabilidad de las lesiones desmielinizantes.
RMN cerebral: presencia de lesiones hipercaptantes digitiformes en secuencia FLAIR periventriculares. La imagen de la izquierda corresponde a la RMN al diagnóstico (octubre 2017) y la de la derecha a la RMN de control (junio 2018), sin objetivar aparición de nuevas lesiones desmielinizantes.
Llama la atención, desde el punto de vista de la CU, que tras fracaso a diferentes líneas de tratamiento médico, la paciente presentó una respuesta completa clínica y endoscópica a las 12 semanas del inicio del fingolimod. La paciente lleva actualmente más de tres años en tratamiento con fingolimod.
La patogenia de la EM con la terapia anti-TNFα aún no está aclarada1,3. Están emergiendo nuevos fármacos para la CU, destacando los fármacos moduladores del receptor S1P (fingolimod, aprobado para la EM y ozanimod, de segunda generación)4,5. El bloqueo de dicho receptor condiciona el secuestro de linfocitos en los órganos linfoides periféricos, lo que dificulta su tránsito a las zonas de inflamación. Estos fármacos podrían ser eficaces en el manejo de la CU y la EM. Aunque se trata de un caso anecdótico de respuesta profunda con fingolimod, esta familia de fármacos podría ser una opción por uso compasivo en pacientes crónicamente activos y refractarios a los tratamientos farmacológicos actuales, cuya única opción es la cirugía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.