En el momento histórico en el que nos encontramos en el ámbito del tratamiento de la hepatitis C, en que disponemos de fármacos excepcionalmente eficaces y con muy escasos efectos secundarios, se nos plantea el problema del retratamiento en los pacientes que fracasan al mismo. Los factores que influyen en el fracaso son muy diversos, si bien en esta revisión nos vamos a centrar en las resistencias antivirales. Las sustituciones asociadas a resistencias pueden ser tanto basales como inducidas por el tratamiento; estas últimas parece que son las más importantes clínicamente y las que deben ser estudiadas ante la falta de respuesta virológica. En este artículo ofrecemos los últimos datos de ensayos clínicos y estudios en práctica clínica real, y en base a la evidencia actual se ofrecen unas recomendaciones de manejo y retratamiento de estos pacientes.
We are currently living in an unprecedented era of hepatitis C treatment with the availability of highly effective drugs yielding minimal side effects. The problem we currently face is the retreatment of patients refractory to these drugs. Although several factors can influence treatment failure, this review focuses on antiviral resistance. Resistance-associated substitutions may be identified at baseline or be treatment-emergent. The latter seem to be more clinically relevant and must be studied in the event of treatment failure (no virological response). In this article, we present the latest data from clinical trials and studies in real-life clinical practice. Finally, based on this current evidence, we propose some recommendations for the management and retreatment of these patients.
Los antivirales de acción directa (AAD) son en la actualidad el tratamiento de elección para la infección por el virus de la hepatitis C (VHC)1. Estos fármacos consiguen una tasa de respuesta viral sostenida (RVS) por encima del 90% en la práctica totalidad de los grupos poblacionales, siendo solo discretamente menor en los pacientes con infección por el genotipo 3 en estadio cirrótico y que han fracasado a un tratamiento previo. Además, el perfil de seguridad es excelente sobre todo en los regímenes libres de ribavirina (RBV).
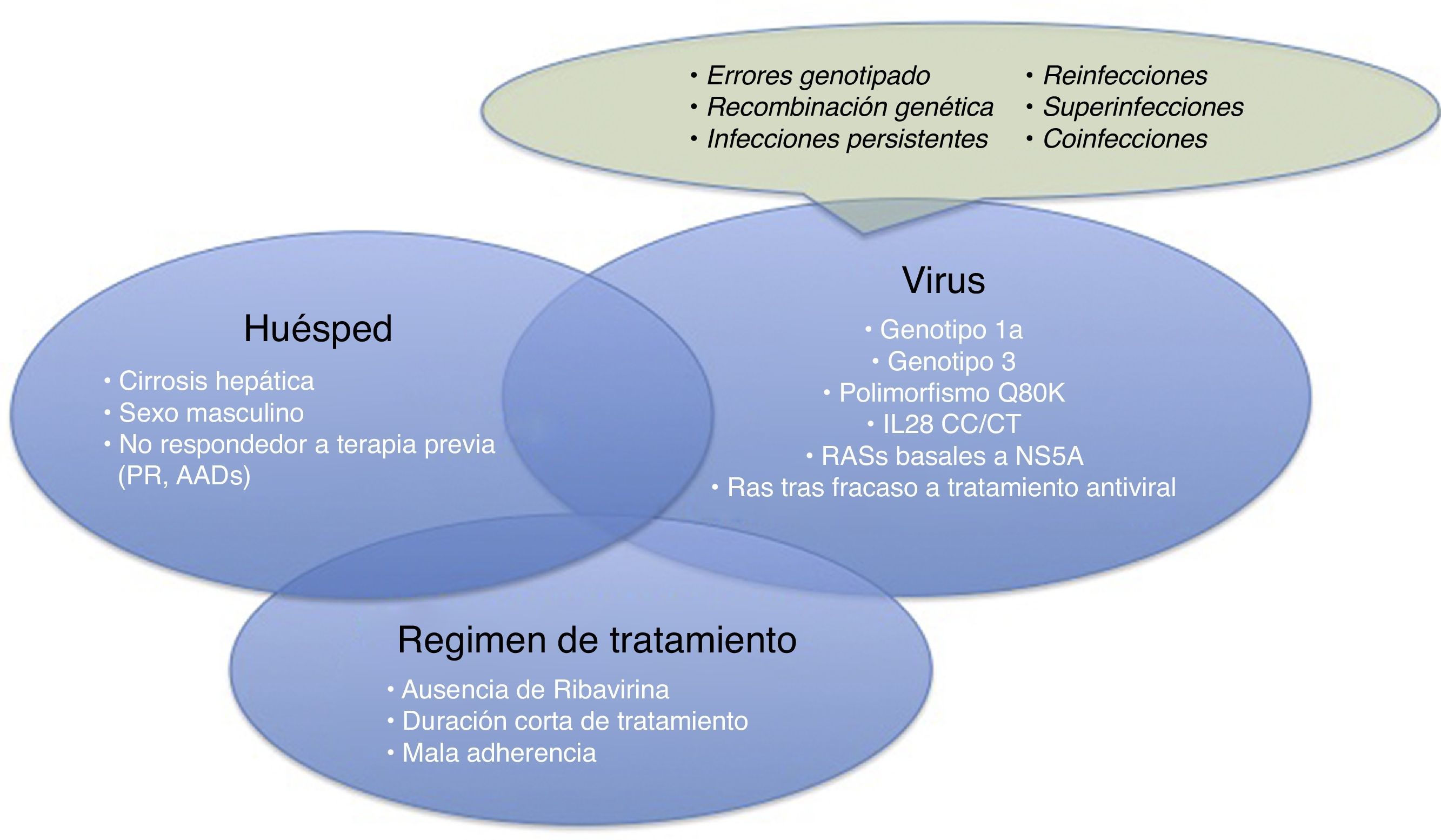
Por lo tanto, en el momento actual, nuestras miradas deben dirigirse a los fracasos terapéuticos que vayamos experimentando. Estos se van a deber a diversos factores, relacionados con el propio huésped, el virus o el tratamiento antiviral elegido (fig. 1). Una de las causas de fracaso de tratamiento con un mayor interés es el desarrollo de sustituciones asociadas a resistencias (RAS). El análisis de las RAS debe de ser preciso. Actualmente el conocimiento de estas ha mejorado notablemente, por lo que sabemos que no todas las RAS tienen trascendencia clínica ni deben de ser analizadas.
El objetivo de esta revisión es profundizar en las RAS, su concepto, importancia clínica, momento de aparición, cuándo analizarlas o no y mediante qué método. En base a este análisis de RAS, definiremos cómo seleccionar el mejor esquema de retratamiento para nuestros pacientes.
Virus de la hepatitis C. Conceptos virológicos y variabilidadEl VHC es un virus ARN de una sola cadena del genero Hepacivirus, de la familia de los flaviviridae descubierto en 19892. El VHC circula en la sangre formando parte de partículas lipídicas y una vez incluido en el hepatocito se libera el ARN para comenzar la translación para la síntesis de la poliproteína que será procesada por las proteasas virales (NS2-3 y NS3-4A) y del huésped. La formación de nuevas copias de ARN la lleva a cabo el complejo replicativo viral compuesto de las proteínas no estructurales (NS3, NS4A, NS4B, NS5A y NS5B), provocando un reordenamiento intracelular de membranas para generar un microambiente para optimizar la replicación viral llamado membranous web, compuesto de vesículas de doble membrana. Y, en último lugar, se produce el ensamblaje en el retículo endoplasmático.
El VHC es un virus dotado de una extraordinaria variabilidad3 explicada por una alta tasa de «turnover» estimada de 2-5h, con una enorme producción de viriones diarios (1012 viriones) por paciente. Además debido a la escasa capacidad de reparación de errores de la ARN polimerasa ARN dependiente4,5 se producen una elevada tasa de mutaciones (10−4 a×10−5 por nucleótido y por ciclo replicativo).
Esta capacidad del VHC hace que se produzcan una gran cantidad de variantes, la mayoría son directamente eliminadas por el sistema inmune o son incapaces de replicarse debido a la pérdida de proteínas codificantes pero otras van a ser capaces de sobrevivir y perpetuar la infección.
De las variantes que van a persistir surgen los diferentes 7 genotipos que difieren entre ellos en su secuencia nucleotídica en un 30-35% y 67 subtipos, cuya diferencia genotípica oscila entre el 20-25%. Además, en un mismo paciente, encontramos una especie dominante (wild type) y diferentes cuasiespecies con una variabilidad de secuencias de hasta el 10%.
Causas de fracaso terapéuticoLos fallos a tratamientos antivirales pueden aparecer en diferentes momentos:
- •
Durante el tratamiento antiviral, denominado rebote o breakthrough.
- •
Una vez finalizado el tratamiento, recaída viral. Es la más frecuente con el uso de AAD.
- •
Nula respuesta al tratamiento antiviral, ausencia primaria de respuesta al tratamiento.
Como ya se ha explicado anteriormente, los antivirales disponibles en la actualidad están dotados de una extraordinaria eficacia, no obstante el 1-7% de nuestros pacientes no consiguen alcanzar la curación6 y esto es debido a muy diversas razones.
Antes de centrarnos en los fracasos en el tratamiento relacionados con el desarrollo de resistencias al VHC, explicaremos brevemente qué otros motivos de fracaso terapéutico existen, resumidos en la figura 1.
- •
Causas relacionadas con el paciente: género masculino, cirrosis compensada, fallo a tratamientos previos (basados en IFN o con AAD)
- •
Causas relacionadas con el virus: genotipo 1a, 3, RAS basales a NS5A, RAS desarrolladas tras el tratamiento con AAD, Q80K (solo en pacientes sometidos a tratamiento con simeprevir [SMV]), polimorfismo desfavorable IL28b.
Además hay que tener en cuenta que aparte de las RAS existen otras causas de fracaso virológico como errores de genotipado, fenómenos de recombinación genética (fenómenos poco frecuentes de entrecruzamiento de intermediarios de ARN que da lugar a la recombinación de 2 cepas virales, por ejemplo un virus híbrido con un genotipo 1 y 2), infecciones persistentes, reinfecciones, sobreinfección (evidencia en el análisis filogenético del virus de una mezcla de reinfección e infección persistente) o coinfecciones.
- •
Causas relacionadas con el régimen de tratamiento: falta de adherencia al tratamiento, tratamientos cortos, no uso de RBV.
Para producirse un fracaso virológico 2 o más factores de los anteriormente citados deben de confluir en un mismo paciente6, no obstante la presencia de cada uno de ellos puede tener un efecto discreto sobre la RVS.
Consecuencias de la variabilidad viralDe esta capacidad de producir variantes del virus va a surgir el concepto de RAS en el cual ahondaremos más adelante, pero que en definitiva son cambios en la secuencia nucleotídica responsable de la síntesis de las proteínas contra las que van a actuar los diferentes AAD (NS3/4A, NS5A, NS5B).
La capacidad de generar variantes, y en concreto de producir RAS, va a ser muy importante en los pacientes que fracasen a un tratamiento con AAD, puesto que un tratamiento con AAD que no es suficientemente potente y que solo suprime parcialmente la replicación viral permite la selección de variantes y la aparición de RAS que puedan conferir una sensibilidad reducida a futuros tratamientos antivirales.
Los AAD actúan sobre puntos clave del ciclo celular del VHC y se denominan según la diana sobre la que actúan. Los tratamientos disponibles actualmente se recogen en la tabla 1:
- •
Inhibidores de la polimerasa NS5B no nucleósidos: dasabuvir (DSV).
- •
Inhibidores de la polimerasa NS5B nucleósidos: sofosbuvir (SOF).
- •
Inhibidores de la proteasa NS3/4A: SMV, paritaprevir potenciado con ritonavir (PTVr) y grazoprevir (GZV).
- •
Inhibidores de NS5A: ledipasvir (LDV), elbasvir (EBV), daclatasvir (DCV), velpatasvir (VPA), ombitasvir (OBV).
Agentes antivirales directos (AAD) disponibles actualmente
| Diana terapéutica | Fármacos |
|---|---|
| Inhibidores NS5B no nucleósidos | Dasabuvir (DSV) |
| Inhibidores NS5B nucleósidos | Sofosbuvir (SOF) |
| Inhibidores de proteasa NS3-4A | Simeprevir (SMV), paritaprevir potenciado con ritonavir (PTVr), grazoprevir (GZV) |
| Inhibidores NS5A | Ledipasvir (LDV), elbasvir (EBV), daclatasvir (DCV), velpatasvir (VPA), ombitasvir (OBV) |
El tratamiento con AAD se basa en actuar sobre varias dianas del virus para intentar suprimir completamente la replicación viral, y por tanto, conseguir la curación.
Una idea que parece lógica es que, para prevenir la emergencia de virus multirresistentes a los antivirales, una estrategia óptima es el uso de combinaciones de AAD contra varias dianas del virus.
Por tanto, los esquemas de tratamiento habitual suelen constar de un inhibidor de la polimerasa acompañado de uno a 3 fármacos que actúen sobre diferentes dianas.
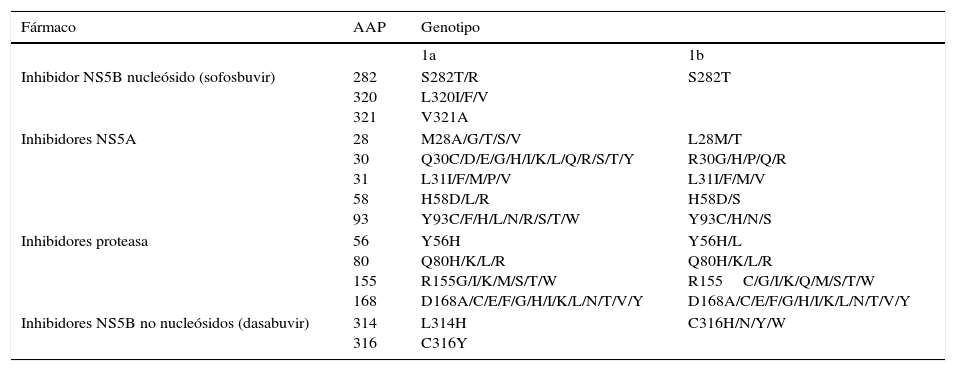
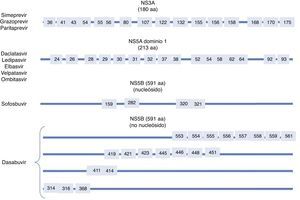
Sustituciones asociadas a resistenciaComo ya indicamos con anterioridad, son una consecuencia de la variabilidad del virus, que genera mutaciones en la secuencia nucleotídica responsable de la síntesis de las proteínas contra las que van a actuar los diferentes AAD (NS3/4A, NS5A, NS5B)(fig. 2). Se sabe que la capacidad de generar RAS del VHC es mayor que la de otros virus como el VIH o el VHB7. La propia presencia de las RAS no justifica la resistencia a un tratamiento. La resistencia al mismo y por tanto el fracaso al tratamiento va a depender de factores virológicos y no virológicos. Son factores implicados en la importancia de la RAS a la hora de condicionar resistencia: 1) La importancia cuantitativa de esta RAS, 2) Tipo de RAS: basal/surgida tras un fracaso a AAD, 3) La potencia del régimen antiviral, 4) La barrera genética del AAD: número de mutaciones necesarias para que el VHC se haga resistente al AAD. SOF es el antiviral con mayor barrera genética y 5) El fitness viral, es decir su capacidad replicativa. Las RAS más comunes se recogen en la tabla 2.
Sustituciones asociadas a resistencias (RAS) más importantes
| Fármaco | AAP | Genotipo | |
|---|---|---|---|
| 1a | 1b | ||
| Inhibidor NS5B nucleósido (sofosbuvir) | 282 320 321 | S282T/R L320I/F/V V321A | S282T |
| Inhibidores NS5A | 28 30 31 58 93 | M28A/G/T/S/V Q30C/D/E/G/H/I/K/L/Q/R/S/T/Y L31I/F/M/P/V H58D/L/R Y93C/F/H/L/N/R/S/T/W | L28M/T R30G/H/P/Q/R L31I/F/M/V H58D/S Y93C/H/N/S |
| Inhibidores proteasa | 56 80 155 168 | Y56H Q80H/K/L/R R155G/I/K/M/S/T/W D168A/C/E/F/G/H/I/K/L/N/T/V/Y | Y56H/L Q80H/K/L/R R155C/G/I/K/Q/M/S/T/W D168A/C/E/F/G/H/I/K/L/N/T/V/Y |
| Inhibidores NS5B no nucleósidos (dasabuvir) | 314 316 | L314H C316Y | C316H/N/Y/W |
AAP: aminoacid position.
- -
RAS basales: Son las RAS detectadas en pacientes no tratados previamente o naive. Su frecuencia depende del genotipo y subtipo3. Parece que las RAS basales no tienen influencia a la hora de alcanzar la RVS.
- ∘
En el caso de las RAS basales a NS3 aparecen en un 3%. Cabe destacar el polimorfismo Q80K, presente en más de la mitad de los sujetos infectados por el genotipo 1a8, su presencia predice menores tasas de RVS en pacientes tratados con interferón (IFN) pegilado, RBV y SMV. Pero en la era de los AAD, se ha visto que su presencia basal no tiene una influencia tan decisiva en combinaciones de SOF+SMV, recomendándose solo su determinación basal en pacientes con genotipo 1a cirróticos que vayan a ser tratados con SOF+SMV9.
- ∘
Las RAS basales a NS5A no tienen una importancia clínica a la hora de decidir tratamiento, salvo que aparezcan tras un tratamiento previo. En algunos estudios en pacientes tratados son SOF+LDV se ha visto que las RAS basales a LDV disminuyen la tasa de RVS en pacientes previamente tratados, pero sin exposición a inhibidores de NS5A10. Solo cabría destacar las RAS a EBV; el análisis de los ensayos en fase ii/iii de aprobación de EBV/GZV mostró que para conseguir tasas de RVS elevadas con un tratamiento de 12 semanas de duración en genotipos 1a cirróticos con respuesta nula previa es necesario descartar la presencia de RAS basales en NS5A relacionadas con resistencia a EBV (variantes en las posiciones 28, 30, 31, 93) que reducen la susceptibilidad de este antiviral 5 o más veces detectadas mediante secuenciación poblacional11.
- ∘
Finalmente se han descrito varias RAS basales a NS5B, tanto para DSV como para SOF, pero tienen una frecuencia muy pequeña y su impacto sobre la respuesta viral no parece importante. Algunas RAS de SOF como la C316N/H/F y la sustitución S282T tienen una aparición mínima y aún debe de aclararse el efecto que tienen sobre la respuesta antiviral12.
- ∘
En un estudio publicado recientemente en el que participaron 312 pacientes europeos se investigaron las RAS basales de las regiones NS3, NS5A y NS5B potencialmente relevantes para el tratamiento con telaprevir, SMV, asunaprevir, DCV, LDV, OBV y DSV. No se observaron RAS basales resistentes a SOF. Se detectaron RAS de NS3 en el 20,5% de los casos, de NS5A en el 11,5% (más frecuentes en el genotipo 1b que en el 1a) y de NS5B en el 21,5% (también más frecuentes en genotipo 1b). Estos autores concluían en la necesidad de realización de RAS basales antes del inicio de tratamiento13. Aunque como en el trabajo anterior algunos autores concluyen que la terapia antiviral debería de ser guiada por las RAS basales especialmente en cirróticos o con la idea de aplicar tratamientos cortos14, actualmente no hay evidencia de ello y no se recoge en las guías clínicas la necesidad de analizarlas previamente. Estudios en pacientes tratados con SOF+LDV al menos 6 semanas o retratados 12 semanas tras tratamiento con regímenes más cortos, alcanzaron la misma tasa de RVS con RAS o sin ellas15,16. Otro estudio en el mismo sentido analizó 94 casos con RAS basales a NS5A (de una serie de 511, siendo el 18% cirróticos) tratados con SOF y LDV, encontrándose una tasa de RVS similar en los pacientes con y sin RAS basales (91 vs. 98%)17. Solo se debe recomendar la detección del polimorfismo Q80K de la región NS3 antes de administrar tratamiento con SMV+SOF en pacientes cirróticos genotipo 1a18 y la determinación de RAS basales en pacientes genotipo 1a (en particular las posiciones M28, Q30, L31 e Y93) que van a recibir tratamiento con EBV/GZV con el fin de extender el tratamiento a 16 semanas y añadir RBV si son portadores de las mismas19.
- ∘
- -
RAS que aparecen en pacientes que han fracasado previamente a un tratamiento antiviral:
- ∘
RAS NS3: aparecen en<7% de los pacientes tratados con anterioridad20. Suelen ser transitorias, desapareciendo en un período corto tras la suspensión del fármaco debido a su baja capacidad replicativa (fitness viral)20. Las que se asocian con más frecuencia a un fallo terapéutico emergen como consecuencia del tratamiento con telaprevir y boceprevir. Quizás la más importante es la R155K/T, cuyo fitness puede mejorar cuando se asocia a otra RAS, la V36M. Las RAS asociadas a inhibidores de la proteasa de segunda generación más frecuentes son, de nuevo, la R155K y la D168A/V/E/T. En el estudio OPTIMIST, 26 pacientes tratados con SOF+ SMV cirróticos que recibieron 12 semanas de tratamiento sin RBV, el 16% fracasaron al tratamiento, 14 pacientes fueron secuenciados detectando RAS a NS3A en 11 de ellos en el momento del fallo, no detectando RAS para SOF.
- ∘
RAS NS5A: probablemente representan el mayor problema en la actualidad, aunque sus inhibidores tienen una cobertura pangenotípica, la actividad específica de cada uno es variable y su barrera genética es relativamente baja. La tasa de detección de RAS NS5A en diferentes estudios de secuenciación poblacional directa es del 0,3-3,5%21. Existen múltiples variantes potenciales de la región que pueden inducir resistencia a los inhibidores del complejo. Estas RAS al contrario que las de NS3 persisten a lo largo del tiempo, hasta el 85% permanecen presentes tras 1-2 años de la finalización del tratamiento22,14 y pueden tener un impacto en la eficacia de futuros tratamientos de rescate. La mayoría de las RAS son cruzadas, es decir, la resistencia a un fármaco inhibidor de NS5A suele condicionar la resistencia al resto de los fármacos del mismo grupo. En el caso del DCV, las más frecuentes son la L31V/M y la Y93H/N en el genotipo 1b, y la Q30H/S en el genotipo 423. Variantes resistentes a OBV se detectan en las posiciones 28, 30, 58 y 93, prácticamente de forma exclusiva en infecciones por genotipo 1a. Las variantes para LDV con una mayor influencia a la hora de alcanzar la RVS son para el genotipo 1a Q30E/R, L31M, Y93C/H/N, y para el genotipo 1b es la Y93H. Esta última es la más frecuente, se presenta en el 3,8-14,1% de los pacientes confiriendo una resistencia media-alta a los fármacos que actúan sobre NS5A. Esta variante es más frecuente en pacientes europeos (15%) que en estadounidenses (9,3%)21. En un estudio de 2.144 pacientes tratados con LDV/SOF, el 2,4% experimentaron un fracaso virológico al tratamiento, de ellos el 74% tenían RAS tras el fracaso, la mayoría eran genotipo 1a24. La combinación de asunaprevir y DCV en pacientes con genotipo 1a actualmente no esta recomendada en Europa y EE. UU. por el impacto de las RAS a NS5A en la tasa de respuesta viral sostenida; además, en pacientes con genotipo 1b, con RAS basal en la posición L31 tampoco está recomendada la utilización de este régimen por el impacto en la tasa de éxito25. Otro estudio en la misma dirección, multicéntrico, fase iii, en pacientes genotipo 1b tratados con ASN y DCV se detectó en un 75% RAS para NS3 en posición D168 y en NS5A Y93 con el potencial impacto en la respuesta a tratamiento26.
- ∘
RAS NS5B: la presencia de estas suele ser muy prolongada en un estudio alrededor del 85% de los sujetos de NS5A hasta 96 semanas después de finalizado el tratamiento, lo que indica un mayor fitness viral de estas variantes. La sustitución S282T es la única mutación asociada con una disminución de la susceptibilidad a los inhibidores nucleotídicos, del que el SOF es la molécula paradigmática. La frecuencia de su aparición es mínima, probablemente por su bajo fitness que hace que rápidamente sea sustituida de nuevo por el wild type virus27 y no tiene relación con otras RAS de NS5B28. La RAS S282T fue detectada en el estudio Electron de SOF en monoterapia, en un paciente infectado con un genotipo 2 y que recidivó en la semana 4 postratamiento29. Hasta el momento, esta RAS solo se ha detectado en 4 pacientes. Las RAS de NS5B que confieren resistencia a los inhibidores de NS5B no nucleosídicos (como por ejemplo, DSV o tegobuvir) son mucho más frecuentes que las que afectan a los inhibidores nucleotídicos y se relacionan con resistencia y breakthrough viral. En general, son más frecuentes en el genotipo 1a que el genotipo 1b30 aunque la variante C316N se observa con más frecuencia en el genotipo 1b31.
- ∘
La consecuencia más importante de la aparición de RAS es su impacto en cuanto a la disminución de la sensibilidad del virus al tratamiento antiviral; parece que las únicas RAS con importancia clínica son las RAS que aparecen tras un fallo terapéutico con AAD, y de ellas las que aparecen en la región NS5A son las que mayor impacto tienen hoy en día. En un estudio multicéntrico en el que analizaron las RAS de 165 pacientes con fracaso previo a tratamiento procedentes de 33 hospitales españoles mediante next generation sequencing con cebadores específicos de subtipo, se observaron RAS asociadas a resistencia en el 84,2% de ellos32. La sola presencia de las RAS no es decisiva a la hora de experimentar un fracaso terapéutico y la mayoría de los estudios coinciden en que la asociación de RAS con factores pronósticos negativos como el genotipo viral (1a, 3), la presencia de cirrosis o la duración más corta de tratamiento tiene un mayor impacto en la respuesta viral. El estudio ION-3 demuestra que en los pacientes que habían recibido tratamiento previo durante 8 semanas y no presentaron RVS el retratamiento durante 24 semanas se asoció a una tasa muy baja de RVS (inferior al 50%) si presentaban 2 o más RAS para NS5A33.
Métodos diagnósticosLa capacidad de detección de RAS depende principalmente del método utilizado. Clásicamente la detección de las mismas se realizaba por secuenciación poblacional (secuenciación directa, PCR), mediante la cual somos capaces de detectar variantes que representen, al menos, el 10% de la población viral34. Si aplicamos técnicas más sensibles como la secuenciación clonal (PCR de vectores plasmídicos, seguida de secuenciación directa), detectamos variantes que pueden suponer solo el 1% de la población viral completa y, finalmente, hoy en día disponemos de técnicas de extraordinaria sensibilidad, como las de next generation sequencing, analizando incluso poblaciones que suponen menos del 0,5-1% de la muestra total35. Estas técnicas permiten además la detección de la infección por más de un subtipo al mismo tiempo, lo cual tiene implicaciones diagnósticas y terapéuticas evidentes. Las nuevas tecnologías de next generation sequencing permiten, además del estudio de resistencias y mutaciones compensatorias en el mismo genoma, la identificación de virus recombinantes, el subtipado y la detección de infecciones mixtas36,37. Además, permite el estudio de la capacidad replicativa (fitness viral).
La interpretación de las RAS según el método de secuenciación utilizado no siempre es sencillo, la relación con resistencia antiviral de las RAS detectadas mediante secuenciación directa está claramente establecida mientras que muchas de las variantes minoritarias analizadas con técnicas de alta sensibilidad no se asocian a ningún fenómeno clínico y no tienen repercusión en cuanto a la elección de tratamiento antiviral. Por esto se recomienda su interpretación por grupos multidisciplinares compuesto por expertos en las áreas implicadas. En un estudio en pacientes retratados con LDV-SOF, se observó que de los pacientes con RAS detectadas por secuenciación profunda solo alcanzaban la RVS el 60% con regímenes que además incluían RBV, en cambio en pacientes sin RAS la RVS era del 100%33. Actualmente, estos test están disponibles en EE. UU., pero son muy costosos. En Europa no están disponibles estos test comerciales pero diferentes laboratorios de investigación tienen experiencia en el análisis de las secuencias de NS3, NS5A y NS5B. Parece que la mayoría de los expertos están de acuerdo en la realización de un test de resistencias en todos los pacientes que fallen a un AAD para guiar la terapia de rescate por lo que parece urgente estandarizar y comercializar un test de resistencias para estos pacientes.
Recomendaciones/estrategias de retratamientoAntes de detallar las posibles opciones de tratamiento en estos pacientes, es importante plantearnos ciertos aspectos antes de iniciar el retratamiento de estos pacientes:
- -
Importancia de un correcto genotipado en estos pacientes.
- -
Valorar el contexto clínico del paciente, las comorbilidades y por tanto la urgencia del retratamiento en este momento. En pacientes genotipo 1, no cirróticos con fallo a terapia a NS5A, las actuales guías de la AASLD recomiendan diferir el retratamiento de los mismos hasta la aparición de nuevos fármacos.
- -
Analizar las condiciones del tratamiento previo, si se usó RBV o no, la duración del mismo, los posibles fallos de adherencia, las interacciones posibles con la medicación concomitante (por ejemplo, los tan frecuentemente usados inhibidores de la bomba de protones).
- -
Tener en cuenta la posibilidad de fracaso de tratamiento por reinfecciones (especialmente en determinados colectivos, usuarios de drogas por vía parenteral, prisiones…), sobreinfecciones, procesos de recombinación genética, que aunque no son objeto de esta revisión, debemos de pensar en ellos.
- -
Analizar las RAS tras un fracaso a tratamiento previo con AAD: parece sensato recomendarlo; aunque la secuenciación completa del genoma viral no está disponible en todos los centros sí es importante valorar extraer una muestra basal a todos nuestros pacientes y conservarlas a −70°C ante la posibilidad de necesitar un análisis virológico completo si el paciente experimenta un fracaso al tratamiento. Esta muestra se añadirá a una muestra postratamiento que nos permita analizar las posibles RAS implicadas en el fallo.
- -
Las estrategias de retratamiento deben incluir SOF (alta barrera genética, RAS que desaparecen rápidamente tras el cese del tratamiento) acompañado de 1-3 fármacos más (idealmente sin resistencias cruzadas con los utilizados previamente, como ocurre con los NS5A)
- -
La duración del tratamiento debe de ser de 12 semanas con RBV o 24 semanas con RBV en los pacientes más difíciles de tratar o 24 semanas sin RBV en los pacientes con contraindicación a la misma. El análisis de 513 pacientes con genotipo 1 y cirrosis, naives y pretratados, que recibieron SOF/LDV±RBV durante 12 o 24 semanas, permite concluir que la RBV es especialmente útil en los pacientes con RAS, incrementando en casi un 10% la posibilidad de RVS38.
Aunque se tiene poca experiencia en los retratamientos en pacientes con RAS, ya disponemos de algunos datos de ensayos clínicos y de práctica real:
- -
Fallo a SOF +SMV: A pesar de estar descritas ciertas resistencias cruzadas entre RAS de NS3 y NS5A, las opciones de retratamiento deben de incluir inhibidores de NS5A, podrían ser posibles opciones SOF+LDV o SOF+DCV39,40.
- -
Fracaso a SOF+LDV: Los fallos a esta combinación se deben en la mayoría de los casos a aparición de RAS a NS5A, que se objetivan en el 76% de los fallos a este tratamiento41. No se han descrito sustituciones S282T en los estudios de registro. En un estudio con 41 pacientes que fallaron a SOF+LDV, fueron retratados con la misma pauta 24 semanas. Treinta de ellos fueron tratados con el esquema de 8 semanas, consiguiendo con el retratamiento una tasa de RVS del 80%, en cambio los tratados previamente durante 12 semanas solo consiguieron la RVS del 46%. La posibilidad de alcanzar la RVS en los pacientes con RAS a NS5A fue de solo el 60%, mientras los que no las tenían alcanzaron la RVS en el 100%. Los pacientes con 2 RAS a NS5A alcanzaron la RVS en un 50%41. En otro estudio en genotipo 1 que incluía a pacientes previamente tratados con varios NS5A, fueron retratados con SOF+3D. Aunque el tamaño muestral era pequeño, se consiguió un RVS del 100% en los pacientes con RAS a NS5A (6 pacientes), la presencia de la variante Y93H/N fue especialmente resistente al tratamiento (solo 2 de los 6 portadores de esta RAS consiguieron la RVS)42. Recientemente se ha ensayado el retratamiento con SOF/LDV+GS-9669+GS-9451 en fracasos a SOF/LDV con una elevada eficacia antiviral, aunque en un caso se produjo una resistencia de alta complejidad (L31M, Y93H, S282T, V321) para la que no existe ninguna opción terapéutica en este momento43.
- -
Fracasos a regímenes que contienen DCV: Los datos existentes sobre el fracaso de SOF+DCV son similares a la combinación con LDV. La combinación SOF+DCV ha sido evaluada en 152 pacientes genotipo 3 naive y experimentados, produciéndose recidiva en el 9% de los pacientes naives y en el 14% de los pacientes experimentados especialmente en pacientes cirróticos. Todos los pacientes que recidivaron tenían RAS a NS5A, 6 pacientes antes de comenzar el tratamiento y 10 después del mismo44. Una posible pauta de retratamiento podría ser la explorada en un estudio piloto45 que evaluó la eficacia de SOF+SMV sin RBV durante 12 semanas en 15 pacientes que no respondieron a DCV+PR (n=12) o DCV+ASV+PR (n=3). Se alcanzó la respuesta en 13 casos. Los 2 pacientes con recidiva eran genotipo 1a con cirrosis y presentaban resistencias basales a NS3 y NS5A (R155K, Q80K y V170I) y NS5A (M28T, L31M)25. El estudio C-ISLE ofrece datos preliminares presentados en la AASLD, en pacientes no respondedores a tratamientos previos, incluyendo a pacientes tratados con SOF+DCV+RBV, los cuales se retratan con el régimen de SOF+GZP+EBV consiguiendo tasas de RVS del 100%46.
- -
Fracaso a SOF+VPA, en un estudio en el que fueron retratados con SOF+VPA+RBV 24 semanas, consiguieron una alta tasa de RVS, si bien es cierto que en pacientes genotipo 3 con RAS a NS5A la RVS disminuyo al 77%29.
- -
Fracaso al régimen 3D: Al igual que la combinación de SOF+LDV, su eficacia es muy alta e, igual que con la anterior, la experiencia con el retratamiento tras estos fracasos es escasa. En un estudio de más de 1.000 pacientes tratados se realizó estudio de secuenciación profunda en los fallos virológicos. Se detectó variantes resistentes a NS3-NS4 en el 78% de los genotipo 1a y en el 57% de los genotipo 1b, siendo la más frecuente en la posición D168. El 72% de los pacientes con genotipo 1a mostraron variantes resistentes a NS5A y solo un 29% de los pacientes con genotipo 1b. En este estudio no se publicó el número de pacientes con variantes resistentes frente a las 3 dianas (NS3, NS5A y NS5B), pero se estima por los datos que se encuentra por encima del 70%22. Se han explorado las siguientes opciones de retratamiento: la adicción de INF y RBV al régimen 3D y añadir SOF al régimen 3D, aunque los resultados de estas 2 estrategias todavía no se conocen con certeza. El estudio QUARTZ-1 analiza el retratamiento a fracasos del régimen 3D (y otras combinaciones) en 22 pacientes con una combinación de paritaprevir, OBV, DSV, SOF con o sin RBV durante 12 o 24 semanas, consiguiendo la RVS en 20 casos. Los 2 pacientes con recaídas eran cirróticos genotipo 1a y fueron tratados durante 12 semanas47.
Existen varios ensayos clínicos con datos preliminares muy prometedores y que pueden representar opciones de retratamiento muy eficaces en un corto plazo de tiempo. Un estudio fase ii, tratamiento con SOF+VPA+voxilaprevir en pacientes previamente tratados con AAD, con y sin cirrosis, los pacientes secuenciados (48) se encontraron RAS en el 73% (15% RAS en NS3, 31% en NS5A, 27% mixtas). Se consiguieron RVS en el 100% (24/24) de los tratados con SOF+VPA+voxilaprevir sin RBV y en el 96% (24/25) de los tratados con RBV 48. Otra combinación que se encuentra en fase ii es glecaprevir y pibrentasvir, en 50 pacientes no cirróticos previamente tratados con AAD encontrando RAS en NS3, NS5A y en ambas, con tasas de RVS del 100, 91 y 93% respectivamente. En pacientes sin RAS la tasa de RVS fue del 100%49.
Los ensayos clínicos son el gold standard para valorar la actividad viral intrínseca, el perfil de resistencias y los eventos adversos, pero estudios recientes ofrecen una aproximación interesante y prometedora, como el publicado recientemente, en el que mezcla una parte experimental con modelos matemáticos con el fin de evaluar la actividad intrínseca viral y la teórica aparición de resistencias a los antivirales en combinaciones dobles y triples de estos agentes. Estos enfoques serán muy útiles para diseñar combinaciones en base a un mejor perfil antiviral y de hipotéticas resistencias50.
Los regímenes de retratamiento recomendados por la EASL son51:
- •
Fallos a PEG-IFN+RBV+(SMV, TPV, BOC): Rescatar con regímenes basados en SOF+inhibidor de NS5A (LDV, DCV, VPA)+RBV 12 semanas
- •
Fallos a regímenes de SOF en monoterapia, SOF con RBV o PEG-IFN+SOF+RBV: rescatar en genotipos 1, 2, 3, 4, 5 o 6 con SOF+inhibidor de NS5A (LDV, DCV, VPA)+RBV 12 semanas en no cirróticos, 24 semanas en cirróticos, también se podría retratar con SOF+SMV+RBV con las mismas recomendaciones en cuanto a la duración. En genotipo 1 y 4 se podría utilizar regímenes con 3D (PTVr, OBV, DSV) o 2D (PTVr, OBV) según sea 1 o 4 o GZP/EBV.
- •
Fallos a SOF+SMV: Rescatar con SOF+inhibidor e NS5A (LDV, DCV, VPA)+RBV 12 semanas en no cirróticos, 24 semanas en cirróticos.
- •
Fallos a regímenes con NS5A: En genotipos 2, 3, 5 y 6 SOF+VPA+RBV 24 semanas. En los genotipos 1: SOF+3D+RBV 12/24 semanas o SOF+GZP+EBV+RBV 12/24 semanas o SOF+DCV+SMV+RBV 12/24 semanas. En genotipo 4 SOF+2D+RBV 12/24 semanas o SOF+GZP+EBV+RBV 12/24 semanas o SOF+DCV+SMV+RBV 12/24 semanas.
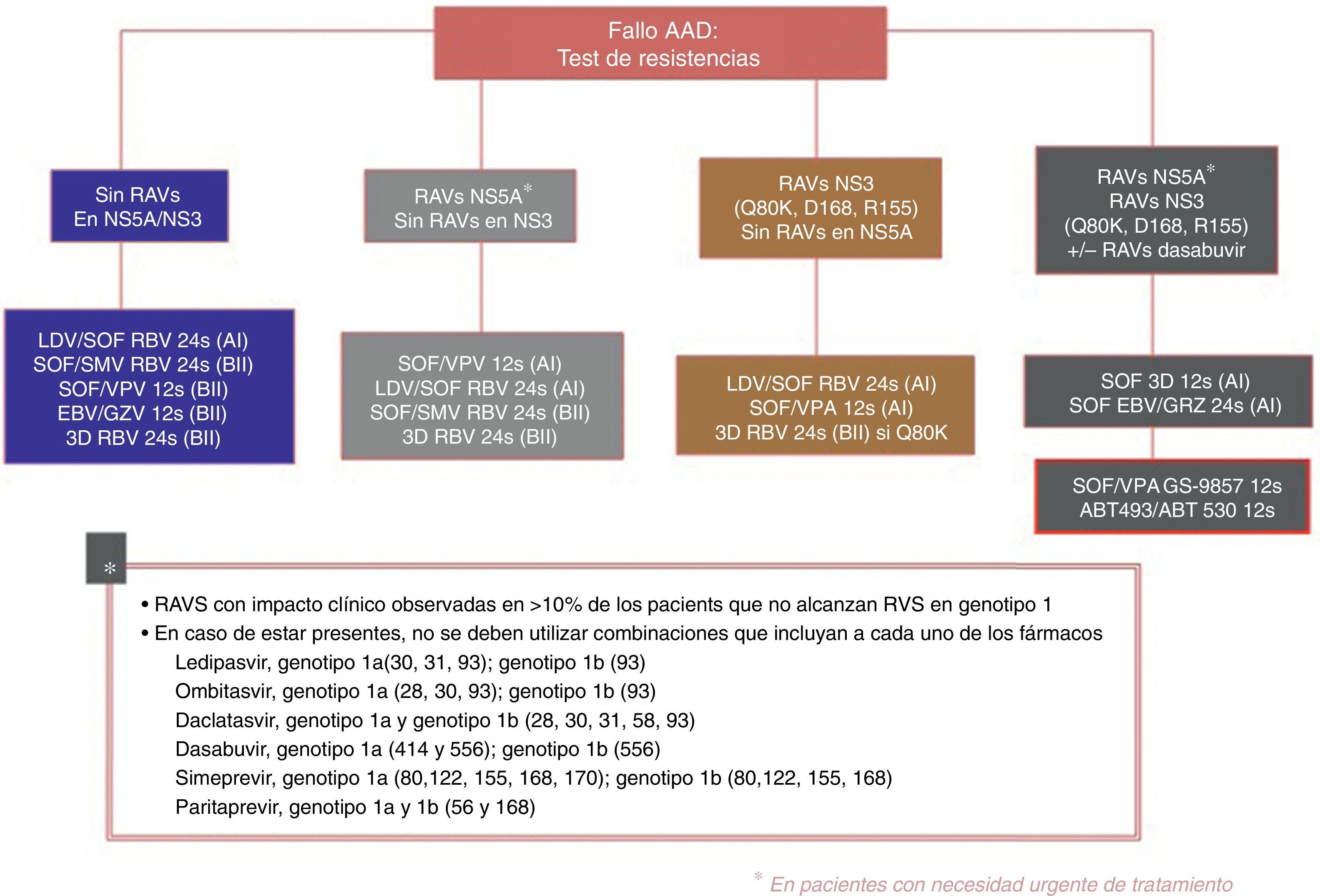
Las actuales recomendaciones en cuanto al estudio de resistencias de la Asociación Española para el Estudio del Hígado52 son:
- ∘
En el momento actual no se puede hacer una recomendación general para estudiar resistencias basales, sin embargo:
- ∘
En genotipo 1a con cirrosis, es necesario determinar el polimorfismo Q80K para el inicio o rescate de pautas basadas en SMV (A1)
- ∘
En genotipo 1a con cirrosis «null responders» para emplear la combinación EBV / GZV sin RBV durante 12 semanas, es necesario descartar la presencia de RAS en NS5A asociadas a resistencia a EBV (A1)
- ∘
Los test de resistencias se deben utilizar para guiar el cambio de tratamiento en aquellos pacientes que no puedan esperar a la llegada de nuevos regímenes de tratamiento. Si no existe una necesidad urgente de retratamiento, la mejor estrategia es diferirlo hasta que las nuevas combinaciones estén disponibles (A1)
- ∘
Si no se dispone de test de resistencias, las estrategias de retratamiento han de incluir necesariamente esquemas con RBV y de mayor duración (A2)
- ∘
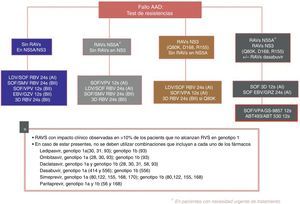
En la figura 3 se recogen las opciones de retratamiento y las combinaciones que deben ser evitadas en función de la RAS encontrada, propuestas por la Asociación Española para el Estudio del Hígado en su último documento de consenso53.
Recomendaciones de retratamiento según la Asociación Española para el Estudio del Higado52.
AADs: agentes antivirales directos; ABT 493: glecaprevir; ABT 530: pibrentasvir; EBV: elbasvir; GZV: grazoprevir; RAVs: variantes asociadas a resistencia; RVS: respuesta viral sostenida; LDV: ledipasvir; SOF: sofosbuvir; RBV: ribavirina; SMV: simeprevir; VPA, velpatasvir.
En la era de los AAD, que permiten la curación de la mayoría de los pacientes, nuestros esfuerzos deben de ir dirigidos a los fracasos de tratamiento que aunque pocos siguen teniendo lugar.
Estos fracasos se deben a factores virológicos y no virológicos, en los que múltiples agentes desempeñan cada uno su papel.
Las RAS, cuyo concepto y significado cada vez nos es más cercano, son en parte responsables de la pérdida de sensibilidad a los agentes antivirales. Hay que insistir en la necesidad de extracción de muestras basales de nuestros pacientes previas al tratamiento y así testar las RAS en las muestras basales y postratamiento en el caso de que se produzca un fracaso a los AAD que nos oriente entre las opciones de retratamiento. Estas muestras deben de ser remitidas a centros especializados y los resultados analizados por profesionales expertos.
El conocimiento de las RAS y el generado de los nuevos ensayos clínicos, nos ofrecen opciones de retratamiento eficaces para nuestros pacientes.
Conflicto de interesesJavier Crespo ha recibido financiación de AbbVie, BMS, Gilead, Janssen and MSD.
El resto de los autores declara no tener ningún tipo de conflicto de interés.