La infección por el virus de la hepatitis C (VHC) es problema de salud pública mundial. Los tratamientos utilizados hasta hace poco tenían una eficacia limitada, con una respuesta viral sostenida (RVS) inferior al 50%.
La infección por VHC aguda generalmente es asintomática. El problema aparece cuando se cronifica (60-80%), produciendo daño hepático progresivo, dando lugar a graves complicaciones.
La transmisión del VHC es principalmente por vía parenteral, por ello gran porcentaje de afectados por VHC también lo están por el virus de inmunodeficiencia humana (VIH).
Con la llegada de los antivirales de acción directa (AAD) se ha elevado hasta un 95% la tasa de éxitos. Sin embargo, sigue habiendo un pequeño porcentaje de pacientes que fracasan a ADD. Nuestro objetivo fue evaluar la respuesta a retratamientos con ADD en pacientes que ya habían fracasado a tratamiento con estos fármacos, así como sus causas.
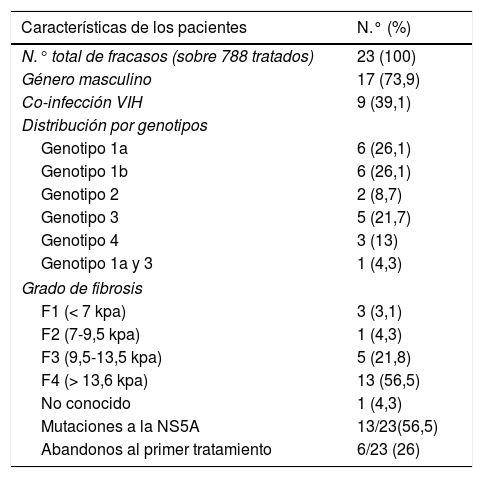
Para ello se realizó un estudio retrospectivo en un solo centro entre enero del 2012 y abril del 2018, donde se analizó a 788 pacientes infectados por VHC y tratados con AAD. De estos, finalmente, se retrató a 22 (2,79%) pacientes con una mediana de edad de 57 años, que habían fracasado en primera instancia. En la tabla 1 se recogen las características de esta muestra. No se recogieron las características de la muestra total (sexo, fibrosis y genotipo). Tras el retratamiento se obtuvo una tasa de éxitos del 100%, habiendo solo un paciente con doble fracaso que requirió un tercer tratamiento, no existiendo diferencias en la respuesta al tratamiento entre pacientes coinfectados por VIH/VHC y monoinfectados (tabla 2).
Características de la muestra
| Características de los pacientes | N.° (%) |
|---|---|
| N.° total de fracasos (sobre 788 tratados) | 23 (100) |
| Género masculino | 17 (73,9) |
| Co-infección VIH | 9 (39,1) |
| Distribución por genotipos | |
| Genotipo 1a | 6 (26,1) |
| Genotipo 1b | 6 (26,1) |
| Genotipo 2 | 2 (8,7) |
| Genotipo 3 | 5 (21,7) |
| Genotipo 4 | 3 (13) |
| Genotipo 1a y 3 | 1 (4,3) |
| Grado de fibrosis | |
| F1 (< 7 kpa) | 3 (3,1) |
| F2 (7-9,5 kpa) | 1 (4,3) |
| F3 (9,5-13,5 kpa) | 5 (21,8) |
| F4 (> 13,6 kpa) | 13 (56,5) |
| No conocido | 1 (4,3) |
| Mutaciones a la NS5A | 13/23(56,5) |
| Abandonos al primer tratamiento | 6/23 (26) |
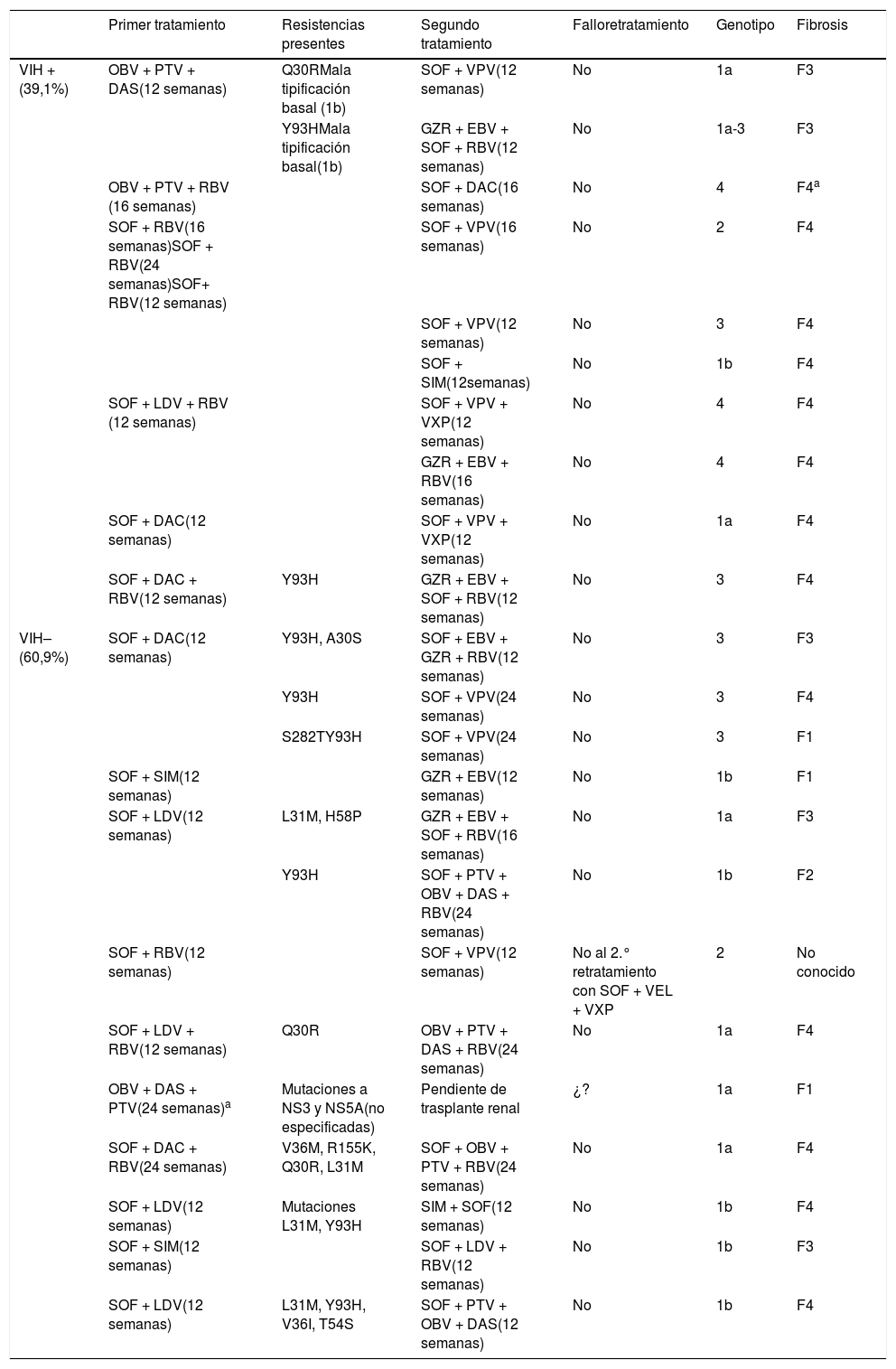
Primer y segundo régimen de tratamiento de pacientes tratados con AAD
| Primer tratamiento | Resistencias presentes | Segundo tratamiento | Falloretratamiento | Genotipo | Fibrosis | |
|---|---|---|---|---|---|---|
| VIH + (39,1%) | OBV + PTV + DAS(12 semanas) | Q30RMala tipificación basal (1b) | SOF + VPV(12 semanas) | No | 1a | F3 |
| Y93HMala tipificación basal(1b) | GZR + EBV + SOF + RBV(12 semanas) | No | 1a-3 | F3 | ||
| OBV + PTV + RBV (16 semanas) | SOF + DAC(16 semanas) | No | 4 | F4a | ||
| SOF + RBV(16 semanas)SOF + RBV(24 semanas)SOF+ RBV(12 semanas) | SOF + VPV(16 semanas) | No | 2 | F4 | ||
| SOF + VPV(12 semanas) | No | 3 | F4 | |||
| SOF + SIM(12semanas) | No | 1b | F4 | |||
| SOF + LDV + RBV (12 semanas) | SOF + VPV + VXP(12 semanas) | No | 4 | F4 | ||
| GZR + EBV + RBV(16 semanas) | No | 4 | F4 | |||
| SOF + DAC(12 semanas) | SOF + VPV + VXP(12 semanas) | No | 1a | F4 | ||
| SOF + DAC + RBV(12 semanas) | Y93H | GZR + EBV + SOF + RBV(12 semanas) | No | 3 | F4 | |
| VIH– (60,9%) | SOF + DAC(12 semanas) | Y93H, A30S | SOF + EBV + GZR + RBV(12 semanas) | No | 3 | F3 |
| Y93H | SOF + VPV(24 semanas) | No | 3 | F4 | ||
| S282TY93H | SOF + VPV(24 semanas) | No | 3 | F1 | ||
| SOF + SIM(12 semanas) | GZR + EBV(12 semanas) | No | 1b | F1 | ||
| SOF + LDV(12 semanas) | L31M, H58P | GZR + EBV + SOF + RBV(16 semanas) | No | 1a | F3 | |
| Y93H | SOF + PTV + OBV + DAS + RBV(24 semanas) | No | 1b | F2 | ||
| SOF + RBV(12 semanas) | SOF + VPV(12 semanas) | No al 2.° retratamiento con SOF + VEL + VXP | 2 | No conocido | ||
| SOF + LDV + RBV(12 semanas) | Q30R | OBV + PTV + DAS + RBV(24 semanas) | No | 1a | F4 | |
| OBV + DAS + PTV(24 semanas)a | Mutaciones a NS3 y NS5A(no especificadas) | Pendiente de trasplante renal | ¿? | 1a | F1 | |
| SOF + DAC + RBV(24 semanas) | V36M, R155K, Q30R, L31M | SOF + OBV + PTV + RBV(24 semanas) | No | 1a | F4 | |
| SOF + LDV(12 semanas) | Mutaciones L31M, Y93H | SIM + SOF(12 semanas) | No | 1b | F4 | |
| SOF + SIM(12 semanas) | SOF + LDV + RBV(12 semanas) | No | 1b | F3 | ||
| SOF + LDV(12 semanas) | L31M, Y93H, V36I, T54S | SOF + PTV + OBV + DAS(12 semanas) | No | 1b | F4 |
DAS: dasabuvir; EBV: elbasvir; GZR: grazoprevir; LDV: ledipasvir; OBV: ombitasvir; PTV: paritaprevir; RBV: ribavirina; SIM: simeprevir; SOF: sofosbuvir; VEL: velpatasvir; VXP: voxilaprevir F4.
Esta tasa de éxitos de nuestro estudio es similar a la que se consiguieron de Lédinghen et al.1 sobre el retratamiento con sofosbuvir (SOF) + grazoprevir/ elbasvir + ribavirina durante 16-24 semanas en pacientes con VHC genotipos 1 o 4 que fallaron a un primer tratamiento con AAD y que hicieron resistencias a inhibidores de NS5A/NS3, donde se obtuvo una tasa de RVS del 100%.
Si comparamos la tasa de RVS entre monoinfectados y coinfectados VHC/VIH, en nuestro estudio, de los 22 pacientes que fracasaron a un primer tratamiento con AAD 9 eran VIH+ (40,9%) respondiendo los 9(tasa de éxitos de los VIH+ del 100%). Por su parte, de los 13 pacientes VIH– (59,1%), 13 han obtenido RVS (100%). En nuestra serie, como describieron Berenguer et al.2, la tasa de respuestas en coinfectados fue similar a los monoinfectados.
Al analizar las posibles causas del fallo al primer tratamiento con ADD, podemos deducir que las resistencias a los inhibidores de la NS5A (56,5%) son las que aparecen con mayor frecuencia pero, a diferencia de lo publicado por de Lédinghen et al.1, en nuestro estudio observamos que la RVS en el retratamiento entre pacientes con resistencias a NS5A fue del 100%, por lo que, aun con la aparición de resistencias, los pacientes pueden ser retratados con un inhibidor NS5A diferente, siendo estos resultados iguales al trabajo publicado por Halfon et al.3.
Con relación al resto de factores que pudieran haber influido en la RVS, el grado de fibrosis (evaluado mayoritariamente por elastografía y ocasionalmente por biopsia hepática) tampoco fue decisivo, hecho ya descrito por Bourliere et al.4, mientras que aquellos con genotipo 3, aún considerado genotipo difícil de tratar, consiguieron la curación en todos los casos.
Las características del único paciente que fracasó a doble tratamiento con AAD son: varón, genotipo 2, grado de fibrosis no conocido, VIH– y no amplificador a NS5A. El paciente ha sido tratado con SOF/velpatasvir/voxilaprevir, obteniendo RVS. Cuando los pacientes fracasan a un doble tratamiento con AAD, como es el caso de nuestro paciente, se postula la combinación SOF/velpatasvir/voxilaprevir, durante 12 semanas, como terapia de rescate en todos los pacientes sin cirrosis o con cirrosis compensada, con independencia del tipo de tratamiento o del genotipo (AI)5. El paciente que no ha sido retratado es un paciente pendiente de trasplante renal, por poliquistosis renal con fibrosis F1 y por decisión de su médico.
Una limitación de nuestro estudio es el pequeño número de pacientes retratados, debido al escaso número de fracasos al primer tratamiento.
Concluimos que la tasa de RVS a los retratamientos con AAD es muy elevada entre los pacientes que han fracasado previamente a estos, por lo que todos deben ser tratados. Las causas del fracaso no se diferencian de las descritas en la bibliografía.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.