Numerosos ensayos clínicos demuestran una alta eficacia en el tratamiento con interferón pegilado y ribavirina; sin embargo, se conoce poco sobre los resultados obtenidos en la práctica clínica.
ObjetivoEvaluar en la práctica clínica la respuesta y los factores que influyen en el tratamiento de la hepatitis crónica por el virus C.
Material y métodosEntre agosto de 2001 y diciembre de 2005, se trató a 219 pacientes con interferón pegilado (alfa-2a en dosis fijas o alfa-2b según el peso) y ribavirina. Los pacientes que presentaban un genotipo 1 o 4 recibieron tratamiento con interferón pegilado alfa-2a (180 |xg/semana) y ribavirina (1.000 mg/día si <75kg o 1.200mg/día si >75kg) o interferón alfa-2b (1,5μg/kg/semana) y ribavirina (10,6mg/kg/día) durante 48 semanas. Los pacientes con genotipo 2 y 3 fueron tratados durante 24 semanas con la misma pauta de interferón pegilado alfa-2a o alfa-2b, pero con 800mg de ribavirina al día repartida en dos dosis. La respuesta viral sostenida (RVS) se ha determinado como la negatividad del ARN del virus de la hepatitis C a los 6 meses después de finalizar el tratamiento.
ResultadosSe incluyeron 219 pacientes (un 69% varones, con una edad de 44±10 años). Como antecedentes epidemiológicos, un 22,4% había consumido drogas por vía parenteral y un 22,4% había sido transfundido antes del año 1992. Un 47% de los pacientes con biopsia hepática tenía puentes de fibrosis o cirrosis hepática establecida. Los genotipos se distribuyeron de la siguiente forma: 69,8% genotipo 1; 4,1% genotipo 2; 17,8% genotipo 3; 8,2% genotipo 4. Del total de 219 pacientes, 76 (35%) fueron tratados con interferón pegilado alfa-2a y 143 (65%) con interferón alfa-2b. Según el genotipo, la RVS se obtuvo en un 46% genotipo 1, un 88,9% genotipo 2, un 78,9% genotipo 3 y un 33,3% genotipo 4. El análisis univariado mostró que el genotipo es la única variable que influyó en la RVS.
ConclusiónEl tratamiento con interferón pegilado y ribavirina en la práctica clínica diaria presenta una RVS similar a la obtenida en los ensayos clínicos. El genotipo viral continúa siendo la principal variable correlacionada con la RVS.
Numerous clinical trials have demonstrated the efficacy of treatment with pegylated interferon and ribavirin but little is known about the results obtained in clinical practice.
ObjectiveTo evaluate treatment response and factors influencing the treatment of chronic hepatitis C in clinical practice.
Material and methodsBetween August 2001 and December 2005, we treated 219 patients with pegylated interferon (alpha 2a -fixed dose, or alpha 2b, according to weight) and ribavirin. Patients with genotype 1 or 4 received treatment with pegylated interferon alpha 2a (180μg/week) and ribavirin (1000mg/day if body weight was <75kg or 1200mg/day if body weight was >75kg) or interferon alpha 2b (1.5μg/kg/week) and ribavirin (10.6mg/kg/day) for 48 weeks. Patients with genotype 2 or 3 were treated for 24 weeks with the same regimen of pegylated interferon alpha-2a or alpha-2b, but with 800 mg of ribavirin divided in two daily doses. Sustained viral response was defined as absence of HCV-RNA 6 months after the end of treatment.
ResultsA total of 219 patients were included (69% men; mean age 44±10). As epidemiological antecedents, 22.4% of the treated patients had previously consumed drugs parenterally and 22.4% had received blood transfusions before 1992. Forty-seven percent of the patients with liver biopsy had fibrosis bridges or established liver cirrhosis. The genotype was distributed as follows: 69.8% genotype 1, 4.1% genotype 2, 17.8% genotype 3, and 8.2% genotype 4. Of the 219 patients, 76 (35%) were treated with pegylated interferon alpha 2a and 143 (65%) with interferon alpha 2b. Analysis of response by genotype revealed that sustained viral response was obtained in 46% genotype 1, 88.9% genotype 2, 78.9% genotype 3, and 33.3% genotype 4. Univariate analysis showed that the only variable influencing sustained viral response was genotype.
ConclusionTreatment with pegylated interferon and ribavirin in clinical practice shows a similar pattern of sustained viral response to that obtained in clinical research. The main variable correlated with sustained viral response continues to be viral genotype.
La hepatitis crónica por el virus C tiene una alta prevalencia, que varía entre las diferentes autonomías (1,6-2,6%), lo que significa que puede haber entre 480.000 y 760.000 personas infectadas en España1. Es la causa más frecuente de cirrosis hepática y de trasplante hepático, no sólo en nuestro país, sino en todo el mundo2.
Hasta la actualidad, el tratamiento de elección para obtener la respuesta viral sostenida (RVS) es la combinación de interferón alfa-2a o alfa-2b más ribavirina3. Numerosos estudios aleatorizados han mostrado que la tasa de respuesta sostenida es superior al 60% en el total de los pacientes tratados, y de aproximadamente un 50% en los que presentan el genotipo 1 difíciles de tratar4–6. El tratamiento combinado requiere por parte del paciente una gran implicación, dado que han de autoadministrarse inyecciones subcutáneas de interferón semanalmente, tomar cada día medicación oral, realizar frecuentes visitas al especialista y soportar los efectos secundarios no desdeñables del tratamiento7–9. Su calidad de vida durante el tratamiento disminuye de forma significativa10. Por otro lado, se ha demostrado que el cumplimiento del tratamiento favorece la tasa de RVS11.
Todo ello hace que los resultados obtenidos en la RVS en los estudios aleatorizados puedan ser diferentes de los hallados en la práctica clínica. Los pacientes que participan en los estudios aleatorizados suelen ser sujetos motivados, con un seguimiento del tratamiento y de sus efectos mucho más estricto que los no seleccionados previamente.
Por ello, el objetivo de nuestro estudio fue analizar los resultados obtenidos en una cohorte de pacientes no seleccionados a los que se les administró el tratamiento antiviral con interferón pegilado y ribavirina en la práctica clínica habitual.
MATERIAL Y MÉTODOSPacientesSe incluyeron todos los pacientes (mayores de 18 años) que realizaron tratamiento con interferón pegilado alfa-2a o alfa-2b más ribavirina en el período comprendido entre agosto de 2001 y diciembre de 2005 en nuestra unidad.
Todos los pacientes incluidos presentaban criterios de hepatitis crónica por el virus de la hepatitis C (VHC) con elevación de la alanina-aminotransferasa (ALT) superior a 1,5 veces el valor normal y ARN-VHC cuantificable (> 600 U/ml por COBAS Amplicor HCV Monitor v2.0, Roche Diagnostics, Basilea, Suiza). Todos los pacientes incluidos fueron informados de los efectos adversos del tratamiento, y firmaron el consentimiento informado. Asimismo, se les informó de la necesidad de tomar medidas anticonceptivas durante el tratamiento y hasta 6 meses después de finalizarlo.
Fueron excluidos los pacientes que realizaron tratamiento antiviral con interferón pegilado y ribavirina, pero que presentaban otras infecciones virales crónicas concomitantes, como hepatitis crónica por el virus de la hepatitis B, virus de la hepatitis D o virus de la inmunodeficiencia humana.
No se indicó tratamiento antiviral a los pacientes con cirrosis hepática descompensada, trastornos psiquiátricos mayores, adicción a drogas o consumo excesivo de alcohol. Los pacientes con plaquetas < 75.000/μl, neutrófilos < 1.500/μl, hemoglobina < 12 g/dl en mujeres o < 13 g/dl en varones, o las mujeres embarazadas o en período de lactancia tampoco realizaron el tratamiento antiviral.
Pautas de tratamientoLos pacientes fueron tratados de acuerdo con las pautas establecidas. Si presentaban un genotipo 1 o 4, recibían tratamiento con interferón pegilado alfa-2a (180 μg/semana) y ribavirina (1.000 mg/día si < 75 kg, o 1.200 mg/día si > 75 kg) o interferón alfa-2b (1,5 μg/kg/semana) y ribavirina (10,6 mg/kg/día) durante 48 semanas. Los pacientes con genotipo 2 y 3 fueron tratados durante 24 semanas con la misma pauta de interferón pegilado alfa-2a o alfa-2b, pero con 800 mg de ribavirina al día repartida en 2 dosis.
El tipo de interferón pegilado utilizado para cada paciente fue decidido por el propio médico responsable, sin ninguna pauta preestablecida.
Base de datosTras una revisión exhaustiva de la historia clínica de cada paciente se recogieron los siguientes datos:
- –
Datos demográficos: edad, sexo.
- –
Datos epidemiológicos: antecedentes de transfusión de sangre, adicción a drogas por vía parenteral.
- –
Datos de la hepatitis crónica: resultado de la biopsia hepática (la fibrosis se valoró según el estadio de Knodell12?), ARN-VHC basal (si el ARN-VHC fue < 600.000 U se consideró una carga viral baja, y alta si era ≥ a 600.000 U. Se utilizó este valor de corte dado que es el utilizado por la Direcció General de Recursos Sanitaris del Departament de Salut, para recomendar la duración del tratamiento en los genotipo 1 o 4, basado en múltiples ensayos internacionales. Asimismo, se recogieron también como variables el genotipo viral, la ALT, la AST, el colesterol, la ferritina, la hormona tiroestimulante y la bilirrubina total.
- –
Respuesta obtenida al tratamiento. Según los criterios establecidos de forma habitual, RVS (negatividad del ARN-VHC 6 meses después de finalizado el tratamiento), respuesta completa (negatividad del ARNVHC al finalizar el tratamiento), recidiva (positividad del ARN-VHC tras la obtención de una respuesta viral completa), sin respuesta (positividad del ARN-VHC a las 24 semanas de tratamiento o disminución inferior a 2 log del ARN-VHC a las 12 semanas de tratamiento). Asimismo, en este grupo se incluyeron los pacientes que tuvieron que abandonar el tratamiento por la aparición de efectos adversos.
- –
Efectos adversos del tratamiento. Se recogieron los efectos secundarios que precisaron el inicio de medicación concomitante para su control o que obligaron a la retirada del tratamiento.
Los datos fueron analizados con la base de datos SPSS 14.0. Las variables continuas se presentan como media ± desviación estándar. Los datos sin distribución normal se presentan como mediana y rango. La prueba de la t de Student se utilizó para la comparación de variables continuas y el test de la χ2 para las variables categóricas; se consideró estadísticamente significativo un valor de p < 0,05.
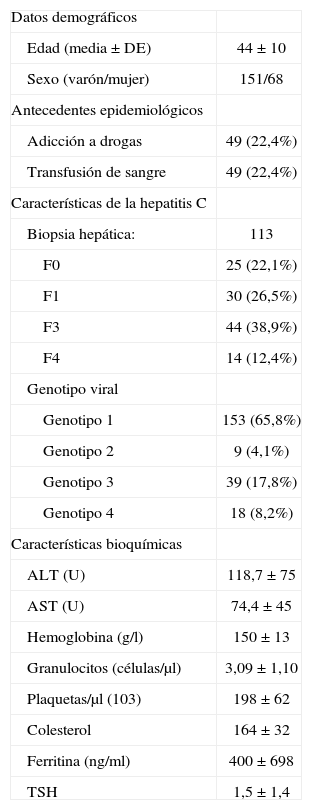
RESULTADOSUn total de 219 pacientes realizaron el tratamiento en el período comprendido entre agosto de 2001 y diciembre de 2005 (151 varones y 68 mujeres). La edad media fue de 44 ± 10 años (tabla I).
Características basales de los pacientes
| Datos demográficos | |
| Edad (media ± DE) | 44 ± 10 |
| Sexo (varón/mujer) | 151/68 |
| Antecedentes epidemiológicos | |
| Adicción a drogas | 49 (22,4%) |
| Transfusión de sangre | 49 (22,4%) |
| Características de la hepatitis C | |
| Biopsia hepática: | 113 |
| F0 | 25 (22,1%) |
| F1 | 30 (26,5%) |
| F3 | 44 (38,9%) |
| F4 | 14 (12,4%) |
| Genotipo viral | |
| Genotipo 1 | 153 (65,8%) |
| Genotipo 2 | 9 (4,1%) |
| Genotipo 3 | 39 (17,8%) |
| Genotipo 4 | 18 (8,2%) |
| Características bioquímicas | |
| ALT (U) | 118,7 ± 75 |
| AST (U) | 74,4 ± 45 |
| Hemoglobina (g/l) | 150 ± 13 |
| Granulocitos (células/μl) | 3,09 ± 1,10 |
| Plaquetas/μl (103) | 198 ± 62 |
| Colesterol | 164 ± 32 |
| Ferritina (ng/ml) | 400 ± 698 |
| TSH | 1,5 ± 1,4 |
ALT: alanina-aminotransferasa; AST: aspartato-aminotransferasa; DE: desviación estándar; TSH: hormona tiroestimulante.
Del total de pacientes que realizaron el tratamiento, un 44,8% presentaba antecedentes epidemiológicos de interés, 49 de ellos (22,4%) tenían antecedentes de adicción a drogas por vía parenteral y a otros 49 se les había realizado transfusión de sangre antes del año 1992 (en que la detección de la hepatitis C en las donaciones fue universal) (tabla I).
Datos basales de la hepatitis crónica por el virus CLos datos bioquímicos previos al inicio del tratamiento de los pacientes están reflejados en la tabla I.
La biopsia hepática se realizó en un total de 113 pacientes (51,6%). La fibrosis se distribuyó de la siguiente manera: F0, 25 (22,1%); F1, 30 (26,5%); F3, 44 (38,9%) y F4,14 (12,4%).
El genotipo predominante fue el 1, con un total de 153 casos (69,8%). El resto de los pacientes se distribuyó de manera que el genotipo 2 estaba presente en 9 de ellos (4,1%), el genotipo 3 en 39 (17,8%) y el genotipo 4 en 18 (8,2%).
La carga viral previa al tratamiento fue baja (< 600.000 U/ml) en 103 (47%) y alta (≥ 600.000 U/ml) en 116 (53%).
Efectos secundarios durante el tratamiento antiviralEntre los efectos psicológicos más destacables, un total de 30 pacientes (13,7%) presentaron una depresión clínicamente relevante y requirieron el inicio de tratamiento con inhibidores de la recaptación de serotonina. Ninguno de los pacientes precisó abandonar el tratamiento por dicha razón. Otros efectos psicológicos prevalentes fueron la ansiedad y el insomnio, presente en 28 pacientes (12,7%), que precisaron el inicio de tratamiento con benzodiacepinas, 3 de estos pacientes tuvieron que abandonar el tratamiento por falta de mejoría de los síntomas. Un paciente presentó un brote psicótico, por lo que se le retiró el tratamiento y se le efectuaron controles en el servicio de psiquiatría.
Entre los efectos digestivos adversos, las náuseas estuvieron presentes en 14 pacientes (6,4%), que cedieron en todos los casos con el inicio de tratamiento con clorhidrato de metroclopramida. Las epigastralgias estuvieron presentes en 17 pacientes (7,8%) y se resolvieron con dosis habituales de inhibidores de la bomba de protones. Los principales efectos metabólicos se presentaron como disfunción del tiroides. Un total de 3 (1,3%) pacientes desarrollaron hipotiroidismo, de éstos, 2 presentaron un buen control con la administración de levotiroxina y uno de ellos tuvo que abandonar el tratamiento antiviral por mala tolerancia. Los 3 pacientes han continuado posteriormente con tratamiento sustitutivo para el tiroides. Otro paciente presentó hipertiroidismo, por lo que abandonó el tratamiento antiviral y tuvo una recuperación posterior ad integrum.
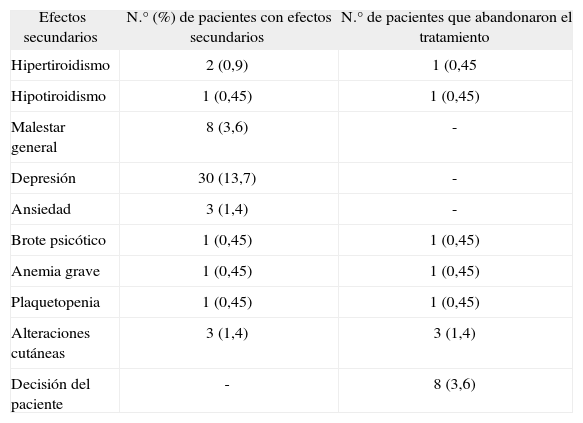
Los motivos de abandono del tratamiento antiviral por efectos adversos se reflejan en la tabla II.
Número de pacientes con efectos secundarios y causas de abandono del tratamiento
| Efectos secundarios | N.° (%) de pacientes con efectos secundarios | N.° de pacientes que abandonaron el tratamiento |
| Hipertiroidismo | 2 (0,9) | 1 (0,45 |
| Hipotiroidismo | 1 (0,45) | 1 (0,45) |
| Malestar general | 8 (3,6) | - |
| Depresión | 30 (13,7) | - |
| Ansiedad | 3 (1,4) | - |
| Brote psicótico | 1 (0,45) | 1 (0,45) |
| Anemia grave | 1 (0,45) | 1 (0,45) |
| Plaquetopenia | 1 (0,45) | 1 (0,45) |
| Alteraciones cutáneas | 3 (1,4) | 3 (1,4) |
| Decisión del paciente | - | 8 (3,6) |
El tratamiento con interferón pegilado y ribavirina en los 219 pacientes tratados logró una RVS del 52,1%. La respuesta completa, aunque con posterior recidiva, se obtuvo en el 12,3%. La tasa de no respondedores al tratamiento fue del 23,7% y la tasa de abandono por efectos adversos del 11%.
En el análisis univariado se analizaron los diversos factores que podrían influir en la respuesta obtenida tras el tratamiento antiviral, entre ellos, el genotipo viral, la edad, el sexo, la viremia inicial, el nivel basal de ALT, el tipo de interferón pegilado utilizado y el grado de fibrosis en la biopsia hepática.
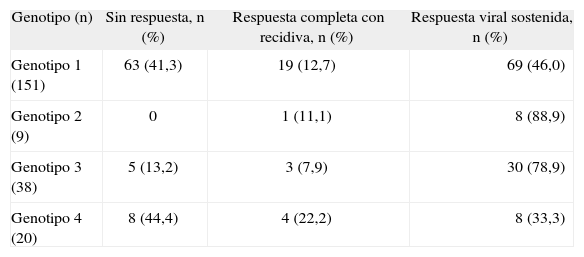
La respuesta obtenida tras el tratamiento según el genotipo se específica en la tabla III. Se observa una gran diferencia entre la RVS obtenida en el grupo de los genotipos 2 y 3, con un 88,9 y un 78,9%, respectivamente, frente al 46 y el 33,3% en los genotipos 1 y 4. Estos resultados alcanzan significación estadística.
Respuesta obtenida al tratamiento antiviral según el genotipo viral
| Genotipo (n) | Sin respuesta, n (%) | Respuesta completa con recidiva, n (%) | Respuesta viral sostenida, n (%) |
| Genotipo 1 (151) | 63 (41,3) | 19 (12,7) | 69 (46,0) |
| Genotipo 2 (9) | 0 | 1 (11,1) | 8 (88,9) |
| Genotipo 3 (38) | 5 (13,2) | 3 (7,9) | 30 (78,9) |
| Genotipo 4 (20) | 8 (44,4) | 4 (22,2) | 8 (33,3) |
Los pacientes con biopsia hepática se subdividieron en dos grupos según el grado de fibrosis; F0-F1 (53%) frente a F3-F4 (47%). La RVS obtenida en el grupo F0-F1 fue del 61,8% frente al 41,4% en el grupo F3-F4, sin que adquiriese significación estadística. Los varones presentaron un porcentaje de RVS del 54% y las mujeres del 49,3%, sin significación estadística. La tasa de RVS en los pacientes con carga viral baja fue del 53% frente al 41,3% en los pacientes con carga viral alta. Tampoco hubo diferencias significativas según el tipo de interferón pegilado utilizado. Así, los 76 pacientes (35%) tratados con interferón pegilado alfa-2a presentaron una tasa de RVS del 50% frente al 53,6% de los 143 (65%) tratados con interferón pegilado alfa-2b. Ni la edad ni el valor basal de ALT fueron tampoco estadísticamente significativos.
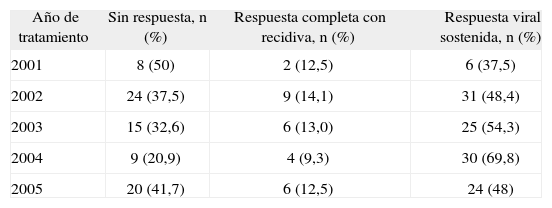
Otro factor que se ha valorado es el año en que se inició el tratamiento antiviral y el grado de RVS alcanzado. En la tabla IV se observa que progresivamente aumenta la tasa de respuesta anual, si bien hay un pequeño retroceso en el año 2005. No hubo diferencias en los otros factores asociados ni en el genotipo viral, el sexo, el grado de fibrosis o los valores basales de ALT. Sin embargo, esta progresión en la RVS no resulta estadísticamente significativa.
Respuesta obtenida en el tratamiento antiviral en función del año de inicio del tratamiento
| Año de tratamiento | Sin respuesta, n (%) | Respuesta completa con recidiva, n (%) | Respuesta viral sostenida, n (%) |
| 2001 | 8 (50) | 2 (12,5) | 6 (37,5) |
| 2002 | 24 (37,5) | 9 (14,1) | 31 (48,4) |
| 2003 | 15 (32,6) | 6 (13,0) | 25 (54,3) |
| 2004 | 9 (20,9) | 4 (9,3) | 30 (69,8) |
| 2005 | 20 (41,7) | 6 (12,5) | 24 (48) |
Durante los últimos años, el tratamiento antiviral para la hepatitis crónica por el virus C ha ido evolucionando de forma muy favorable. Inicialmente, el tratamiento con interferón como monoterapia alcanzaba sólo una tasa de RVS del 10%13. El gran salto en la evolución del tratamiento fue la incorporación de la ribavirina como medicamento adyuvante con el que se lograron tasas de RVS del 40%14. En la actualidad, el tratamiento recomendado es el interferón pegilado y la ribavirina3. El interferón pegilado se caracteriza por tener una vida media más prolongada que el interferón recombinante15. Hay dos formas de interferón pegilado, el alfa-2b y el alfa-2a, que pueden administrarse una vez por semana16.
Sin embargo, todos estos cambios positivos en el tratamiento con una mejora en la RVS obtenida no se han correlacionado con una disminución de los efectos secundarios que se presentan de manera casi uniforme en todos los pacientes en forma de astenia o síndrome seudogripal, si bien la mayoría de estos efectos adversos son controlables y permiten continuar con el tratamiento hasta su finalización7. Dadas las características de nuestro estudio, únicamente hemos contemplado los efectos adversos que obligaron al inicio de tratamiento coadyuvante o al abandono de la terapia antiviral. El porcentaje de pacientes con ansiedad o depresión que precisaron tratamiento en nuestro estudio fue del 13 y el 12%, respectivamente. En los estudios previamente publicados estas tasas son más altas, probablemente por tratarse de estudios aleatorizados con instrumentos de detección y seguimiento más exhaustivos17. El porcentaje de abandono del tratamiento por efectos adversos graves en nuestro estudio es del 11%, menor que en los publicados en otros de características similares18,19.
Múltiples ensayos clínicos aleatorizados han mostrado la eficacia de la combinación como tratamiento antiviral y los factores predictores de respuesta, entre los que destaca el genotipo viral como el más importante, pero también otros, como la carga viral inicial, el sexo, el valor basal de ALT, el índice de masa corporal y el grado de lesión histológica20. En los últimos años, otro factor añadido ha sido el del cumplimiento terapéutico. McHutchison et al11 mostraron en su estudio que con un mayor cumplimiento terapéutico se lograban mejores resultados en la RVS. La mayoría de estos ensayos clínicos han sido promovidos por los propios laboratorios para introducir en el mercado los nuevos productos21.
Recientemente, Diago et al22 han publicado los datos obtenidos de una cohorte de 475 pacientes con hepatitis crónica por el VHC y genotipo 1, tratados con interferón pegilado alfa-2a y ribavirina. La RVS obtenida fue del 48%. Estos resultados son similares a los de estudios previos multicéntricos y aleatorizados4,5. En otro estudio de similares características, recientemente publicado en Francia sobre la población difícil de tratar (genotipo 1), la RVS fue del 44%23, semejante a la obtenida por nuestra cohorte de pacientes con genotipo 1, que fue del 46%.
En el estudio de Lee et al19 se incluyen los resultados de una cohorte amplia de pacientes tratados con interferón pegilado y ribavirina. La RVS obtenida fue del 55% en pacientes sin fibrosis o con fibrosis periportal, y del 42% en pacientes con fibrosis en puente o cirróticos (F3/F4, 34%). Nuestros resultados, si bien no se pueden comparar, dado que se trata de diferentes poblaciones y que sólo disponemos de biopsia de un 51% de nuestros pacientes, fueron similares pues correspondería al 61% en F0-F1 y el 41% en F3/F4, teniendo en cuenta que el porcentaje de pacientes con F3/F4 en nuestra cohorte es superior y alcanza el 47%.
En los resultados obtenidos en nuestra cohorte llama la atención la baja RVS alcanzada por los pacientes con genotipo 4, que fue únicamente del 33%. Dos estudios aleatorizados han mostrado resultados más favorables en este tipo de pacientes. Así, Hasan et al24 obtuvieron una RVS del 68% realizando tratamiento en 66 pacientes infectados con genotipo 4 con interferón alfa-2b y ribavirina. Resultados similares obtienen Diago et al25 en 24 pacientes con hepatitis crónica por el virus C y genotipo 4, que recibieron tratamiento con interferón pegilado alfa-2a y ribavirina durante 48 semanas, con una RVS del 79%, similar a la obtenida en los genotipo 2/3. Los resultados obtenidos por nosotros con el genotipo 4 han de tomarse con precaución, dado que el número de pacientes incluidos es únicamente de 18, con un porcentaje de no respuesta del 44% y una tasa de respuesta completa con recidiva del 22,2%.
En nuestro estudio no hemos encontrado diferencias estadísticamente significativas en los factores tradicionalmente asociados con una mejor respuesta, como la carga viral inicial, la fibrosis o el sexo de los pacientes. En todos ellos se halla una tendencia favorable sin que llegue a la significación estadística, probablemente por un problema relacionado con la muestra. Aunque sí hay una significación estadística respecto al genotipo dado que éste es el factor que más fuertemente se asocia a la respuesta.
En nuestro análisis estadístico también hemos tenido en cuenta el posible papel del tipo de interferón pegilado utilizado. No hay ninguna diferencia estadísticamente significativa en la RVS, la tasa de recidiva o de no respuesta. Pocos estudios hasta la actualidad han comparado ambos tipos de interferón, y ninguno de ellos tampoco ha demostrado diferencias estadísticamente significativas26.
Un dato interesante obtenido en nuestro estudio, aunque no alcance significación estadística, es la mejoría en la RVS con los años, como se muestra en la tabla IV. Ello podría estar relacionado con un mejor manejo de los efectos adversos en los pacientes, lo que ayudaría a un mayor cumplimiento terapéutico y, por tanto, a una mejoría en los resultados. Ningún artículo hasta la actualidad ha mostrado resultados en este sentido, por lo que se precisarían estudios más extensos y exhaustivos para poder llegar a alguna conclusión.
En resumen, en la práctica clínica el tratamiento antiviral con interferón pegilado y ribavirina obtiene resultados similares a los hallados en los estudios aleatorizados. El genotipo continúa siendo el factor predictor fundamental de la RVS, y otros factores asociados no alcanzan significación estadística, como el sexo, el grado de fibrosis o el valor de ALT inicial. En futuros estudios se tendría que tener en cuenta, como otro posible factor predictivo asociado, el conocimiento y la experiencia progresiva del equipo multidisciplinario.
CONFLICTOS DE INTERESESLos autores declaran no tener ningún conflicto de intereses.