La ciclosporina (CyA) intravenosa (i.v.) ha demostrado ser eficaz en el control de los brotes agudos graves de colitis ulcerosa que no responden a esteroides i.v. Tras la respuesta inicial a la CyA i.v., se han propuesto dos alternativas para mantener la remisión, la doble o triple asociación de inmunosupresores. Los objetivos de nuestro estudio han sido valorar la eficacia de CyA i.v., sus efectos secundarios y la efectividad posterior a largo plazo de la azatioprina/6-mercaptopurina sin CyA oral.
Material y métodosSe administró CyA i.v. durante 10 días, en dosis de 4 mg/kg/día a 20 pacientes diagnosticados de colitis ulcerosa en brote grave y que no respondieron a tratamiento con esteroides i.v. A los que respondieron y pudieron ser dados de alta se les administró azatioprina o 6-mercaptopurina asociadas a esteroides orales en pauta descendente y sin CyA oral.
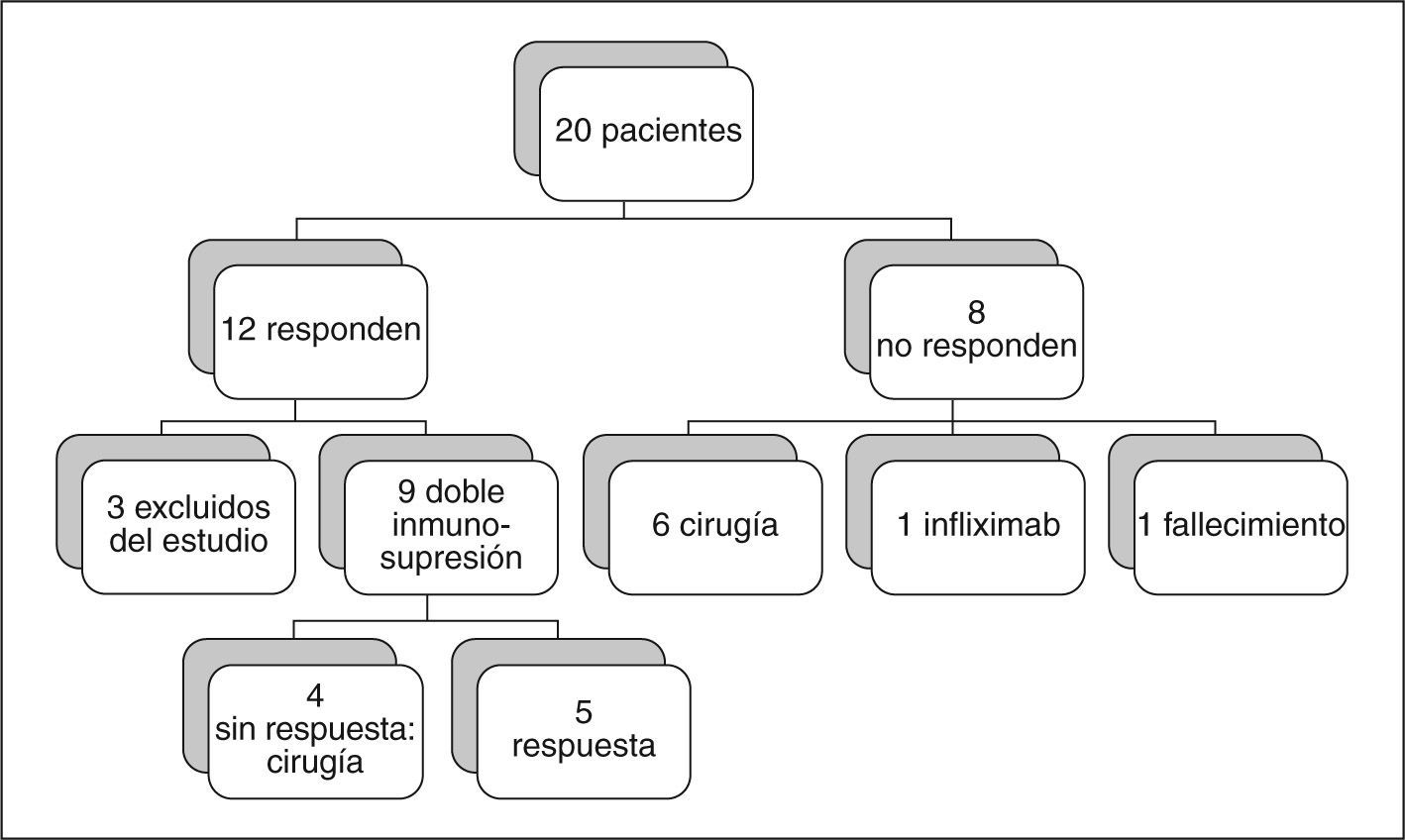
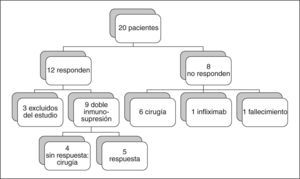
ResultadosEl 60% (12/20) de los pacientes presentó una mejoría clínicobiológica tras la administración de CyA, lo que permitió evitar la colectomía y que fueran dados de alta hospitalaria. Se siguieron a largo plazo 9 de los 12 pacientes que respondieron (3 se excluyeron del estudio), y de ellos 4 (44,4%) tuvieron que ser colectomizados, todos antes del sexto mes del alta. Los efectos secundarios fueron todos leves, excepto un fallecimiento.
ConclusionesLa CyA i.v. es eficaz para inducir la remisión de la colitis ulcerosa en los brotes graves resistentes a esteroides i.v. Con la estrategia de administrar azatioprina sin CyA oral, los pacientes que requieren colectomía la precisan en los primeros 6 meses tras el alta.
Intravenous (i.v.) cyclosporine (CsA) has proved effective in controlling acute attacks of ulcerative colitis unresponsive to IV steroids. After the initial response to i.v. CsA, two alternatives for maintaining remission have been proposed: either double or triple association with immunosuppressors. The aim of this study was to evaluate the effectiveness of i.v. CsA, its adverse effects, and the subsequent long-term effectiveness of azathioprine/6-mercaptopurine without oral CsA.
Material and methodsIntravenous CsA was administered for 10 days, at a dose of 4 mg/kg per day, to 20 patients diagnosed with a severe attack of ulcerative colitis who did not respond to IV steroid treatment. Patients who responded to CsA and could be discharged were administered azathioprine or 6-mercaptopurine associated with a decrea-sing dose of oral steroids, without oral CsA.
ResultsSixty per cent (12/20) of the patients showed clinical-biological improvement after CsA administration, thus avoiding colectomy, and were discharged from hospital. Nine of the 12 responders (three withdrew from the study) were followed-up long term. Of these nine patients, four (44.4%) underwent colectomy, all before the sixth month of discharge. All adverse effects were mild, except for one death.
ConclusionsIntravenous CsA is effective in inducing remission of ulcerative colitis in severe attacks resistant to i.v. steroids. When treatment with azathioprine is administered without oral CsA, patients requiring colectomy need this procedure within the first 6 months of discharge.
A lo largo de su vida aproximadamente el 15% de los pacientes afectados de colitis ulcerosa (CU) van a presentar brotes de actividad grave que requerirán ingreso hospitalario y tratamiento con corticoides intravenosos (i.v.)1. La respuesta a éstos es de alrededor del 60%, por lo que un 40% va a precisar otros tratamientos. Hasta los años noventa el único tratamiento para este tipo de pacientes era la proctocolectomía total.
En 1994 se publicó el único estudio aleatorizado que compara la ciclosporina (CyA) i.v. frente a placebo en pacientes no respondedores a esteroides i.v., y se obtuvo una respuesta de hasta el 80%, evitando así la colectomía precoz2. Posteriormente, otras series, tanto controladas como no controladas, han obtenido resultados de entre el 62 y el 100%3–6. Por otra parte, Jarnerot et al7 en el año 2005 confirmaron que infliximab puede ser útil en los brotes graves de CU refractarios a esteroides, lo que constituye una segunda alternativa de tratamiento médico para estos pacientes8.
Tras la respuesta inicial a la CyA i.v., se han propuesto dos alternativas para mantener la remisión. La primera es la triple asociación inmunosupresora de azatioprina (AZA)/6-mercaptopurina (6-MP), corticoides y CyA oral (esta última debe suspenderse a los 3-6 meses)9. La segunda opción defendida por otros autores no incluye la CyA oral, con lo que se evitan sus posibles efectos secundarios10,11.
Los objetivos del presente estudio fueron: a) valorar la eficacia de CyA i.v. para evitar la colectomía a corto plazo, así como sus efectos secundarios, y b) evaluar la efectividad del mantenimiento de la respuesta a medio y largo plazo con AZA/6-MP y sin CyA oral.
MATERIAL Y MÉTODOSDesde octubre de 1998 hasta enero de 2007 ingresaron en el Servicio de Patología Digestiva del Hospital General Universitario de Valencia 20 pacientes con CU en brote grave, refractarios a esteroides i.v. (hidrocortisona i.v.). A los pacientes que no respondieron a estos fármacos tras 7- 10 días se les administró CyA i.v. (Sandimmun en ampollas de 50 mg/ml) con dosis inicial de 4 mg/kg/día. Diariamente la dosis de CyA se ajustaba para mantener los valores plasmáticos en un rango de 100– 200 ng/ml (dosis inferiores a las utilizadas habitualmente con el objetivo de minimizar sus efectos secundarios), se analizaba su concentración mediante inmunofluorescencia polarizada, y se realizaba una analítica básica (hemograma, función renal, electrolitos y transaminasas) y un control estricto de las cifras de presión arterial. La dosis de CyA se aumentó un 10% si los valores eran menores de 100 ng/ml, y se redujo un 10% si éstos eran mayores de 200 ng/ml, la función renal empeoraba en más del 30% o si se habían elevado las transaminasas más de 2 veces su valor normal. También diariamente los pacientes eran valorados de forma conjunta por el servicio de cirugía y derivados a proctocolectomía si se producía un grave empeoramiento clínico o ante la ausencia de respuesta al tratamiento médico tras 10 días de CyA i.v.
A los pacientes que obtuvieron respuesta al tratamiento con CyA i.v. (normalización del número y las características de las deposiciones y reducción de los reactantes inflamatorios) se les administró AZA (dosis 2- 2,5 mg/kg/día) o 6-MP (dosis 1-1,5 mg/kg/día) previamente al alta, corticoides orales (prednisona 1 mg/kg/día) en pauta descendente de 5 mg cada 7 días y mesalazina oral (3 g/día). No se administró profilaxis de Pneumocistis carinii con cotrimoxazol.
Las variables del estudio se expresaron en medias, rango y porcentajes. Para determinar si el número de deposiciones o el valor de la proteína C reactiva (PCR) al tercer día influyen en que los pacientes respondan a CyA i.v. o requieran colectomía, se aplicó la regresión logística. El valor de significación elegido para realizar los contrastes fue de 0,05. Los cálculos se realizaron mediante el paquete estadístico SPSS 13.0.
RESULTADOSCaracterísticas de los pacientesComo puede apreciarse en la tabla I, la extensión de la enfermedad era, en la mayoría de los casos, una pancolitis (85%), y en 4 de ellos la enfermedad había progresado a una pancolitis desde el diagnóstico previo de colitis izquierda. La mayoría de los pacientes eran no fumadores y solamente 2 estaban siendo tratados con AZA previamente al brote.
Respuesta a corto plazoEl 60% (12/20) de los pacientes presentó una mejoría clínico- biológica tras la administración de CyA, lo que permitió evitar la colectomía y que fueran dados de alta hospitalaria. La duración media de administración de CyA i.v. fue de 9,5 días (rango, 7-11).
De los 8 pacientes en los que la CyA no fue efectiva, 6 se intervinieron quirúrgicamente durante el ingreso, un paciente sin respuesta se negó a someterse a la intervención quirúrgica, por lo que fue tratado con infliximab 5 mg/kg en pauta habitual, con buena respuesta a los 6 meses del inicio del tratamiento, y otro paciente pendiente de intervención quirúrgica falleció a causa de un fallo multiorgánico secundario a shock séptico y mielinosis central pontina (20 días después de haber finalizado la administración de CyA).
Al tercer día de tratamiento con CyA, los pacientes que respondieron tenían una media de 4 deposiciones/día (rango, 2-6), mientras que ésta era de 7,8 deposiciones/ día (rango, 4-11) en los que no respondieron. La media de PCR al tercer día en los pacientes que respondieron fue de 36,3 mg/l (rango, 16–57,6), y en los que no respondieron de 62,45 mg/l (rango, 13–107,3). Al realizar el contraste de hipótesis se obtiene un valor significativo (p = 0,002) para el número de deposiciones y no significativo (p = 0,385) en cuanto al valor de PCR, lo cual indica que al tercer día el número de deposiciones, no la PCR, puede predecir la respuesta a CyA.
Respuesta a largo plazoDe los 12 pacientes iniciales que respondieron a la CyA i.v., 3 se han excluido del estudio, uno por asociar CyA oral tras la respuesta al tratamiento con CyA i.v., otro porque siguió un tratamiento sólo con salicilatos orales, y otro por seguimiento tras el alta menor de 6 meses.
De los 9 pacientes incluidos en el estudio, 2 reingresaron al cabo de un mes por reaparición de los síntomas y fueron intervenidos quirúrgicamente, y en otro se realizó una colectomía electiva a los 5 meses, al no poder retirar los esteroides orales.
En 6 pacientes (66,7%) se pudo retirar los esteroides en una media de 111 días (rango, 90–150). El seguimiento medio de éstos fue de 57 meses (rango, 6-94). Cuatro de los 6 pacientes tuvieron recaídas clínicas que requirieron corticoides orales, 3 de ellos se controlaron con estos fármacos (un brote en un paciente, 2 brotes en un paciente y un brote anual durante 6 años de seguimiento en otro paciente, que rechazó la cirugía electiva); a un cuarto paciente se le realizó una colectomía al presentar un brote moderado- grave a los 2 meses de suspender los esteroides y no responder a la reintroducción de corticoides i.v. (fig. 1).
Se colectomizaron 4 de los 9 pacientes iniciales (44,4%), todos ellos antes del sexto mes tras haber sido dados de alta.
Los 2 pacientes que estaban siendo tratados con AZA previamente a la administración de CyA respondieron a ésta, pero fueron colectomizados en los primeros 6 meses tras el alta hospitalaria.
Eficacia de la estrategiaSi analizamos la eficacia de la estrategia utilizada para los brotes graves refractarios a esteroides en nuestro servicio (CyA i.v. seguida de AZA o 6-MP + mesalazina oral en los que respondían), observamos que de los 16 pacientes en los que se utilizó (en 2 no se siguió esta estrategia de mantenimiento, en otro el seguimiento es menor de 6 meses y otro paciente, que no respondió a la CyA, se negó a someterse a la intervención y fue tratado con infliximab), solamente en 5 de ellos (31,25%) se evitó la colectomía a los 6 meses del tratamiento, pero todos ellos se mantenían libres de colectomía al final del seguimiento (media, 57 meses; rango, 6-94).
Efectos secundariosDurante la administración de la CyA i.v. se observaron los siguientes efectos secundarios, resumidos en la tabla II. Infecciones en los pacientes: una amigdalitis pultácea, un síndrome febril sin foco con neutropenia asociada, una bacteriemia por grampositivos por catéter central y neutropenia asociada, y un muguet lingual. Se observó una elevación de las transaminasas: leve (< 2 veces el valor normal) en 2 pacientes, 2 veces el valor normal en uno y más de 5 veces el valor normal en otros 2 que requirieron un ajuste de la dosis. Dos casos de hipertensión arterial, ambos leves, que se controlaron tras el tratamiento médico. Dos pacientes presentaron nerviosismo, insomnio, rubor, cefalea leve y prurito durante las infusiones. Un paciente presentó una hipertricosis leve reversible tras finalizar el tratamiento. Otro presentó a los 5 días de finalizado el tratamiento con CyA un desprendimiento de retina y hemorragia del nervio óptico, ambos leves. Una paciente falleció a los 20 días de finalizado el tratamiento con CyA mientras esperaba para ser intervenida, presentando alteraciones hidroelectrolíticas que le causaron una mielinosis central pontina y posteriormente un shock séptico.
Efectos secundarios
| Efectos secundarios | n (%) |
| Infecciones | |
| Amigdalitis pultácea | 1 (5) |
| Síndrome febril sin foco | 1 (5) |
| Bacteriemia por grampositivos | 1 (5) |
| Muguet lingual | 1 (5) |
| Hipertransaminasemia | 5 (25) |
| Hipertensión arterial | 2 (10) |
| Fallecimiento | 1 (5) |
| Hipertricosis | 1 (5) |
| Oculares | 1 (5) |
| Otras | 2 (10) |
No se observaron infecciones oportunistas durante el seguimiento. Sólo en un caso se tuvo que suspender temporalmente la 6-mercaptopurina por presentar neutropenia grave (neutrófilos menores de 1.000 células/_l).
DISCUSIÓNLa CyA i.v. ha demostrado ser eficaz en el control de los brotes graves de colitis ulcerosa resistentes al tratamiento con esteroides i.v.; la respuesta en nuestra serie fue del 60%, similar a lo publicado en la literatura médica, donde en una reciente revisión sistemática se obtiene una media de respuesta del 71,4% en los estudios no controlados como el nuestro3, en los que el porcentaje de respuestas descrito por los diferentes autores variaba entre el 62 y el 100%3,5,6.
La dosis inicial de CyA utilizada fue de 4 mg/kg/día, la misma que en la mayoría de las series2,3; posteriormente se mantuvieron los valores terapéuticos entre 100 y 200 ng/ml, que eran incluso menores a los considerados en el estudio de Van Assche12, en el que se sugiere que una dosis inicial de 2 mg/kg/día puede ser igual de eficaz que el tratamiento estándar y reducir los efectos secundarios. Se utilizaron valores terapéuticos inferiores, similares a los utilizados en otros estudios publicados11, con el objetivo de minimizar los posibles efectos adversos.
Al analizar los factores que pudieran predecir la respuesta al tratamiento con CyA i.v., observamos que el número de deposiciones, así como la media de PCR, eran menores al tercer día de tratamiento en el grupo que respondió frente a los no respondedores, y sólo se obtuvieron diferencias estadísticas en el número de deposiciones. Esto podría ser un criterio para seleccionar a los pacientes que van a requerir una colectomía, y con ello se evitaría prolongar la administración de CyA y los problemas de desnutrición, hipoproteinemia y/o anemia que pueden aparecer al retrasar la decisión del tratamiento quirúrgico; no obstante, dado el reducido número de pacientes con estas características, habría que considerar con cautela estos resultados.
El tratamiento previo con AZA ha sido descrito como factor predictor de mala respuesta a la CyA i.v. y necesidad de colectomía13. En nuestro estudio solamente 2 de los 20 pacientes estaban siendo tratados con AZA al ingreso, y aunque respondieron inicialmente al tratamiento con CyA i.v., los 2 tuvieron que ser colectomizados en los primeros 6 meses tras haber sido dados de alta hospitalaria.
La estrategia más utilizada para el mantenimiento a largo plazo de la respuesta inducida con CyA i.v. es la triple inmunosupresión (esteroides + AZA/6-MP + ciclosporina oral), manteniendo algunos meses la CyA oral y reduciendo la dosis de esteroides9. Sin embargo, esta asociación no está exenta de posibles efectos adversos, principalmente infecciosos, que se intenta prevenir con la administración de trimetoprima-sulfametoxazol. En los pacientes de nuestro estudio se utilizó la estrategia de doble inmunosupresión propuesta por algunos autores11. En ellos se pudo retirar los esteroides en el 66,7% de los casos tras 111 días de media, datos que difieren de lo descrito en el estudio de Domènech et al11, en el que se pudo retirar los esteroides en el 88,9% de los pacientes con una mediana de tiempo de 90 días. Estas diferencias podrían atribuirse a las distintas pautas de reducción de los esteroides utilizadas en ambos estudios. Durante el seguimiento el 66,7% de los pacientes sufrió nuevos ataques que requirieron tratamiento con esteroides, porcentaje parecido al descrito por Domènech et al11, del 54,2%. Al final del seguimiento la colectomía se había realizado en el 44,7% de los pacientes que inicialmente habían respondido, y en el estudio de Domènech et al fue del 40,7%. Sin embargo, nuestros pacientes se colectomizaron todos antes del sexto mes tras la administración de CyA i.v., mientras que en el estudio de Domènech et al solamente 5 de 11 habían sido colectomizados en el primer año, y sólo 4 de 11 en los primeros 6 meses (36,4%). Aunque el número de pacientes de nuestro estudio es reducido y podría explicar estas diferencias, creemos que habría que reconsiderar la estrategia de doble inmunosupresión, ya que la AZA tiene un inicio de acción lento y alguno de nuestros pacientes podría haberse beneficiado del tratamiento con CyA oral, por lo que es necesario realizar más estudios aleatorizados que comparen ambas estrategias de mantenimiento.
Durante la administración de la CyA i.v,. la aparición de efectos secundarios fueron leves y fácilmente controlables, a excepción de una paciente en la que las alteraciones hidroelectrolíticas con posterior clínica neurológica (mielinosis central pontina a los 15 días de finalizar la ciclosporina) y la presencia de shock séptico desencadenaron su fallecimiento 20 días después de la administración de la CyA, mientras seguía una pauta de reducción esteroidea y estaba pendiente de intervención quirúrgica. El hecho de que la paciente estuviera en tratamiento esteroideo probablemente influyó en la infección y el fallecimiento posterior. Estos resultados son comparables con los publicados en la literatura médica3,14,15, donde la mayoría de los efectos secundarios descritos son leves y fácilmente controlables, aunque se han documentado algunos casos de fallecimiento durante la fase aguda de administración del fármaco i.v. En el seguimiento a largo plazo no surgieron complicaciones, lo que confirma la baja aparición de infecciones con esta estrategia terapéutica.
En resumen, nuestros resultados de eficacia a corto plazo son aceptables y similares a lo publicado en la bibliografía. En cuanto a las tasas de colectomía tras la respuesta inicial, si bien son parecidas a las publicadas por otros autores, difieren en el momento en que ésta tuvo que realizarse, que en nuestra serie fue en todos los pacientes en los primeros 6 meses. Creemos que este hecho obliga a realizar más estudios controlados y aleatorizados que nos permitan discernir si es adecuada o no la estrategia de doble inmunosupresión.
CONFLICTOS DE INTERESESLos autores declaran no tener ningún conflicto de intereses.