La erradicación del virus de la hepatitis C (VHC) con esquemas libres de interferón (AAD) ha modificado la evolución de la enfermedad ya que más del 95% de los pacientes con cirrosis compensada logran la respuesta virológica sostenida. Sin embargo, el impacto de la erradicación del VHC sobre el desarrollo del carcinoma hepatocelular (CHC) es controvertido. Dicha controversia podría dividirse en diversos aspectos fundamentales: el impacto del AAD en la tasa de recurrencia del CHC, la asociación temporal entre el inicio de AAD y el desarrollo de la recurrencia del CHC y finalmente la agresividad de los CHC. Es por ello que esta revisión tiene por objetivo analizar los resultados disponibles en esta población de pacientes desde una perspectiva clínica donde se valoran los riesgos/beneficios de erradicar el VHC con AAD en el contexto de pacientes con CHC en respuesta completa.
Eradication of the hepatitis C virus (HCV) with interferon-free therapies (DAAs) has modified the course of the disease, as the rate of patients with compensated cirrhosis who achieve a sustained virological response exceeds 95%. However, the impact on development of hepatocellular carcinoma (HCC) is currently in dispute. This argument could be divided into different key points: the impact of DAA on rate of HCC recurrence, the temporal link between starting DAAs and HCC recurrence, and finally, the aggressive pattern of HCC. Therefore, the aim of this review is to analyse the available results in this population of patients from a clinical perspective where the risks and benefits of HCV eradication with DAA therapies are evaluated in patients with complete response of HCC.
Los pacientes con hepatopatía crónica en estadio de cirrosis son pacientes en riesgo de desarrollar complicaciones y descompensación hepática independientemente de su etiología. Es por ello, que el objetivo principal de todos los médicos dedicados al manejo de estos enfermos es eliminar el agente etiológico (si es posible) o evitar el desarrollo de complicaciones con medidas profilácticas. En el caso de los pacientes con virus de hepatitis C (VHC), la aprobación de los tratamientos libres de interferón e internacionalmente conocidos como antivirales de acción directa (AAD) permiten erradicar el VHC y obtener respuesta virológica sostenida (RVS) en el 90% de los pacientes compensados (Child-Pugh A) y en el 81,6% de los pacientes descompensados (Child-Pugh B y C) al momento de iniciar AAD1-3.
La incorporación de los AAD llevó a la comunidad médica a considerar la erradicación del VHC como una opción de tratamiento adyuvante para disminuir la tasa de recurrencia del carcinoma hepatocelular (CHC). Sin embargo, en el año 2016 una observación clínica y posterior confirmación en un estudio multicéntrico/retrospectivo que lideramos desde las Unidades de Oncología Hepática y Hepatitis Virales del Hospital Clínic de Barcelona alertó a la comunidad científica sobre la posible asociación temporal (tiempo entre el inicio del tratamiento con AAD y el desarrollo de recurrencia de CHC), así como la presencia de una tasa de recurrencia mayor de la observada habitualmente en pacientes a los que se les documenta respuesta completa (RC)4-12. De forma simultánea, otra cohorte italiana de características similares describió resultados prácticamente idénticos13.
Han pasado más de 2 años desde dichas publicaciones e investigadores de todo el mundo se han hecho eco de las mismas y han evaluado el impacto de los tratamientos libres de interferón en cohortes de datos retrospectivas que se habían diseñado con otros objetivos o han puesto en marcha cohortes prospectivas con el objetivo de analizar el desarrollo de recurrencia de CHC.
Por lo cual, el objetivo de esta revisión es analizar críticamente los resultados disponibles y no simplemente trascribir las conclusiones de los manuscritos publicados. Por ello el lector podrá identificar que hay interpretaciones de los resultados originales que no coinciden exactamente con las conclusiones de los autores. Esto nos permite revisar la literatura desde una perspectiva clínica donde se valoran los riesgos/beneficios de erradicar el VHC en el contexto del paciente con carcinoma hepatocelular en RC.
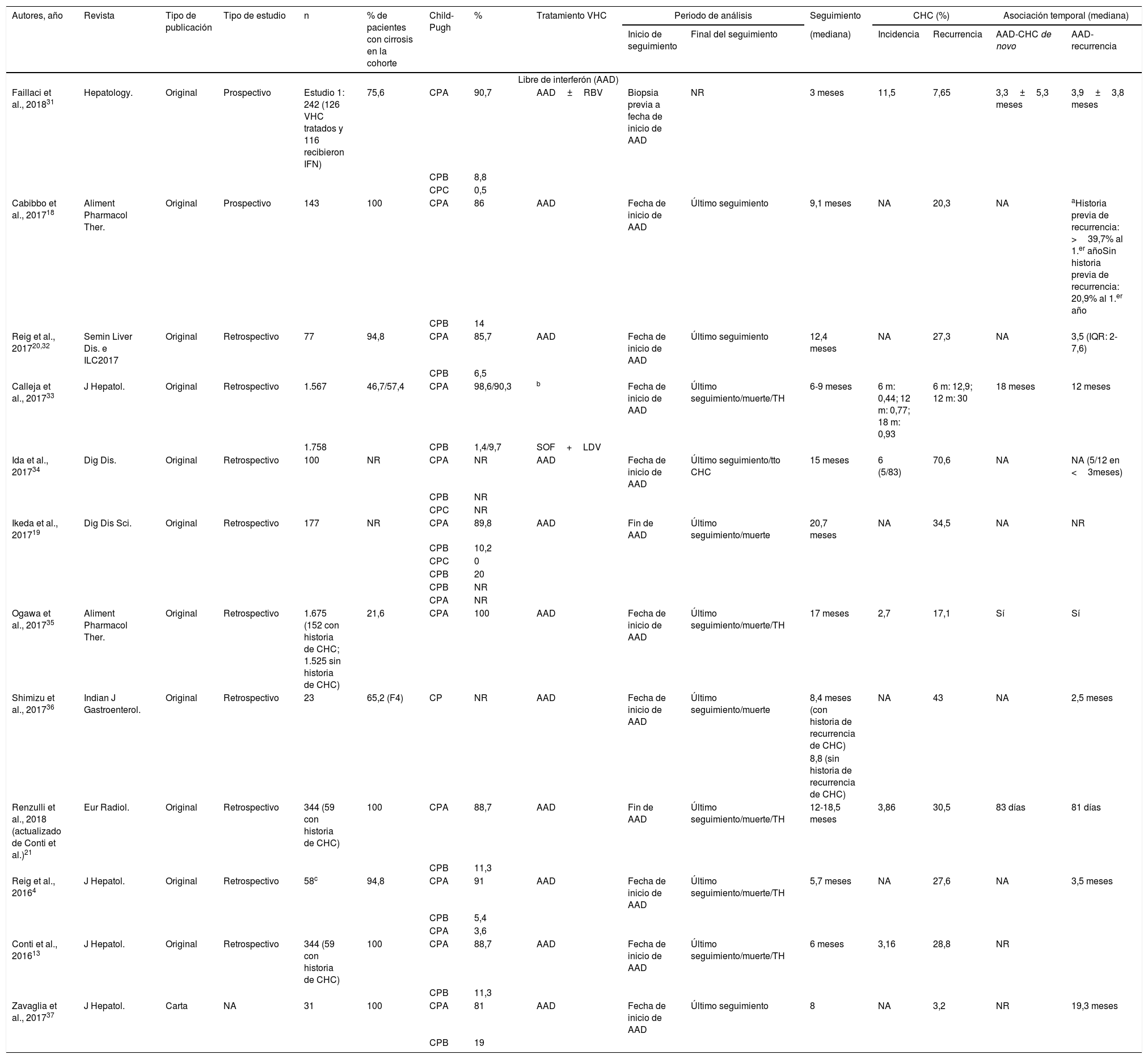
La tabla 1 describe las características de todas las publicaciones en relación con la recurrencia de CHC, la metodología utilizada y los resultados observados.
Publicaciones que evalúan la incidencia o recurrencia de carcinoma hepatocelular en pacientes tratados con esquemas que incluyen tratamientos libres de interferón (AAD) y aquellos que incluyen interferón
| Autores, año | Revista | Tipo de publicación | Tipo de estudio | n | % de pacientes con cirrosis en la cohorte | Child-Pugh | % | Tratamiento VHC | Periodo de análisis | Seguimiento | CHC (%) | Asociación temporal (mediana) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inicio de seguimiento | Final del seguimiento | (mediana) | Incidencia | Recurrencia | AAD-CHC de novo | AAD-recurrencia | |||||||||
| Libre de interferón (AAD) | |||||||||||||||
| Faillaci et al., 201831 | Hepatology. | Original | Prospectivo | Estudio 1: 242 (126 VHC tratados y 116 recibieron IFN) | 75,6 | CPA | 90,7 | AAD±RBV | Biopsia previa a fecha de inicio de AAD | NR | 3 meses | 11,5 | 7,65 | 3,3±5,3 meses | 3,9±3,8 meses |
| CPB | 8,8 | ||||||||||||||
| CPC | 0,5 | ||||||||||||||
| Cabibbo et al., 201718 | Aliment Pharmacol Ther. | Original | Prospectivo | 143 | 100 | CPA | 86 | AAD | Fecha de inicio de AAD | Último seguimiento | 9,1 meses | NA | 20,3 | NA | aHistoria previa de recurrencia: >39,7% al 1.er añoSin historia previa de recurrencia: 20,9% al 1.er año |
| CPB | 14 | ||||||||||||||
| Reig et al., 201720,32 | Semin Liver Dis. e ILC2017 | Original | Retrospectivo | 77 | 94,8 | CPA | 85,7 | AAD | Fecha de inicio de AAD | Último seguimiento | 12,4 meses | NA | 27,3 | NA | 3,5 (IQR: 2-7,6) |
| CPB | 6,5 | ||||||||||||||
| Calleja et al., 201733 | J Hepatol. | Original | Retrospectivo | 1.567 | 46,7/57,4 | CPA | 98,6/90,3 | b | Fecha de inicio de AAD | Último seguimiento/muerte/TH | 6-9 meses | 6 m: 0,44; 12 m: 0,77; 18 m: 0,93 | 6 m: 12,9; 12 m: 30 | 18 meses | 12 meses |
| 1.758 | CPB | 1,4/9,7 | SOF+LDV | ||||||||||||
| Ida et al., 201734 | Dig Dis. | Original | Retrospectivo | 100 | NR | CPA | NR | AAD | Fecha de inicio de AAD | Último seguimiento/tto CHC | 15 meses | 6 (5/83) | 70,6 | NA | NA (5/12 en <3meses) |
| CPB | NR | ||||||||||||||
| CPC | NR | ||||||||||||||
| Ikeda et al., 201719 | Dig Dis Sci. | Original | Retrospectivo | 177 | NR | CPA | 89,8 | AAD | Fin de AAD | Último seguimiento/muerte | 20,7 meses | NA | 34,5 | NA | NR |
| CPB | 10,2 | ||||||||||||||
| CPC | 0 | ||||||||||||||
| CPB | 20 | ||||||||||||||
| CPB | NR | ||||||||||||||
| CPA | NR | ||||||||||||||
| Ogawa et al., 201735 | Aliment Pharmacol Ther. | Original | Retrospectivo | 1.675 (152 con historia de CHC; 1.525 sin historia de CHC) | 21,6 | CPA | 100 | AAD | Fecha de inicio de AAD | Último seguimiento/muerte/TH | 17 meses | 2,7 | 17,1 | Sí | Sí |
| Shimizu et al., 201736 | Indian J Gastroenterol. | Original | Retrospectivo | 23 | 65,2 (F4) | CP | NR | AAD | Fecha de inicio de AAD | Último seguimiento/muerte | 8,4 meses (con historia de recurrencia de CHC) | NA | 43 | NA | 2,5 meses |
| 8,8 (sin historia de recurrencia de CHC) | |||||||||||||||
| Renzulli et al., 2018 (actualizado de Conti et al.)21 | Eur Radiol. | Original | Retrospectivo | 344 (59 con historia de CHC) | 100 | CPA | 88,7 | AAD | Fin de AAD | Último seguimiento/muerte/TH | 12-18,5 meses | 3,86 | 30,5 | 83 días | 81 días |
| CPB | 11,3 | ||||||||||||||
| Reig et al., 20164 | J Hepatol. | Original | Retrospectivo | 58c | 94,8 | CPA | 91 | AAD | Fecha de inicio de AAD | Último seguimiento/muerte/TH | 5,7 meses | NA | 27,6 | NA | 3,5 meses |
| CPB | 5,4 | ||||||||||||||
| CPA | 3,6 | ||||||||||||||
| Conti et al., 201613 | J Hepatol. | Original | Retrospectivo | 344 (59 con historia de CHC) | 100 | CPA | 88,7 | AAD | Fecha de inicio de AAD | Último seguimiento/muerte/TH | 6 meses | 3,16 | 28,8 | NR | |
| CPB | 11,3 | ||||||||||||||
| Zavaglia et al., 201737 | J Hepatol. | Carta | NA | 31 | 100 | CPA | 81 | AAD | Fecha de inicio de AAD | Último seguimiento | 8 | NA | 3,2 | NR | 19,3 meses |
| CPB | 19 | ||||||||||||||
| Tratamientos con interferón o libres de interferón (AAD) | |||||||||||||||
| Adhoute et al., 201828 | Eur J Gastroenterol Hepatol. | Original | Retrospectivo (Propensity score) | 22 | 100 | CPA | 82 | AAD | Fecha de inicio de AAD | Último seguimiento/muerte | 19 meses | NA | 41 | NA | 7 meses |
| 49 (controles) | CPB | 18 | Sin tratamiento VHC | 19 meses | 35 | ||||||||||
| Mashiba et al., 201838 | PloS One | Original | Retrospectivo (Propensity score) | 148 | NA (Fib score) | CPA | NA | IFN | Fecha de fin de AAD | Último seguimiento/muerte | 25,5 meses | NA | NR | NA | NR |
| 368 | CPB | NA | AAD | 7,7 meses | NR | ||||||||||
| Merchante et al., 201839 | AIDS. | Original | Retrospectivo/Prospectivo | 322 (VIH-VHC) | 100 | CPA | 53 | Fecha de inicio de tto | NR | 10 meses | NA | 25% en IFN; 8 con historia previa de CHC | NA | 22 meses | |
| CPB | 32 | IFN | 21% en AAD; 31 con historia previa de CHC | ||||||||||||
| CPC | 15 | AAD | |||||||||||||
| Bielen et al., 201740 | J Viral Hepat. | Original | Retrospectivo | 567 | IFN+AAD: 46,8 | CPA | 100 | IFN+AAD | Fecha de fin de tto | Último seguimiento/muerte | 6 meses | 1,7 | 0 | NR | 24 meses |
| AAD: 67,1 | AAD | 1,1 | 15 | ||||||||||||
| Virlogeux et al., 201741 | Liv Int. | Original | Retrospectivo | 68 (solo 34% tratados) | 100 | CP | NR | AAD (23) | Fecha de remisión del CHC | Último seguimiento | Tratados: 35,7 meses. No tratados: 15,4 meses | NA | 47,8 | NA | 13 meses |
| Sin tto VHC (45) | NA | 73,3 | |||||||||||||
| El Kassas et al., 201822 | J Viral Hepat. | Original | Prospectivo | 116 | 100 | CPA | 89,7 | AAD (53) | Fecha de respuesta radiológica completa | Último seguimiento/muerte | 16 | NA | 37,7 | NA | NR |
| CPB | 10,3 | NA | |||||||||||||
| CPC | 0 | 23 | NA | 25,4 | |||||||||||
| Nagata et al., 201742 | J Hepatol. | Original | Retrospectivo (Propensity score) | 1.897 | NR | CP | NR | IFN (1.145) | Fecha del tto curativo para CHC inicial | Recurrencia CHC/último seguimiento | 7,5 años | 2,5 | 53 | NA | NA |
| AAD (752) | 1,1 | 29 | |||||||||||||
| Warzyszyńska et al., 201743 | Clin Exp Hepatol. | Carta | NA | 51 | NR | CP | NR | AAD 19 | NR | NR | NR | NR | AAD 42 | NR | Días posresección: 265 en AAD |
| No AAD 32 (control) | No AAD 65 | 532 en no AAD | |||||||||||||
| Zanetto et al., 201744 | Liver Transpl. | Original | Retrospectivo (caso-control) | 46 | 100 | CPA | 60,9 | AAD 23 | Fecha de inicio de tto | Último seguimiento/muerte | 10 meses | NR | AAD 12,5 | NR | NR |
| CPB | 23,9 | NO AAD 23 (control) | 7 meses | NO AAD 8,3 | |||||||||||
| CPC | 15,2 | ||||||||||||||
| Tsai et al., 201745 | J Hepatol. | Carta | NA | 105 | NR | NR | NR | pegIFN+RBV | NR | NR | 6 meses postratamiento | NA | 22,9 | NR | NR |
| ANRS cohorts, 201624 | J Hepatol. | Original | Prospectivo/Retrospectivod | HEPATHER (n=267): AAD=189d | 77,5 | CPC | NA | AAD+/AAD− | NR | Último seguimiento | AAD+: 20,2 meses; AAD−: 26,1 meses | NA | HR 1,21 (IC 95% [0,62-2,34], p=0,5782) | NA | NR |
| CIRVIR (n=79): AAD=13 | 100 | AAD+/AAD− | Tto de CHC | Último seguimiento | 21,3 meses | HR 0,41 (IC 95% [0,05-3,08], p=0,386) | NR | ||||||||
| CUPILT (n=314) AAD=314d | 15,6 | AAD+/AAD− | TH | Último seguimiento | NR | 2,2e | 7±3 meses | ||||||||
| Petta et al., 201746 | Aliment Pharmacol Ther. | Análisis post-hoc de información de otras publicaciones | Retrospectivo | 58 | 100 | CPA | 91 | AAD | Tto de CHC | Último seguimiento | 18 meses | NA | 27,6 | NA | NR |
| CPB | 5 | ||||||||||||||
| CPC | 4 | ||||||||||||||
| 57 | 100 | CPA | 90 | IFN | 34 meses | 38,6 | NR | ||||||||
| CPB | 10 | ||||||||||||||
| CPC | (−) | ||||||||||||||
| Torres et al., 201615 | J Hepatol. | Carta | NA | 8 | 87,5 | CPA | 42,9 | AAD | Uso de AAD | NR | 12 meses | NA | 0 | NA | |
| Yang et al., 201647 | J Hepatol. | Carta | NA | 63 (no AAD) | NR | NR | NR | No AAD | TH | NR | NR | NR | 9,6 | NA | NR |
| 18 (AAD) | AAD | NT | 4/5 pacientes en los primeros 6 meses post-TH | 27,8 | |||||||||||
| 578 (IFN) | IFN | 0,28-0,035f | |||||||||||||
| Minami et al., 201648 | J Hepatol. | Carta | NA | 27 | 100 | CPA | 100 | AAD | NR | Último seguimiento | 1,3 años | NA | 29,6 | NA | 5,8 meses |
| 38 | 100 | CPA | 100 | IFN | NR | 68,4 | 5,4 meses | ||||||||
| 861 | 100 | CPA | 74 | Sin tratamiento VHC | 64,2 | NR | |||||||||
AAD: agentes antivirales directos; CHC: carcinoma hepatocelular; CPA: Child-Pugh A score; CPB: Child-Pugh B score; CPC: Child-Pugh C score; IFN: interferón; NA: no aplicable; NR: no reportado; RBV: ribavirina; TH: trasplante hepático; Tto: tratamiento; VHC: virus hepatitis C.
Cohorte actualizada en el ILCA 2016 (77 pacientes; mediana de seguimiento: 8,2 meses; 27,3% de recurrencia de CHC; 14,3% evolucionaron a CHC terminal; 47,6% quimioembolización transarterial, radioembolización o regorafenib después de la recurrencia; 38,1% candidatos a resección, tratamiento percutáneo o trasplante hepático después de la recurrencia.
El desarrollo de CHC no era un objetivo de estudio primario. Los datos proceden de análisis retrospectivo.
Se observó recurrencia de CHC en 7 pacientes (2,2%) (edad media: 58,0±8,4 años) dentro de una media de tiempo después de TH de 70±64 meses, 7±3 meses, 21±14 semanas tras la introducción de AAD y después de obtener respuesta viral, respectivamente. Cinco de los 7 pacientes (71%) murieron 58±47 meses después del TH.
Tras la publicación de los dos trabajos originales4,13, se publicaron cartas al editor con resultados similares a los mismos y otras con resultados opuestos que sugerían que comenzar el tratamiento antiviral durante los primeros 6 meses de documentarse la RC era la causa de una mayor tasa de recurrencia o que la inclusión de pacientes tratados con quimioembolización (QE) podría haber condicionado dicha asociación (por considerar la QE como un tratamiento sin intención curativa)14,15. En este sentido, Cammà et al.14 realizaron un análisis post-hoc de los resultados de nuestro estudio4 concluyendo que la indicación precoz del AAD (durante los primeros 6 meses de documentarse la RC) se asociaba al aumento de recurrencia del CHC. Sobre la base de dicho análisis, la recomendación de los autores fue la de iniciar el tratamiento antiviral más allá de los primeros 6 meses de documentarse la RC con el fin de así evitar un falso aumento de la recurrencia del CHC al descartar todos aquellos pacientes con fallo al tratamiento oncológico.
Tomando como base racional la interpretación de Cammà et al., otros autores concluyen sus trabajos con la misma recomendación16,17. Sin embargo, en un trabajo prospectivo del mismo grupo italiano18 en el cual incluyeron pacientes similares a Reig et al.4, ya que incluyeron 143 pacientes con RC y sin evidencia de nódulos no caracterizados (86% Child-Pugh A, 100% BCLC 0/A), observaron que los factores predictivos de recurrencia del CHC eran la historia previa de recurrencia de CHC y el tamaño del CHC18. No obstante, no identificaron que el tiempo trascurrido entre la RC y el inicio de AAD fuera un factor predictivo de recurrencia. Este hallazgo sugiere que la recomendación inicial de iniciar tratamiento con AAD mas allá de los 6 meses de documentarse la RC para evitar o disminuir el riesgo de recurrencia fue solo una sobreinterpretación de los datos de Reig et al.4. De hecho, la recurrencia dentro del primer año de iniciar el tratamiento con AAD en pacientes BCLC 0/A fue del 40% en pacientes sin historia de recurrencia de CHC previa y de más de un 60% en aquellos que presentaban historia de recurrencia previa. Por ello, el hecho de que no observaran que la recurrencia se relacione con el momento en que se inicia el tratamiento antiviral y que las tasas de recurrencias descritas en su trabajo son similares a las descritas originalmente por nuestro trabajo valida los datos reportados en los trabajos originales4,13. El impacto de la historia previa de recurrencia (un factor que está directamente relacionado con el riesgo de recurrencia y que ha sido ampliamente estudiado) fue también analizado por Ikeda et al.19 y, al igual que Cabibbo18, observaron que los pacientes con antecedente de recurrencia CHC al momento de iniciar AAD presentaron mayores tasas de recurrencia. Sin embargo, los mismos autores19 realizaron un estudio caso-control en el que compararon pacientes tratados con AAD posteriormente de recibir su primer tratamiento para el CHC versus aquellos pacientes que no recibieron tratamiento antiviral (no AAD), pero no se tuvo en cuenta el número de tratamientos previos para CHC. Este factor que se ha omitido en la selección de pacientes es un factor predictor de recurrencia de CHC y por lo tanto introduce un sesgo de selección. Los autores comparan pacientes que parten de un perfil de riesgo diferente y por ende invalida cualquier tipo de interpretación. Es por ello que, pese a presentarse el trabajo como un estudio caso-control ajustado por edad y BCLC, la conclusión en relación con una menor tasa de recurrencia en pacientes tratados con AAD en comparación con los pacientes no tratados no es válida.
Adicionalmente, otros trabajos reportaron recurrencias de CHC que varían de un 23,6% a más de un 60%18-22 y que validan los datos iniciales reportados por nuestro trabajo multicéntrico y el grupo italiano de Bologna4,13.
Publicaciones con resultados opuestos a las publicaciones originales e interpretación de los mismosSin embargo, cohortes con un número de pacientes mayor y prospectivas en las cuales el desarrollo de CHC no formaba parte de los objetivos primarios, también evaluaron el desarrollo de recurrencia de CHC23,24 y llegan a conclusiones diferentes, ya que no observan un cambio en la tasa de recurrencia. ¿Cómo puede explicarse dicha discrepancia? ¿Es el tamaño de la muestra el factor que determina la presencia de resultados discordantes? En líneas generales puede considerarse que disponer de cohortes de pacientes amplias se asociaría a resultados más confiables. No obstante, el disponer de una muestra amplia pero que no estudia el evento de interés agrega un nuevo sesgo a esta controversia y dicho sesgo no puede ser minimizado con herramientas estadísticas. En este sentido, parte de la comunidad médica considera que los trabajos que disponen de un gran tamaño muestral disponen de datos robustos y con ello refutan la hipótesis planteada en 2016 sobre un cambio en la tasa de recurrencia. Sin embargo, para estudiar el impacto de cualquier factor en el desarrollo de CHC es necesario disponer de estudios que consideren el desarrollo de CHC como objetivo primario ya que es un evento que solo se identifica por medio de pruebas de imagen. La ausencia de imágenes preestablecidas y regladas imposibilita la observación del evento. En este sentido, la mayoría de las cohortes que estudian la evolución de pacientes con VHC realizan determinaciones sanguíneas al inicio del tratamiento, en los puntos de interés del tratamiento antiviral, al final del tratamiento y al momento de definir la obtención de la RVS. Sin embargo, los seguimientos suelen restringirse hasta la valoración de RVS, y el cribado de CHC por medio de ecografía no forma parte de los estudios. Todo ello podría explicar por qué, pese a observar asociación temporal y CHC en estadios más avanzados, no observen un cambio en la tasa de recurrencia. Por todo ello, el tamaño muestral no es condición sine qua non para considerar mayor robustez al momento de analizar/comparar los resultados con un estudio de menor tamaño muestral pero diseñado con el fin de estudiar el desarrollo del CHC. Esta interpretación es aplicable tanto a trabajos que analizan incidencia como recurrencia de CHC.
Otro autores optaron por realizar un metaanálisis25 para analizar el impacto de AAD en el contexto de la recurrencia de CHC, pero la elevada heterogeneidad (I; 89%) observada en dicho estudio invalida las conclusiones realizadas por los autores. La heterogeneidad descrita está condicionada por las características de los estudios incluidos (diferentes poblaciones, seguimientos y puntos de análisis, así como nivel de evidencia de la información seleccionada) y que no se puede minimizar a pesar de utilizar herramientas estadísticas con este fin (metarregresión). Es por ello, que dadas las limitaciones de los trabajos analizados y la imposibilidad de realizar trabajos prospectivos y aleatorizados continúa el debate en relación con el impacto de los AAD en términos de la tasa de recurrencia. Sin embargo, lo que sí ha quedado demostrado es que la erradicación del VHC con esquemas libres de interferón no elimina el riesgo de recidiva de CHC. Desde un punto de vista práctico y en el contexto de pacientes con cirrosis hepática compensada en los cuales el objetivo es, no solo erradicar el VHC con fines epidemiológicos, sino también evitar el riesgo de descompensación (incluyendo la recurrencia del CHC), su indicación es controvertida. El motivo de la controversia está definido por el riesgo/beneficio que presenta cada paciente antes de iniciar el tratamiento antiviral. Este riesgo no está establecido y dependerá de si logra o no la RVS, ya que se ha demostrado que los pacientes que no logran RVS tienen mayor riesgo de desarrollar CHC. Por otro lado, el beneficio de lograr erradicar el VHC (95%) se asocia a menor número de complicaciones de la hepatopatía, pero el riesgo de evitar el desarrollo de CHC no está establecido. Desafortunadamente se desconoce el beneficio del tratamiento antes de iniciarlo, ya que en los pacientes con historia de CHC este es variable y depende de características basales tales como el grado de hipertensión portal y su evolución postinicio de AAD, la presencia o no de RC y el estadio del CHC. En relación con este tema, si tomamos como base los datos de Cabibbo et al.26, el riesgo de recurrencia esperado de CHC tras documentar RC se incrementa con el tiempo partiendo de un 21% al año hasta un 64% a los 5 años (41,5 y 61% a los 2, 3 y 4 años, respectivamente). Lo mismo sucede con el riesgo de descompensación, que se incrementa desde solo un 10% al año hasta un 44% a los 5 años en pacientes con VHC compensados que no recibieron tratamiento para VHC (21,3 y 36% a los 2, 3 y 4 años, respectivamente), que presentaban un CHC en estadio temprano y que lograron la RC. Por lo cual, de acuerdo con dicho trabajo (que refleja la historia natural de pacientes con VHC no tratados), el riesgo de descompensación siempre es menor que el riesgo de recurrencia. Si a estos datos, sumamos la controversia con relación a la tasa de recurrencia del CHC, la decisión de tratar a estos pacientes debe ser individualizada. Es por ello que en el Hospital Clínic de Barcelona, los pacientes con antecedente de CHC son informados del riesgo de recurrencia, riesgo de descompensación y, a la espera de resultados que invaliden la alarma inicial publicada en el año 2016, no se aconseja el tratamiento con esquemas libres de interferón. En este sentido, el trabajo reciente de Huang et al.27 sugiere que los pacientes tratados con AAD no tienen mayor riesgo de recurrencia que los no tratados. Sin embargo, dicha afirmación carece de robustez por los siguientes motivos: a) el riesgo de recurrencia era mayor en pacientes no AAD [los pacientes no AAD eran mayoritariamente pacientes sin RC al momento del análisis (67,8% vs. 98,4% en el grupo AAD; p<0,001) y pacientes con mayor grado de descompensación sin opción a tratamiento en lista de espera en comparación con los pacientes que recibieron AAD (50,5% Child-Pugh B/C en el grupo no AAD vs. 33,8% en grupo AAD; p=0,006)]; b) el resultado del propensity score (n=59 vs. n=61 pacientes) no permite concluir que los pacientes AAD tienen el mismo riesgo que los no AAD porque los intervalos de confianza incluyen el 1 [univariado (HR, 1,02; IC 95%, 0,65-1,60; p=0,93) y el multivariado (HR, 0,91; IC 95%, 0,58-1,42; p=0,67).]. La interpretación adecuada de estos resultados es que no se puede excluir que tengan resultados similares porque según el resultado multivariado el riesgo de recurrencia en el grupo AAD puede ser hasta 1,42 veces mayor que en el grupo no AAD.
Asociación temporal entre el inicio del tratamiento antiviral con esquemas libres de interferón y el desarrollo de recurrencia del carcinoma hepatocelularPara poder valorar adecuadamente el impacto de la tasa de recurrencia y llegar a una conclusión inequívoca se necesitarían trabajos aleatorizados. Sin embargo, para el estudio de la asociación temporal este tipo de estudios no es indispensable. La asociación temporal es un «patrón de temporalidad entre un determinado factor y un evento de interés» y como en cualquier otro patrón, la repetición del mismo lo valida.
Sorprendentemente, los títulos y conclusiones de la mayoría de las publicaciones sugieren que no se observa una asociación temporal entre el inicio de AAD y el desarrollo de recurrencia de CHC y/o que el tratamiento con AAD disminuye o no modifica la recurrencia del CHC. Sin embargo, el análisis detallado de dichas publicaciones refleja una clara asociación temporal en la mayoría de los estudios, tal y como se puede observar en la tabla 1 de esta revisión y gráficamente en la figura 4 de Adhoute et al.28. En este sentido, Colombo y Boccaccio16, en una carta de opinión de experto llamada «News & Views», concluyen que el tiempo entre la RC y el desarrollo de la recurrencia del CHC es más corto en los pacientes tratados con AAD que en pacientes no tratados o tratados con esquemas que incluyen interferón. Pese a que la forma de expresar la asociación temporal es diferente, ¿cómo podría explicarse un acortamiento entre la RC y el desarrollo de recurrencia de CHC sin asociación temporal?
Forma de presentación y velocidad de progresión de la recurrencia del carcinoma hepatocelular en el contexto del tratamiento libre de interferónLa forma de presentación y velocidad de progresión de la recurrencia del CHC se simplifica en el término de «agresividad tumoral». La agresividad del CHC en el contexto del tratamiento con AAD es otro tema de controversia en la comunidad médica actual. La agresividad tumoral puede evidenciarse por la clínica que presenta el paciente, el impacto que tiene el CHC sobre la función hepática y/o la carga tumoral al momento del diagnóstico del CHC. La clasificación BCLC29 contempla los factores pronósticos y clasifica a los pacientes en estadios que varían desde BCLC 0 (CHC único ≤2cm), que es el estadio más temprano, a pacientes en estadio terminal (BCLC-D) en el cual, independientemente de la carga tumoral, los pacientes desarrollan síntomas relacionados con el tumor (ECOG-PS ≥2) y/o descompensación hepática (Child-Pugh B-C) sin opción de trasplante hepático. Sin embargo, no solo la presentación del CHC, sino también la evolución de los pacientes, como se mencionó previamente, es lo que marca el grado de agresividad. En este sentido, la actualización de nuestra cohorte original20 en la cual se incluyeron un mayor número de pacientes y un mayor tiempo de seguimiento (n=77, mediana de seguimiento: 12,4 meses) pone en evidencia que tanto el patrón de aparición como la evolución de las recurrencias es agresiva. En dicho análisis, el 32,4% de los pacientes desarrollaron recurrencia del CHC a pesar de ser pacientes que presentaban RC sin evidencia de nódulos no caracterizados al momento de iniciar AAD, y el 6,5% falleció por progresión del CHC dentro del primer año de iniciar el tratamiento con AAD. Adicionalmente, en el 28,6% de los pacientes la forma de presentación de la recurrencia del CHC fue en estadio BCLC B/C y en el 14,3% en estadio BCLC-D. Sin embargo, el 33% de los pacientes a los que se les pudo ofrecer un tratamiento específico (resección, tratamiento percutáneo, tratamientos locorregionales o sistémicos; n=19) desarrolló recurrencia del CHC o progresó dentro de los primeros 6 meses de tratamiento con AAD (solo un paciente tuvo opción de recibir trasplante hepático como tratamiento de la recurrencia del CHC).
Estos resultados desalentadores (a pesar de realizar una selección pormenorizada de los pacientes para minimizar una sobrevaloración de la recurrencia y considerando solo aquellos pacientes con RC pero sin presencia de nódulos no caracterizados) llevaron a parte de la comunidad médica a considerar que los resultados publicados estarían condicionados por haber incluido pacientes tratados con QE. Sin embargo, ninguno de los pacientes tratados con QE en nuestra cohorte desarrolló recurrencia o progresión del CHC durante el seguimiento20. Pero dado que se podría considerar un sesgo de selección la inclusión de pacientes tratados con QE y atendiendo a las críticas recibidas en este sentido en la actualización de nuestra cohorte, realizamos el mismo análisis que en la cohorte original excluyendo los pacientes tratados con QE y solo considerando aquellos pacientes en estadio BCLC 0-A que iniciaron el tratamiento con AAD dentro de los 4 meses de haberse documentado la RC (n=20). En dicho análisis observamos que 9 pacientes desarrollaron recurrencia del CHC (45%) y 4 fallecieron por progresión del CHC dentro de los primeros 16 meses de recibir el tratamiento con AAD (a los 9, 10, 15 y 16 meses postinicio del tratamiento con AAD). Posteriormente, este patrón de agresividad fue descrito por otros autores18,19,21,22,30; a pesar de que no lo mencionen como asociación temporal describen un tiempo de seguimiento corto y mencionan el evento, por ende la recurrencia se presentó en dicho periodo de tiempo. Otro punto a tener en cuenta es la presencia de mayor invasión microvascular descrito por Renzulli et al.21.
Es por ello que a pesar de no poder hacer una comparación directa entre las cohortes que estudian este fenómeno, el trabajo de Cabibbo et al.26 describe que el 21% de los pacientes con VHC y CHC en estadios iniciales, que logran RC después de recibir tratamientos con intención curativa y que no recibieron tratamiento para el VHC, desarrollaron recurrencia del CHC dentro del primer año de documentarse la RC. Este porcentaje de pacientes (21%) es francamente menor que el descrito en nuestra cohorte (32,4%) o en otras cohortes estudiadas posteriormente en las cuales las tasas de recurrencia varían desde un 23% a más de un 60% en función de la historia previa de recurrencia19,22,26.
Otro factor indirecto de agresividad es la supervivencia global de los pacientes, y según la cohorte de pacientes no tratada para el VHC publicada por Cabibbo et al.26, el 3% de los pacientes fallecieron dentro del primer año de documentarse la RC del CHC, cifra de nuevo marcadamente inferior a la observada en nuestra cohorte (6,5%)4 o en la cohorte de pacientes tratados con AAD por el grupo de Cabibbo et al. (4,2%)18. Cabe resaltar que las características basales de las 2 cohortes publicadas por Cabibbo et al.18,26 son similares pero no idénticas. En la cohorte de pacientes tratados con AAD se excluyeron todos aquellos pacientes con nódulos no caracterizados18. Sin embargo, en la cohorte de pacientes no tratados para el VHC dichos pacientes no fueron excluidos y de este modo es esperable que estos pacientes tengan un porcentaje de recurrencia superior y supervivencia inferior que los pacientes sin nódulos no caracterizados26. Por lo tanto, las diferencias podrían ser aún más amplias que las que se observan en una simple comparación directa entre ambas cohortes.
Actualmente aún hay autores que consideran que el patrón de agresividad no debe considerarse una particularidad de los pacientes que reciben AAD. Sin embargo, la mayoría de ellos no descartan dicha hipótesis y sugieren que se debe estudiar16.
ConclusionesPor lo cual, podemos concluir que, a 2 años de la alarma inicial, el debate sobre la asociación temporal (inicio del tratamiento antiviral libre de interferón y el desarrollo de recurrencia de CHC) y la tasa de recurrencia inesperada continúa abierto. El escepticismo inicial ha evolucionado a: a) la aceptación de que el riesgo de recurrencia del CHC no se elimina a pesar de erradicar el VHC con AAD; b) que se observa un acortamiento en el tiempo entre la RC y el desarrollo de CHC en los pacientes tratados con AAD; c) la no negación de que el patrón de agresividad es un factor clave en la evolución de estos pacientes.
Por todo ello, el desafío para los próximos años será responder a la pregunta: ¿cómo podemos explicar un acortamiento en el tiempo entre la RC y el desarrollo de CHC en los pacientes tratados con AAD sin aceptar la presencia de asociación temporal, un cambio en la tasa de recurrencia y la presencia de un CHC más agresivo?
El avance del tratamiento del VHC ha determinado un impacto inequívoco en la erradicación del VHC, pero a su vez, ha dado lugar a una nueva área de investigación que nos desafía a estudiar y comprender mecanismos relacionados con la hepatocarcinogénesis que aún desconocemos. Sin embargo, dado que el seguimiento de los pacientes tratados con AAD es aún muy corto no se puede conocer cuál será el impacto a largo plazo. Por todo ello, actualmente no disponemos de datos que nos permitan valorar el riesgo/beneficio del impacto de AAD en relación con la recurrencia a largo plazo porque esto dependerá de si logra o no la RVS.
FinanciaciónEl presente trabajo ha sido financiado por el Instituto de Salud Carlos III, España (beca número CM15/00050 y PI15/00145).
Conflicto de interesesTania Hernáez Alsina: honorarios de viaje de Bayer.
Berta Caballol-Oliva: honorarios de viaje de Bayer.
Álvaro Díaz-González: speaker y honorarios de viaje de Bayer. Becas de viaje de BTG.
Cassia Regina Guedes-Leal: honorarios de viaje de Bayer.
María Reig: asesoría para Bayer, BMS, Roche, Ipsen, AstraZeneca y Lilly. Honorarios conferencia de Bayer, BMS, Gilead y Lilly. Becas de investigación de Bayer e Ipsen.