El sarcoma hepático es un tumor primario hepático poco frecuente, que por su aspecto abigarrado en las pruebas de imagen puede confundirse con un absceso o con un quiste hidatídico complicado. La singularidad del caso que presentamos estriba en que se trata de un sarcoma primario sobre una cirrosis hepática, con un carcinoma hepatocelular (CHC) 6 años antes, del cual estaba en respuesta completa tras recibir tratamiento locorregional. Describimos las características clínicas, radiológicas y anatomopatológicas de esta entidad y hacemos una breve revisión de los casos similares descritos en la literatura médica.
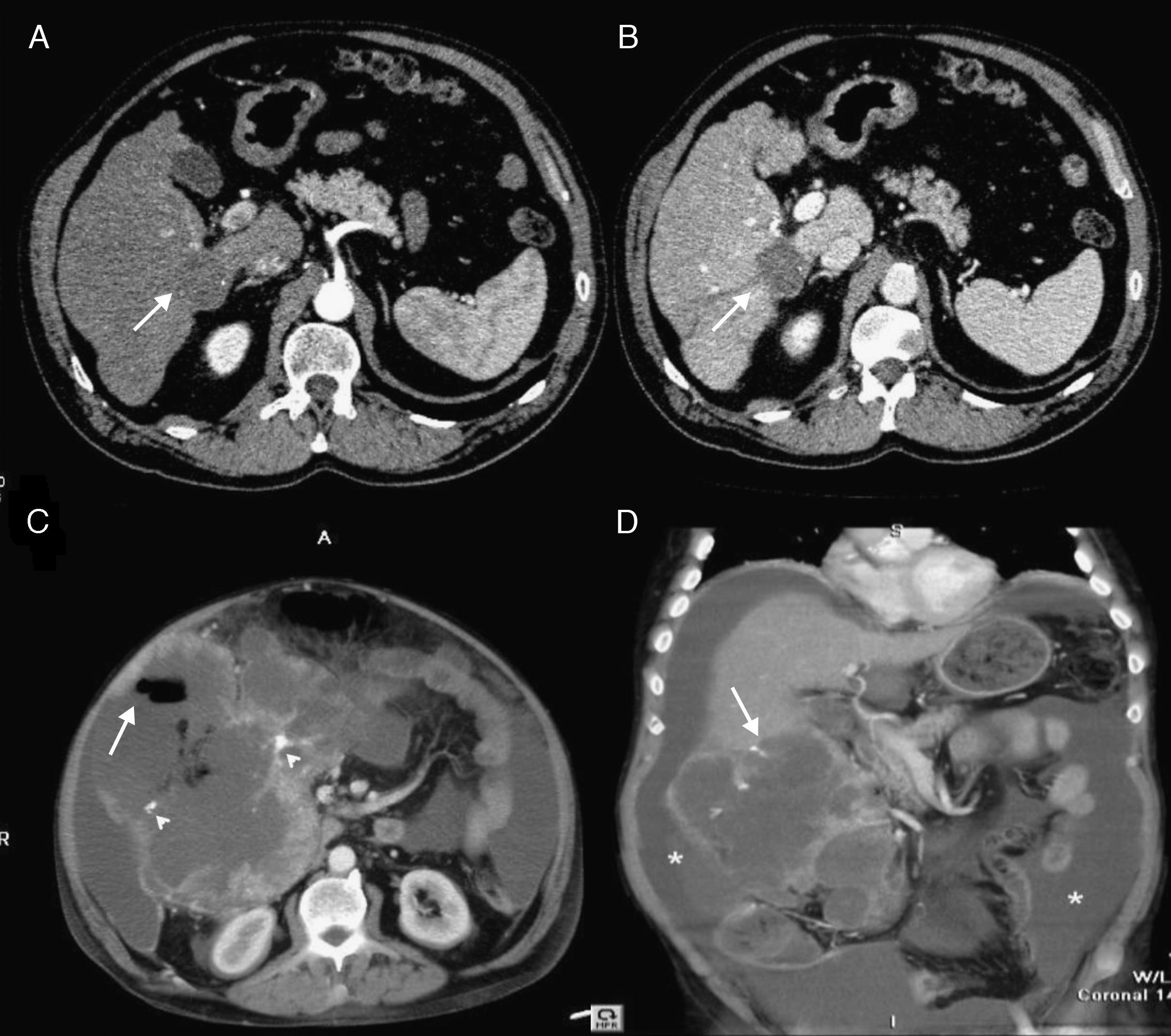
Se trata de un varón de 70 años, con cirrosis hepática por alcohol diagnosticada en 2004, Child-Pugh clase A y con un CHC tratado con inyección percutánea de alcohol (agosto de 2004) y con quimioembolización transarterial hepática (TACE) en septiembre de 2004 y julio de 2005, en respuesta completa desde entonces (fig. 1A y B). La TC multifásica hepática de octubre de 2009 mostraba 3 nódulos hipodensos de 40, 35 y 15mm de diámetro máximo en los segmentos V-VI.
Tomografía computarizada multidetectora (TCMD) dinámica hepática en la que se identifica el carcinoma hepatocelular (CHC) tratado (flechas) sin realce en fase arterial (A) ni portal (B), sin signos de recidiva. C) La TCMD hepática muestra una gran masa localizada en el lóbulo hepático derecho que engloba los focos de CHC tratados así como los restos de lipiodol (cabeza de flecha) con presencia de aire que sugiere abscesificación (flecha). D) En la TCMD coronal se identifica la gran masa en lóbulo hepático derecho (flecha) con extensión intraabdominal englobando estructuras vecinas, sin conseguir individualizar el ángulo hepático del colon. Abundante líquido ascítico (asterisco).
En marzo de 2010 ingresa para estudio de una masa abdominal palpable en hipocondrio derecho, de crecimiento progresivo desde hacía 2 meses, sin dolor, síndrome general ni otra sintomatología acompañante. Se realiza una TC de control, que muestra gran masa quística (de aproximadamente 20cm), con imagen «en panal de abejas», localizada en epigastrio y subhepática (fig. 1C). Se realizó una punción aspirativa con aguja fina (PAAF) guiada por ecografía, extrayendo un líquido seroso con células mesoteliales reactivas.
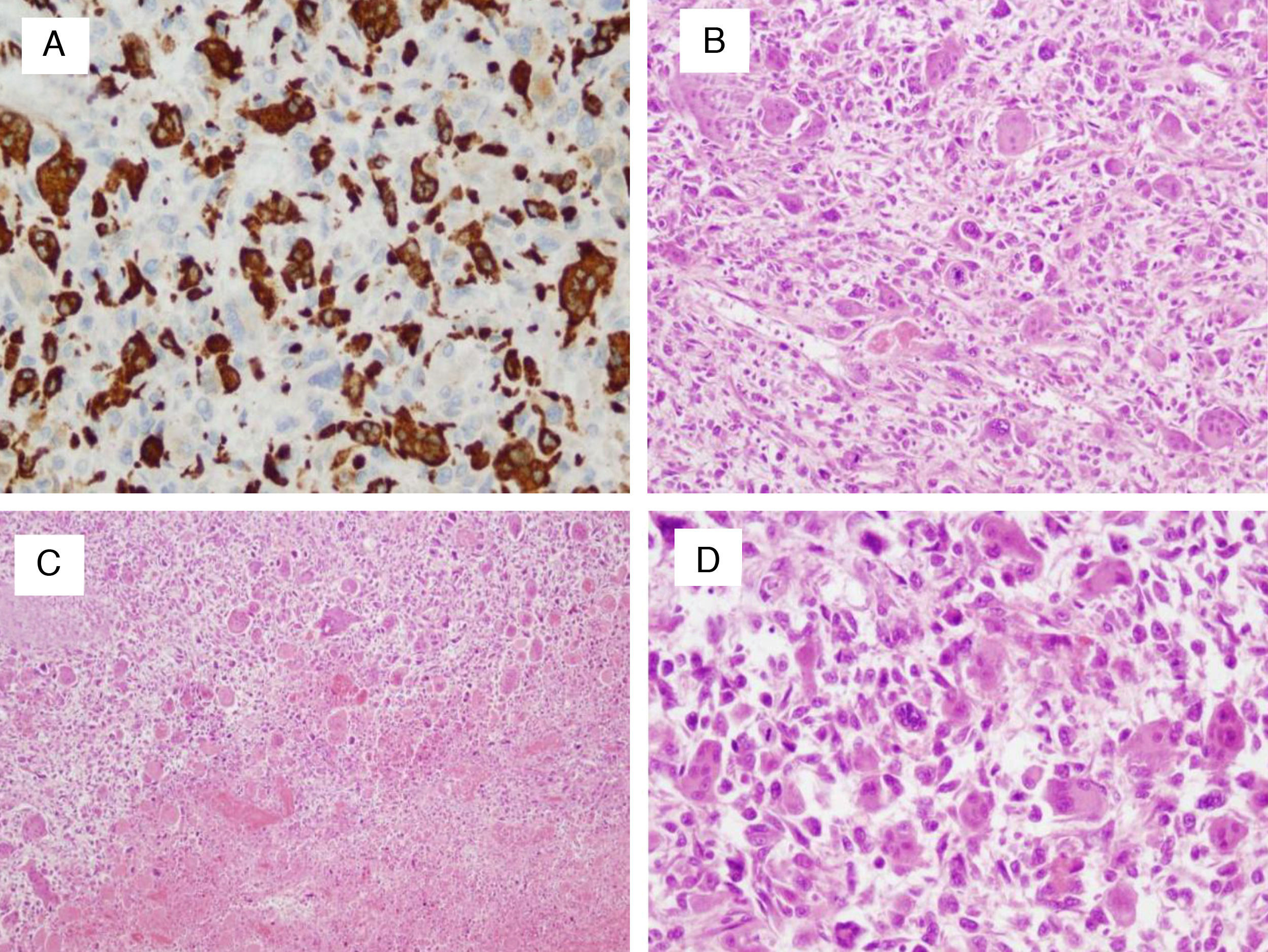
Al quinto día presentó fiebre de 39°C y dolor intenso con signos de irritación peritoneal en el hipocondrio derecho. En ese momento comenzó un deterioro general rápidamente progresivo con hipotensión, desorientación, disminución del nivel de conciencia, oliguria y desarrollo de ascitis, cuyo análisis demostró una peritonitis bacteriana secundaria (leucocitos 3.050 [91% neutrófilos]), glucosa 3mg/dl, y LDH 2.206 U/l) con aislamiento de Escherichia coli y Bacteroides. Se instauró tratamiento antibiótico de amplio espectro y se confirmó la sospecha de perforación colónica mediante TC abdominal urgente (fig. 1D). Ante la mala evolución clínica y los hallazgos de la TC se decidió intervención quirúrgica urgente. Se observó ascitis purulenta y una tumoración de aspecto necrótico que parecía depender del tejido hepático. Se procedió a resección de la masa y se realizó una hemicolectomía derecha, con anastomosis terminoterminal. Pudo ser trasladado a planta, pero el décimo día postoperatorio desarrolló una fuga de alto débito de material fecaloideo y murió el 14 día postoperatorio. El estudio histológico reveló una lesión constituida por una proliferación de células fusiformes u ovoides, de aspecto pleomórfico, con cromatina tosca y elevada actividad mitótica, entre las cuales destacaban células multinucleadas gigantes de tipo osteoclásticas. Se apreciaban extensas áreas de necrosis y hemorragia. Las células tumorales fueron positivas para actina, músculo liso y CD68, siendo el resto de los marcadores negativos (desmina, S-100, CD34, CD117 y Hepatocite); el Ki-67 mostró un índice proliferativo del 40%. El dictamen anatomopatológico final de la pieza fue sarcoma pleomórfico indiferenciado con células gigantes (fig. 2).
A) Inmunohistoquímica positiva para CD68 (×20): positividad en el componente gigantocelular. B) Hematoxilina-eosina (×10): lesión muy celular con patrón fascicular anárquico. C) Hematoxilina-eosina (×4): amplios focos de necrosis y hemorragia. D) Hematoxilina-eosina (×20): células fusiformes atípicas, células epitelioides y numerosas células gigantes de tipo osteoclásticas. Frecuentes figuras mitóticas.
El sarcoma pleomórfico indiferenciado es un tumor que asienta de forma muy poco frecuente en el hígado. El primer caso fue descrito en 1985 por Alberti-Flor et al.1 y hasta la actualidad han sido descritos 45 casos en la literatura médica inglesa. El país con mayor número de casos registrados es China, con un total de 762. Aún más infrecuente es la coexistencia en un mismo paciente de sarcoma y CHC. Hay 3 casos descritos en Japón con aparición simultánea de CHC y sarcoma primario hepático, pero son informes de autopsias que no revelan la inmunohistoquímica. El cuarto, bien documentado, corresponde a un paciente de Corea del Sur con aparición simultánea de un CHC y un sarcoma primario hepático sobre un hígado con cirrosis3. De acuerdo con la Organización Mundial de la Salud, los términos «histiocitoma fibroso maligno», «histiocitoma fibroso maligno pleomórfico» y «sarcoma pleomórfico indiferenciado de alto grado» son sinónimos. Dicha clasificación recomienda agruparlos en 2 subtipos: «inflamatorio» y «con células gigantes»4. En nuestro caso se trata de este último, ante el predominio de células gigantes osteoclásticas. Suele presentarse con dolor abdominal difuso, pérdida de peso, anorexia, fiebre, ictericia y masa abdominal palpable. En cuanto al diagnóstico, debe realizarse por exclusión, descartándose en primer lugar lesiones primarias en cualquier parte del organismo que sugieran origen metastásico. La inmunohistoquímica es esencial para descartar otras neoplasias. Normalmente el tumor que nos ocupa presenta un fenotipo inmunohistoquímico que incluye la expresión de CD68, α1-antitripsina y α1-antiquimiotripsina5. La ausencia de reactividad para panCK, CK8 y CK18 descarta CHC anaplásico sarcomatoso y colangiocarcinoma; el SMA negativo descarta leiomoisarcoma; CD31, CD34 y antígeno relacionado con el factor VIII excluyen hemangiopericitomas y angiosarcomas. Otros tumores de características histológicas similares se pueden excluir gracias a la inmunohistoquímica: liposarcoma (S-100), rabdomiosarcoma (desmina), melanoma metastásico (S-100 y HMB-45) y linfoma (LCA)5. Nuestro caso presentaba CD68 y actina músculo liso positivos, así como desmina, S-100, CD117, CD34 y hepatocito negativos6. La forma de presentación más frecuente es como masa sólida, aunque dado el elevado grado de necrosis y hemorragia, en ocasiones puede verse como una gran cavidad quística, o multiquística, como es nuestro caso, por lo que en el diagnóstico diferencial deben incluirse los quistes hepáticos benignos, colangiocarcinoma intrahepático, abscesos hepáticos o infección por Equinococcus6.
Por supuesto, en el diagnóstico diferencial de cualquier tumor hepático en un paciente con cirrosis debe estar el CHC. Se da la peculiaridad que nuestro caso es el cuarto en coexistencia con CHC. No se ha publicado ninguna evidencia histológica de cirrosis o hepatitis viral crónica asociada con la aparición de histiocitoma fibroso maligno7. Es importante establecer el diagnóstico diferencial con el CHC con diferenciación sarcomatosa. Respecto al tratamiento, la opción quirúrgica es el único método efectivo aunque el pronóstico es malo. La tasa media de supervivencia a 2 años es aproximadamente del 60%. Se han intentado radioterapia y quimioterapia sin buenos resultados8. La embolización arterial hepática se ha utilizado en 2 casos sin éxito7. La mayoría de los pacientes fueron tratados quirúrgicamente, con una media de seguimiento de 48 meses; solo 7 pacientes sobrevivieron sin evidencia de recurrencia local o metástasis a distancia9.
Los factores pronósticos más importantes son el tamaño tumoral, la invasión de órganos adyacentes, y la presencia de metástasis a distancia8. El caso descrito medía 20cm de diámetro (la media de los casos descritos es de 12cm) con invasión del colon ascendente que provocó perforación colónica, con la subsecuente peritonitis bacteriana secundaria.
Por lo que respecta a esta manifestación, cabe destacar la importancia del diagnóstico precoz, resaltando las diferencias con la peritonitis bacteriana espontánea. En un estudio reciente de Soriano et al.10 se cifra la mortalidad en un 66,6%, con una diferencia significativa entre los pacientes tratados de forma conservadora (mortalidad del 81,8%), frente a los manejados quirúrgicamente (53,8%); además de observarse que el tiempo entre la paracentesis diagnóstica y la cirugía fue más corto en los supervivientes. Por todo ello, debe hacerse un rápido diagnóstico diferencial teniendo en cuenta los criterios de Runyon: proteínas totales > 1g/dl, Glc < 50mg/dl, LDH > 225 mU/ml; muy elevado recuento leucocitario, y la frecuente presencia de flora polimicrobiana. Esta sospecha debe complementarse con la pronta realización de pruebas de imagen (TC) y una temprana valoración quirúrgica11, medidas todas ellas encaminadas a disminuir la mortalidad en esta entidad, que aunque poco frecuente (4,5% de todas las peritonitis en pacientes cirróticos), presenta una elevada tasa de mortalidad, de hasta el 80% en algunas series.
En conclusión, el sarcoma primario hepático entra en el diagnóstico diferencial de las lesiones focales hepáticas, si bien es un tumor muy poco frecuente y no debe confundirse con un absceso o con un quiste hidatídico. Puede desarrollarse sobre un hígado con cirrosis, incluso simultáneamente con un CHC.